文档内容
【中小学教辅资源店 微信:mlxt2022】
2022年湖北省武汉市中考化学试卷
一、选择题(本题包括8小题,每小题只有一个选项符合题意。每小题3分,共24分)
1.(3分)笔、墨、纸、砚并称文房四宝,其中“墨”的主要成分是炭黑。炭黑的下列性
质中属于化学性质的是( )
A.熔点高 B.可燃性
C.难溶于水 D.常温下呈固态
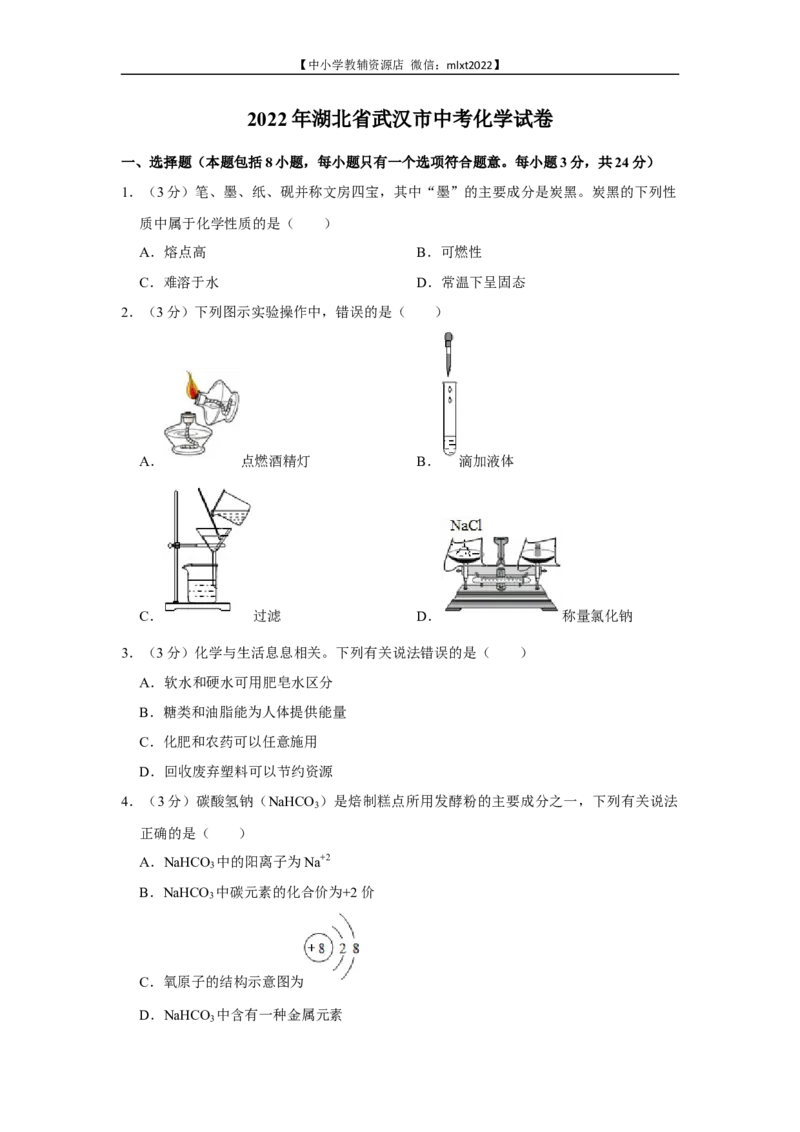
2.(3分)下列图示实验操作中,错误的是( )
A. 点燃酒精灯 B. 滴加液体
C. 过滤 D. 称量氯化钠
3.(3分)化学与生活息息相关。下列有关说法错误的是( )
A.软水和硬水可用肥皂水区分
B.糖类和油脂能为人体提供能量
C.化肥和农药可以任意施用
D.回收废弃塑料可以节约资源
4.(3分)碳酸氢钠(NaHCO )是焙制糕点所用发酵粉的主要成分之一,下列有关说法
3
正确的是( )
A.NaHCO 中的阳离子为Na+2
3
B.NaHCO 中碳元素的化合价为+2价
3
C.氧原子的结构示意图为
D.NaHCO 中含有一种金属元素
3【中小学教辅资源店 微信:mlxt2022】
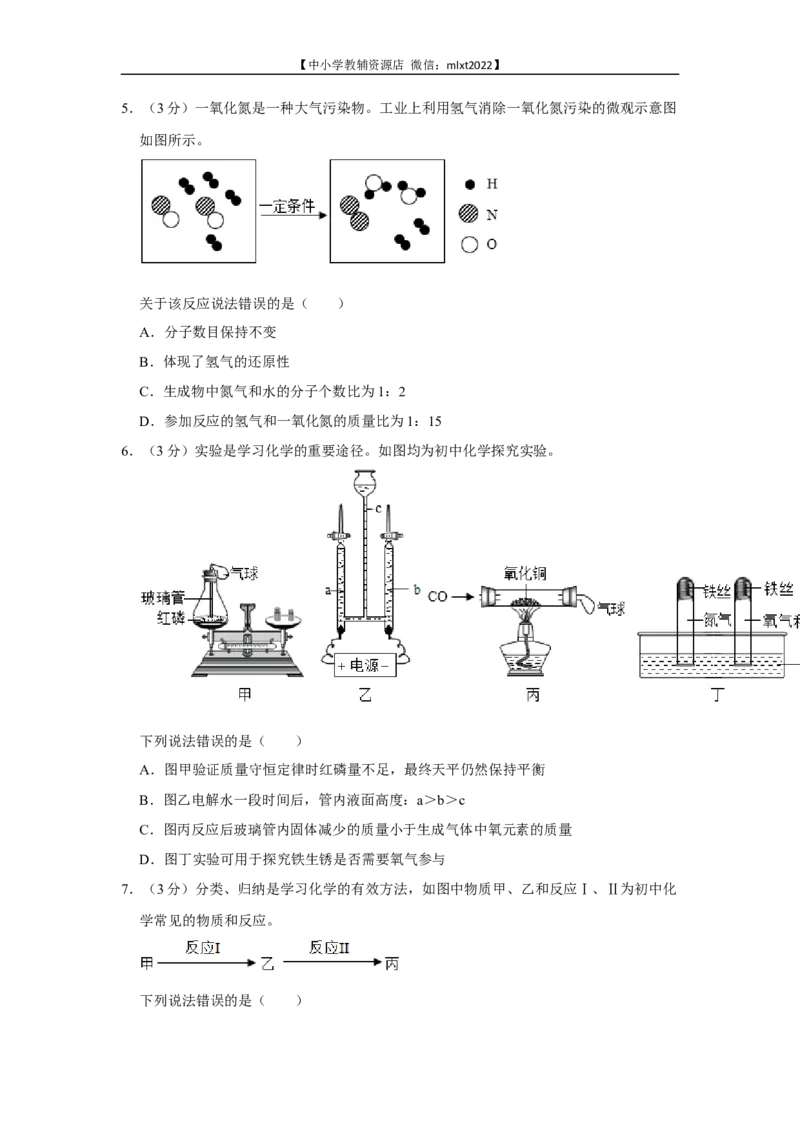
5.(3分)一氧化氮是一种大气污染物。工业上利用氢气消除一氧化氮污染的微观示意图
如图所示。
关于该反应说法错误的是( )
A.分子数目保持不变
B.体现了氢气的还原性
C.生成物中氮气和水的分子个数比为1:2
D.参加反应的氢气和一氧化氮的质量比为1:15
6.(3分)实验是学习化学的重要途径。如图均为初中化学探究实验。
下列说法错误的是( )
A.图甲验证质量守恒定律时红磷量不足,最终天平仍然保持平衡
B.图乙电解水一段时间后,管内液面高度:a>b>c
C.图丙反应后玻璃管内固体减少的质量小于生成气体中氧元素的质量
D.图丁实验可用于探究铁生锈是否需要氧气参与
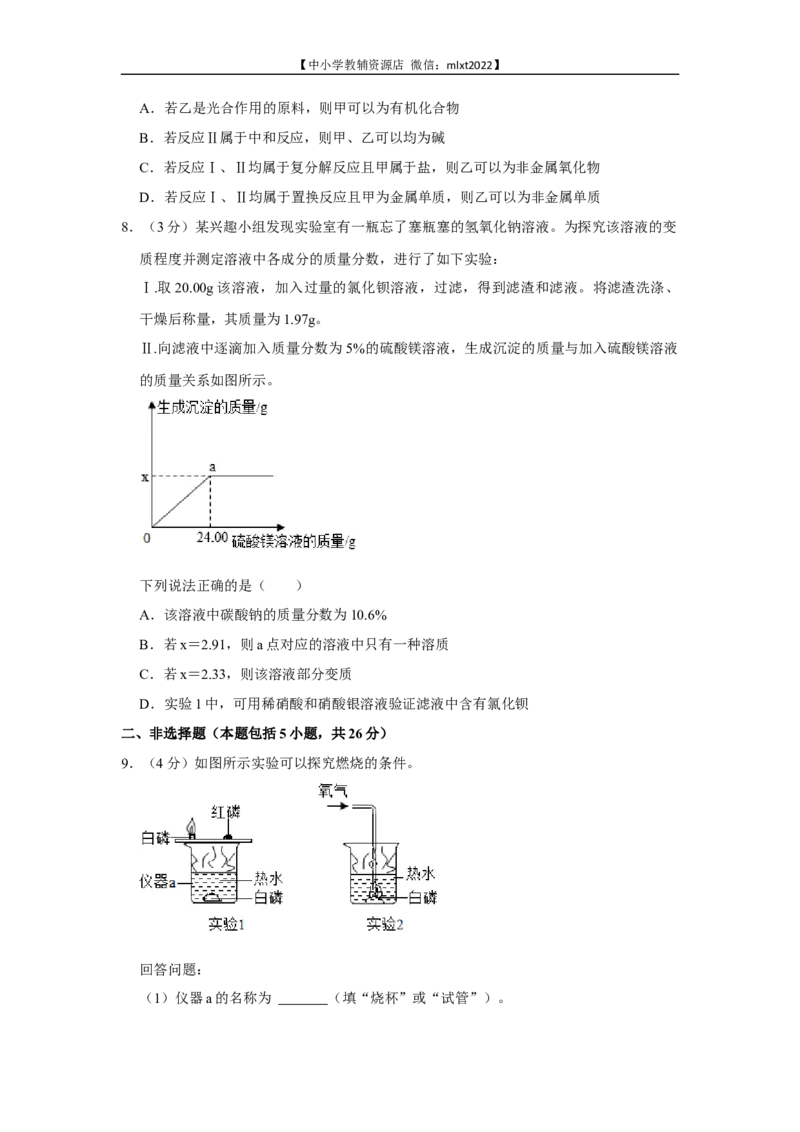
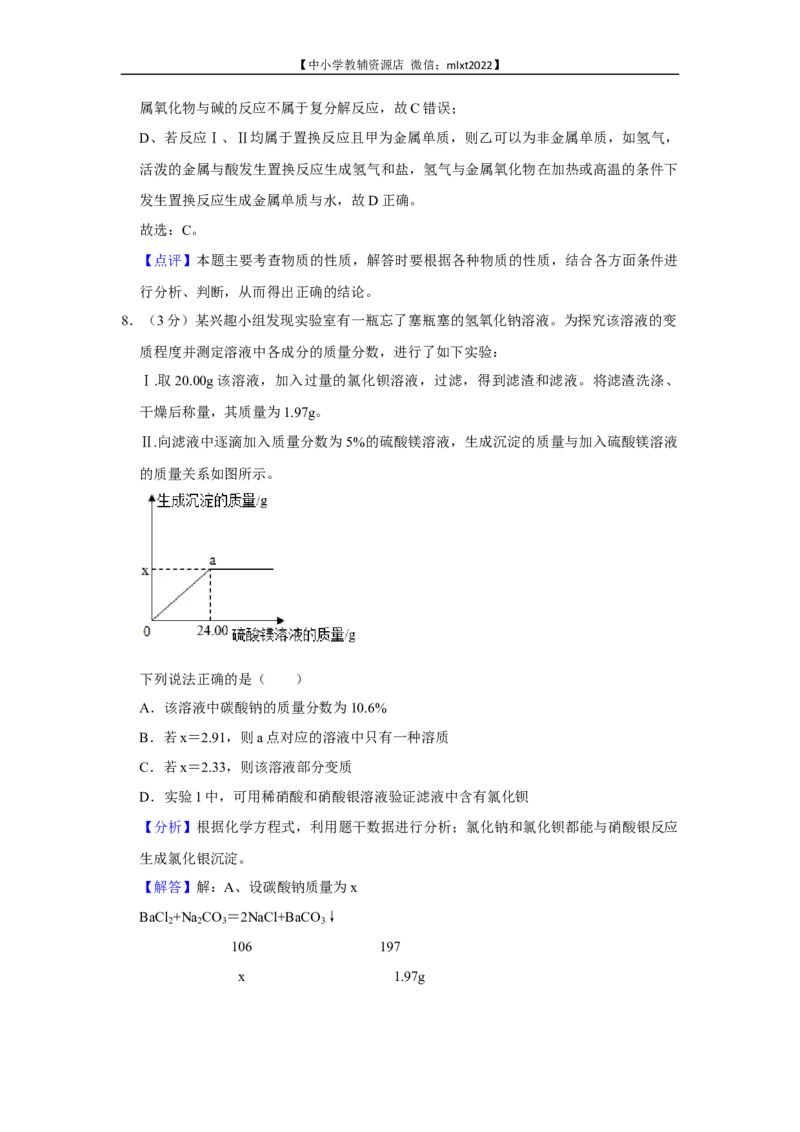
7.(3分)分类、归纳是学习化学的有效方法,如图中物质甲、乙和反应Ⅰ、Ⅱ为初中化
学常见的物质和反应。
下列说法错误的是( )【中小学教辅资源店 微信:mlxt2022】
A.若乙是光合作用的原料,则甲可以为有机化合物
B.若反应Ⅱ属于中和反应,则甲、乙可以均为碱
C.若反应Ⅰ、Ⅱ均属于复分解反应且甲属于盐,则乙可以为非金属氧化物
D.若反应Ⅰ、Ⅱ均属于置换反应且甲为金属单质,则乙可以为非金属单质
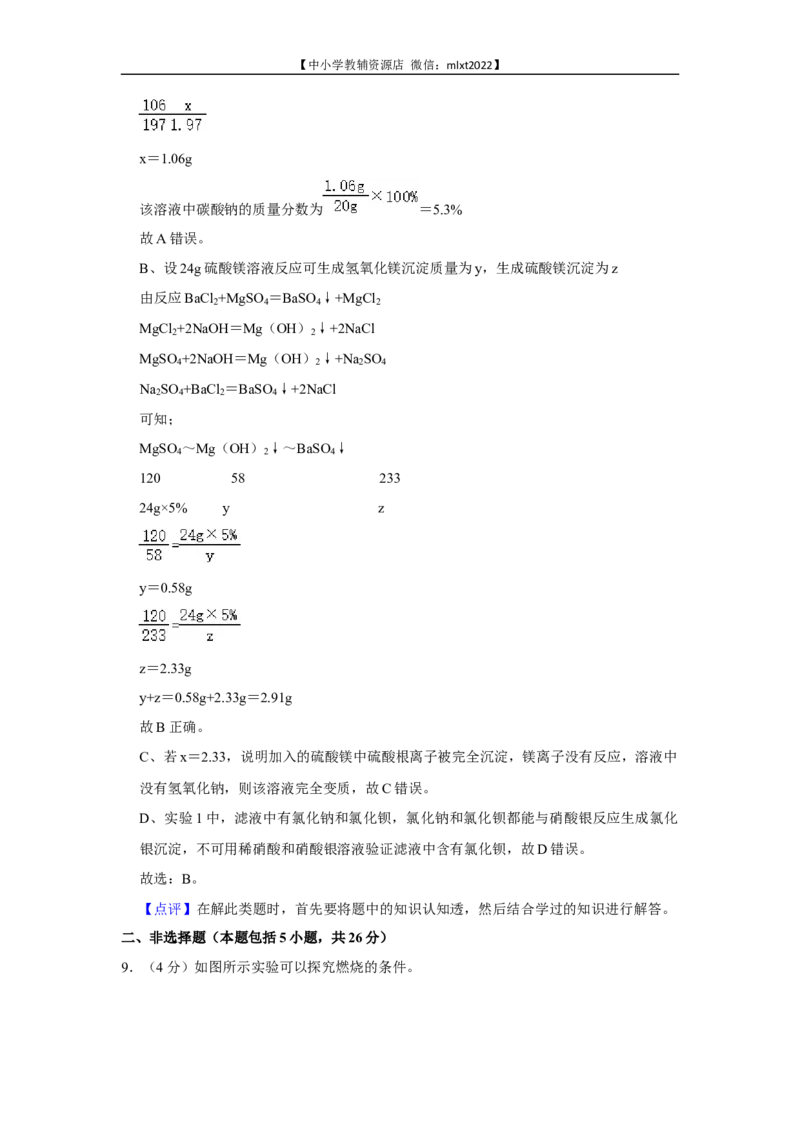
8.(3分)某兴趣小组发现实验室有一瓶忘了塞瓶塞的氢氧化钠溶液。为探究该溶液的变
质程度并测定溶液中各成分的质量分数,进行了如下实验:
Ⅰ.取20.00g该溶液,加入过量的氯化钡溶液,过滤,得到滤渣和滤液。将滤渣洗涤、
干燥后称量,其质量为1.97g。
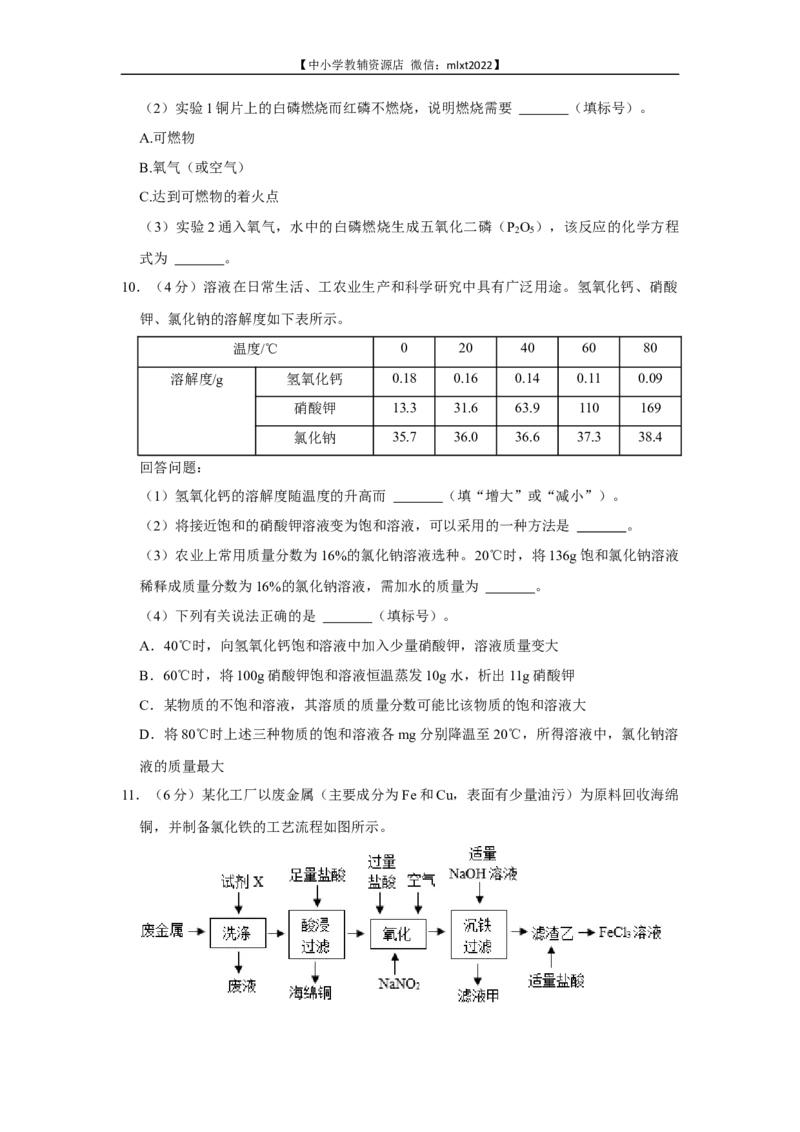
Ⅱ.向滤液中逐滴加入质量分数为5%的硫酸镁溶液,生成沉淀的质量与加入硫酸镁溶液
的质量关系如图所示。
下列说法正确的是( )
A.该溶液中碳酸钠的质量分数为10.6%
B.若x=2.91,则a点对应的溶液中只有一种溶质
C.若x=2.33,则该溶液部分变质
D.实验1中,可用稀硝酸和硝酸银溶液验证滤液中含有氯化钡
二、非选择题(本题包括5小题,共26分)
9.(4分)如图所示实验可以探究燃烧的条件。
回答问题:
(1)仪器a的名称为 (填“烧杯”或“试管”)。【中小学教辅资源店 微信:mlxt2022】
(2)实验1铜片上的白磷燃烧而红磷不燃烧,说明燃烧需要 (填标号)。
A.可燃物
B.氧气(或空气)
C.达到可燃物的着火点
(3)实验2通入氧气,水中的白磷燃烧生成五氧化二磷(P O ),该反应的化学方程
2 5
式为 。
10.(4分)溶液在日常生活、工农业生产和科学研究中具有广泛用途。氢氧化钙、硝酸
钾、氯化钠的溶解度如下表所示。
温度/℃ 0 20 40 60 80
溶解度/g 氢氧化钙 0.18 0.16 0.14 0.11 0.09
硝酸钾 13.3 31.6 63.9 110 169
氯化钠 35.7 36.0 36.6 37.3 38.4
回答问题:
(1)氢氧化钙的溶解度随温度的升高而 (填“增大”或“减小”)。
(2)将接近饱和的硝酸钾溶液变为饱和溶液,可以采用的一种方法是 。
(3)农业上常用质量分数为16%的氯化钠溶液选种。20℃时,将136g饱和氯化钠溶液
稀释成质量分数为16%的氯化钠溶液,需加水的质量为 。
(4)下列有关说法正确的是 (填标号)。
A.40℃时,向氢氧化钙饱和溶液中加入少量硝酸钾,溶液质量变大
B.60℃时,将100g硝酸钾饱和溶液恒温蒸发10g水,析出11g硝酸钾
C.某物质的不饱和溶液,其溶质的质量分数可能比该物质的饱和溶液大
D.将80℃时上述三种物质的饱和溶液各mg分别降温至20℃,所得溶液中,氯化钠溶
液的质量最大
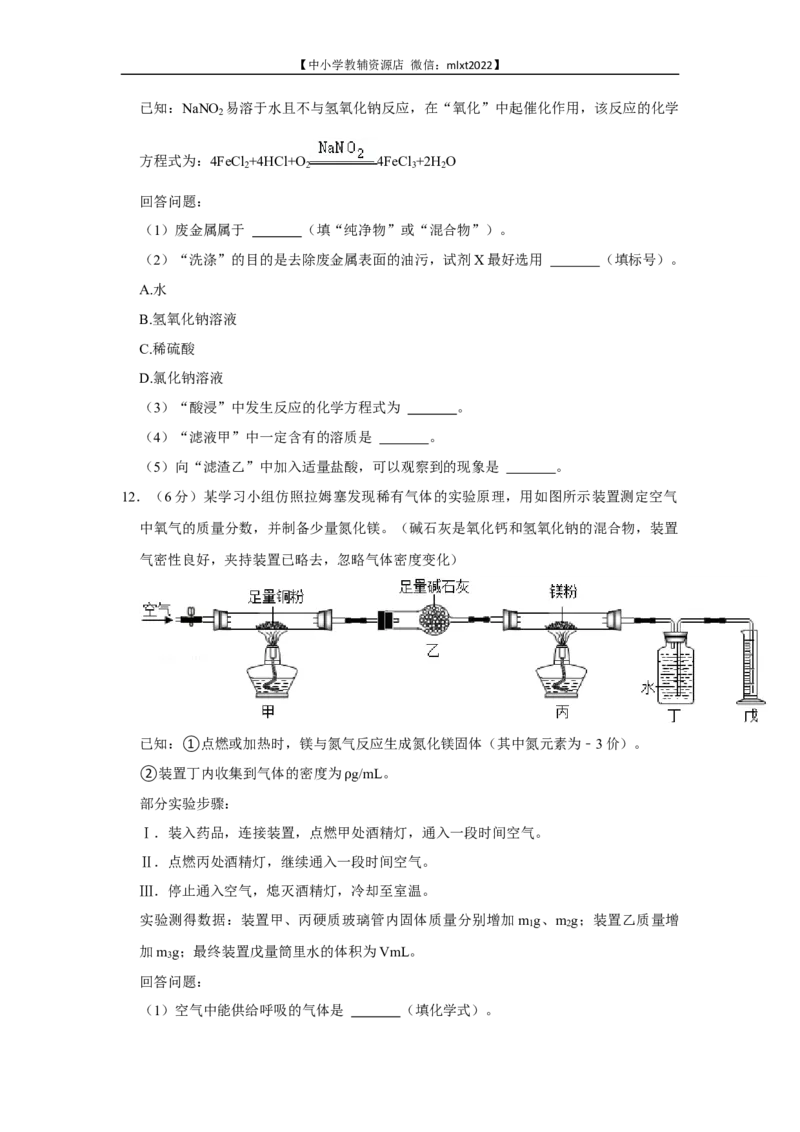
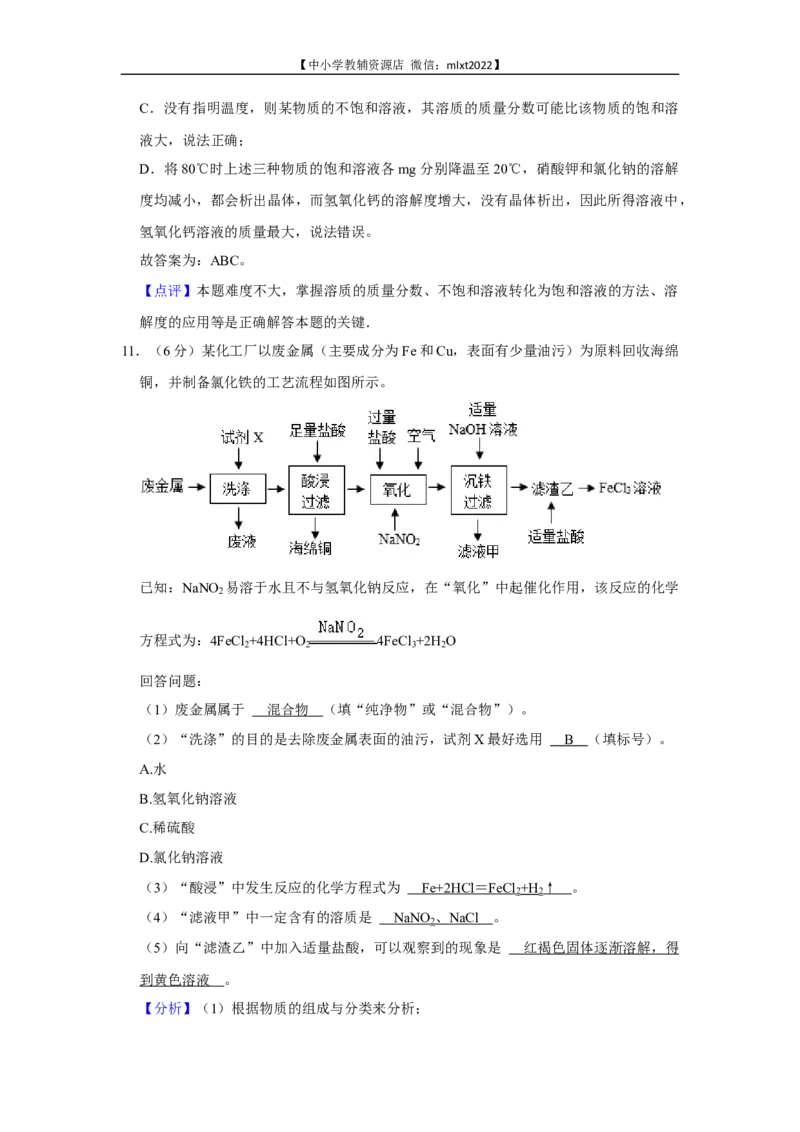
11.(6分)某化工厂以废金属(主要成分为Fe和Cu,表面有少量油污)为原料回收海绵
铜,并制备氯化铁的工艺流程如图所示。【中小学教辅资源店 微信:mlxt2022】
已知:NaNO 易溶于水且不与氢氧化钠反应,在“氧化”中起催化作用,该反应的化学
2
方程式为:4FeCl +4HCl+O 4FeCl +2H O
2 2 3 2
回答问题:
(1)废金属属于 (填“纯净物”或“混合物”)。
(2)“洗涤”的目的是去除废金属表面的油污,试剂X最好选用 (填标号)。
A.水
B.氢氧化钠溶液
C.稀硫酸
D.氯化钠溶液
(3)“酸浸”中发生反应的化学方程式为 。
(4)“滤液甲”中一定含有的溶质是 。
(5)向“滤渣乙”中加入适量盐酸,可以观察到的现象是 。
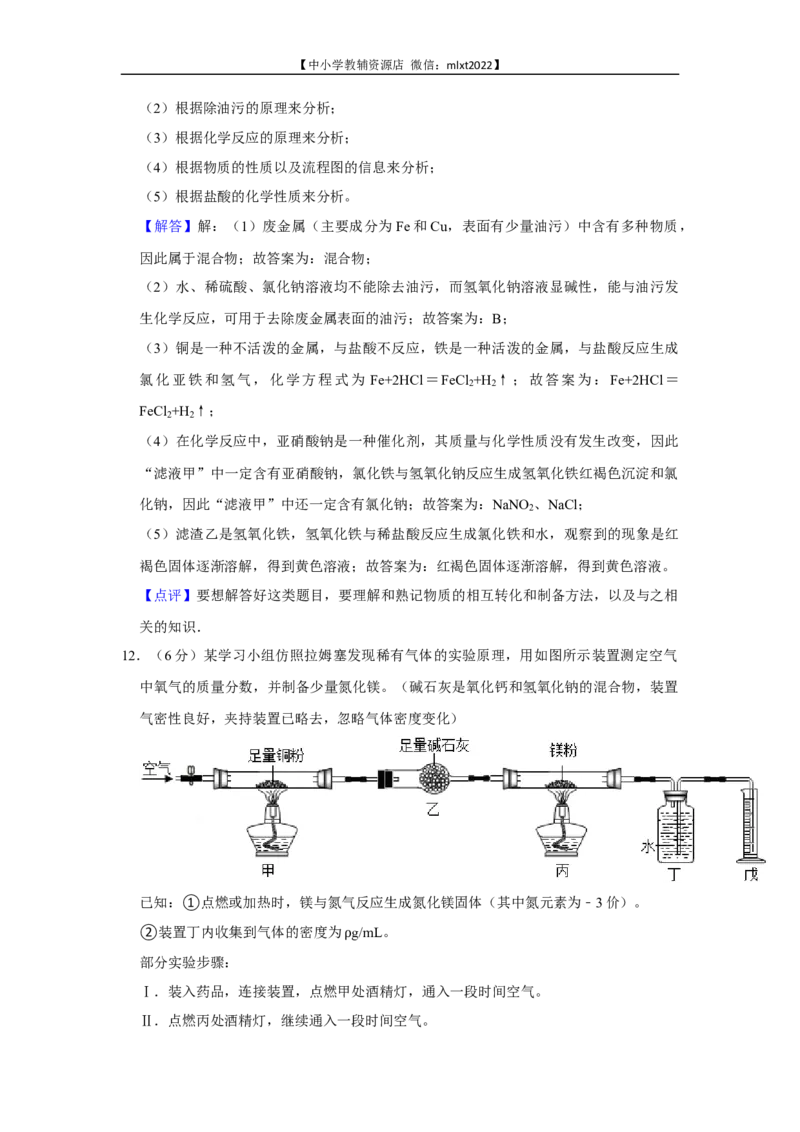
12.(6分)某学习小组仿照拉姆塞发现稀有气体的实验原理,用如图所示装置测定空气
中氧气的质量分数,并制备少量氮化镁。(碱石灰是氧化钙和氢氧化钠的混合物,装置
气密性良好,夹持装置已略去,忽略气体密度变化)
已知:①点燃或加热时,镁与氮气反应生成氮化镁固体(其中氮元素为﹣3价)。
②装置丁内收集到气体的密度为 g/mL。
部分实验步骤: ρ
Ⅰ.装入药品,连接装置,点燃甲处酒精灯,通入一段时间空气。
Ⅱ.点燃丙处酒精灯,继续通入一段时间空气。
Ⅲ.停止通入空气,熄灭酒精灯,冷却至室温。
实验测得数据:装置甲、丙硬质玻璃管内固体质量分别增加m g、m g;装置乙质量增
1 2
加m g;最终装置戊量筒里水的体积为VmL。
3
回答问题:
(1)空气中能供给呼吸的气体是 (填化学式)。【中小学教辅资源店 微信:mlxt2022】
(2)装置甲硬质玻璃管内观察到的实验现象是 。
(3)装置丙硬质玻璃管内发生反应的化学方程式为 。
(4)步骤Ⅰ中点燃甲处酒精灯,通入一段时间空气的目的是 。
(5)空气中氧气的质量分数为 (用m 、m 、m 、 、V的代数式表示)。
1 2 3
13.(6分)某兴趣小组用氧化铜和稀硫酸制取硫酸铜溶液。向ρ 盛有一定质量氧化铜的烧
杯中加入100.0g稀硫酸,恰好完全反应,得到104.0g溶液。
回答问题:
(1)稀硫酸的pH 7(填“<”“=”或“>”)。
(2)求所得溶液中硫酸铜的质量分数(精确到0.1%)。【中小学教辅资源店 微信:mlxt2022】
2022年湖北省武汉市中考化学试卷
参考答案与试题解析
一、选择题(本题包括8小题,每小题只有一个选项符合题意。每小题3分,共24分)
1.(3分)笔、墨、纸、砚并称文房四宝,其中“墨”的主要成分是炭黑。炭黑的下列性
质中属于化学性质的是( )
A.熔点高 B.可燃性
C.难溶于水 D.常温下呈固态
【分析】物质在化学变化中表现出来的性质叫化学性质,如可燃性、助燃性、氧化性、
还原性、酸碱性、稳定性等;物质不需要发生化学变化就表现出来的性质,叫物理性质;
物理性质经常表现为:颜色、状态、气味、密度、硬度、熔点、沸点、导电性、导热性、
溶解性、挥发性、吸附性、延展性等。
【解答】解:熔点、溶解性以及物质的状态都不需要发生化学变化就能表现出来,属于
物质的物理性质;物质的可燃性需要发生化学变化才能表现出来,属于物质的化学性质。
故选:B。
【点评】本考点考查了物理性质和化学性质的区分,要记忆有关铁的性质,并能够在比
较的基础上进行应用,本考点的基础性比较强,主要出现在选择题和填空题中。
2.(3分)下列图示实验操作中,错误的是( )
A. 点燃酒精灯 B. 滴加液体
C. 过滤 D. 称量氯化钠
【分析】根据基本实验操作的正确方法以及注意事项来分析。
【解答】解:A、使用酒精灯时要注意“两查、两禁、一不可”,可用火柴点燃酒精灯,
切不可用燃着的酒精灯去引燃另一盏酒精灯,以防发生火灾,图中所示操作错误。【中小学教辅资源店 微信:mlxt2022】
B、使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内
壁,应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,图中所示操作正确。
C、过滤液体时,要注意“一贴、二低、三靠”的原则,图中所示操作正确。
D、用天平称量时应该左物右码,且天平左右两盘上各放着一张相同大小的白纸,图中
所示操作正确。
故选:A。
【点评】本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作
的注意事项是解答此类试题的关键。
3.(3分)化学与生活息息相关。下列有关说法错误的是( )
A.软水和硬水可用肥皂水区分
B.糖类和油脂能为人体提供能量
C.化肥和农药可以任意施用
D.回收废弃塑料可以节约资源
【分析】A、根据硬水与软水的检验方法来分析;
B、根据人体的供能物质来分析;
C、根据使用化肥与农药的注意事项来分析;
D、根据回收废弃塑料的意义来分析。
【解答】解:A、软水和硬水可用肥皂水区分,产生较多泡沫的是软水,产生泡沫较少
的是硬水,故A正确;
B、糖类和油脂能为人体提供能量,故B正确;
C、化肥和农药要合理施用,任意施用会造成土壤污染、水体污染等,故C错误;
D、回收废弃塑料可以节约资源,还能减少白色污染,故D正确。
故选:C。
【点评】本题考查的是化学基础知识,完成此题,可以依据已有的知识进行。
4.(3分)碳酸氢钠(NaHCO )是焙制糕点所用发酵粉的主要成分之一,下列有关说法
3
正确的是( )
A.NaHCO 中的阳离子为Na+2
3
B.NaHCO 中碳元素的化合价为+2价
3
C.氧原子的结构示意图为【中小学教辅资源店 微信:mlxt2022】
D.NaHCO 中含有一种金属元素
3
【分析】A、根据离子符号的写法来分析;
B、根据化合物中元素化合价的计算方法来分析;
C、根据氧原子结构来分析;
D、根据元素的分类来分析。
【解答】解:A、离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带
的正负电荷数,数字在前,正负符号在后,带 1个电荷时,1要省略。钠离子表示为
Na+,故A错误;
B、NaHCO 中,钠元素显+1价,氢元素显+1价,氧元素显﹣2价,设其中碳元素的化
3
合价为x,则:(+1)+(+1)+x+(﹣2)×3=0,x=+4,故B错误;
C、氧原子的核内有8个质子,核外有8个电子,分两层排布,依次为2、6,因此氧原
子结构示意图为: ,故C错误;
D、NaHCO 中含有一种金属元素——钠元素,而氢元素、碳元素和氧元素均属于非金
3
属元素,故D正确。
故选:D。
【点评】本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号
意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易。
5.(3分)一氧化氮是一种大气污染物。工业上利用氢气消除一氧化氮污染的微观示意图
如图所示。
关于该反应说法错误的是( )
A.分子数目保持不变
B.体现了氢气的还原性
C.生成物中氮气和水的分子个数比为1:2【中小学教辅资源店 微信:mlxt2022】
D.参加反应的氢气和一氧化氮的质量比为1:15
【分析】根据微观反应示意图书写化学方程式,然后根据各选项内容分析解答。
【解答】解:由微观反应示意图可知,该反应是由一氧化氮和氢气在一定条件下反应生
成氮气和水,化学方程式为2NO+2H N +2H O。
2 2 2
A、由化学方程式可知,反应前后分子数目不同,故A错误;
B、在该反应中,氢气夺去了一氧化氮中的氧元素,体现了氢气的还原性,故B正确;
C、由化学方程式可知,生成物中氮气和水的分子个数比为1:2,故C正确;
D、由化学方程式可知,参加反应的氢气和一氧化氮的质量比为(2×2):(30×2)=
1:15,故D正确。
故选:A。
【点评】本题主要考查了化学反应的微观模型表示,完成此题,关键是根据反应的实质
结合模型的结构充分理解图中的信息,只有这样才能对问题做出正确的判断。
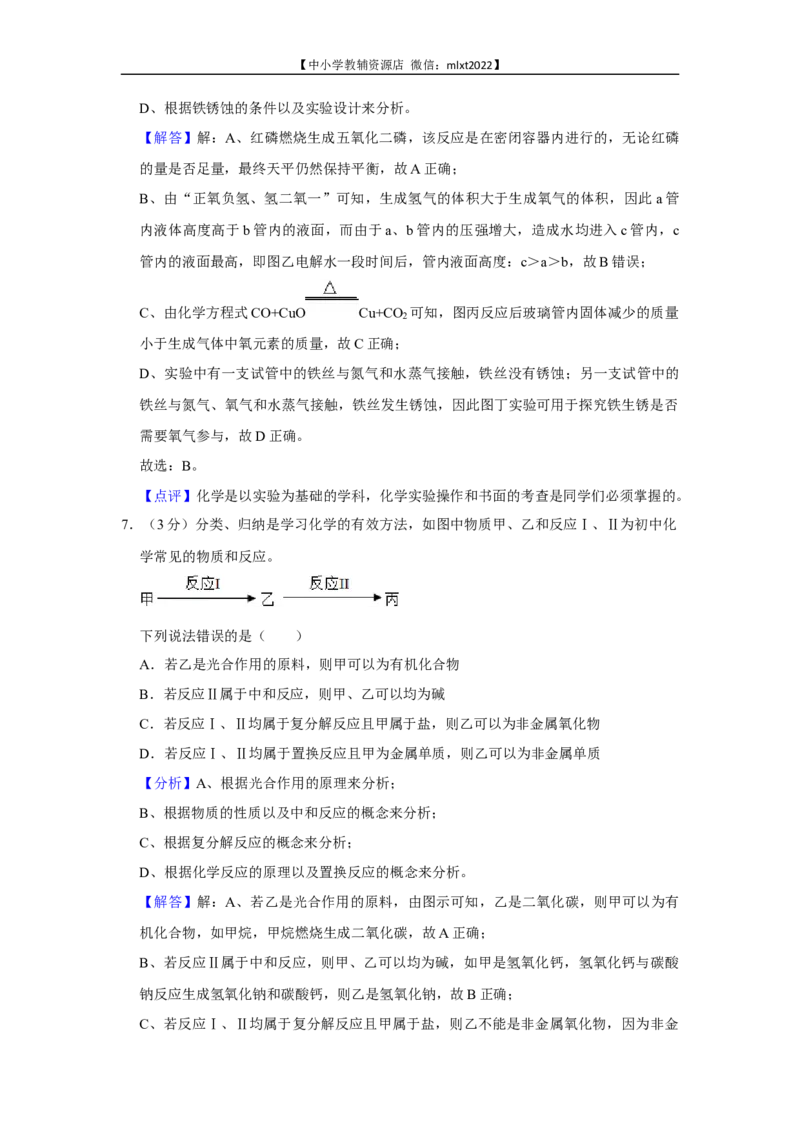
6.(3分)实验是学习化学的重要途径。如图均为初中化学探究实验。
下列说法错误的是( )
A.图甲验证质量守恒定律时红磷量不足,最终天平仍然保持平衡
B.图乙电解水一段时间后,管内液面高度:a>b>c
C.图丙反应后玻璃管内固体减少的质量小于生成气体中氧元素的质量
D.图丁实验可用于探究铁生锈是否需要氧气参与
【分析】A、根据验证质量守恒定律的方法来分析;
B、根据电解水的原理来分析;
C、根据化学反应的原理来分析;【中小学教辅资源店 微信:mlxt2022】
D、根据铁锈蚀的条件以及实验设计来分析。
【解答】解:A、红磷燃烧生成五氧化二磷,该反应是在密闭容器内进行的,无论红磷
的量是否足量,最终天平仍然保持平衡,故A正确;
B、由“正氧负氢、氢二氧一”可知,生成氢气的体积大于生成氧气的体积,因此a管
内液体高度高于b管内的液面,而由于a、b管内的压强增大,造成水均进入c管内,c
管内的液面最高,即图乙电解水一段时间后,管内液面高度:c>a>b,故B错误;
C、由化学方程式CO+CuO Cu+CO 可知,图丙反应后玻璃管内固体减少的质量
2
小于生成气体中氧元素的质量,故C正确;
D、实验中有一支试管中的铁丝与氮气和水蒸气接触,铁丝没有锈蚀;另一支试管中的
铁丝与氮气、氧气和水蒸气接触,铁丝发生锈蚀,因此图丁实验可用于探究铁生锈是否
需要氧气参与,故D正确。
故选:B。
【点评】化学是以实验为基础的学科,化学实验操作和书面的考查是同学们必须掌握的。
7.(3分)分类、归纳是学习化学的有效方法,如图中物质甲、乙和反应Ⅰ、Ⅱ为初中化
学常见的物质和反应。
下列说法错误的是( )
A.若乙是光合作用的原料,则甲可以为有机化合物
B.若反应Ⅱ属于中和反应,则甲、乙可以均为碱
C.若反应Ⅰ、Ⅱ均属于复分解反应且甲属于盐,则乙可以为非金属氧化物
D.若反应Ⅰ、Ⅱ均属于置换反应且甲为金属单质,则乙可以为非金属单质
【分析】A、根据光合作用的原理来分析;
B、根据物质的性质以及中和反应的概念来分析;
C、根据复分解反应的概念来分析;
D、根据化学反应的原理以及置换反应的概念来分析。
【解答】解:A、若乙是光合作用的原料,由图示可知,乙是二氧化碳,则甲可以为有
机化合物,如甲烷,甲烷燃烧生成二氧化碳,故A正确;
B、若反应Ⅱ属于中和反应,则甲、乙可以均为碱,如甲是氢氧化钙,氢氧化钙与碳酸
钠反应生成氢氧化钠和碳酸钙,则乙是氢氧化钠,故B正确;
C、若反应Ⅰ、Ⅱ均属于复分解反应且甲属于盐,则乙不能是非金属氧化物,因为非金【中小学教辅资源店 微信:mlxt2022】
属氧化物与碱的反应不属于复分解反应,故C错误;
D、若反应Ⅰ、Ⅱ均属于置换反应且甲为金属单质,则乙可以为非金属单质,如氢气,
活泼的金属与酸发生置换反应生成氢气和盐,氢气与金属氧化物在加热或高温的条件下
发生置换反应生成金属单质与水,故D正确。
故选:C。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进
行分析、判断,从而得出正确的结论。
8.(3分)某兴趣小组发现实验室有一瓶忘了塞瓶塞的氢氧化钠溶液。为探究该溶液的变
质程度并测定溶液中各成分的质量分数,进行了如下实验:
Ⅰ.取20.00g该溶液,加入过量的氯化钡溶液,过滤,得到滤渣和滤液。将滤渣洗涤、
干燥后称量,其质量为1.97g。
Ⅱ.向滤液中逐滴加入质量分数为5%的硫酸镁溶液,生成沉淀的质量与加入硫酸镁溶液
的质量关系如图所示。
下列说法正确的是( )
A.该溶液中碳酸钠的质量分数为10.6%
B.若x=2.91,则a点对应的溶液中只有一种溶质
C.若x=2.33,则该溶液部分变质
D.实验1中,可用稀硝酸和硝酸银溶液验证滤液中含有氯化钡
【分析】根据化学方程式,利用题干数据进行分析;氯化钠和氯化钡都能与硝酸银反应
生成氯化银沉淀。
【解答】解:A、设碳酸钠质量为x
BaCl +Na CO =2NaCl+BaCO ↓
2 2 3 3
106 197
x 1.97g【中小学教辅资源店 微信:mlxt2022】
x=1.06g
该溶液中碳酸钠的质量分数为 =5.3%
故A错误。
B、设24g硫酸镁溶液反应可生成氢氧化镁沉淀质量为y,生成硫酸镁沉淀为z
由反应BaCl +MgSO =BaSO ↓+MgCl
2 4 4 2
MgCl +2NaOH=Mg(OH) ↓+2NaCl
2 2
MgSO +2NaOH=Mg(OH) ↓+Na SO
4 2 2 4
Na SO +BaCl =BaSO ↓+2NaCl
2 4 2 4
可知;
MgSO ~Mg(OH) ↓~BaSO ↓
4 2 4
120 58 233
24g×5% y z
y=0.58g
z=2.33g
y+z=0.58g+2.33g=2.91g
故B正确。
C、若x=2.33,说明加入的硫酸镁中硫酸根离子被完全沉淀,镁离子没有反应,溶液中
没有氢氧化钠,则该溶液完全变质,故C错误。
D、实验1中,滤液中有氯化钠和氯化钡,氯化钠和氯化钡都能与硝酸银反应生成氯化
银沉淀,不可用稀硝酸和硝酸银溶液验证滤液中含有氯化钡,故D错误。
故选:B。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
二、非选择题(本题包括5小题,共26分)
9.(4分)如图所示实验可以探究燃烧的条件。【中小学教辅资源店 微信:mlxt2022】
回答问题:
(1)仪器a的名称为 烧杯 (填“烧杯”或“试管”)。
(2)实验1铜片上的白磷燃烧而红磷不燃烧,说明燃烧需要 C (填标号)。
A.可燃物
B.氧气(或空气)
C.达到可燃物的着火点
(3)实验2通入氧气,水中的白磷燃烧生成五氧化二磷(P O ),该反应的化学方程
2 5
式为 4P+5O 2P O 。
2 2 5
【分析】(1)熟记仪器的名称;
(2)根据燃烧的条件以及实验现象来分析;
(3)根据化学反应的原理来分析。
【解答】解:(1)仪器a的名称为烧杯;故答案为:烧杯;
(2)白磷和红磷均为可燃物,实验 1铜片上的白磷与红磷均与氧气接触,实验中白磷
燃烧而红磷不燃烧,说明燃烧需要温度达到可燃物的着火点;故答案为:C;
(3)在点燃的条件下,白磷与氧气反应生成五氧化二磷,化学方程式为 4P+5O
2
2P O ;故答案为:4P+5O 2P O 。
2 5 2 2 5
【点评】本题较易,主要考查了燃烧的条件、着火点相关知识,答题时需要明确物质燃
烧时的条件及不同物质的着火点不同。
10.(4分)溶液在日常生活、工农业生产和科学研究中具有广泛用途。氢氧化钙、硝酸
钾、氯化钠的溶解度如下表所示。
温度/℃ 0 20 40 60 80【中小学教辅资源店 微信:mlxt2022】
溶解度/g 氢氧化钙 0.18 0.16 0.14 0.11 0.09
硝酸钾 13.3 31.6 63.9 110 169
氯化钠 35.7 36.0 36.6 37.3 38.4
回答问题:
(1)氢氧化钙的溶解度随温度的升高而 减小 (填“增大”或“减小”)。
(2)将接近饱和的硝酸钾溶液变为饱和溶液,可以采用的一种方法是 降低温度或加
硝酸钾或蒸发水 。
(3)农业上常用质量分数为16%的氯化钠溶液选种。20℃时,将136g饱和氯化钠溶液
稀释成质量分数为16%的氯化钠溶液,需加水的质量为 89 g 。
(4)下列有关说法正确的是 ABC (填标号)。
A.40℃时,向氢氧化钙饱和溶液中加入少量硝酸钾,溶液质量变大
B.60℃时,将100g硝酸钾饱和溶液恒温蒸发10g水,析出11g硝酸钾
C.某物质的不饱和溶液,其溶质的质量分数可能比该物质的饱和溶液大
D.将80℃时上述三种物质的饱和溶液各mg分别降温至20℃,所得溶液中,氯化钠溶
液的质量最大
【分析】(1)根据表格中的数据来分析;
(2)根据将不饱和溶液转化为饱和溶液的方法来分析;
(3)根据溶液加水稀释过程中溶质的质量不变来分析;
(4)根据饱和溶液的概念、溶解度的数据、溶质的质量分数比较方法来分析。
【解答】解:(1)由表格中的数据可知,氢氧化钙的溶解度随温度的升高而减小;故
答案为:减小;
(2)由表格中的数据可知,硝酸钾的溶解度随着温度的升高而增大,因此将接近饱和
的硝酸钾溶液变为饱和溶液,可以采用的方法是降低温度或加硝酸钾或蒸发水;故答案
为:降低温度或加硝酸钾或蒸发水;
(3)20℃时,氯化钠的溶解度为36.0g,则20℃时,将136g饱和氯化钠溶液中含有36g
氯化钠,16%的氯化钠溶液的质量为36g÷16%=225g,则需要加水的质量为225g﹣136g
=89g;故答案为:89g;
(4)A.40℃时,向氢氧化钙饱和溶液中加入少量硝酸钾,硝酸钾能继续溶解,则溶液
质量变大,说法正确;
B.60℃时,硝酸钾的溶解度为110g,则该温度下将100g硝酸钾饱和溶液恒温蒸发10g
水,析出11g硝酸钾,说法正确;【中小学教辅资源店 微信:mlxt2022】
C.没有指明温度,则某物质的不饱和溶液,其溶质的质量分数可能比该物质的饱和溶
液大,说法正确;
D.将80℃时上述三种物质的饱和溶液各mg分别降温至20℃,硝酸钾和氯化钠的溶解
度均减小,都会析出晶体,而氢氧化钙的溶解度增大,没有晶体析出,因此所得溶液中,
氢氧化钙溶液的质量最大,说法错误。
故答案为:ABC。
【点评】本题难度不大,掌握溶质的质量分数、不饱和溶液转化为饱和溶液的方法、溶
解度的应用等是正确解答本题的关键.
11.(6分)某化工厂以废金属(主要成分为Fe和Cu,表面有少量油污)为原料回收海绵
铜,并制备氯化铁的工艺流程如图所示。
已知:NaNO 易溶于水且不与氢氧化钠反应,在“氧化”中起催化作用,该反应的化学
2
方程式为:4FeCl +4HCl+O 4FeCl +2H O
2 2 3 2
回答问题:
(1)废金属属于 混合物 (填“纯净物”或“混合物”)。
(2)“洗涤”的目的是去除废金属表面的油污,试剂X最好选用 B (填标号)。
A.水
B.氢氧化钠溶液
C.稀硫酸
D.氯化钠溶液
(3)“酸浸”中发生反应的化学方程式为 Fe+2HC l = FeC l +H ↑ 。
2 2
(4)“滤液甲”中一定含有的溶质是 NaNO 、 NaC l 。
2
(5)向“滤渣乙”中加入适量盐酸,可以观察到的现象是 红褐色固体逐渐溶解,得
到黄色溶液 。
【分析】(1)根据物质的组成与分类来分析;【中小学教辅资源店 微信:mlxt2022】
(2)根据除油污的原理来分析;
(3)根据化学反应的原理来分析;
(4)根据物质的性质以及流程图的信息来分析;
(5)根据盐酸的化学性质来分析。
【解答】解:(1)废金属(主要成分为Fe和Cu,表面有少量油污)中含有多种物质,
因此属于混合物;故答案为:混合物;
(2)水、稀硫酸、氯化钠溶液均不能除去油污,而氢氧化钠溶液显碱性,能与油污发
生化学反应,可用于去除废金属表面的油污;故答案为:B;
(3)铜是一种不活泼的金属,与盐酸不反应,铁是一种活泼的金属,与盐酸反应生成
氯化亚铁和氢气,化学方程式为 Fe+2HCl=FeCl +H ↑;故答案为:Fe+2HCl=
2 2
FeCl +H ↑;
2 2
(4)在化学反应中,亚硝酸钠是一种催化剂,其质量与化学性质没有发生改变,因此
“滤液甲”中一定含有亚硝酸钠,氯化铁与氢氧化钠反应生成氢氧化铁红褐色沉淀和氯
化钠,因此“滤液甲”中还一定含有氯化钠;故答案为:NaNO 、NaCl;
2
(5)滤渣乙是氢氧化铁,氢氧化铁与稀盐酸反应生成氯化铁和水,观察到的现象是红
褐色固体逐渐溶解,得到黄色溶液;故答案为:红褐色固体逐渐溶解,得到黄色溶液。
【点评】要想解答好这类题目,要理解和熟记物质的相互转化和制备方法,以及与之相
关的知识.
12.(6分)某学习小组仿照拉姆塞发现稀有气体的实验原理,用如图所示装置测定空气
中氧气的质量分数,并制备少量氮化镁。(碱石灰是氧化钙和氢氧化钠的混合物,装置
气密性良好,夹持装置已略去,忽略气体密度变化)
已知:①点燃或加热时,镁与氮气反应生成氮化镁固体(其中氮元素为﹣3价)。
②装置丁内收集到气体的密度为 g/mL。
部分实验步骤: ρ
Ⅰ.装入药品,连接装置,点燃甲处酒精灯,通入一段时间空气。
Ⅱ.点燃丙处酒精灯,继续通入一段时间空气。【中小学教辅资源店 微信:mlxt2022】
Ⅲ.停止通入空气,熄灭酒精灯,冷却至室温。
实验测得数据:装置甲、丙硬质玻璃管内固体质量分别增加m g、m g;装置乙质量增
1 2
加m g;最终装置戊量筒里水的体积为VmL。
3
回答问题:
(1)空气中能供给呼吸的气体是 O (填化学式)。
2
(2)装置甲硬质玻璃管内观察到的实验现象是 红色粉末逐渐变黑 。
(3)装置丙硬质玻璃管内发生反应的化学方程式为 3Mg+N Mg N 。
2 3 2
(4)步骤Ⅰ中点燃甲处酒精灯,通入一段时间空气的目的是 排出装置内的氧气,防
止镁与氧气反应 。
(5)空气中氧气的质量分数为 (用m 、m 、m 、 、
1 2 3
ρ
V的代数式表示)。
【分析】(1)根据氧气的性质来分析;
(2)根据铜粉与氧气的反应来分析;
(3)根据化学反应的原理来分析;
(4)根据除氧气的方法来的分析;
(5)根据实验数据来分析。
【解答】解:(1)空气的氧气能供给呼吸,故答案为:O ;
2
(2)在加热的条件下,铜与空气中的氧气反应生成氧化铜,铜是红色粉末,氧化铜是
黑色粉末,因此实验中观察到红色粉末逐渐变黑;故答案为:红色粉末逐渐变黑;
(3)足量的铜粉除去了空气中的氧气,足量的碱石灰除去了空气中的二氧化碳和水蒸
气,剩余的主要是氮气,在加热的条件下,镁和氮气反应生成氮化镁,化学方程式为
3Mg+N Mg N ;故答案为:3Mg+N Mg N ;
2 3 2 2 3 2
(4)整套装置内充满了空气,步骤Ⅰ中点燃甲处酒精灯,通入一段时间空气的目的是
排出装置内的氧气,防止镁与氧气反应;故答案为:排出装置内的氧气,防止镁与氧气
反应;
(5)装置甲增重的质量即为空气中氧气的质量,丙增重的质量为空气中氮气的质量,
乙增重的质量为空气中二氧化碳与水蒸气的质量,最终装置戊量筒里水的体积为
VmL,则丁装置收集到气体的体积为VmL,该气体的密度为 g/mL,因此该气体的质
ρ【中小学教辅资源店 微信:mlxt2022】
量为 Vg。空气中氧气的质量分数为 ;故答案为:
ρ
。
【点评】实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结
论和实验规律的探究等。本题通过实验资料和实验分析,得到了正确的结论,属于结论
性探究。同学们要具体分析,综合掌握。
13.(6分)某兴趣小组用氧化铜和稀硫酸制取硫酸铜溶液。向盛有一定质量氧化铜的烧
杯中加入100.0g稀硫酸,恰好完全反应,得到104.0g溶液。
回答问题:
(1)稀硫酸的pH < 7(填“<”“=”或“>”)。
(2)求所得溶液中硫酸铜的质量分数(精确到0.1%)。
【分析】(1)根据溶液的酸碱性与pH的关系来分析;
(2)根据化学反应的原理以及化学方程式来分析计算。
【解答】解:(1)稀硫酸显酸性,pH小于7;故答案为:<;
(2)氧化铜与硫酸反应生成硫酸铜和水,由质量守恒定律可知,溶液增重的质量即为
参加反应的氧化铜的质量,即104.0g﹣100.0g=4.0g
设生成硫酸铜的质量为x,则:
CuO+H SO =CuSO +H O
2 4 4 2
80 160
4.0g x
x=8.0g
所得溶液中硫酸铜的质量分数为 ≈7.7%
答:所得溶液中硫酸铜的质量分数约为7.7%。
【点评】本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答
本题,解题时要注意解题的规范性。
声明:试题解析著作权属所有,未经书面同意,不得复制发布日期:2022/8/2 17:24:56;用户:平凉市第七中学;邮箱:plsdqzx@xyh.com;学号:44351847【中小学教辅资源店 微信:mlxt2022】