文档内容
四川省泸州市2018年中考化学真题试题
可供选用的相对原子质量:O=16 C=12 Ca=40
一、单选题(24分)
7.常温下,下列物质呈气态的是 (C)
A.酒精 B.纯碱 C.氨 D.硫酸
8.分类是科学研究的重要方法,下列物质对应的类别不正确的是 (B)
选项 A B C D
物质 HO 0 CHCOOH Cu(OH)
2 2 3 3 2
类别 氧化物 化合物 酸 碱
9.下列说法不正确的是 (A)
A.普通玻璃是纯净物 B.农药波尔多液不宜装在铁桶内
C.氢能是一种无污染的能源 D.向煤炭中加人石灰石可减少SO 的排放
2
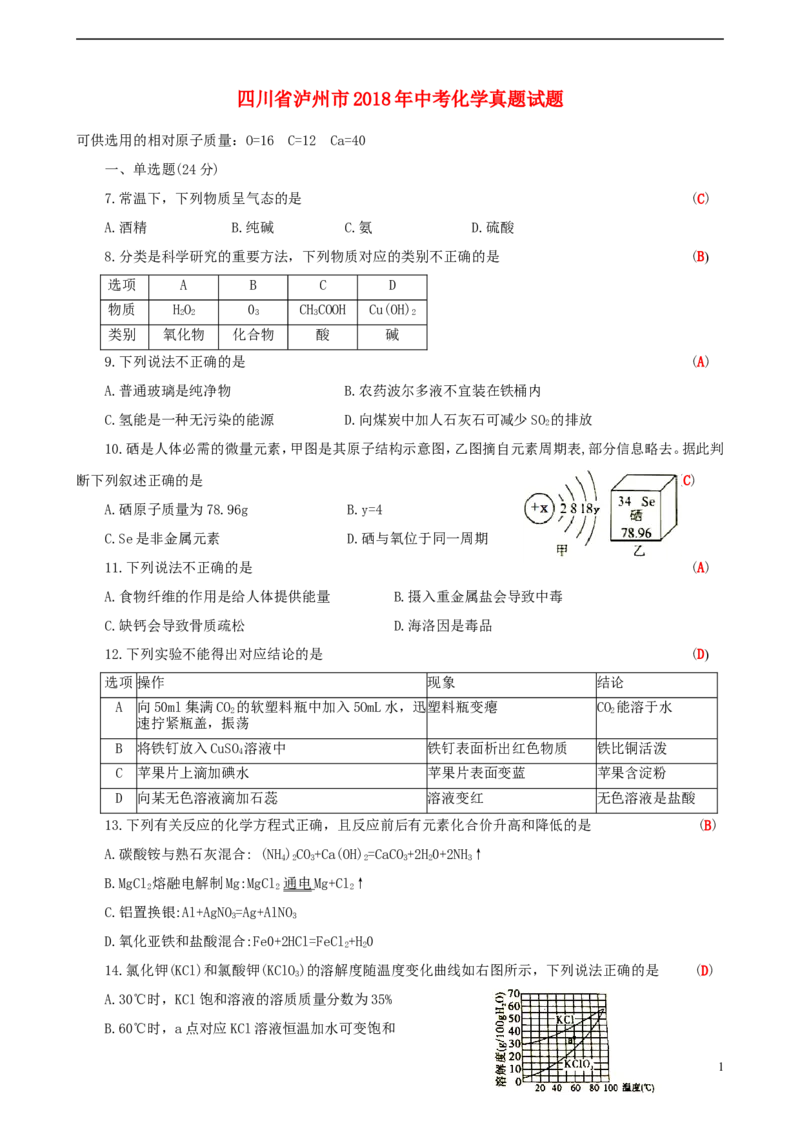
10.硒是人体必需的微量元素,甲图是其原子结构示意图,乙图摘自元素周期表,部分信息略去。据此判
断下列叙述正确的是 (C)
A.硒原子质量为78.96g B.y=4
C.Se是非金属元素 D.硒与氧位于同一周期
11.下列说法不正确的是 (A)
A.食物纤维的作用是给人体提供能量 B.摄入重金属盐会导致中毒
C.缺钙会导致骨质疏松 D.海洛因是毒品
12.下列实验不能得出对应结论的是 (D)
选项操作 现象 结论
A 向50ml集满CO 的软塑料瓶中加入5OmL水,迅塑料瓶变瘪 CO 能溶于水
2 2
速拧紧瓶盖,振荡
B 将铁钉放入CuSO 溶液中 铁钉表面析出红色物质 铁比铜活泼
4
C 苹果片上滴加碘水 苹果片表面变蓝 苹果含淀粉
D 向某无色溶液滴加石蕊 溶液变红 无色溶液是盐酸
13.下列有关反应的化学方程式正确,且反应前后有元素化合价升高和降低的是 (B)
A.碳酸铵与熟石灰混合: (NH)CO+Ca(OH)=CaCO+2H0+2NH↑
4 2 3 2 3 2 3
B.MgCl 熔融电解制Mg:MgCl 通电 Mg+Cl↑
2 2 2
C.铝置换银:Al+AgNO=Ag+AlNO
3 3
D.氧化亚铁和盐酸混合:Fe0+2HCl=FeCl+H0
2 2
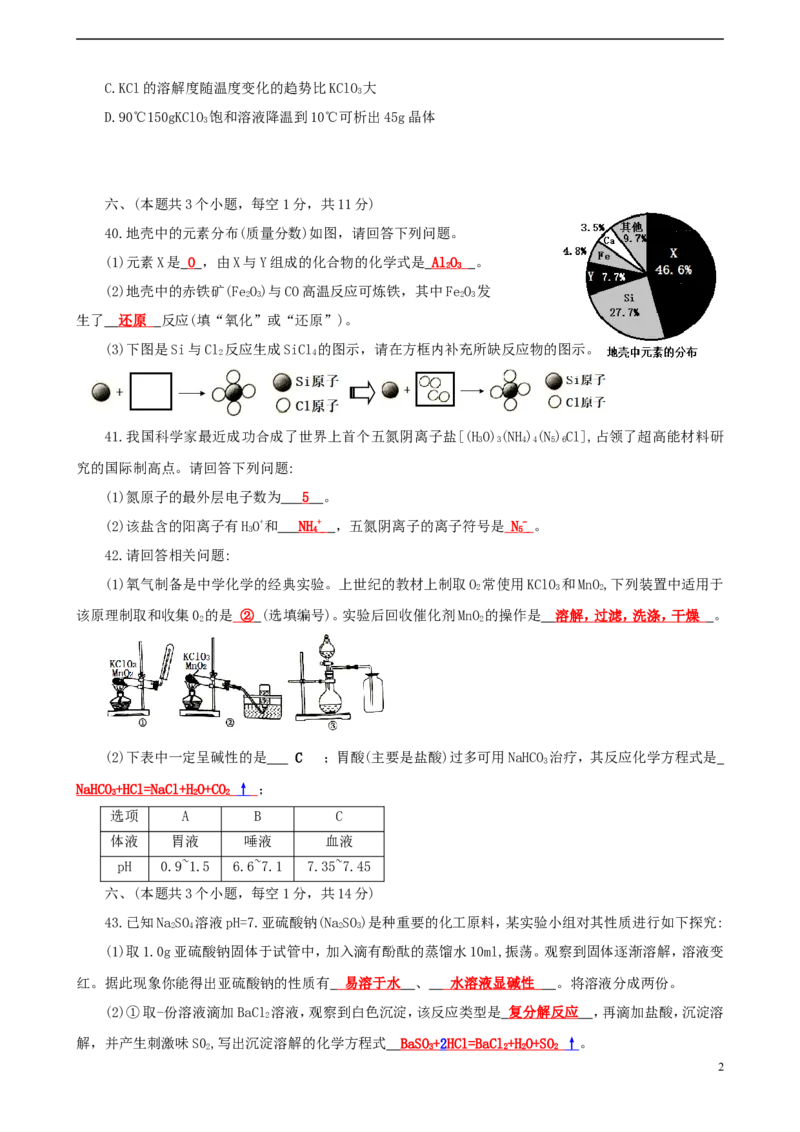
14.氯化钾(KCl)和氯酸钾(KClO)的溶解度随温度变化曲线如右图所示,下列说法正确的是 (D)
3
A.30℃时,KCl饱和溶液的溶质质量分数为35%
B.60℃时,a点对应KCl溶液恒温加水可变饱和
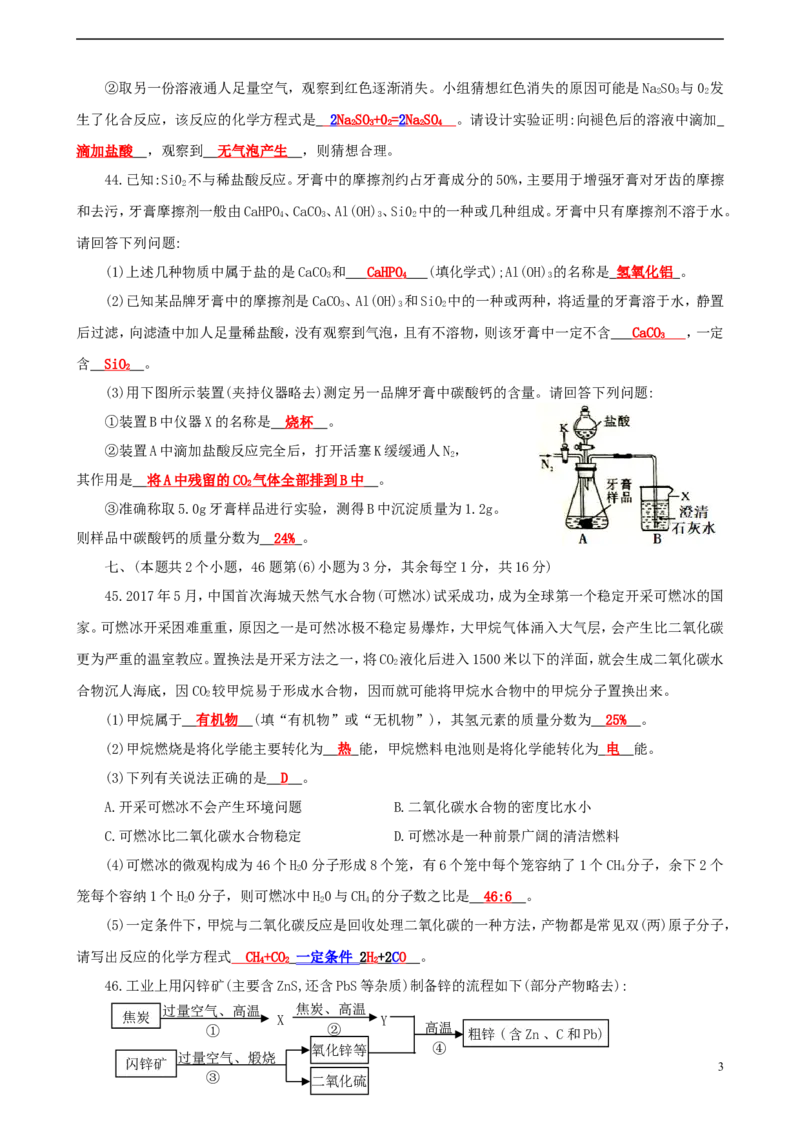
1C.KCl的溶解度随温度变化的趋势比KClO 大
3
D.90℃150gKClO 饱和溶液降温到10℃可析出45g晶体
3
六、(本题共3个小题,每空1分,共11分)
40.地壳中的元素分布(质量分数)如图,请回答下列问题。
(1)元素X是 O ,由X与Y组成的化合物的化学式是 A lO 。
2 3
(2)地壳中的赤铁矿(FeO)与CO高温反应可炼铁,其中FeO 发
2 3 2 3
生了 还原 反应(填“氧化”或“还原”)。
(3)下图是Si与Cl 反应生成SiCl 的图示,请在方框内补充所缺反应物的图示。
2 4
41.我国科学家最近成功合成了世界上首个五氮阴离子盐[(HO)(NH)(N)Cl],占领了超高能材料研
3 3 4 4 5 6
究的国际制高点。请回答下列问题:
(1)氮原子的最外层电子数为 5 。
(2)该盐含的阳离子有HO+和 N H + ,五氮阴离子的离子符号是 N - 。
3 4 5
42.请回答相关问题:
(1)氧气制备是中学化学的经典实验。上世纪的教材上制取O 常使用KClO 和MnO,下列装置中适用于
2 3 2
该原理制取和收集0 的是 ② (选填编号)。实验后回收催化剂MnO 的操作是 溶解,过滤,洗涤,干燥 。
2 2
(2)下表中一定呈碱性的是 C ;胃酸(主要是盐酸)过多可用NaHCO 治疗,其反应化学方程式是
3
NaHCO+HCl=NaCl+HO+CO ↑ ;
3 2 2
选项 A B C
体液 胃液 唾液 血液
pH 0.9~1.5 6.6~7.1 7.35~7.45
六、(本题共3个小题,每空1分,共14分)
43.已知NaSO 溶液pH=7.亚硫酸钠(NaSO)是种重要的化工原料,某实验小组对其性质进行如下探究:
2 4 2 3
(1)取1.0g亚硫酸钠固体于试管中,加入滴有酚酞的蒸馏水10ml,振荡。观察到固体逐渐溶解,溶液变
红。据此现象你能得出亚硫酸钠的性质有 易溶于水 、 水溶液显碱性 。将溶液分成两份。
(2)①取-份溶液滴加BaCl 溶液,观察到白色沉淀,该反应类型是 复分解反应 ,再滴加盐酸,沉淀溶
2
解,并产生刺激味S0,写出沉淀溶解的化学方程式 B a S O + 2 HCl=BaC l+HO+SO ↑ 。
2 3 2 2 2
2②取另一份溶液通人足量空气,观察到红色逐渐消失。小组猜想红色消失的原因可能是NaSO 与0 发
2 3 2
生了化合反应,该反应的化学方程式是 2 N a S O + 0 = 2 N a S O 。请设计实验证明:向褪色后的溶液中滴加
2 3 2 2 4
滴加盐 酸 ,观察到 无气泡产生 ,则猜想合理。
44.已知:Si0 不与稀盐酸反应。牙膏中的摩擦剂约占牙膏成分的50%,主要用于增强牙膏对牙齿的摩擦
2
和去污,牙膏摩擦剂一般由CaHPO、CaCO、Al(OH)、Si0 中的一种或几种组成。牙膏中只有摩擦剂不溶于水。
4 3 3 2
请回答下列问题:
(1)上述几种物质中属于盐的是CaCO 和 CaHP O (填化学式);Al(OH) 的名称是 氢氧化铝 。
3 4 3
(2)已知某品牌牙膏中的摩擦剂是CaCO、Al(OH) 和SiO 中的一种或两种,将适量的牙膏溶于水,静置
3 3 2
后过滤,向滤渣中加人足量稀盐酸,没有观察到气泡,且有不溶物,则该牙膏中一定不含 CaC O ,一定
3
含 Si O 。
2
(3)用下图所示装置(夹持仪器略去)测定另一品牌牙膏中碳酸钙的含量。请回答下列问题:
①装置B中仪器X的名称是 烧杯 。
②装置A中滴加盐酸反应完全后,打开活塞K缓缓通人N,
2
其作用是 将 A 中残留的 C O 气体全部排到 B 中 。
2
③准确称取5.0g牙膏样品进行实验,测得B中沉淀质量为1.2g。
则样品中碳酸钙的质量分数为 24 % 。
七、(本题共2个小题,46题第(6)小题为3分,其余每空1分,共16分)
45.2017年5月,中国首次海城天然气水合物(可燃冰)试采成功,成为全球第一个稳定开采可燃冰的国
家。可燃冰开采困难重重,原因之一是可然冰极不稳定易爆炸,大甲烷气体涌入大气层,会产生比二氧化碳
更为严重的温室教应。置换法是开采方法之一,将CO 液化后进入1500米以下的洋面,就会生成二氧化碳水
2
合物沉人海底,因CO 较甲烷易于形成水合物,因而就可能将甲烷水合物中的甲烷分子置换出来。
2
(1)甲烷属于 有机物 (填“有机物”或“无机物”),其氢元素的质量分数为 25 % 。
(2)甲烷燃烧是将化学能主要转化为 热 能,甲烷燃料电池则是将化学能转化为 电 能。
(3)下列有关说法正确的是 D 。
A.开采可燃冰不会产生环境问题 B.二氧化碳水合物的密度比水小
C.可燃冰比二氧化碳水合物稳定 D.可燃冰是一种前景广阔的清洁燃料
(4)可燃冰的微观构成为46个H0分子形成8个笼,有6个笼中每个笼容纳了1个CH 分子,余下2个
2 4
笼每个容纳1个H0分子,则可燃冰中H0与CH 的分子数之比是 46: 6 。
2 2 4
(5)一定条件下,甲烷与二氧化碳反应是回收处理二氧化碳的一种方法,产物都是常见双(两)原子分子,
请写出反应的化学方程式 C H+CO 一定条件 2 H + 2 C O 。
4 2 2
46.工业上用闪锌矿(主要含ZnS,还含PbS等杂质)制备锌的流程如下(部分产物略去):
过量空气、高温 焦炭、高温
焦炭 X Y
① ② 高温 粗锌(含Zn、C和Pb)
氧化锌等 ④
过量空气、煅烧
闪锌矿
3
③
二氧化硫(1)X的化学式是 C O ,图中用过量空气的目的是 使焦炭完全反应 。
2
(2)①~④中属于化合反应的是 ①② 。
(3)Zn 能 (填“能”或“不能”)与PbCl 溶被反应。
2
(4)写出反应③中生成ZnO的化学方程式 2 Zn S + 3 O 高温 2 Z n O + 2 S O 。
2 2
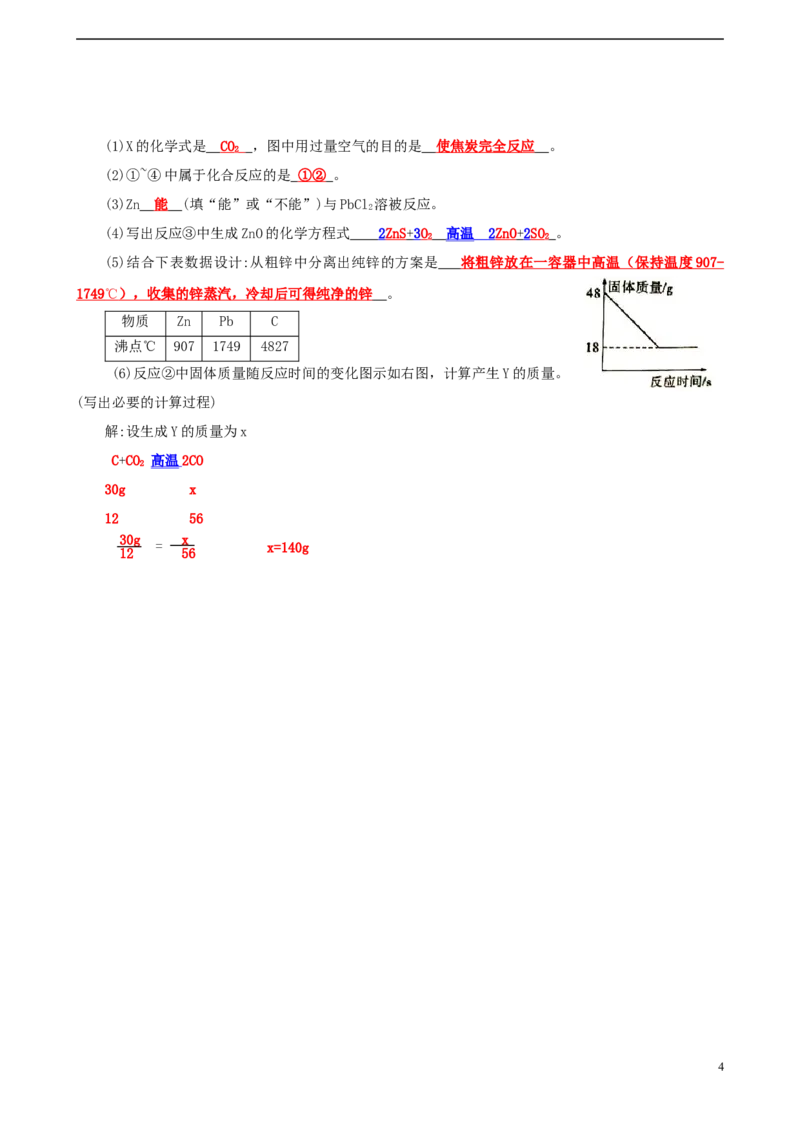
(5)结合下表数据设计:从粗锌中分离出纯锌的方案是 将粗锌放在一容器中高温(保持温度 907 -
174 9 ℃ ),收集的锌蒸汽,冷却后可得纯净的锌 。
物质 Zn Pb C
沸点℃ 907 1749 4827
(6)反应②中固体质量随反应时间的变化图示如右图,计算产生Y的质量。
(写出必要的计算过程)
解:设生成Y的质量为x
C+CO 高温 2CO
2
30g x
12 56
30g x
= x=140g
12 56
4