文档内容
四川省泸州市2018年中考化学真题试题
一、单选题(24分)
1.(3分)常温下,下列物质呈气态的是( )
A.酒精 B.纯碱 C.氨 D.硫酸
【解答】解:A、常温下酒精是液体,故错误;
B、常温下纯碱是固体,故错误;
C、常温下氨气是气体,故正确;
D、常温下硫酸是液体,故错误;
故选:C。
2.(3分)分类是科学研究的重要方法,下列物质对应的类别不正确的是( )
选项 A B C D
物质 HO O CHCOOH Cu(OH)
2 2 3 3 2
类别 氧化物 化合物 酸 碱
A.A B.B C.C D.D
【解答】解:A、HO 是由氢元素和氧元素两种元素组成的化合物,属于氧化物,故说法正确;
2 2
B、O 是由一种元素组成的纯净物,属于单质,故说法错误。
3
C、CHCOOH是由氢离子和酸根离子构成的化合物,属于酸,故说法正确;
3
D、Cu(OH) 是氢氧根离子和金属离子构成的化合物,故说法正确。
2
故选:B。
3.(3分)下列说法不正确的是( )
A.普通玻璃是纯净物
B.农药波尔多液不宜装在铁桶内
C.氢能是一种无污染的能源
D.向煤炭中加人石灰石可减少SO 的排放
2
【解答】解:
A、普通玻璃成分是:二氧化硅,硅酸钠和硅酸钙,比例根据原料比例不同而不同,为混合物,
故错误;
B、配制波尔多液需要用到硫酸铜溶液,而铁能与硫酸铜溶液发生反应,故正确;
C、氢能的优点是放热量高,生成物是水,无污染,是一种无污染的能源,故正确; D、煤炭中
的硫燃烧时生成二氧化硫气体,在高温下可以和碳酸钙或生石灰反应,最终生成硫酸钙而被
除去,减少了对环境的污染,故正确。
1故选:A。
4.(3分)硒是人体必需的微量元素,甲图是其原子结构示意图,乙图摘自元素周期表,部分
信息略去。据此判断下列叙述正确的是( )
A.硒原子质量为78.96g B.y=4
C.Se是非金属元素 D.硒与氧位于同一周期
【解答】解:A、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的
相对原子质量为78.96,相对原子质量单位是“1”,不是“克”,故选项说法错误。
B、根据元素周期表中的一格可知,左上角的数字为34,表示原子序数为34;根据原子中原子
序数=核电荷数=质子数=核外电子数,则该元素原子的核内质子数和核外电子数为34,甲图
是其原子结构示意图,则x=34,34=2+8+18+y,y=6,故选项说法错误。
C、Se是硒元素的元素符号,带“石”字旁,属于固态非金属元素,故选项说法正确。
D、周期数=原子核外电子层数,硒元素的原子核外有4个电子层,则在元素周期表中,该元素
位于第4周期;而氧元素为于第二周期,故选项说法错误。
故选:C。
5.(3分)下列说法不正确的是( )
A.食物纤维的作用是给人体提供能量
B.摄入重金属盐会导致中毒
C.缺钙会导致骨质疏松
D.海洛因是毒品
【解答】解:A.食物纤维的作用是促进胃肠蠕动,不能给人体提供能量,故错误;
B.重金属盐有毒,摄入重金属盐会导致中毒,故正确;
C.来年人缺钙易患骨质疏松症,故正确;
D.海洛因是一种毒品,故正确。
故选:A。
6.(3分)下列实验不能得出对应结论的是 ( )
选 操作 现象 结论
项
A 向50mL集满CO 的软塑料瓶中加入50mL水,迅速 塑料瓶变瘪 CO 能溶于水
2 2
拧紧瓶盖,振荡
2B 将铁钉放入CuSO 溶液中 铁钉表面析出红 铁比铜活泼
4
色物质
C 苹果片上滴加碘水 苹果片表面变蓝 苹果含淀粉
D 向某无色溶液滴加石蕊 溶液变红 无色溶液是
盐酸
A.A B.B C.C D.D
【解答】解:A、向50mL集满CO 的软塑料瓶中加入50mL水,迅速拧紧瓶盖,振荡,塑料瓶变瘪,
2
可以得出是CO 能溶于水结论,故选项实验能得出对应结论。B、将铁钉放入CuSO 溶液中生成
2 4
硫酸亚铁溶液和铜,铁钉表面析出红色物质,说明发生了置换反应,可以得出铁比铜活泼的
结论,故选项实验能得出对应结论。
C、淀粉遇碘变蓝色,苹果片上滴加碘水,苹果片表面变蓝,说明苹果含淀粉,故选项实验能得
出对应结论。
D、向某无色溶液滴加石蕊,溶液变红,无色溶液不一定是盐酸,也可能碳酸、硫酸等酸性物质,
故选项实验不能得出对应结论。
故选:D。
7.(3分)下列有关反应的化学方程式正确,且反应前后有元素化合价升高和降低的是 (
)
A.碳酸铵与熟石灰混合:(NH)CO+Ca(OH)=CaCO+2HO+2NH↑
4 2 3 2 3 2 3
B.MgCl 熔融电解制Mg:MgCl Mg+Cl↑
2 2 2
C.铝置换银:Al+AgNO=Ag+AlNO
3 3
D.氧化亚铁和盐酸混合:FeO+2HCl=FeCl+HO
2 2
【解答】解:A.反应方程式正确,但反应前后没有元素化合价升降,不合题意; B.反应方程式
正确,且镁元素由+2价变成0价;氯元素由﹣1价变成0价,符合题意; C.化学方程式中硝
酸铝的化学式书写错误,正确的应为:Al+3AgNO=3Ag+Al(NO),不合题意;
3 3 3
D.反应方程式正确,但反应前后没有元素化合价升降,不合题意。
故选:B。
8.(3分)氯化钾(KCl)和氯酸钾(KClO)的溶解度随温度变化曲线如图所示,下列说法正确
3
的是 ( )
3A.30℃时,KCl饱和溶液的溶质质量分数为35%
B.60℃时,a点对应KCl溶液恒温加水可变饱和
C.KCl的溶解度随温度变化的趋势比KClO 大
3
D.90℃150gKClO 饱和溶液降温到10℃可析出45g晶体
3
【解答】解:A、30℃时,氯化钾的溶解度是35g,所以KCl饱和溶液的溶质质量分数为:
×100%=25.9%,故A错误;
B、60℃时,a点对应KCl溶液是氯化钾的不饱和溶液,所以恒温蒸发溶剂可变饱和,故B错误;
C、通过分析溶解度曲线可知,KCl的溶解度随温度变化的趋势比KClO 小,故C错误;
3
D、90℃时,氯酸钾的溶解度是50g,所以150gKClO 饱和溶液中含有氯酸钾质量为:50g,降温
3
到10℃,溶解度为:5g,所以可析出晶体质量为50g﹣5g=45g,故D正确。
故选:D。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解
度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
二、(本题共3个小题,每空1分,共11分)
9.(4分)地壳中的元素分布(质量分数)如图,请回答下列问题。
(1)元素X是 氧 ,由X与Y组成的化合物的化学式是 A lO 。
2 3
(2)地壳中的赤铁矿(FeO)与CO高温反应可炼铁,其中FeO 发生了 还原 反应(填“氧
2 3 2 3
化”或“还原”)。
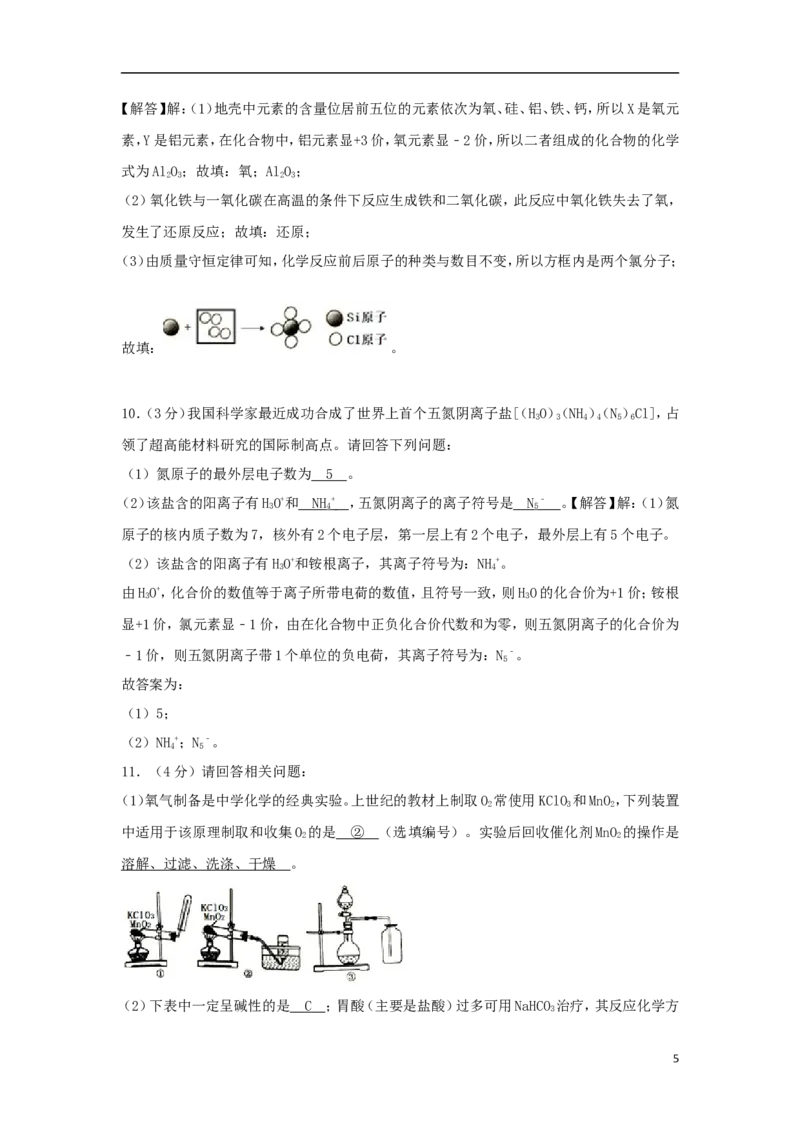
(3)如图是Si与Cl 反应生成SiCl 的图示,请在方框内补充所缺反应物的图示。
2 4
4【解答】解:(1)地壳中元素的含量位居前五位的元素依次为氧、硅、铝、铁、钙,所以X是氧元
素,Y是铝元素,在化合物中,铝元素显+3价,氧元素显﹣2价,所以二者组成的化合物的化学
式为AlO;故填:氧;AlO;
2 3 2 3
(2)氧化铁与一氧化碳在高温的条件下反应生成铁和二氧化碳,此反应中氧化铁失去了氧,
发生了还原反应;故填:还原;
(3)由质量守恒定律可知,化学反应前后原子的种类与数目不变,所以方框内是两个氯分子;
故填: 。
10.(3分)我国科学家最近成功合成了世界上首个五氮阴离子盐[(HO)(NH)(N)Cl],占
3 3 4 4 5 6
领了超高能材料研究的国际制高点。请回答下列问题:
(1)氮原子的最外层电子数为 5 。
(2)该盐含的阳离子有HO+和 N H + ,五氮阴离子的离子符号是 N ﹣ 。【解答】解:(1)氮
3 4 5
原子的核内质子数为7,核外有2个电子层,第一层上有2个电子,最外层上有5个电子。
(2)该盐含的阳离子有HO+和铵根离子,其离子符号为:NH+。
3 4
由HO+,化合价的数值等于离子所带电荷的数值,且符号一致,则HO的化合价为+1价;铵根
3 3
显+1价,氯元素显﹣1价,由在化合物中正负化合价代数和为零,则五氮阴离子的化合价为
﹣1价,则五氮阴离子带1个单位的负电荷,其离子符号为:N﹣。
5
故答案为:
(1)5;
(2)NH+;N﹣。
4 5
11.(4分)请回答相关问题:
(1)氧气制备是中学化学的经典实验。上世纪的教材上制取O 常使用KClO 和MnO,下列装置
2 3 2
中适用于该原理制取和收集O 的是 ② (选填编号)。实验后回收催化剂MnO 的操作是
2 2
溶解、过滤、洗涤、干燥 。
(2)下表中一定呈碱性的是 C ;胃酸(主要是盐酸)过多可用NaHCO 治疗,其反应化学方
3
5程式是 NaHC O + HCl=NaC l + H O + C O ↑ ;
3 2 2
选项 A B C
体液 胃液 唾液 血液
pH 0.9~1.5 6.6~7.1 7.35~7.45
【解答】解:(1)氯酸钾在二氧化锰的催化作用下在加热条件下生成氯化钾和氧气,属于固体
加热型;氧气不易溶于水,密度比空气的大,能用排水法、向上排空气法收集,即装置中适用
于该原理制取和收集O 的是②。
2
实验后得到的是氯化钾和二氧化锰的混合物,氯化钾易溶于水,二氧化锰难溶于水,可采用
加水溶解、过滤、洗涤、干燥的方法回收催化剂MnO。
2
(2)血液的pH范围是7.35~7.45,大于7,一定呈碱性。唾液的pH范围是6.6~7.1,可能显
酸性、中性或碱性。
碳酸氢钠与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:
NaHCO+HCl=NaCl+HO+CO↑。
3 2 2
故答案为:
(1)②;溶解、过滤、洗涤、干燥;
(2)C;NaHCO+HCl=NaCl+HO+CO↑。
3 2 2
三、(本题共3个小题,每空1分,共14分)
12.(7分)已知NaSO 溶液pH=7.亚硫酸钠(NaSO)是种重要的化工原料,某实验小组对其性
2 4 2 3
质进行如下探究:
(1)取1.0g亚硫酸钠固体于试管中,加入滴有酚酞的蒸馏水10mL,振荡。观察到固体逐渐溶
解,溶液变红。据此现象你能得出亚硫酸钠的性质有 易溶于水 、 水溶液显碱性 。将溶
液分成两份。
(2)①取一份溶液滴加BaCl 溶液,观察到白色沉淀,该反应类型是 复分解反应 ,再滴加
2
盐 酸 , 沉 淀 溶 解 , 并 产 生 刺 激 味 SO , 写 出 沉 淀 溶 解 的 化 学 方 程 式
2
BaSO + 2HCl=BaC l + H O + S O ↑ 。
3 2 2 2
②取另一份溶液通入足量空气,观察到红色逐渐消失。小组猜想红色消失的原因可能是
NaSO 与O 发生了化合反应,该反应的化学方程式是 2N aSO + O=2NaSO 。请设计实验证
2 3 2 2 3 2 2 4
明:向褪色后的溶液中滴加 滴加盐酸 ,观察到 无气泡产生 ,则猜想合理。
【解答】解:(1)取1.0g亚硫酸钠固体于试管中,加入滴有酚酞的蒸馏水10mL,振荡。观察到
固体逐渐溶解,说明亚硫酸钠易溶于水;溶液变红,说明亚硫酸钠水溶液显碱性。(2)①取一
份溶液滴加BaCl 溶液,观察到白色沉淀,是因为亚硫酸钠与氯化钡反应生成了亚硫酸钡沉
2
6淀和氯化钠,该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反
应。
再滴加盐酸,沉淀溶解,并产生刺激味SO,是因为亚硫酸钡与盐酸反应生成氯化钡、水和二
2
氧化碳,反应的化学方程式为:BaSO+2HCl=BaCl+HO+SO↑。
3 2 2 2
②NaSO 与O 发生了化合反应,反应的化学方程式为2NaSO+O=2NaSO;亚硫酸钠能与稀盐
2 3 2 2 3 2 2 4
酸反应生成二氧化硫气体,硫酸钠不能与稀盐酸反应,故可向褪色后的溶液中滴加稀盐酸,
观察到无气泡产生,说明不含亚硫酸钠。
故答案为:
(1)易溶于水;水溶液显碱性;
(2)①复分解反应;BaSO+2HCl=BaCl+HO+SO↑;
3 2 2 2
②2NaSO+O=2NaSO;稀盐酸;无气泡产生。
2 3 2 2 4
13.(7分)已知:SiO 不与稀盐酸反应。牙膏中的摩擦剂约占牙膏成分的50%,主要用于增强
2
牙膏对牙齿的摩擦和去污,牙膏摩擦剂一般由CaHPO、CaCO、Al(OH)、SiO 中的一种或几种
4 3 3 2
组成。牙膏中只有摩擦剂不溶于水。请回答下列问题:
(1)上述几种物质中属于盐的是CaCO 和 CaHP O (填化学式);Al(OH)的名称是 氢氧化
3 4 3
铝 。
(2)已知某品牌牙膏中的摩擦剂是CaCO、Al(OH)和SiO 中的一种或两种,将适量的牙膏溶
3 3 2
于水,静置后过滤,向滤渣中加人足量稀盐酸,没有观察到气泡,且有不溶物,则该牙膏中一
定不含 CaC O ,一定含 Si O 。
3 2
(3)用如图所示装置(夹持仪器略去)测定另一品牌牙膏中碳酸钙的含量。请回答下列问题:
①装置B中仪器X的名称是 烧杯 。
②装置A中滴加盐酸反应完全后,打开活塞K缓缓通入N,其作用是 将 A 中残留的 C O 气体
2 2
全部排到 B 中 。
③准确称取5.0g牙膏样品进行实验,测得B中沉淀质量为1.2g。则样品中碳酸钙的质量分
数为 24 % 。
7【分析】由金属离子和酸根离子组成的化合物属于盐;
稀盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,和氢氧化铝反应生成氯化铝和水;
二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水。
【解答】解:(1)上述几种物质中属于盐的是CaCO 和CaHPO,Al(OH)的名称是氢氧化铝。
3 4 3
故填:CaHPO;氢氧化铝。
4
(2)将适量的牙膏溶于水,静置后过滤,向滤渣中加人足量稀盐酸,没有观察到气泡,则该牙
膏中一定不含碳酸钙,且有不溶物,则一定含SiO。
2
故填:CaCO;SiO。
3 2
(3)①装置B中仪器X的名称是烧杯。
故填:烧杯。
②装置A中滴加盐酸反应完全后,打开活塞K缓缓通入N,其作用是将A中残留的CO 气体全
2 2
部排到B中,使实验结果更准确。
故填:将A中残留的CO 气体全部排到B中。
2
③设牙膏中碳酸钙质量为x,
由CaCO+2HCl═CaCl+HO+CO↑,Ca(OH)+CO═CaCO↓+HO可知,CaCO~CO~CaCO↓,
3 2 2 2 2 2 3 2 3 2 3
CaCO~CO~CaCO↓,
3 2 3
100 100
x 1.2g
= ,
x=1.2g,
则样品中碳酸钙的质量分数为: ×100%=24%。故填:24%。
七、(本题共2个小题,46题第(6)小题为3分,其余每空1分,共16分)14.(7分)2017年5
月,中国首次海城天然气水合物(可燃冰)试采成功,成为全球第一个稳定开采可燃冰的国家。
可燃冰开采困难重重,原因之一是可然冰极不稳定易爆炸,大甲烷气体涌入大气层,会产生
比二氧化碳更为严重的温室教应。置换法是开采方法之一,将CO 液化后进入1500米以下的
2
洋面,就会生成二氧化碳水合物沉人海底,因CO 较甲烷易于形成水合物,因而就可能将甲烷
2
水合物中的甲烷分子置换出来。
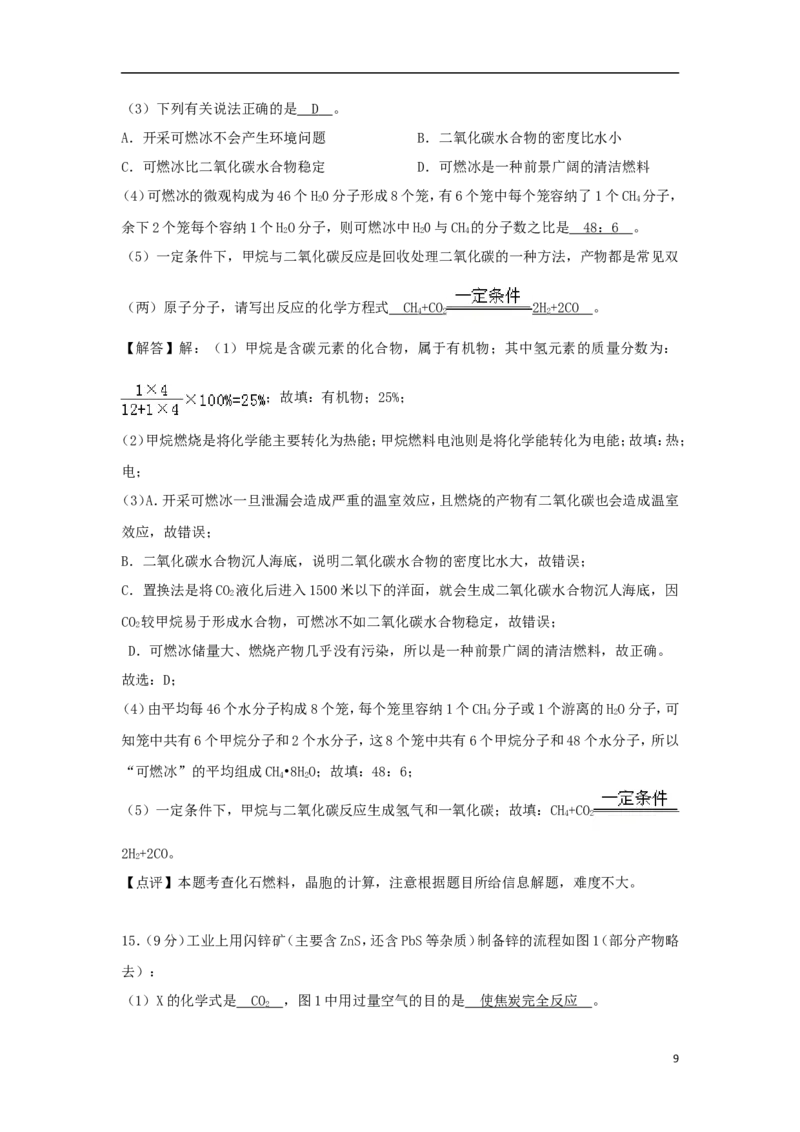
(1)甲烷属于 有机物 (填“有机物”或“无机物”),其氢元素的质量分数为 25 % 。
(2)甲烷燃烧是将化学能主要转化为 热 能,甲烷燃料电池则是将化学能转化为 电 能。
8(3)下列有关说法正确的是 D 。
A.开采可燃冰不会产生环境问题 B.二氧化碳水合物的密度比水小
C.可燃冰比二氧化碳水合物稳定 D.可燃冰是一种前景广阔的清洁燃料
(4)可燃冰的微观构成为46个H0分子形成8个笼,有6个笼中每个笼容纳了1个CH 分子,
2 4
余下2个笼每个容纳1个HO分子,则可燃冰中H0与CH 的分子数之比是 4 8 : 6 。
2 2 4
(5)一定条件下,甲烷与二氧化碳反应是回收处理二氧化碳的一种方法,产物都是常见双
(两)原子分子,请写出反应的化学方程式 C H + C O 2H + 2C O 。
4 2 2
【解答】解:(1)甲烷是含碳元素的化合物,属于有机物;其中氢元素的质量分数为:
;故填:有机物;25%;
(2)甲烷燃烧是将化学能主要转化为热能;甲烷燃料电池则是将化学能转化为电能;故填:热;
电;
(3)A.开采可燃冰一旦泄漏会造成严重的温室效应,且燃烧的产物有二氧化碳也会造成温室
效应,故错误;
B.二氧化碳水合物沉人海底,说明二氧化碳水合物的密度比水大,故错误;
C.置换法是将CO 液化后进入1500米以下的洋面,就会生成二氧化碳水合物沉人海底,因
2
CO 较甲烷易于形成水合物,可燃冰不如二氧化碳水合物稳定,故错误;
2
D.可燃冰储量大、燃烧产物几乎没有污染,所以是一种前景广阔的清洁燃料,故正确。
故选:D;
(4)由平均每46个水分子构成8个笼,每个笼里容纳1个CH 分子或1个游离的HO分子,可
4 2
知笼中共有6个甲烷分子和2个水分子,这8个笼中共有6个甲烷分子和48个水分子,所以
“可燃冰”的平均组成CH•8HO;故填:48:6;
4 2
(5)一定条件下,甲烷与二氧化碳反应生成氢气和一氧化碳;故填:CH+CO
4 2
2H+2CO。
2
【点评】本题考查化石燃料,晶胞的计算,注意根据题目所给信息解题,难度不大。
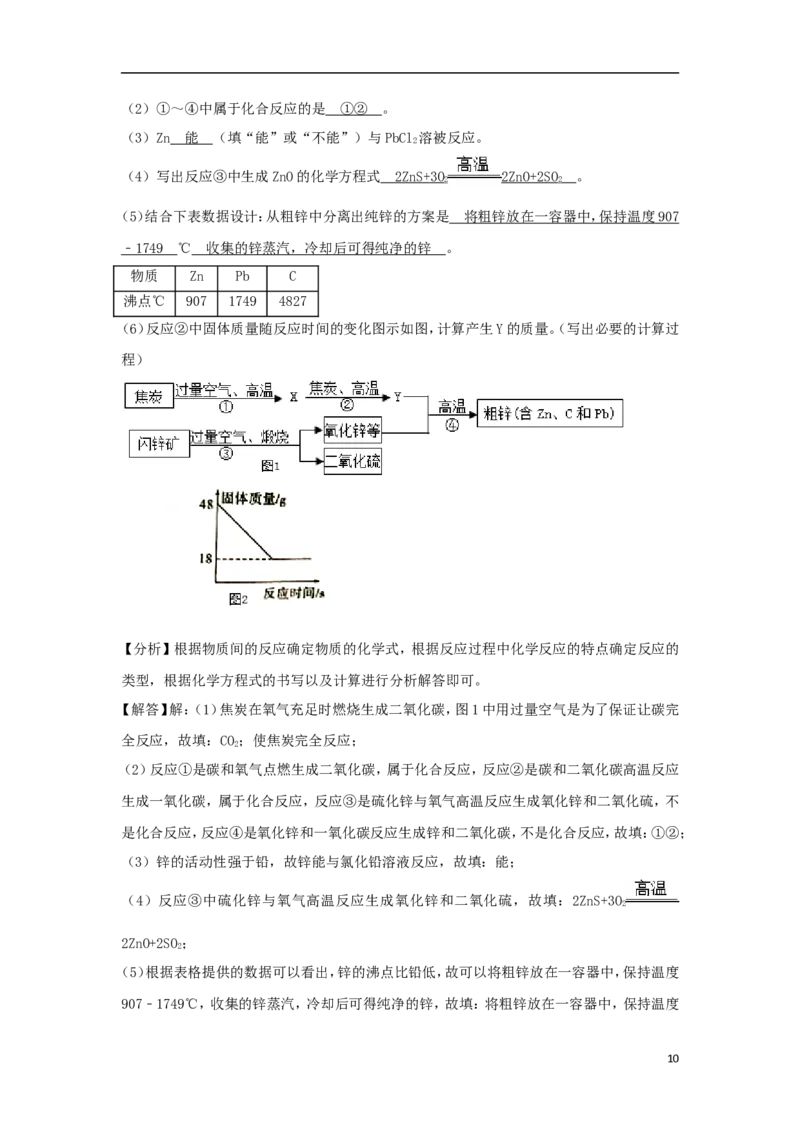
15.(9分)工业上用闪锌矿(主要含ZnS,还含PbS等杂质)制备锌的流程如图1(部分产物略
去):
(1)X的化学式是 C O ,图1中用过量空气的目的是 使焦炭完全反应 。
2
9(2)①~④中属于化合反应的是 ①② 。
(3)Zn 能 (填“能”或“不能”)与PbCl 溶被反应。
2
(4)写出反应③中生成ZnO的化学方程式 2Zn S + 3 O 2Zn O + 2S O 。
2 2
(5)结合下表数据设计:从粗锌中分离出纯锌的方案是 将粗锌放在一容器中,保持温度 90 7
﹣174 9 ℃ 收集的锌蒸汽,冷却后可得纯净的锌 。
物质 Zn Pb C
沸点℃ 907 1749 4827
(6)反应②中固体质量随反应时间的变化图示如图,计算产生Y的质量。(写出必要的计算过
程)
【分析】根据物质间的反应确定物质的化学式,根据反应过程中化学反应的特点确定反应的
类型,根据化学方程式的书写以及计算进行分析解答即可。
【解答】解:(1)焦炭在氧气充足时燃烧生成二氧化碳,图1中用过量空气是为了保证让碳完
全反应,故填:CO;使焦炭完全反应;
2
(2)反应①是碳和氧气点燃生成二氧化碳,属于化合反应,反应②是碳和二氧化碳高温反应
生成一氧化碳,属于化合反应,反应③是硫化锌与氧气高温反应生成氧化锌和二氧化硫,不
是化合反应,反应④是氧化锌和一氧化碳反应生成锌和二氧化碳,不是化合反应,故填:①②;
(3)锌的活动性强于铅,故锌能与氯化铅溶液反应,故填:能;
(4)反应③中硫化锌与氧气高温反应生成氧化锌和二氧化硫,故填:2ZnS+3O
2
2ZnO+2SO;
2
(5)根据表格提供的数据可以看出,锌的沸点比铅低,故可以将粗锌放在一容器中,保持温度
907﹣1749℃,收集的锌蒸汽,冷却后可得纯净的锌,故填:将粗锌放在一容器中,保持温度
10907﹣1749;收集的锌蒸汽,冷却后可得纯净的锌;
(6)设生成Y的质量为x
C+CO 2CO
2
12 56
30g x
x=140g
答:产生Y的质量为140g。
11