文档内容
四川省绵阳市2015年中考化学试卷
一、选择题(每小题0分,共63分.每个小题只有一个选项最符合题目要求)
1.日常生产、生活中化学无处不在,下列说法正确的是( )
A.利用活性炭的吸附性可以将硬水转化为软水
B.二氧化碳灭火器的灭火原理是隔绝空气和提高可燃物的着火点
C.在金属表面除油或刷漆的目的是隔绝氧气和水蒸气,防止腐蚀
D.化学肥料有利于植物的生长,大量使用不会引起环境污染
2.分类法是学习化学常用的一种方法.下列选项不符合如图关系(a、b并列关系,分别包含c、d)的是
( )
选项 a b c d
A 化学变化 物理变化 铁锅生锈 蔗糖溶解
B 单质 化合物 C 纯净的空气
60
C 无机化合物 有机化合物 CuSO•5HO 葡萄糖
4 2
D 纯净物 混合物 冰水混合物 食盐溶液
A.A B.B C.C D.D
3.随着我国综合实力的增强,人民生活水平的日益提高,汽车已走进千家万户.下列说法不正确的是
( )
A.汽车轴承和骨架是由合金制成,轮胎是由合成橡胶制成
B.汽车改用压缩天然气或液化石油气做燃料,可以减少对空气的污染
C.少开私家车,多乘坐公共交通工具,符合“节能减碳”的环保理念
D.在加油站附近能闻到汽油的气味,是因为分子间存在一定的距离
4.(2015•绵阳)锰(Mn)是维持人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛
应用.结合图中信息,下列叙述正确的是( )
A.锰原子核内有25个质子,一个锰原子的质量是54.94g
B.锰原子核外有4个电子层,其化学性质由最内层电子决定
C.MnO 属于氧化物,在HO 分解制O 的实验中做催化剂
2 2 2 2
D.KMnO 为紫黑色固体,易溶于水、汽油等溶剂,形成紫红色溶液
4
5.(2015•绵阳)分析推理是学习化学常用的一种方法.下列推理正确的是( )
A.Zn置换H 是有元素化合价变化的置换反应,则所有置换反应都有元素化合价变化
2
B.酸碱中和反应有盐和HO生成的反应一定是酸碱中和反应
2
C.一定温度下的不饱和溶液还能溶解溶质,则一定温下的饱和溶液不能溶解任何物质
D.CH 充分燃烧生成的HO和CO,则充分燃烧生成HO和CO 的物质只含C、H元素
4 2 2 2 2
6.(2015•绵阳)工业上可利用黄铁矿(主要成分是FeS)煅烧的产物冶炼铁和生产硫酸,其反应方程如下:
2
①4FeS+11O 2FeO+8SO②FeO+3CO 2Fe+3CO③2SO+O 2SO④SO+HO═HSO
2 2 2 3 2 2 3 2 2 2 3 2 2 2 4
1下列说法不正确的是( )
A.反应①②③均有元素化合价发生变化
B.反应①②不属于四种基本反应类型中的任何一种,反应③④属于化合反应
C.将5g SO 溶于95g水形成溶液,其溶液的质量分数大于5%
2
D.将100g蒸馏水加水100g 98%的浓硫酸中,可配制200g质量分数为49%的稀硫酸
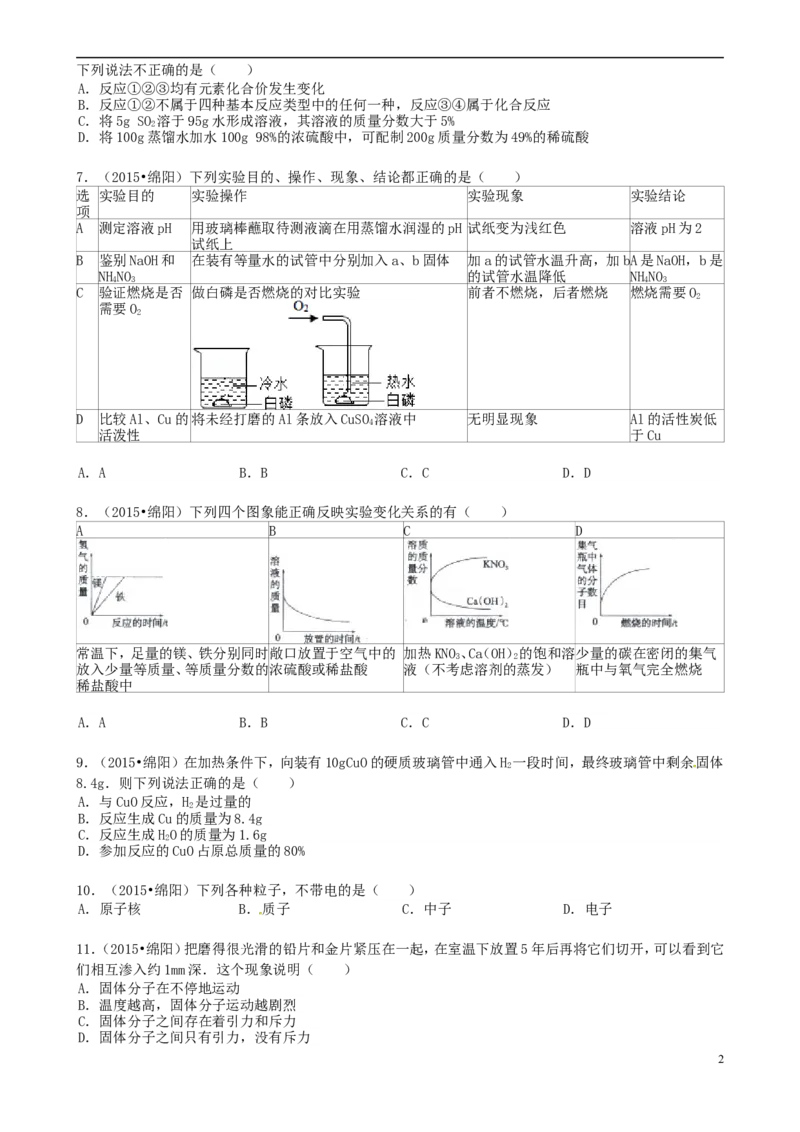
7.(2015•绵阳)下列实验目的、操作、现象、结论都正确的是( )
选 实验目的 实验操作 实验现象 实验结论
项
A 测定溶液pH 用玻璃棒蘸取待测液滴在用蒸馏水润湿的pH 试纸变为浅红色 溶液pH为2
试纸上
B 鉴别NaOH和 在装有等量水的试管中分别加入a、b固体 加a的试管水温升高,加bA是NaOH,b是
NHNO 的试管水温降低 NHNO
4 3 4 3
C 验证燃烧是否 做白磷是否燃烧的对比实验 前者不燃烧,后者燃烧 燃烧需要O
2
需要O
2
D 比较Al、Cu的将未经打磨的Al条放入CuSO 溶液中 无明显现象 Al的活性炭低
4
活泼性 于Cu
A.A B.B C.C D.D
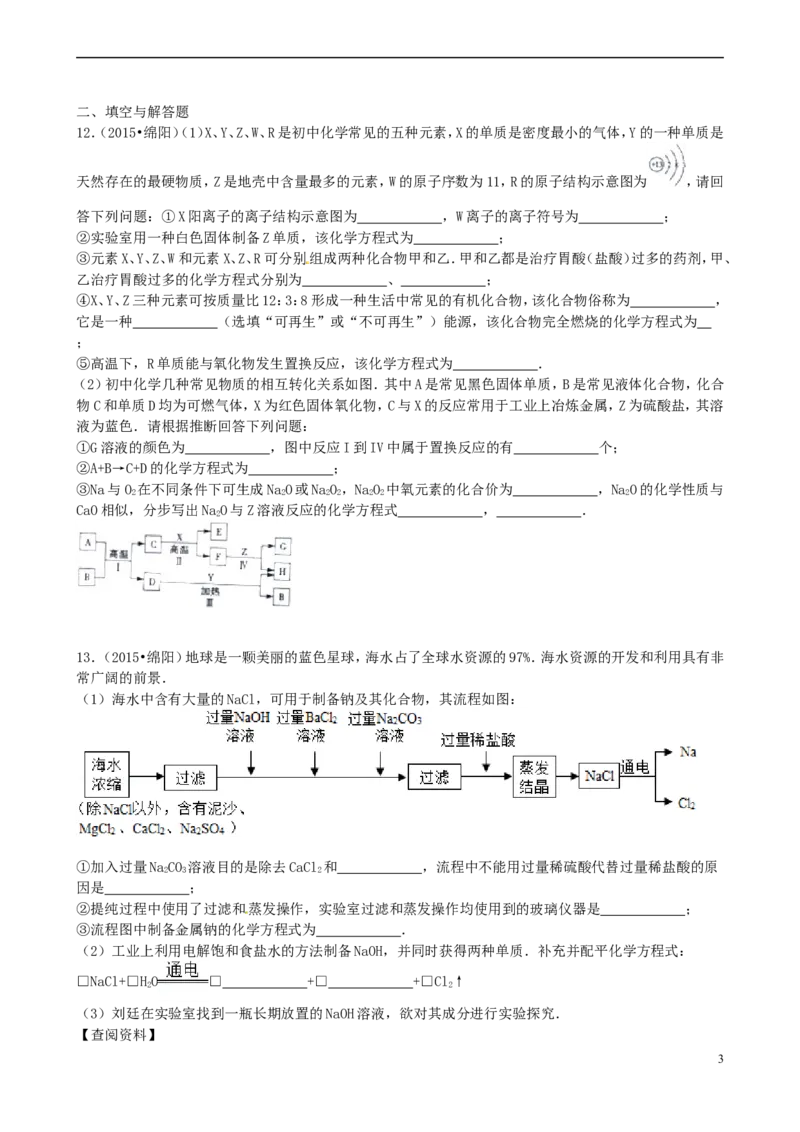
8.(2015•绵阳)下列四个图象能正确反映实验变化关系的有( )
A B C D
常温下,足量的镁、铁分别同时敞口放置于空气中的 加热KNO、Ca(OH)的饱和溶少量的碳在密闭的集气
3 2
放入少量等质量、等质量分数的浓硫酸或稀盐酸 液(不考虑溶剂的蒸发) 瓶中与氧气完全燃烧
稀盐酸中
A.A B.B C.C D.D
9.(2015•绵阳)在加热条件下,向装有10gCuO的硬质玻璃管中通入H 一段时间,最终玻璃管中剩余固体
2
8.4g.则下列说法正确的是( )
A.与CuO反应,H 是过量的
2
B.反应生成Cu的质量为8.4g
C.反应生成HO的质量为1.6g
2
D.参加反应的CuO占原总质量的80%
10.(2015•绵阳)下列各种粒子,不带电的是( )
A.原子核 B.质子 C.中子 D.电子
11.(2015•绵阳)把磨得很光滑的铅片和金片紧压在一起,在室温下放置5年后再将它们切开,可以看到它
们相互渗入约1mm深.这个现象说明( )
A.固体分子在不停地运动
B.温度越高,固体分子运动越剧烈
C.固体分子之间存在着引力和斥力
D.固体分子之间只有引力,没有斥力
2二、填空与解答题
12.(2015•绵阳)(1)X、Y、Z、W、R是初中化学常见的五种元素,X的单质是密度最小的气体,Y的一种单质是
天然存在的最硬物质,Z是地壳中含量最多的元素,W的原子序数为11,R的原子结构示意图为 ,请回
答下列问题:①X阳离子的离子结构示意图为 ,W离子的离子符号为 ;
②实验室用一种白色固体制备Z单质,该化学方程式为 ;
③元素X、Y、Z、W和元素X、Z、R可分别组成两种化合物甲和乙.甲和乙都是治疗胃酸(盐酸)过多的药剂,甲、
乙治疗胃酸过多的化学方程式分别为 、 ;
④X、Y、Z三种元素可按质量比12:3:8形成一种生活中常见的有机化合物,该化合物俗称为 ,
它是一种 (选填“可再生”或“不可再生”)能源,该化合物完全燃烧的化学方程式为
;
⑤高温下,R单质能与氧化物发生置换反应,该化学方程式为 .
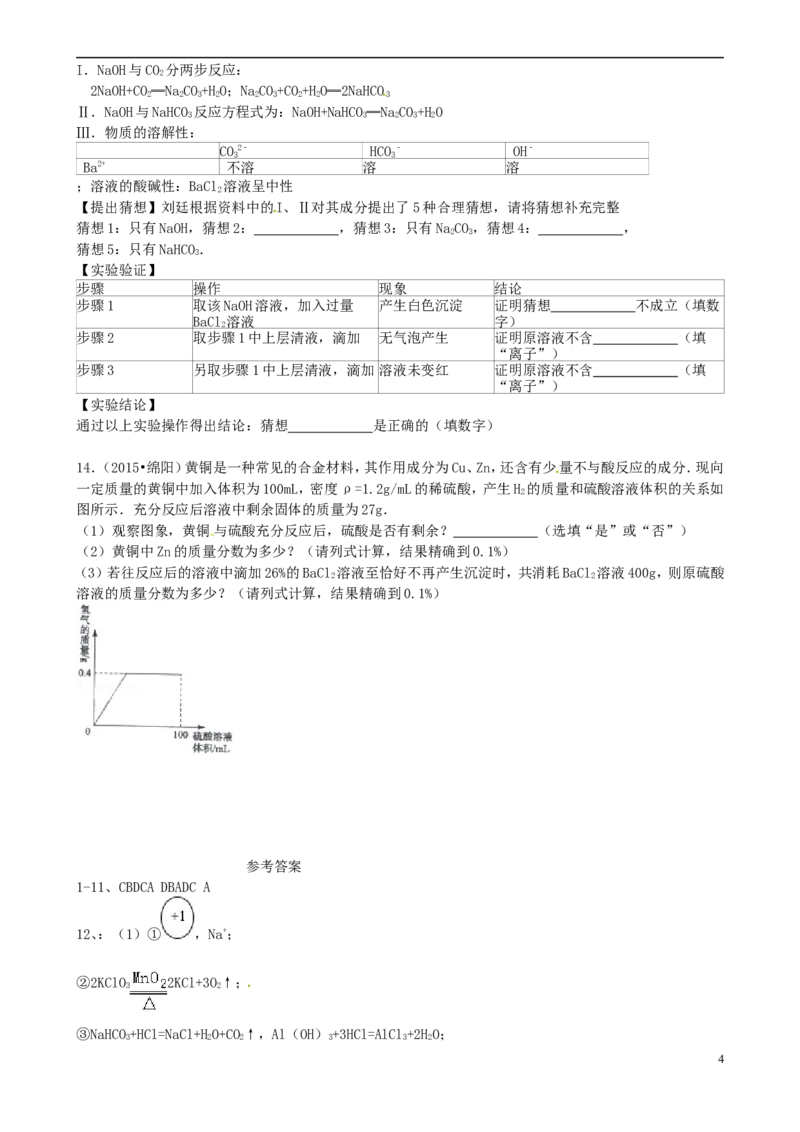
(2)初中化学几种常见物质的相互转化关系如图.其中A是常见黑色固体单质,B是常见液体化合物,化合
物C和单质D均为可燃气体,X为红色固体氧化物,C与X的反应常用于工业上冶炼金属,Z为硫酸盐,其溶
液为蓝色.请根据推断回答下列问题:
①G溶液的颜色为 ,图中反应I到IV中属于置换反应的有 个;
②A+B→C+D的化学方程式为 ;
③Na与O 在不同条件下可生成NaO或NaO,NaO 中氧元素的化合价为 ,NaO的化学性质与
2 2 2 2 2 2 2
CaO相似,分步写出NaO与Z溶液反应的化学方程式 , .
2
13.(2015•绵阳)地球是一颗美丽的蓝色星球,海水占了全球水资源的97%.海水资源的开发和利用具有非
常广阔的前景.
(1)海水中含有大量的NaCl,可用于制备钠及其化合物,其流程如图:
①加入过量NaCO 溶液目的是除去CaCl 和 ,流程中不能用过量稀硫酸代替过量稀盐酸的原
2 3 2
因是 ;
②提纯过程中使用了过滤和蒸发操作,实验室过滤和蒸发操作均使用到的玻璃仪器是 ;
③流程图中制备金属钠的化学方程式为 .
(2)工业上利用电解饱和食盐水的方法制备NaOH,并同时获得两种单质.补充并配平化学方程式:
□NaCl+□HO □ +□ +□Cl↑
2 2
(3)刘廷在实验室找到一瓶长期放置的NaOH溶液,欲对其成分进行实验探究.
【查阅资料】
3I.NaOH与CO 分两步反应:
2
2NaOH+CO═NaCO+HO;NaCO+CO+HO═2NaHCO
2 2 3 2 2 3 2 2 3
Ⅱ.NaOH与NaHCO 反应方程式为:NaOH+NaHCO═NaCO+HO
3 3 2 3 2
Ⅲ.物质的溶解性:
CO2﹣ HCO﹣ OH﹣
3 3
Ba2+ 不溶 溶 溶
;溶液的酸碱性:BaCl 溶液呈中性
2
【提出猜想】刘廷根据资料中的I、Ⅱ对其成分提出了5种合理猜想,请将猜想补充完整
猜想1:只有NaOH,猜想2: ,猜想3:只有NaCO,猜想4: ,
2 3
猜想5:只有NaHCO.
3
【实验验证】
步骤 操作 现象 结论
步骤1 取该NaOH溶液,加入过量 产生白色沉淀 证明猜想 不成立(填数
BaCl 溶液 字)
2
步骤2 取步骤1中上层清液,滴加 无气泡产生 证明原溶液不含 (填
“离子”)
步骤3 另取步骤1中上层清液,滴加 溶液未变红 证明原溶液不含 (填
“离子”)
【实验结论】
通过以上实验操作得出结论:猜想 是正确的(填数字)
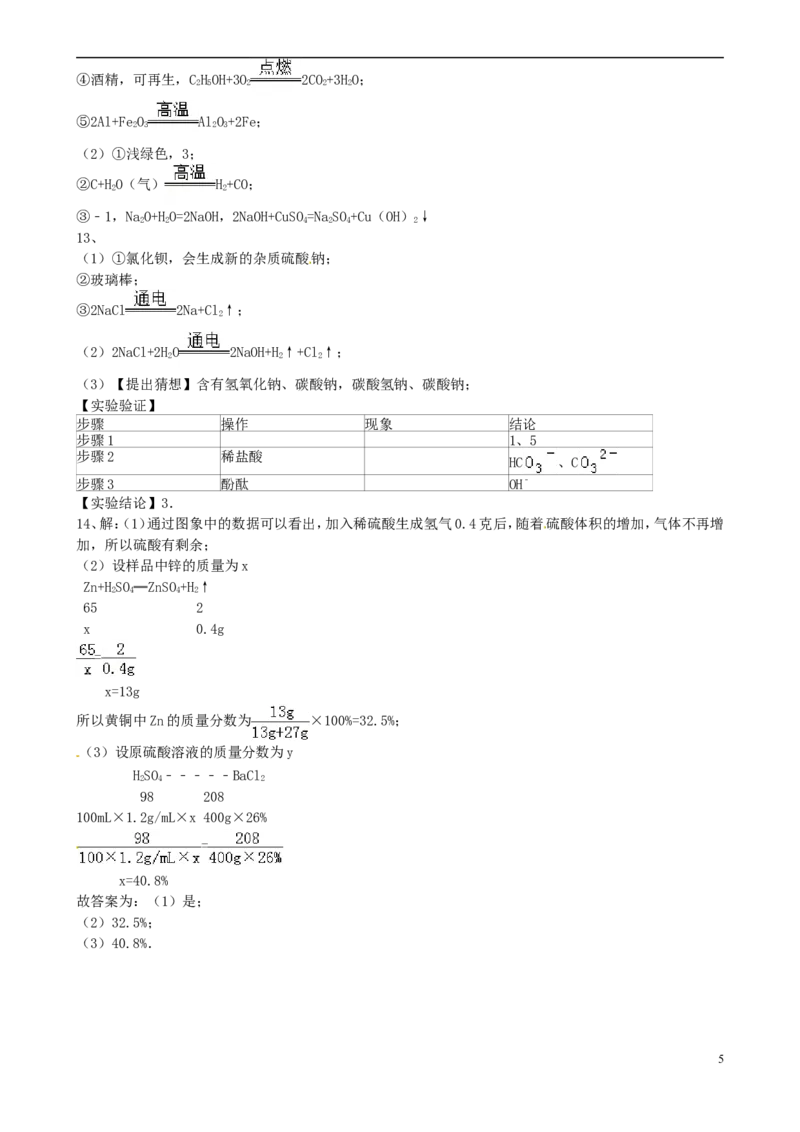
14.(2015•绵阳)黄铜是一种常见的合金材料,其作用成分为Cu、Zn,还含有少量不与酸反应的成分.现向
一定质量的黄铜中加入体积为100mL,密度ρ=1.2g/mL的稀硫酸,产生H 的质量和硫酸溶液体积的关系如
2
图所示.充分反应后溶液中剩余固体的质量为27g.
(1)观察图象,黄铜与硫酸充分反应后,硫酸是否有剩余? (选填“是”或“否”)
(2)黄铜中Zn的质量分数为多少?(请列式计算,结果精确到0.1%)
(3)若往反应后的溶液中滴加26%的BaCl 溶液至恰好不再产生沉淀时,共消耗BaCl 溶液400g,则原硫酸
2 2
溶液的质量分数为多少?(请列式计算,结果精确到0.1%)
参考答案
1-11、CBDCA DBADC A
12、:(1)① ,Na+;
②2KClO 2KCl+3O↑;
3 2
③NaHCO+HCl=NaCl+HO+CO↑,Al(OH)+3HCl=AlCl+2HO;
3 2 2 3 3 2
4④酒精,可再生,CHOH+3O 2CO+3HO;
2 5 2 2 2
⑤2Al+FeO AlO+2Fe;
2 3 2 3
(2)①浅绿色,3;
②C+HO(气) H+CO;
2 2
③﹣1,NaO+HO=2NaOH,2NaOH+CuSO=NaSO+Cu(OH)↓
2 2 4 2 4 2
13、
(1)①氯化钡,会生成新的杂质硫酸钠;
②玻璃棒;
③2NaCl 2Na+Cl↑;
2
(2)2NaCl+2HO 2NaOH+H↑+Cl↑;
2 2 2
(3)【提出猜想】含有氢氧化钠、碳酸钠,碳酸氢钠、碳酸钠;
【实验验证】
步骤 操作 现象 结论
步骤1 1、5
步骤2 稀盐酸
HC 、C
步骤3 酚酞 OH﹣
【实验结论】3.
14、解:(1)通过图象中的数据可以看出,加入稀硫酸生成氢气0.4克后,随着硫酸体积的增加,气体不再增
加,所以硫酸有剩余;
(2)设样品中锌的质量为x
Zn+HSO═ZnSO+H↑
2 4 4 2
65 2
x 0.4g
=
x=13g
所以黄铜中Zn的质量分数为 ×100%=32.5%;
(3)设原硫酸溶液的质量分数为y
HSO﹣﹣﹣﹣﹣BaCl
2 4 2
98 208
100mL×1.2g/mL×x 400g×26%
=
x=40.8%
故答案为:(1)是;
(2)32.5%;
(3)40.8%.
5