文档内容
2025-2026 学年高一化学上学期第一次月考卷
(考试时间:60 分钟 试卷满分:100 分)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证号
填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
4.测试范围:第一章(人教版 2019)。
5.难度系数:0.65
6.考试结束后,将本试卷和答题卡一并交回。
第Ⅰ卷(选择题 共 60 分)
一、选择题:本题共 20 个小题,每小题 3 分,共 60 分。在每小题给出的四个选项中,只有一项是符合题
目要求的。
1.化学与生活密切相关。下列说法不正确的是
A.食品包装袋中“干燥剂”成分 CaO 属于碱性氧化物
B.豆浆能产生丁达尔效应是由于胶体粒子对光线的散射
C.铁粉能与 O 反应,可用作食品保存的脱氧剂
2
D.维生素 C 可用作补血剂中的抗氧化剂是由于其具有氧化性
【答案】D
【解析】A.CaO 能与酸反应生成盐和水,属于碱性氧化物,A 正确;
B.丁达尔效应是胶体粒子散射光线形成的,豆浆属于胶体,B 正确;
C.铁粉与 O₂反应消耗氧气,防止食品氧化,C 正确;
D.维生素 C 作为抗氧化剂是因具有还原性,而非氧化性,D 错误;
故选 D。
2.下列是与实验有关的部分图标.制备 胶体的实验方案中需要标注的图标是
A B C D
/护目镜 排风 锐器 用电
【答案】A
【解析】氯化铁溶液滴入沸水中制备 胶体,为防止液体灼伤眼睛,需佩戴护目镜,故选 A。
3.目前,科学家发现在负压和超低温条件下,可将水形成像棉花糖一样的气凝胶的冰,该冰称为“气态冰”。
下列说法不正确的是
A.“气态冰”具有丁达尔效应
B.“气态冰”与普通冰化学性质基本相同
C.18g“气态冰”在标准状况下的体积等于 22.4L
D.“气态冰”是由分子构成的
【答案】C
【解析】A.在负压和超低温条件下,可将水形成像棉花糖一样的气溶胶的冰,该冰称为“气态冰”,气溶胶
属于胶体,可以产生丁达尔效应,A 说法正确;
B.“气态冰”与普通冰一样都是由水分子构成,因此化学性质相同,B 说法正确;
C.18g“气态冰”的物质的量是 1mol,但其状态是固态,所以不能使用标准状况下的气体摩尔体积计算其体
积,C 说法错误;
D.构成“气态冰”的分子为水分子,D 说法正确。
综上所述,答案为 C。
4.分类是一种重要的学习方法。物质的部分分类如图所示,下列说法不正确的是
A.图甲所示的分类方法是树状分类法 B.酸性氧化物不一定是非金属氧化物
C.图甲中“……”包含胶体 D.碱性氧化物一定是金属氧化物
【答案】C
/【解析】A.由题干信息可知,图甲所示的分类方法属于树状分类法,A 项正确;
B.酸性氧化物可以是金属氧化物,如 是金属氧化物,属于酸性氧化物,所以酸性氧化物不一定是非
金属氧化物,B 项正确;
C.胶体是混合物,而化合物均属于纯净物,故胶体不属于化合物,C 项错误;
D.碱性氧化物一定是金属氧化物,D 项正确;
故选 C。
5.最近,“功能饮料”因其饮用后能及时补充人体运动出汗所损失的水分和电解质而受到人们的欢迎。下列属
于人体内常见电解质的是
A.葡萄糖 B. C.NaCl D.
【答案】C
【解析】A.葡萄糖在水溶液里或熔融状态下都不导电,是非电解质,A 错误;
B.氧气为单质,不是电解质,B 错误;
C.NaCl 在水溶液里能电离出自由移动的阴阳离子导致溶液导电,所以 NaCl 是电解质,C 正确;
D.二氧化碳和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子,所以二氧化碳的水溶液导电,但电离
出离子的物质是碳酸不是二氧化碳,所以二氧化碳是非电解质,D 错误;
故选 C。
6.下列各组离子中,能在碱性溶液中大量共存,且溶液无色透明的是
A. 、 、 、 B. 、 、 、
C. 、 、 、 D. 、 、 、
【答案】A
【解析】A.各个离子间可以大量共存,且为无色溶液,A 符合题意;
B. 在溶液中为紫色,B 不符合题意;
C.Fe3+、 在碱性条件下不共存,C 不符合题意;
D.Mg2+在碱性条件下不共存,D 不符合题意;
故答案为:A。
7.准确书写离子方程式有助于我们认识很多化学反应的实质。下列离子方程式书写正确的是
A.碳酸钡与盐酸反应:
/B.铜片插入硝酸银溶液中:
C.稀硫酸滴在铜片上:
D.氧化镁与稀硝酸反应:
【答案】D
【解析】A.BaCO
3
为难溶物,不能拆,离子方程式为 BaCO
3
+2H+=Ba2++H
2
O+CO
2
↑,A 错误;
B.该离子反应电荷不守恒,离子方程式为 2Ag++Cu=2Ag+Cu2+,B 错误;
C.稀硫酸不与 Cu 反应,C 错误;
D.MgO 与稀硝酸反应生成 Mg(NO
3
)
2
和 H
2
O,离子方程式为 MgO+2H+=Mg2++H
2
O,D 正确;
故选 D。
8.常温下,往一定量的 溶液不断通入 的过程中(如图所示),下列图像能正确表示该溶液导电
能力(用电流强度 I 表示)变化的是
A. B. C. D.
【答案】B
【分析】常温下,往一定量的 溶液先通入 会生成碳酸钡和水,继续通入 会生成可溶于水
的碳酸氢钡,溶液中离子浓度大小与导电性有关,据此分析解答。
【解析】根据上述分析可知,刚开始通入二氧化碳时,会生成难溶于水的碳酸钡和水,电流强度 I 不断减小
直至降低到几乎为 0,继续通入二氧化碳,溶液中会生成可溶于水的碳酸氢钡,从而使溶液中离子浓度增大,
电流强度 I 又逐渐增大,只有 B 项符合题意。
故选 B。
9.已知 可以被 氧化,某溶液中存在以下五种离子: 、 、 、 、X,它们的粒子个
数之比为 ,那么 X 离子可能为
/A. B. C. D.
【答案】A
【解析】已知 可以被 氧化,则不存在亚铁离子;氢离子会和碳酸氢根离子生成二氧化碳、水,不存在碳酸氢根离
子;氯离子和银离子生成氯化银沉淀,则不存在银离子;
设 X 所带电荷为 a,则 2×(-1)+6×(-1) +1×(+3) +3×(+1) +1×a=0,解得 a=+2,所以 X 为阳离子,可以为锌离子;
故选 A。
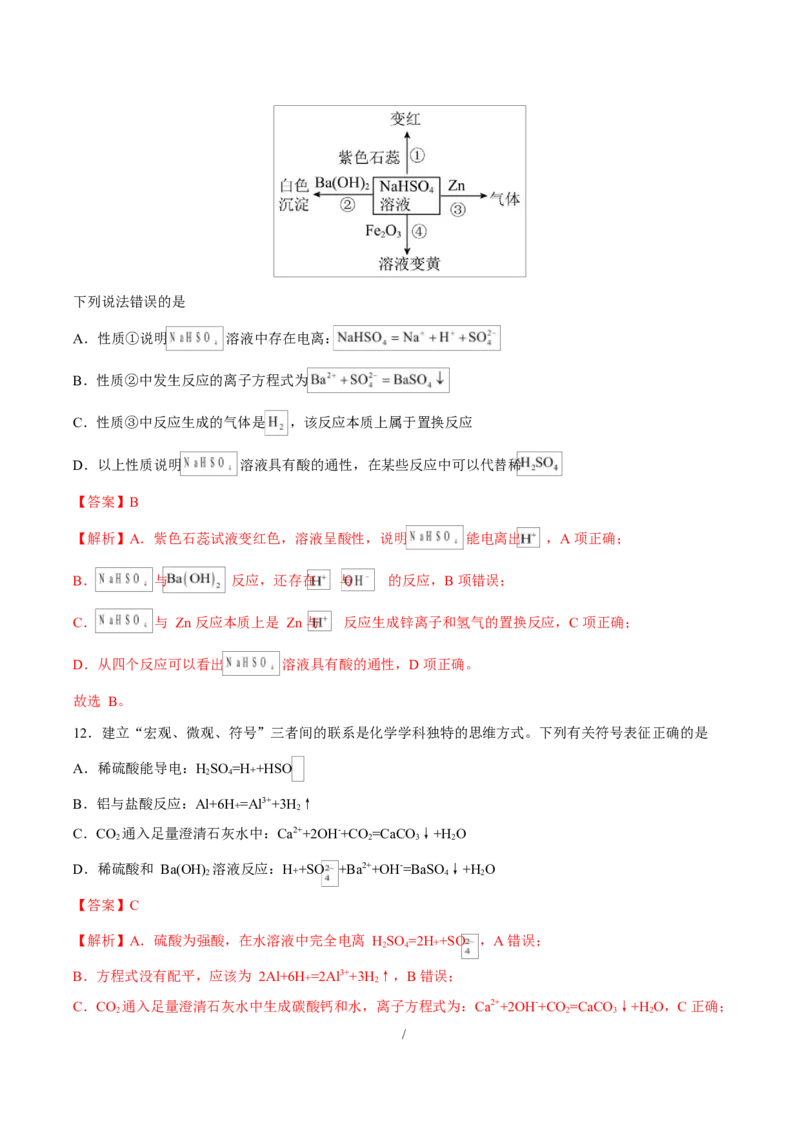
10.下图为 NaCl 在水中溶解和电离的示意图,关于该图的说法中正确的是
A.NaCl 固体不导电,因为 NaCl 固体中没有离子存在
B.NaCl 固体溶于水后,会形成水合钠离子和水合氯离子
C.在水合离子中,水分子都应该是氧原子朝内
D.上述过程通常可表示为 NaCl=Na++Cl+ ,该过程需要通电
【答案】B
【解析】A.NaCl 固体不导电,NaCl 固体中有离子,但是离子不能自由移动,所以不导电,A 错误;
B.由图可以看出 NaCl 固体溶于水后,会形成水合钠离子和水合氯离子,B 正确;
C.由图可知在水合氯离子中,水分子是氧原子朝外,C 错误;
D.上述过程通常可表示为 NaCl=Na++Cl+ ,氯化钠溶于水电离出钠离子和氯离子,该过程不需要通电,D
错误;
故选 B。
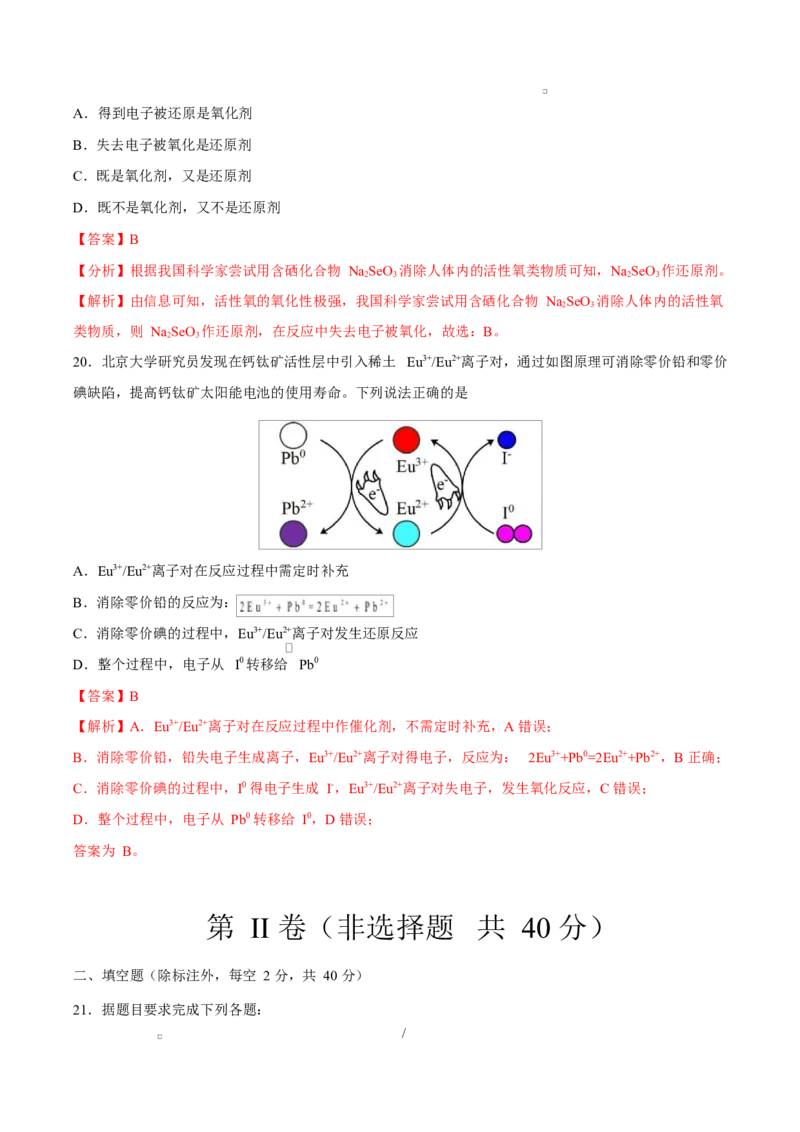
11.下图是某同学总结的硫酸氢钠溶液的部分化学性质。
/下列说法错误的是
A.性质①说明 溶液中存在电离:
B.性质②中发生反应的离子方程式为
C.性质③中反应生成的气体是 ,该反应本质上属于置换反应
D.以上性质说明 溶液具有酸的通性,在某些反应中可以代替稀
【答案】B
【解析】A.紫色石蕊试液变红色,溶液呈酸性,说明 能电离出 ,A 项正确;
B. 与 反应,还存在 与 的反应,B 项错误;
C. 与 Zn 反应本质上是 Zn 与 反应生成锌离子和氢气的置换反应,C 项正确;
D.从四个反应可以看出 溶液具有酸的通性,D 项正确。
故选 B。
12.建立“宏观、微观、符号”三者间的联系是化学学科独特的思维方式。下列有关符号表征正确的是
A.稀硫酸能导电:H
2
SO
4
=H++HSO
B.铝与盐酸反应:Al+6H+=Al3++3H
2
↑
C.CO 通入足量澄清石灰水中:Ca2++2OH-+CO =CaCO ↓+H O
2 2 3 2
D.稀硫酸和 Ba(OH)
2
溶液反应:H++SO +Ba2++OH-=BaSO
4
↓+H
2
O
【答案】C
【解析】A.硫酸为强酸,在水溶液中完全电离 H
2
SO
4
=2H++SO ,A 错误;
B.方程式没有配平,应该为 2Al+6H+=2Al3++3H
2
↑,B 错误;
C.CO 通入足量澄清石灰水中生成碳酸钙和水,离子方程式为:Ca2++2OH-+CO =CaCO ↓+H O,C 正确;
2 2 3 2
/D.稀硫酸和 Ba(OH)
2
溶液反应应该为 2H++SO +Ba2++2OH-=BaSO
4
↓+2H
2
O,D 错误;
故选 C。
13.某工业废水中存在大量的 Na+ 、Cl-、Cu2+、SO ,欲除去其中的 Cu2+、SO (为使离子完全沉淀,沉
淀剂需要过量),设计工艺流程如图所示:下列说法不正确的是
工业废水 溶液 Na+ Cl-
A.NaOH 的作用是除去 Cu2+ B.试剂 a 为 NaCO,试剂 b 为 BaCl
2 3 2
C.流程图中,操作 x 为过滤 D.试剂 c 为盐酸
【答案】B
【解析】由流程可知,工业废水中加入 NaOH 后可除去 Cu2+,废水中含有 Na+ 、Cl-、OH-、SO ;再加入
试剂 a 为 BaCl
2
除去 SO ,此时废水中含有 Na+ 、Cl-、Ba2+,再加入稍过量的试剂 b 为 Na
2
CO
3
除去 Ba2+,
此时废水中含有 Na+ 、Cl-、CO ,操作 x 为过滤,再向滤液中加入试剂 c 为盐酸,至不再产生气泡即可,
此时溶液中只含 Na+ 、Cl-,以此来解答。
【解析】A.废水中,只有 Cu2+可以和 NaOH 反应,故 NaOH 的作用是除去 Cu2+,故 A 正确;
B.由上述分析可知,试剂 a 为 BaCl ,试剂 b 为 NaCO,且碳酸钠一定在氯化钡之后,可除去过量钡离子,
2 2 3
故 B 错误;
C.流程图中操作 x 为过滤,过滤分离出 Cu(OH) 、BaSO、BaCO ,故 C 正确;
2 4 3
D.试剂 c 为盐酸,可除去过量碳酸钠,故 D 正确;
故答案为 B。
14.某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有 、 、 、
、 、 、 、 、 中的若干种离子。该小组同学取部分水样进行实验,向水样中先滴
加足量硝酸钡溶液,产生白色沉淀;再滴加足量稀盐酸,沉淀部分溶解;最后滴加硝酸银溶液,又产生白
色沉淀。下列说法正确的是
A.观察水样可以确定一定不存在的离子只有
B.经过实验可以确定一定存在的离子是 、 、 、
C.水样中可能存在
D.水样中可能存在
/【答案】C
【分析】某无色水样,则不含有 、 ,向水样中先滴加足量硝酸钡溶液,产生白色沉淀,则含有
、 中的一种或两种;再滴加足量稀盐酸,沉淀部分溶解,则 、 均存在;故不存在 、
、 ,根据溶液电中性,则一定含有一种阳离子 ,最后滴加硝酸银溶液,又产生白色沉淀,该白
色沉淀为氯化银,则氯离子可能来自于前面所加盐酸而不一定是原溶液的,故不能确定原溶液中是否含有
。
【解析】A.因水样无色,则观察水样可以确定一定不存在的离子有 、 ,选项 A 错误;
B.经过实验可以确定一定存在的离子是 、 、 ,不能确定是否有 ,选项 B 错误;
C.滴加硝酸银溶液之前加了盐酸,引入了 ,所以无法确定水样中是否含有 ,选项 C 正确;
D.水样中一定存在 ,选项 D 错误。
答案选 C。
15.利用饱和 溶液与 ,反应制得的胶体的胶团结构如图所示,下列说法正确的是
A. 胶体带正电荷
B. 溶液、 胶体与 沉淀的本质区别是有没有丁达尔效应
C.在 U 形管中注入 胶体,插入石墨电极通电(U 形管上方用少量导电液使电极与胶体分开,避免
胶体粒子与电极直接接触),一极周围颜色加深
D.利用半透膜渗析、丁达尔效应等方法均能够区分溶液和胶体
【答案】C
【解析】A.氢氧化铁胶粒带正电荷,氢氧化铁胶体为电中性不带正电荷,A 错误;
B.氯化铁溶液、氢氧化铁胶体、氢氧化铁沉淀三者的本质区别是分散质粒子直径的不同而不是有没有丁达
尔效应,B 错误;
/C.U 形管中注入氢氧化铁胶体,插入石墨电极通电,氢氧化铁胶粒带正电荷向阴极移动,可观察到一极附
近颜色加深,C 正确;
D.利用半透膜渗析是分离溶液和胶体,利用丁达尔效应区分溶液和胶体,D 错误;
故答案选 C。
16.下列化学方程式中,表示电子转移的方向和数目均正确的是
A. B.
C. D.
【答案】C
【解析】
A.氯元素由 0 价降低为-1 价,钠由 0 价升高为+1 价,单线桥由钠指向氯,转移电子数为 2e-,正确的为
,A 错误;
B.铜元素由 0 价升高为+2 价,N 元素由+5 价降低为+2 价,单线桥应该由 Cu 元素指向 N 元素,正确的为
,B 错误;
C.氯气中氯元素由 0 价升高为+1 价,降低为-1 价,双线桥表示为
,C 正确;
D.HCl 与氯酸钾发生归中反应,氯化氢中-1 价的氯升高为氯气中 0 价,氯酸钾中+5 价的氯降为氯气中的 0
价,转移电子数应该是 5e-,正确的为 ,D 错误;
答案选 C。
17.废水脱氮工艺有一种方法是在废水中加入过量 NaClO 使 NH 完全转化为 N,该反应可表示为 2NH +
2
/3ClO-=N ↑+3Cl-+2H++3HO。则下列说法不正确的是
2 2
A.反应中氮元素被氧化,氯元素被还原
B.还原性:NH >Cl-
C.反应中每生成 1 个 N,转移 6 个电子
2
D.氧化剂与还原剂的个数之比为 2:3
【答案】D
【解析】A.反应中氮元素的化合价升高,所以氮元素被氧化;氯元素的化合价降低,所以氯元素被还原,
A 正确;
B. 是还原剂, 是还原产物,所以还原性 > ,B 正确;
C.N 的化合价由-3 升高到 0,所以反应中每生成 1 mol 就转移 6 mol 电子,则每生成 1 个 N,转移 6
2
个电子,C 正确;
D. 是还原剂、ClO-是氧化剂,由化学方程式可知,氧化剂与还原剂的个数之比为 3:2,D 错误;
故选 D。
18.宋代著名法医学家宋慈的《洗冤集录》中有关于银针验毒的记载,“银针验毒”的原理是 4Ag
+2H S+O=2X+2H O,下列说法不正确的是
2 2 2
A.X 的化学式为 Ag S B.银针验毒时,空气中氧气得到电子
2
C.反应中 Ag 和 HS 均是还原剂 D.每生成 1 个 X,反应转移 2 个 e-
2
【答案】C
【解析】A.根据质量守恒定律可知,方程式 4Ag+2HS+O=2X+2H O 中的 X 的化学式为 Ag S,A 正确;
2 2 2 2
B.根据方程式 4Ag+2HS+O=2Ag S+2HO 可知,银针验毒时,空气中氧气得到电子化合价降低,被还原,
2 2 2 2
B 正确;
C.根据方程式 4Ag+2HS+O=2Ag S+2HO 可知,反应中 Ag 的化合价升高,被氧化,Ag 为还原剂,但 HS
2 2 2 2 2
中 H 和 S 的化合价均为改变,故 HS 既不是还原剂也不是氧化剂,C 错误;
2
D.根据方程式 4Ag+2HS+O=2Ag S+2HO 可知,每生成 1 个 X,反应转移 2 个 e-,D 正确;
2 2 2 2
故答案为:C。
19.吸入人体内的 O 有 2%转化为氧化性极强的活性氧类物质,如 等,这些活性氧类物质能加速人体衰
2
老,被称为“生命杀手”。我国科学家尝试用含硒化合物 NaSeO 消除人体内的活性氧类物质,在此反应过
2 3
程中,下列关于 NaSeO 的说法正确的是
2 3
/A.得到电子被还原是氧化剂
B.失去电子被氧化是还原剂
C.既是氧化剂,又是还原剂
D.既不是氧化剂,又不是还原剂
【答案】B
【分析】根据我国科学家尝试用含硒化合物 NaSeO 消除人体内的活性氧类物质可知,NaSeO 作还原剂。
2 3 2 3
【解析】由信息可知,活性氧的氧化性极强,我国科学家尝试用含硒化合物 NaSeO 消除人体内的活性氧
2 3
类物质,则 NaSeO 作还原剂,在反应中失去电子被氧化,故选:B。
2 3
20.北京大学研究员发现在钙钛矿活性层中引入稀土 Eu3+/Eu2+离子对,通过如图原理可消除零价铅和零价
碘缺陷,提高钙钛矿太阳能电池的使用寿命。下列说法正确的是
A.Eu3+/Eu2+离子对在反应过程中需定时补充
B.消除零价铅的反应为:
C.消除零价碘的过程中,Eu3+/Eu2+离子对发生还原反应
D.整个过程中,电子从 I0 转移给 Pb0
【答案】B
【解析】A.Eu3+/Eu2+离子对在反应过程中作催化剂,不需定时补充,A 错误;
B.消除零价铅,铅失电子生成离子,Eu3+/Eu2+离子对得电子,反应为: 2Eu3++Pb0=2Eu2++Pb2+,B 正确;
C.消除零价碘的过程中,I0 得电子生成 I-,Eu3+/Eu2+离子对失电子,发生氧化反应,C 错误;
D.整个过程中,电子从 Pb0 转移给 I0,D 错误;
答案为 B。
第 II 卷(非选择题 共 40 分)
二、填空题(除标注外,每空 2 分,共 40 分)
21.据题目要求完成下列各题:
/(1)写出过量的 和澄清石灰水发生反应的总的离子方程式 。
(2)将 溶液滴加到 固体中,反应的离子方程式为 。
(3)写出氯气溶于水生成 HCl 和 HClO 的离子方程式 。
(4) (次磷酸)与足量 溶液反应只生成一种盐 ,则 属于 。(填写“正盐”、
“酸式盐”、“碱式盐”)
(5) 在碱性溶液中可被 氧化为 ,而 被还原为 。若反应 与 的个
数之比为 1:13,则 的值为 。
【答案】(1)
(2)
(3)
(4)正盐
(5)4
【解析】(1)过量的 和澄清石灰水反应生成可溶性碳酸氢钙,反应离子方程式为:
;
(2) 与 反应生成硫酸钡沉淀、二氧化碳、水和硫酸钠,离子方程式为:
;
(3)氯气溶于水反应生成 HCl 和 HClO,反应离子方程式为: ;
(4) (次磷酸)与足量 溶液反应只生成一种盐 ,可知 中的 H 不能与 NaOH 反应,
应为正盐;
(5)若反应 与 的个数之比为 1:13,设 为 13,则 为 1, ,13
个 转移电子 26 个,则 1 个 失去 26 个电子, , =26,x=4。
22.I.回答下列问题。
(1)实验室常用烧碱溶液吸收 。若将 通入热的烧碱溶液中,可以得到 、 和 的混合
液。当 和 的物质的量之比为 8:1 时,混合液中 和 的物质的量之比
/为 。
(2)把 通入浓氨水中,发生如下反应: ,若反应中有 3.4 克氨气发生氧化反应,
则反应中有生成氮气的质量为 ,用单线桥法表示该反应的电子转移情况: 。
II.有下列三个反应:
a.
b.
c.
(3)上述三个反应中氧化剂与氧化产物的氧化性由强到弱的关系为 。
III.书写以下反应的离子方程式:
(4)氧化镁与稀硝酸: 。
(5)碳酸氢钠与硫酸氢钠溶液: 。
(6)醋酸溶液与氢氧化钠溶液: 。
(7)氢氧化铁与稀硫酸: 。
【答案】(1)3:1
(2) 2.8g
(3)
(4)
(5)
(6)
(7)
【解析】(1)将 Cl 通入热的烧碱溶液中,可以得到 NaCl、NaClO 和 NaClO 的混合液,氯气既是氧化剂又
2 3
是还原剂,当 NaCl 和 NaClO 的物质的量之比为 8:1 时,Cl 原子失电子是 5mol,转移电子总数为 8mol,
3
则生成 NaClO 的物质的量是 3mol,混合液中 NaClO 和 NaClO 的物质的量之比为 3:1,故答案为:3:1。
3
(2)
当有少量 Cl 泄漏,发生反应: ,氯化铵为白色晶体,则可以观察到的现象是出现
2
/白烟,3.4 克氨气,即 0.2mol 发生氧化反应,生成 0.1molN,质量为 2.8g;用单线桥反应表示为:
2
;
(3)根据氧化剂的氧化性大于氧化产物的氧化性,a. 中 ;b.
中 ;c. 中
;综上有 ;
(4)氧化镁与稀硝酸反应生成硝酸镁和水,离子方程式为: ;
(5)碳酸氢钠与硫酸氢钠溶液反应,本质上是氢离子和碳酸氢根反应,离子方程式为:
;
(6)醋酸溶液与氢氧化钠溶液反应生成醋酸钠和水,离子方程式为: ;
(7)氢氧化铁与稀硫酸反应生成硝酸铁和水,离子方程式为: 。
23.I. 是一种消毒杀菌效率高、二次污染小的水处理剂,可以通过下列两种途径得到
方法一:
方法二(酸性条件下):___________ ___________ ___________ ___________
___________
(1)用双线桥法标出方法一反应中电子转移的方向和数目: 。
(2)请完成方法二在酸性条件下的离子方程式,并配平: 。
(3)在方法一中浓盐酸显示出来的性质是 性和 性。
(4)方法二中被还原的元素是 (填元素符号),氧化产物是 (填化学式)。
II.某化学兴趣小组在实验室中以烧杯为容器,用饱和溶液制备 胶体,并对其性质做了如下探究:
【实验制备】
(5)将 溶液加到沸水中,加热至整个体系呈 色为止,即制得 胶体。
(6)制备过程中,发生化学反应的方程式为 。
【性质探究】
小甲同学在制备时,加热时间过久,结果未能得到胶体。
/(7)小乙同学想证明 胶体已经制备成功,他可以利用 (最简单的方法)进行鉴别。
(8)小丙同学利用 (如图)方法对 胶体提纯。
(9)高铁酸钠 是一种新型绿色消毒剂,主要用于饮用水处理,工业制备高铁酸钠有多种方法。其中
一种方法的原理在碱性溶液中可用离子方程式表示为: 。
___________ ___________ ___________ ___________ ___________
___________
【答案】(1)
(2)
(3) 还原(1 分) 酸(1 分)
(4) (1 分) (1 分)
(5)红褐(1 分)
(6)
(7)丁达尔效应(1 分)
(8)渗析
(9)
【解析】(1)反应 2KClO+4HCl(浓)═2KCl+2ClO ↑+Cl↑+2H O 中,KClO 中的 Cl 由+5 价降为 ClO 中
3 2 2 2 3 2
的+4 价,每个 Cl 得 1 个电子,2 个 Cl 共得 2 个电子,HCl 中的 Cl 由-1 价升为 Cl 中的 0 价,每个 Cl 失1
2
个电子,2 个 Cl 共失 2 个电子,双线桥表示为:
;
/(2)ClO 中的 Cl 化合价由+5 价降为 ClO 中的+4 价,每个 Cl 得 1 个电子,HC O 中的 C 由+3 价升为
2 2 2 4
CO 中的+4 价,2 个 C 失 2 个电子,根据转移电子守恒,ClO 与 ClO 前配 2,根据电荷守恒,反应物的 H
2 2
+ 系数为 2,根据 H 守恒,产物中 H 2 O 的系数为 2,离子方程式为:2ClO +H 2 C 2 O 4 +2H+=2ClO 2 ↑+2CO 2 ↑+
2HO;
2
(3)方法一中,HCl 的 Cl 失电子化合价升高,是还原剂,表现还原性;反应中生成的 KCl 为盐,含有 Cl
-,体现了盐酸的酸性;
(4)方法二中,ClO 中的 Cl 化合价降低,发生还原反应,被还原;HC O 中的 C 化合价升高,被氧化,
2 2 4
生成的 CO 是氧化产物;
2
(5)FeCl 溶液加到沸水中,加热至整个体系呈红褐色为止,即制得 Fe(OH) 胶体;
3 3
(6)制备过程中,发生化学反应的方程式为 ;
(7)最简单的鉴别胶体的方法为丁达尔效应,当用激光笔照射时,会有一道明亮的光路,证明 Fe(OH) 胶
3
体已经制成;
(8)溶液能透过半透膜,胶粒不能够透过半透膜,利用渗析能提纯胶体;
(9)反应中氯元素化合价由+1 变为-1,次氯酸根离子为氧化剂,铁元素化合价由+3 变为+6,铁离子为还
原剂,根据电子守恒、质量守恒配平后为: 。
/