文档内容
专题 03 氧化还原反应
内容概览
考点01 氧化还原反应的定义和实质
考点02 氧化还原反应相关概念的判断
考点03 氧化剂与还原剂
考点04 氧化还原反应的规律
考点05 氧化还原反应的综合考查
考点01 氧化还原反应的定义和实质
1.(23-24高一上·安徽省皖北六校·期末)氧化还原反应广泛存在于生产和生活中,下列现象与氧化还原
无关的是
A.植物光合作用 B.食物腐败
C.易燃物的自燃 D.酸雨腐蚀大理石雕像
【答案】D
【分析】有元素化合价变化的反应属于氧化还原反应,没有元素化合价变化的反应则不属于氧化还原反
应。
【解析】A.绿色植物的光合作用是在光照条件下,将二氧化碳和水转化为有机物,并释放出氧气的过
程,反应过程中有元素化合价变化,属于氧化还原反应,A不符合题意;
B.食物的腐败是氧气参与下,将食物氧化的过程,O元素的化合价变化,属于氧化还原反应,B不符合
题意;
C.易燃物的自燃属于燃烧反应,燃烧反应均为氧化还原反应,C不符合题意;
D.大理石的主要成分为 ,与酸雨发生的反应为复分解反应,与氧化还原反应无关,D符合题意;
故选D。
2.(23-24高一上·吉林省部分名校·期末)下列过程不涉及氧化还原反应的是
A.新切开的钠表面变暗 B.氯化钠溶液通电制
C.用铁矿石冶炼生铁 D. 受热分解
【答案】D
【解析】A.用刀切开金属钠,新切开的钠的表面很快变暗,金属钠被氧化为氧化钠,发生了氧化还原反
应,A不符合题意;
B.氯化钠溶液通电生成氢气、氯气、氢氧化钠,有元素化合价发生改变,属于氧化还原反应,B不符合
题意;
C.用铁矿石冶炼生铁,铁元素化合价发生改变,属于氧化还原反应,C不符合题意;
学科网(北京)股份有限公司D. 受热分解生成碳酸钠、水和二氧化碳,元素化合价均未改变,不属于氧化还原反应,D符合
题意;
故选D。
3.(23-24高一上·广东省广州市·期末)下列应用中不涉及氧化还原反应的是
A.用白醋清洗水壶中的水垢 B.发射火箭时燃料的燃烧
C. 用作呼吸面具的供氧剂 D.暖贴中的铁粉遇空气放热
【答案】A
【解析】A.用食醋清洗水壶内的水垢,反应原理为2CHCOOH+CaCO =Ca(CH COO) +H O+CO,是利用
3 3 3 2 2 2
醋酸的酸性比碳酸强,不是氧化还原反应,故A项错误;
B.发射火箭时燃料的燃烧,属于氧化还原反应,故B项正确;
C.NaO 与CO、HO反应生成氧气,可用作呼吸面具的供氧剂,故C项正确;
2 2 2 2
D.铁粉与空气中的氧气发生氧化还原反应,故D项正确;
故本题选A。
4.(23-24高一上·福建省福州市·期末)古籍中有“银针验毒”的记载,其原理为
,该反应属于
A.化合反应 B.分解反应 C.离子反应 D.氧化还原反应
【答案】D
【解析】A.化合反应是由两种或两种以上物质生成一种物质的反应,该反应不属于化合反应,A错误;
B.分解反应是由一种物质生成两种或两种以上物质的反应,该反应不属于分解反应,B错误;
C.离子反应是水溶液中离子之间的反应,该反应不属于离子反应,C错误;
D. 反应中Ag在反应中化合价升高,氧气在反应中化合价降低,是氧化还
原反应,D正确;
答案选D。
5.(23-24高一上·北京市朝阳区·期末)下列物质的应用中,与氧化还原反应无关的是
A.用 和 制取盐酸 B.用生石灰( )作干燥剂
C.用铝粉和 作管道疏通剂 D.用 漂白棉、麻、纸张
【答案】B
【解析】A.氢气和氯气制取盐酸是氧化还原反应,A不符合题意;
B.生石灰( )作干燥剂生石灰和水反应生成氢氧化钙为非氧化还原反应,B符合题意;
C.铝粉和NaOH反应生成氢气和四羟基合铝酸钠,物质用途与氧化还原反应有关,C不符合题意;
D.用 漂白棉、麻、纸张的原理是通过次氯酸离子的氧化作用,D不符合题意;
故选B。
6.(23-24高一上·安徽省芜湖市·期末)下列生产、生活中的事例不涉及氧化还原反应的是
A.燃料的燃烧 B.钢铁的锈蚀 C.干冰用于人工降雨D.食物的腐败
学科网(北京)股份有限公司【答案】C
【解析】A.燃料的燃烧是燃料与氧气发生氧化还原反应,即属于氧化还原反应,故A项正确;
B.钢铁的锈蚀是铁失电子发生氧化反应,属于氧化还原反应,故B项正确;
C.干冰用于人工降雨是利用干冰升华吸热,属于物理变化,故C项错误;
D.食物的腐败是食物被氧气氧化,属于氧化还原反应,故D项正确;
故本题选C。
考点02 氧化还原反应相关概念的判断
7.(23-24高一上·北京市东城区·期末)下列反应中,水只作还原剂的是
A.
B.
C.
D.
【答案】B
【解析】A.HO中氢元素化合价降低,氧元素化合价升高,则HO既作氧化剂又作还原剂,故A不符合
2 2
题意;
B.该反应中F元素化合价降低,F 作氧化剂,氧元素化合价升高,HO作还原剂,故B符合题意;
2 2
C.该反应中Cl元素的化合价既升高又降低,则该反应中Cl 既作氧化剂又作还原剂,HO既不作氧化剂
2 2
又不作还原剂,故C不符合题意;
D.该反应中Fe元素的化合价升高,Fe作还原剂,氢元素化合价降低,HO作氧化剂,故D不符合题意;
2
故选:B。
8.(23-24高一上·山东日照·期末)下列说法正确的是
A.多数酸性氧化物能与水反应生成相应的酸
B.非金属元素从化合态变为游离态一定被氧化
C.电解质的强弱取决于其在水溶液中的导电能力
D.具有还原性的物质在氧化还原反应中一定作还原剂
【答案】A
【解析】A.多数酸性氧化物能与水反应生成相应的酸,二氧化碳与水反应生成碳酸,A正确;
B.非金属元素从化合态变为游离态不一定被氧化,可能被还原,如电解水生成氧气与氢气,氢元素被还
原,B错误;
C.电解质的强弱取决于在水溶液中能否完全电离,完全电离为强电解质,部分电离为弱电解质,C错
误;
D.具有还原性和氧化性的物质,在氧化还原反应中,遇到强氧化剂作还原剂,遇到强还原剂,则作氧化
学科网(北京)股份有限公司剂,D错误;
答案选A。
9.(23-24高一上·浙江丽水·期末)关于化学反应:SO +2H S=3S↓+2H O,下列说法不正确的是
2 2 2
A.HS是还原剂 B.HO是还原产物
2 2
C.SO 是氧化剂 D.S既是氧化产物,又是还原产物
2
【答案】B
【解析】A.反应中HS中硫元素化合价升高,做还原剂,A正确;
2
B.反应中HO中氢、氧元素化合价没有变化,既不是氧化产物,也不是还原产物,B错误;
2
C.反应中SO 中硫元素化合价降低,做氧化剂,C正确;
2
D.反应中硫元素价态归中,S既是氧化产物,又是还原产物,D正确;
故选B。
10.(23-24高一上·湖南衡阳·期末)神舟十三号载人飞船所用的燃料为液态的偏二甲肼(C HN,其中H
2 8 2
元素显+1价) 和四氧化二氮(N O),反应的化学方程式为C HN+2N O=3N ↑+2CO ↑+4H O↑。下列关于该
2 4 2 8 2 2 4 2 2 2
反应的说法中正确的是
A.C HN 是氧化剂 B.属于置换反应
2 8 2
C.N 既是氧化产物,又是还原产物 D.每转移1.6 mol e-,生成11.2L气体
2
【答案】C
【解析】A.C HN 中N元素化合价升高,C元素化合价升高,是还原剂,NO 中N元素化合价降低,是
2 8 2 2 4
氧化剂,A错误;
B.反应物中没有单质,不属于置换反应,B错误;
C.N 既是氧化产物,又是还原产物,C正确;
2
D.没有说明是否是标准状况,无法计算气体的体积,D错误;
故选C。
考点03 氧化剂与还原剂
11.(23-24高一上·广东省广州市·期末)下列转化中,需要加入氧化剂才能实现的是
A. B. C. D.
【答案】B
【解析】A. 溴元素的化合价由零价降到-1价,化合价降低被还原,需要加入还原剂才能实现,
A错误;
B. 铁元素的化合价由零价到+2价,化合价升高被氧化,需要加入氧化剂才能实现,B正确;
C. 碳元素由+4价到+4价,化合价没变,没有发生氧化还原反应,C错误;
D. 氯元素由+7价到0价,化合价降低被还原,需要加入还原剂才能实现,D错误;
故选B。
12.(23-24高一上·湖北省十堰市·期末)实现下列物质间的转化,需要加入氧化剂的是
学科网(北京)股份有限公司A. B.
C. D.
【答案】C
【解析】A. 中H元素化合价降低,需要加入还原剂,A错误;
B. 中Si化合价降低,被还原,需要加入还原剂,B错误;
C. 中Fe元素化合价升高,被氧化,需要加入氧化剂,C正确;
D. 中Cu化合价降低,被还原,需要加入还原剂,D错误;
答案选C。
13.(23-24高一上·湖北省十堰市·期末)下列变化过程需要加入还原剂才能实现的是
A.KMnO →MnO B.SO →S C.Fe→Fe O D.Na→NaOH
4 2 2 3 4
【答案】B
【解析】A.KMnO →MnO ,Mn元素的化合价降低,加入还原剂可实现,但是当KMnO 自身分解时,也
4 2 4
可得到二氧化锰,化学方程式为: ,不需要额外加还原剂,A项不符合题
意;
B.SO →S,化合价降低,SO 作氧化剂,因此需要加入还原剂,B项符合题意;
2 2
C.Fe→Fe O 中Fe元素化合价升高,在反应中被氧化,则需要加入氧化剂才能实现,C项不符合题意;
2 3
D.Na→NaOH中Na元素化合价升高,在反应中被氧化,则需要加入氧化剂才能实现,D项不符合题意;
故选B。
14.(23-24高一上·安徽省皖北六校·期末)氧化还原反应是一类重要的化学反应,下列转化必须加入氧化
剂才能实现的是
A. B.
C. D.
【答案】A
【解析】A. 元素化合价升高,必须加入氧化剂才能实现,A项符合题意;
B. 元素化合价降低,需要加入还原剂或者自身与碱、水等反应,B项不符合题意;
C. 、 元素化合价都无变化,C项不符合题意;
D. 元素化合价升高,但可以通过电解生成,反应中 自身既作为氧化剂又作为还原剂,不一定需要
加入氧化剂,D项不符合题意;
故选A。
考点04 氧化还原反应的规律
15.(23-24高一上·广东省东莞市·期末)由于高温条件下能发生反应: (未配平),当
学科网(北京)股份有限公司火灾现场存放有大量金属Mg时,不能用 而应用干燥的沙土灭火。下列说法不正确的是
A.该反应属于置换反应 B.由该反应可知,Mg的还原性强于C
C.氧化产物与还原产物之比为2:1 D.每生成 ,转移电子的物质的量为2mol
【答案】D
【解析】A.该反应由一种单质和化合物反应生成另一种单质和化合物,是置换反应,故A正确,不符合
题意;
B.由该反应可知,Mg作还原剂,C是还原产物,故Mg的还原性强于C,故B正确,不符合题意;
C.根据化合价升降可知,氧化产物是氧化镁,还原产物为C,方程式为: ,故
氧化产物与还原产物之比为2:1,故C正确,不符合题意;
D.根据方程式可知,每生成一个C,得到四个电子,故每生成 ,转移电子的物质的量为4mol,故D
错误,符合题意;
故选D。
16.(23-24高一上·广东省广州市·期末)钛合金是具有耐腐蚀性的重要金属材料,金属钠在高温时与四氯
化钛反应可制取金属钛,高温反应的化学方程式为: 。下列说法不正确的是
A.Na在反应中被还原 B. 在反应中得到电子
C.Ti是还原产物 D.每生成24gTi,转移 电子
【答案】A
【解析】A.Na原子在反应中容易失去电子生成Na+,其是被氧化,故A错误;
B. 中Ti的化合价降低,在反应中得到电子,被还原,故B正确;
C. 中Ti的化合价降低,在反应中得到电子, 是氧化剂,Ti是还原产物,故C正确;
D.每生成24gTi,即生成0.5molTi,Ti元素化合价由+4降为0,则转移2mol电子,故D正确;
故选A。
17.(23-24高一上·福建省福州市·期末) 是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中
可通过以下反应制得: 。下列说法正确的是
A. 发生还原反应 B. 在反应中作氧化剂
C.该反应中 体现氧化性 D.每生成2mol ,转移的电子数为
【答案】A
【解析】A.Cl元素的化合价降低,得到电子被还原,则KClO 发生还原反应,故A正确;
3
B.C元素的化合价升高,失去电子被氧化,则HC O 在反应中被氧化,作为还原剂,故B错误;
2 2 4
C.在反应中, 中所含的元素均是并未变价,只体现了酸性,故C错误;
学科网(北京)股份有限公司D.由Cl元素的化合价变化可知,每1 mol ClO 生成,转移2mol×(5-4)=2mol电子,即该反应转移的电子
2
数为2N ,故D错误;
A
故答案选A。
18.(23-24高一上·湖北省A9高中联盟·期末)关于反应NaSO+HSO =Na SO +S↓+SO ↑+HO,下列
2 2 3 2 4 2 4 2 2
说法错误的是
A.HSO 没有参与氧化还原反应
2 4
B.NaSO 既是氧化剂又是还原剂
2 2 3
C.氧化剂与还原剂的物质的量之比为1∶1
D.1 mol Na SO 发生反应,转移4 mol电子
2 2 3
【答案】D
【分析】NaSO+H SO =Na SO +S ↓+SO ↑ +H O,该反应的本质是硫代硫酸根离子在酸性条件下发生歧化
2 2 3 2 4 2 4 2 2
反应生成硫和二氧化硫,化合价发生变化的只有S元素一种,硫酸的作用是提供酸性环境。
【解析】A.HSO 转化为硫酸钠和水,其中所含元素的化合价均未发生变化,故其没有发生还原反应,故
2 4
A正确;
B.NaSO 中的S的化合价为+2,其发生歧化反应生成S(0价)和SO (+4价),故其既是氧化剂又是还原
2 2 3 2
剂,故B正确;
C.该反应的氧化产物是SO ,还原产物为S,氧化产物与还原产物的物质的量之比为1:1,故C正确;
2
D.根据其中S元素的化合价变化情况可知,1mol Na SO 发生反应,要转移2 mol电子,故D错误;
2 2 3
故答案选D。
19.(23-24高一上·河南省洛阳市·期末)“绿水青山就是金山银山”,除尘脱硫在环境保护中有着重要的
作用。双碱法脱硫过程如图所示。下列说法错误的是
A.过程I中,SO 表现出酸性氧化物的性质
2
B.过程Ⅱ中,0.5molO 可氧化
2
C.双碱法脱硫过程中,Ca(OH) 可以循环利用
2
D.总反应为
【答案】C
【解析】A.SO 与NaOH生成盐和水,表现出酸性氧化物的性质,选项A正确;
2
B.1mol O 转移4mol e-,1mol Na SO 转移2mol e-,故二者反应时物质的量之比为1∶2,选项B正确;
2 2 3
C.由图可知循环利用的是NaOH,选项C错误;
D.由图可知总反应为 ,选项D正确;
答案选C。
考点05 氧化还原反应的综合考查
学科网(北京)股份有限公司20.(23-24高一上·安徽省皖北六校·期末)氮化硅( )陶瓷材料可应用于原子反应堆。氮化硅可由下列
反应制得: 。已知: 中 元素的化合价为-3。
回答下列问题:
(1)上述反应涉及的物质中属于氧化物的是 (填化学式)。碳元素存在多种单质,其中金刚石
和石墨是应用最广泛的两种,它们互为 。
(2)该反应的氧化剂是 (填化学式,下同),被氧化的物质是 ,氧化产物与还原产
物的质量之比为 。
(3)用双线桥法标出上述反应中电子转移的方向和数目: 。
(4)若生成标准状况下 ,则反应过程中转移 电子。
【答案】(1) 、 同素异形体
(2) 6:5
(3)
(4)3mol或
【解析】(1)由两种元素组成,一种为氧元素的属于氧化物;石墨与金刚石属于由同种元素组成的不同
物种,属于同素异形体;
故答案为:CO、SiO;同素异形体;
2
(2)C单质为0价,失去2个电子,发生氧化反应生成CO,N 中N的化合价为0,1个N 得到6个电
2 2
子,发生还原反应,作氧化剂,CO为氧化产物,Si N 为还原产物;
3 4
故答案为:N2;C;6:1;
(3)1个C失去2个电子,共有6个C发生氧化反应,1个N原子得到3个电子,共4个N发生还原反
应;
故答案为: ;
(4) ,1个CO转移2个电子,则1.5molCO共转移3mol电子;
故答案为:3mol或3N 。
A
21.(23-24高一上·广东省茂名市·期末)铁及其化合物的用途比较广泛,常用于制发电机和电动机的铁
学科网(北京)股份有限公司芯、磁铁、墨水、颜料等,是工业上所说的“黑色金属”之一。铁的化学性质比较活泼,常温下铁可以与
稀硝酸发生反应,反应的化学方程式为 。
(1)反应中氧化剂是 (填化学式),氮元素的化合价 (填“升高”或“降低”)。
(2)该反应中的氧化产物为 ,每生成11.2L(标准状况下)的NO,转移的电子个数为 。
(3)若消耗了 ,则生成标准状况下NO的体积是 L,转移电子的物质的量是
mol。
(4)请用双线桥标出电子转移的情况 。
【答案】(1) 降低
(2) (或 )
(3)5.6 0.75
(4)
【解析】(1)根据反应的化学方程式可知,反应过程中Fe元素的化合价升高,硝酸中部分N元素的化合
价从+5价降低到+2价,则 为氧化剂;氮元素的化合价降低;
(2)反应过程中Fe元素化合价从0价升高到+3价,得到 ,则氧化产物为 ;标准状况下
11.2LNO的物质的量为 ,硝酸中N元素的化合价从+5价降低到+2价,一
个N得到3个电子,则生成0.5molNO转移的电子数为1.5mol,数目为 或 ;
(3)根据反应的化学方程式可知,消耗4mol硝酸生成1molNO,若消耗了1molHNO,则生成标准状况下
3
NO的体积是 ;转移的电子数为 ;
(4)在反应 中,Fe元素的化合价升高,N元素的化合价降低,得
失电子数均为3,则用双线桥标出电子转移的情况为 。
1.(23-24高一上·安徽省芜湖市·期末)下列反应中,过氧化钠既不作氧化剂也不作还原剂的是
A.2NaO+2H O=4NaOH+O ↑
2 2 2 2
B.2NaO+2CO =2NaCO +O
2 2 2 3 2
C.NaO+H SO (稀)=Na SO +H O
2 2 2 4 2 4 2 2
D.Fe O+3Na O(熔融)=2Na FeO 十NaO
2 3 2 2 2 4 2
学科网(北京)股份有限公司【答案】C
【解析】A.在2NaO+2H O=4NaOH+O ↑反应中,过氧化钠既作氧化剂也作还原剂,B错误;
2 2 2 2
B.在2NaO+2CO =2NaCO +O 反应中,过氧化钠既作氧化剂也作还原剂,B错误;
2 2 2 3 2
C.反应NaO+H SO (稀)=Na SO +H O 是复分解反应,没有元素化合价的变化,因此过氧化钠既不作氧化
2 2 2 4 2 4 2 2
剂也不作还原剂,C正确;
D.在Fe O+3Na O(熔融)=2Na FeO 十NaO反应中,NaO 中的氧元素的化合价由反应前的-1价变为反
2 3 2 2 2 4 2 2 2
应后NaFeO、NaO中的-2价,化合价降低,获得电子,因此过氧化钠作氧化剂,D错误;
2 4 2
故选C。
2.(23-24高一上·湖北省A9高中联盟·期末)氧化还原反应与四种基本反应类型的关系如图,分析下列四
个化学反应,其中属于“3”区的是
A.2Na+2HO=2NaOH+H↑
2 2
B.2HClO 2HCl+O↑
2
C.4NH +5O 4NO+6HO
3 2 2
D.4Fe(OH) +O+2HO=4Fe(OH)
2 2 2 3
【答案】C
【解析】A.2Na+2HO=2NaOH+H↑属于置换反应且属于氧化还原反应,在4区,A项错误;
2 2
B.2HClO 2HCl+O↑属于分解反应且为氧化还原反应,在2区,B项错误;
2
C.4NH +5O 4NO+6HO中N、O元素化合价发生变化,属于氧化还原反应,但不属于四种基本
3 2 2
反应类型,在3区,C项正确;
D.4Fe(OH) +O+2HO=4Fe(OH) 属于化合反应且属于氧化还原反应,在1区,D项错误;
2 2 2 3
答案选C。
3.(23-24高一上·湖北省十堰市·期末) —铁纳米粉在现代电子工业上用途极为广泛,用赤铁矿石(含
、 ,也含有 、 、 等)制备纳米铁颗粒。下列说法正确的是
A.反应 中,氧化产物与还原产物的物质的量之比为1:2
B.实验室制氯气的方法为
C.少量 粉末与稀硫酸反应的离子方程式为
学科网(北京)股份有限公司D.将 和 粉末溶于足量的稀盐酸中,加入高锰酸钾溶液,一段时间后,高锰酸钾溶液褪色,则使
高锰酸钾溶液褪色的离子仅为
【答案】A
【解析】A.在反应中,HO 既是氧化剂又是还原剂, HO是还原产物, O 是氧化产物,氧化产物与还
2 2 2 2
原产物的物质的量之比为 1:2 ,A项正确;
B.实验室制氯气,使用的是浓HCl,条件是加热,B项错误;
C.CuO粉末与稀硫酸反应的离子方程式应为CuO+2H+= Cu2+ +H O ,因氧化铜是氧化物,在离子方程
2
式中不能拆成离子形式,C项错误;
D.Fe O 和FeO粉末溶于足量的稀盐酸中,会生成Fe3+ 和Fe2+ ,加入高锰酸钾溶液,一段时间后,高锰
2 3
酸钾溶液褪色 ,因为Fe2+具有还原性,可将酸性高锰酸钾还原为Mn2+,导致褪色,此外溶液中有盐酸,
也可以与高锰酸钾发生氧化还原反应而褪色,D项错误;
答案选A。
4.(23-24高一上·江西省部分学校·期末)以太阳能为热源分解 ,铁氧化合物循环分解水制 的过
程如图所示。下列说法错误的是
A.过程Ⅰ、Ⅱ发生的反应均属于氧化还原反应
B.该制氢过程中,固体的颜色不会发生变化
C.过程Ⅰ中每消耗116g ,理论上转移2mol电子
D.过程Ⅱ的化学方程式为
【答案】C
【解析】A.过程Ⅰ、Ⅱ发生的反应均有单质生成,元素化合价一定发生了变化,属于氧化还原反应,A
项正确;
B. 和 均为黑色固体,固体的颜色不会发生变化,B项正确;
C.116g 的物质的量为0.5mol,生成FeO时,理论上转移1mol电子,C项错误;
D.根据流程中给出的信息,判断反应物和生成物,过程Ⅱ的反应物 、 ,生成物是 、 ,
化学方程式为 ,D项正确;
答案选C。
5.(23-24高一上·山东省青岛市·期末)过氧化氢法制备NaClO 的反应为①
2
学科网(北京)股份有限公司②
。下列说法正确的是
A.ClO 做催化剂
2
B.①中的HSO 表现酸性
2 4
C.HO 在两个反应中分别做氧化剂和还原剂
2 2
D.制备54.3 g NaClO 至少需要10.2 g H O
2 2 2
【答案】B
【解析】A.ClO 在反应①中是生成物,在反应②中是反应物,因此该物质属于中间产物,而不是做催化
2
剂,A错误;
B.①中的HSO 提供酸根离子,用来结合形成盐;提供氢离子,用来形成水,因此硫酸表现酸性,B正
2 4
确;
C.HO 在反应①②中都是作还原剂,失去电子被氧化,C错误;
2 2
D.根据两个反应方程式可知:用NaClO 制取NaClO,每制取NaClO1 mol,反应消耗1 mol H O,54.3 g
3 2 2 2 2
NaClO 的物质的量是n(NaClO)= =0.6 mol,则反应消耗0.6 mol HO,其质量为m(H O)=0.6
2 2 2 2 2 2
mol×34 g/mol=20.4 g,D错误;
故合理选项是B。
6.(23-24高一上·安徽省皖北六校·期末)将绿矾( )溶于水配制成溶液喷施在叶面上,可解决
植物叶面变黄问题,因此绿矾又被誉为“铁肥”。下列有关“铁肥”说法错误的是
A.“铁肥”易被空气氧化变质
B.可用 溶液检验“铁肥”是否发生变质
C.为保证“铁肥”的效果,可向配制后的溶液中加入少量铁粉
D. 的摩尔质量为
【答案】B
【解析】A.亚铁离子具有还原性,易被空气中氧气氧化,所以“铁肥”易被空气氧化变质,故A正确;
B.亚铁离子具有还原性,易被空气中氧气氧化为铁离子,则检验“铁肥”是否发生变质的试剂为硫氰化
钾溶液,故B错误;
C.溶液中铁离子能与铁反应生成亚铁离子,则为防止亚铁离子被氧化,保证“铁肥”的效果,应向配制
后的溶液中加入少量铁粉,故C正确;
D.由化学式可知,七水硫酸亚铁的摩尔质量为278g/mol,故D正确;
故选B。
7.(23-24高一上·广东省东莞市·期末)方程式是世界通用的化学语言。下列方程式书写正确的是
A.钠和冷水反应:
B. 与浓盐酸制备 :
学科网(北京)股份有限公司C.将碳酸钙加入过量盐酸中:
D.Fe在氯气中燃烧:
【答案】B
【解析】A.金属钠和冷水反应生成氢氧化钠和氢气: ,故A错误;
B. 与浓盐酸反应生成 、MnCl 和HO,离子方程式为 ,
2 2
故B正确;
C.将碳酸钙加入过量盐酸中,离子反应为 ,故C正确;
D.Fe在氯气中燃烧生成FeCl ,化学方程式为 ,故D错误;
3
故选B。
8.(23-24高一上·安徽省芜湖市·期末)废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH +完
4
全转化为N,该反应可表示为2NH ++3ClO-=N↑+3Cl-+2H++3H O。下列说法中,不正确的是
2 4 2 2
A.反应中氮元素被氧化,氯元素被还原
B.还原性NH +< Cl-
4
C.反应中每生成1 mol N ,转移6 mol电子
2
D.经此法处理过的废水不可以直接排放
【答案】B
【解析】A. 反应中氮元素的化合价升高,所以氮元素被氧化;氯元素的化合价降低,所以氯元素被还
原,A正确;B. 是还原剂,而 是还原产物,所以还原性 > ,B不正确;C. N的化合价
由-3升高到0,所以反应中每生成1 mol 就转移6 mol电子,C正确;D. 经此法处理过的废水中含有大
量盐酸,盐酸会污染水体、影响水生生物的生存,所以不可以直接排放,D正确。本题选B。
9.(23-24高一上·湖北省荆门市·期末)分别是从海藻灰和智利硝石中提取碘的主要反应:
①
②
下列说法正确的是
A. 与 在一定条件下可生成
B.碘元素在反应(1)中被还原,在反应(2)中被氧化
C.氧化性:
D.反应①②中生成等量 时转移电子数为2:5
【答案】A
【解析】A. 与 可以发生归中反应生成碘单质,A正确;
B.碘元素在反应①中化合价升高,被氧化,在反应②中化合价降低,被还原,B错误;
C.氧化性的强弱:氧化剂大于氧化产物,所以由反应 可知氧化性: ,由反应 可知氧化
① ②
学科网(北京)股份有限公司性: ,C错误;
D.反应 中生成1mol 转移2mol电子,在反应 中生成1mol 转移10mol电子,所以反应 中生成
① ② ①②
等量 时转移电子数为2:10,D错误;
故选A。
10.(23-24高一上·湖北省部分省级示范高中·期末)高铁酸钠 是一种新型绿色消毒剂,主要用
于饮用水的处理。工业上制备高铁酸钠的一种方法化学原理可以用离子方程式表示:
。下列说法正确的是
A. 能杀菌消毒,利用了其强还原性
B.每生成 ,转移电子为
C.离子方程式中涉及的元素都是短周期元素
D. 处理水时,既能杀菌消毒,生成的 胶体又能吸附水中的悬浮杂质
【答案】D
【解析】A. 中Fe的化合价为+6价,具有强氧化性, 能杀菌消毒,利用了其强氧化性,
A错误;
B. 反应中,Fe的化合价由+3价升高到+6价,失去3个电
子,故每生成 ,转移电子为 ,B错误;
C. 反应中涉及的Fe元素为第四周期第VIII族元素,不为短
周期元素,C错误;
D. 在处理水时被还原为Fe3+,Fe3+易水解生成 胶体,能吸附水中的悬浮杂质,D正确;
故选D。
11.(23-24高一上·安徽省部分学校·期末)已知 某溶液(该溶液称为 )中仅含有两种溶质
和 ,且物质的量浓度依次为 和 ,向该溶液中投入 铁粉恰好完全反应,释放出
的气体体积为 。下列叙述正确的是
A. 中 的物质的量为
B.
C.反应后所得溶液中氧化产物与还原产物的物质的量之比为
D.
【答案】C
【解析】A. 中 的物质的量为1.0mol/L×0.2×3L+2.0mol/L×0.2L=1.0mol,A错误;
B. 物质的量为0.2mol, 物质的量为0.4mol,根据2FeCl +Fe=3FeCl 、Fe+2HCl=FeCl +H ↑,
3 2 2 2
学科网(北京)股份有限公司,B错误;
C.反应后所得溶液中氧化产物物质的量为0.1 mol +0.2 mol =0.3mol,还原产物只有氯化铁生成的氯化亚
铁,物质的量为0.2 mol,比值为3:2,C正确;
D.气体存在状态未知,无法确定具体数值,D错误;
故选C。
12.(23-24高一上·广东省茂名市·期末)将HS和空气的混合气体通入FeCl 、FeCl 和CuCl 的混合溶液
2 3 2 2
中回收S,其转化如图所示(CuS不溶于水)。下列说法错误的是
A.整个转化过程中Fe3+可以循环使用
B.过程①发生复分解反应
C.过程中Fe3+数量不变,当有32g硫生成时,消耗16gO
2
D.过程②中,发生反应的离子方程式为
【答案】D
【分析】过程①发生反应:Cu2++H S=CuS↓+2H+,过程②发生反应:CuS+2Fe3+=Cu2++2Fe2++2S,过程③发
2
生反应:4Fe2++O +4H+=4Fe3++2H O。
2 2
【解析】A.整个转化过程中,过程②消耗Fe3+,过程③生成Fe3+,则Fe3+可以循环使用,A正确;
B.过程①中,发生反应Cu2++H S=CuS↓+2H+,属于复分解反应,B正确;
2
C.过程中n(Fe3+)不变,HS与O 存在以下关系式:2HS~O ~2S,当有1mol S生成时,消耗0.5mol O ,氧
2 2 2 2 2
气的质量是16g,C正确;
D.由分析可知,过程②发生反应的离子方程式为:CuS+2Fe3+=Cu2++2Fe2++2S,D错误;
故答案选D。
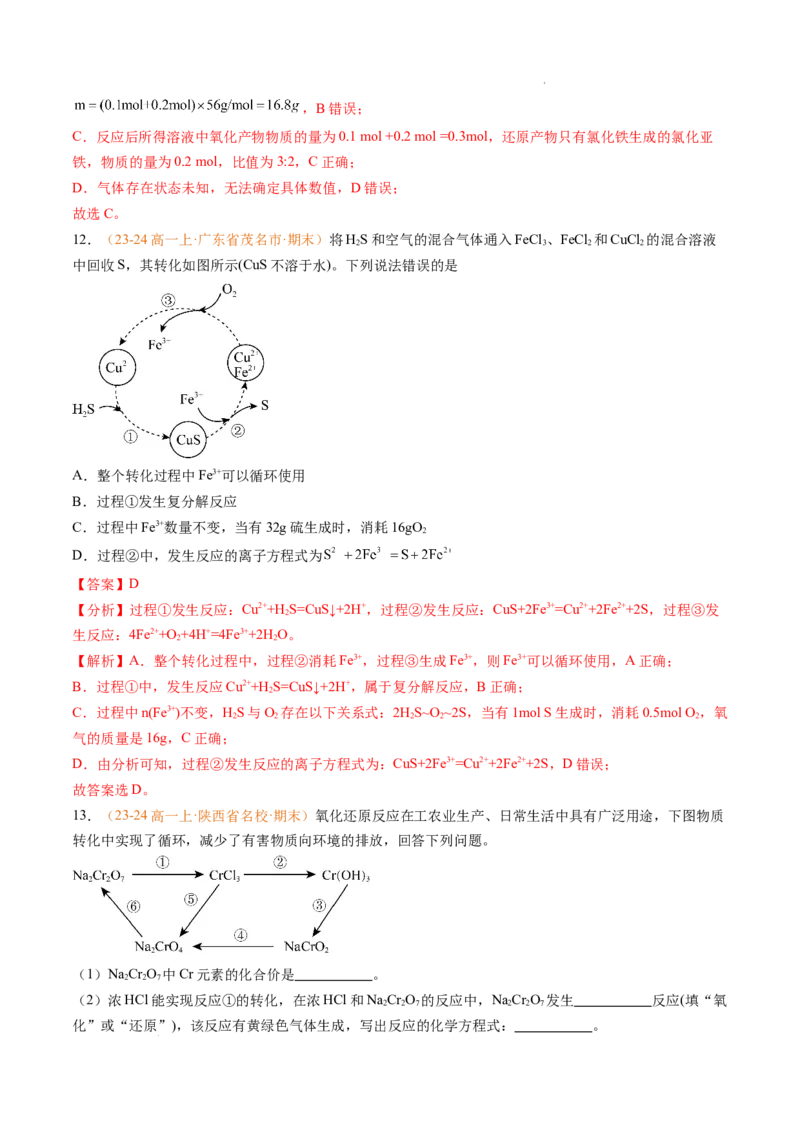
13.(23-24高一上·陕西省名校·期末)氧化还原反应在工农业生产、日常生活中具有广泛用途,下图物质
转化中实现了循环,减少了有害物质向环境的排放,回答下列问题。
(1)NaCr O 中Cr元素的化合价是 。
2 2 7
(2)浓HCl能实现反应①的转化,在浓HCl和NaCr O 的反应中,NaCr O 发生 反应(填“氧
2 2 7 2 2 7
化”或“还原”),该反应有黄绿色气体生成,写出反应的化学方程式: 。
学科网(北京)股份有限公司(3)反应④在碱性条件下发生,反应的离子方程式为:_____ClO +___________
+___________□=___________Cl-+___________ +___________H O,请将□所缺的物质补充完整并配平
2
方程式 。
【答案】(1)+6
(2)还原
(3)
【解析】(1)由化合价代数和为0可知,重铬酸钠中铬元素的化合价为+6价,故答案为:+6;
(2) 反应中铬元素化合价降低被还原,重铬酸钠是反应的氧化剂,发生还原反应;黄绿色气体为氯气,
反应的离子方程式为 ,故答案为:还原;
;
(3)由未配平的方程式可知,在碱性条件下,溶液中氯酸根离子与 离子发生氧化还原反应生成铬酸
根离子、氯离子和水,反应的离子方程式为 ,故答案为:
。
学科网(北京)股份有限公司