文档内容
2023 学年第一学期江浙高中(县中)发展共同体高三年级 10 月联考(浙江卷)
化 学
考生须知:
1.本试卷共6页,21小题。本卷满分100分,考试时间90分钟;
2.答题前,请务必将自己的姓名、准考证号用黑色字迹的签字笔或钢笔分别填写在试题卷和答题纸
规定的位置上;
3.答题时,请按照答题纸上“注意事项”的要求,在答题纸相应的位置上规范作答,在本试题卷上
的作答一律无效;
4.非选择题的答案必须使用黑色字迹的签字笔或钢笔写在答题纸上相应区域内,作图时可先使用2B
铅笔,确定后必须使用黑色字迹签字笔或钢笔描黑;
5.参加联批学校的学生可关注“启望教育”公众号查询个人成绩分析。
6.可能用到的相对原子质量:H1 C12 O16 Na23 Mg24 S32 Cl35.5 Fe56 Co59
Zn65 Ag108
一、选择题(本大题共16题,每小题3分,共48分。每小题列出的四个备选项中只有一个是符合题目要
求的,不选、多选、错选均不得分)
1.下列物质中属于耐高温无机非金属材料的是
A.SiC B.聚四氟乙烯 C.Mg-Al D.普通玻璃
2.下列化学用语表示正确的是
A.苯酚的分子式:C H OH B.异丁烷的球棍模型:
6 5
C.Cl 分子中σ键电子云轮廓图: D.乙醚的结构简式:CH OCH
2 3 3
3.下列说法不
.
正
.
确
.
的是
A.镁很活泼,点燃镁条之前,应该用砂纸打磨掉表面氧化膜
B.FeO不稳定,在空气中受热能迅速氧化成Fe O
2 3
C.工业上用焦炭和石英砂制备粗硅
D.二氧化氮能使湿润的淀粉碘化钾试纸变蓝
4.物质的性质决定用途,下列两者对应关系不
.
正
.
确
.
的是
A.液氨汽化时吸收大量的热,工业上可用作制冷剂
B.硅是重要的半导体,可用来生产光导纤维
C.浓硫酸有吸水性,在实验室中常用作干燥剂
D.明矾溶于水形成胶体,可用于净水
5.下列说法正确的是
A.用图①装置蒸干NH Cl饱和溶液制备NH Cl晶体
4 4
B.用图②装置制备、收集氨气
C.用图③所示操作转移NaOH溶液到容量瓶中
D.装置④用于制备少量含NaClO的消毒液
高三化学试题 第1页(共6页)
{#{QQABTQAEggigQBBAAQgCAwkwCAGQkAECAIoORBAIoAAAwBFABAA=}#}6.FeSO 可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠,反应如下:
4
2FeSO +6Na O =2Na FeO +2Na O+2Na SO +O ↑,下列说法正确的是
4 2 2 2 4 2 2 4 2
A.氧化产物只有Na FeO
2 4
B.生成1molO ,转移8mol电子
2
C.氧化剂和还原剂的物质的量之比为1:3
D.当6molNa O 参加反应时,被FeSO 还原的Na O 有4mol
2 2 4 2 2
7.N 是阿伏伽德罗常数的值,下列说法正确的是
A
A.标准状况下,11.2LSO 分子中所含的O原子数为1.5N
3 A
B.1L0.1mol·L-1CH COONa溶液通HCl气体至中性,醋酸根离子数为0.1N
3 A
C.5.8gC H O中含有的σ键数目最多为N
3 6 A
D.向含1molH O 的水溶液中分别加入足量MnO 、KMnO 固体,转移的电子数均为2N
2 2 2 4 A
8.下列说法不
.
正
.
确
.
的是
A.红外光谱可以测定未知有机物中所含的化学键和官能团
B.网状结构酚醛树脂是由过量苯酚与甲醛发生缩聚反应制得
C.蛋白质溶液遇到饱和(NH ) SO 溶液,有固体析出,该过程叫盐析
4 2 4
D.可用饱和碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
9.下列离子反应方程式正确的是
A.碳酸氢钠溶液呈碱性:HCO -+H O CO 2-+H O+
3 2 3 3
B.常温下铁加入过量浓硝酸中:Fe+6H++3NO -=Fe3++3NO ↑+3H O
3 2 2
C.将碳酸氢钙溶液与过量的澄清石灰水混合:HCO -+Ca2++OH-=CaCO ↓+H O
3 3 2
D.Na S O 溶液中加入稀硫酸:3S O 2-+2H+=4S↓+2SO 2-+H O
2 2 3 2 3 4 2
10.化合物Z是合成某种抗结核候选药物的重要中间体,可由下列反应制得:
下列有关化合物X、Y和Z的说法正确的是
A.X分子中含3个手性碳原子
B.Y分子中的碳原子一定处于同一平面
C.X、Y、Z在NaOH乙醇溶液中加热均能发生消去反应
D.X、Z分别在过量NaOH溶液中加热,均能生成丙三醇
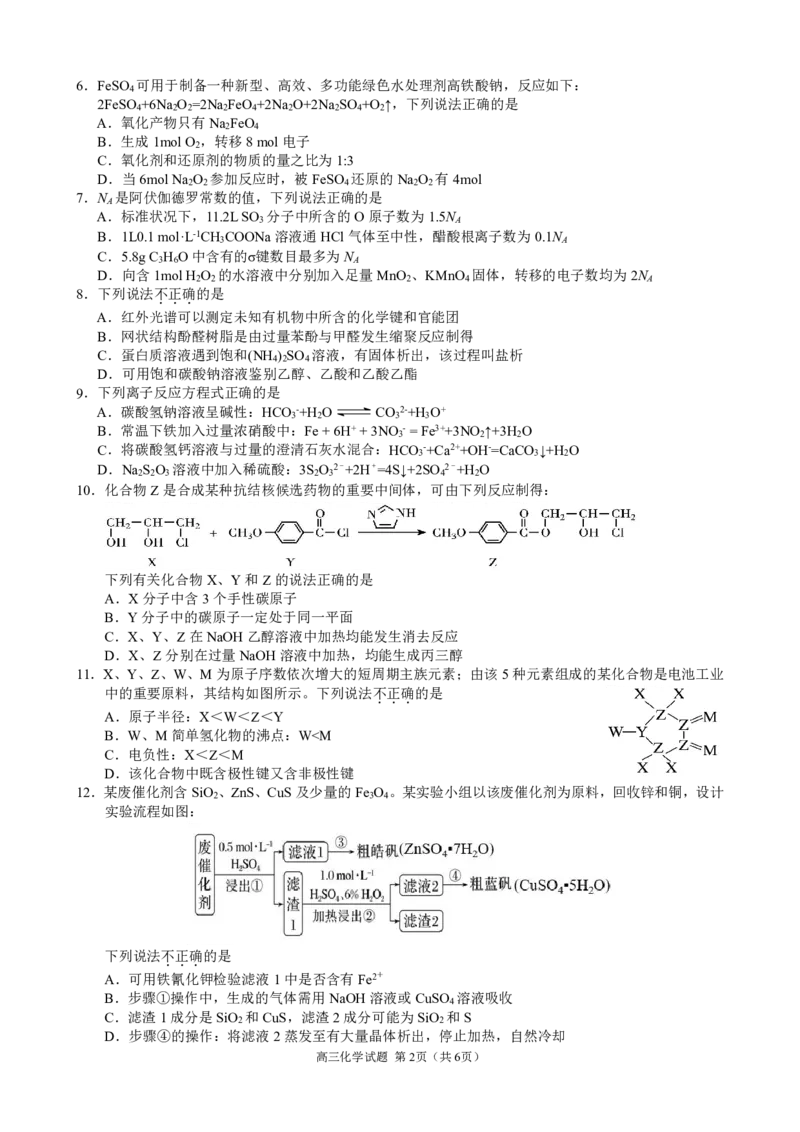
11.X、Y、Z、W、M为原子序数依次增大的短周期主族元素;由该5种元素组成的某化合物是电池工业
中的重要原料,其结构如图所示。下列说法不正确的是
...
A.原子半径:X<W<Z<Y
B.W、M简单氢化物的沸点:W③>②
B.向Na CO 溶液中滴加少量氯水的离子方程式:CO 2-+Cl +H O=HCO -+Cl-+HClO
2 3 3 2 2 3
C.AgCl在盐酸中的K 小于其在水中的K
sp sp
D.向浓度均为1×10-3mol·L-1的KCl和K CrO 的混合溶液中滴加1×10-3mol·L-1的AgNO 溶液,
2 4 3
CrO 2-先形成沉淀
4
16.根据下列实验操作和现象能得到相应结论的是
选项 实验操作和现象 结论
向Na S溶液中通入足量CO ,然后再将产生的
2 2
A K (H CO )>K (H S)
气体导入CuSO 溶液中,产生黑色沉淀 a1 2 3 a1 2
4
取一定量未知溶液于试管中,滴入NaOH溶液并
B 试纸变蓝,说明溶液中含有铵盐
加热,试管口放置湿润红色石蕊试纸
常温下,用pH计分别测定1mol·L-1和0.1mol·L-1 同温下,不同浓度的CH COONH 溶液
3 4
C
CH COONH 溶液的pH,pH均为7 中水的电离程度相同
3 4
D 将炽热的木炭与浓硝酸混合,产生红棕色气体 加热条件下,浓硝酸被木炭还原成NO
2
二、非选择题(本大题共5小题,共52分)
17.(10分)硫及其化合物种类繁多,应用广泛。请回答:
(1)基态硫原子的价层电子排布图是 ▲ 。
(2)下列有关说法正确的是 ▲ 。
A.同周期元素中,第一电离能大于硫元素的有3种
B.SO 的VSEPR模型和空间结构均为V形
2
C.甲基磺酸( )中S原子采取sp杂化
D.[Ne]3s13p44s1的发射光谱不止1条谱线
高三化学试题 第3页(共6页)
{#{QQABTQAEggigQBBAAQgCAwkwCAGQkAECAIoORBAIoAAAwBFABAA=}#}(3)S O 2-( )中的O-O比H O 中的更 ▲ (填“难”或“易”)断裂。
2 8 2 2
其原因是 ▲ 。
(4)锌与硫形成的化合物晶体的晶胞如图所示。
Zn2+的配位数为 ▲ 。
设N 为阿伏伽德罗常数的值,晶胞参数为anm,则该晶
A
体的密度 ▲ 。
18.(10分)碳酸二甲酯( ) 是一种环保性能优异、用途广泛的化工原料,可以通过下列
流程制备:
已知:酰氯具有酯的性质。请回答:
(1)写出NH 的电子式 ▲ 。
3
(2)写出步骤Ⅲ的化学反应方程式 ▲ 。
(3)下列说法正确的是 ▲ 。
A.液氯和氯水工业上均可用铁槽车运送
B.CO(NH ) 属于铵盐,含氮量高,可作氮肥
2 2
C.碳酸二甲酯在酸性条件下水解产生的气体是非极性分子
D.CO与Fe可形成配合物Fe(CO) ,其中配位原子是O
5
(4)碳酸二甲酯比碳酸一甲酯的沸点 ▲ (填“低”或“高”),分析其原因 ▲ 。
(5)设计实验方案检验COCl 中的氯元素 ▲ 。
2
19.(10分)H S的吸收与利用有多种形式,根据下列研究回答:
2
Ⅰ.干法脱硫:2HS(g)+3O (g)=2SO (g)+2HO(l);ΔH=-1124.4kJ·mol-1
2 2 2 2 1
S(s)+O (g)=SO (g); ΔH =-296.8kJ·mol-1
2 2 2
(1)空气氧化脱除H S反应:2HS(g)+O(g)=2S(s)+2H O(l)的ΔH= ▲ kJ·mol-1。
2 2 2 2
Ⅱ.H S高温裂解反应:2H S(g) 2H (g)+S (g)
2 2 2 2
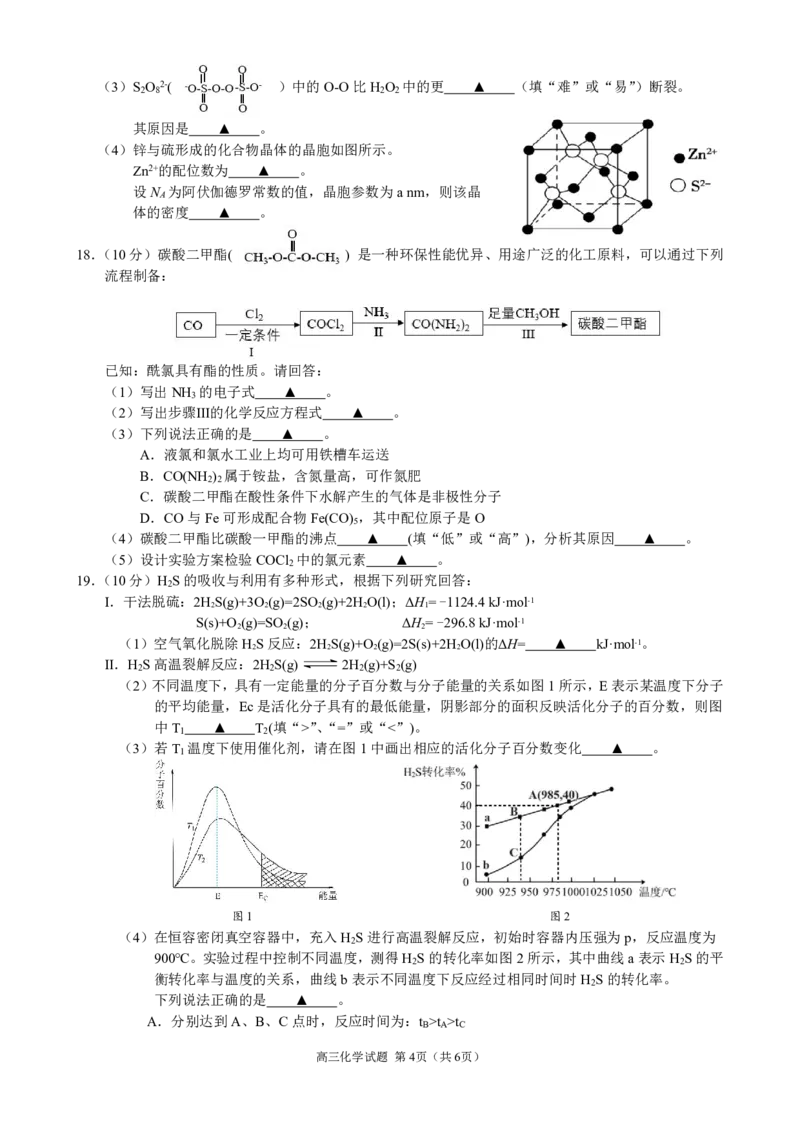
(2)不同温度下,具有一定能量的分子百分数与分子能量的关系如图1所示,E表示某温度下分子
的平均能量,Ec是活化分子具有的最低能量,阴影部分的面积反映活化分子的百分数,则图
中T ▲ T (填“>”、“=”或“<”)。
1 2
(3)若T 温度下使用催化剂,请在图1中画出相应的活化分子百分数变化 ▲ 。
1
图1 图2
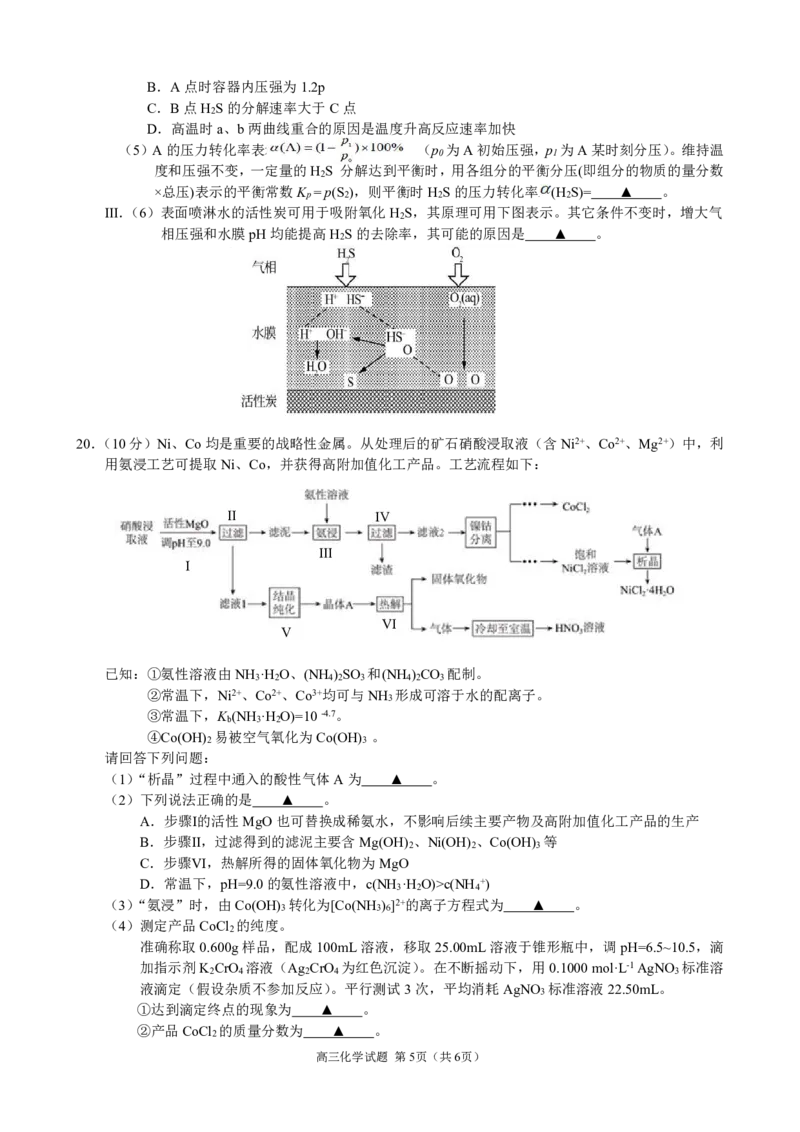
(4)在恒容密闭真空容器中,充入H S进行高温裂解反应,初始时容器内压强为p,反应温度为
2
900℃。实验过程中控制不同温度,测得H S的转化率如图2所示,其中曲线a表示H S的平
2 2
衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H S的转化率。
2
下列说法正确的是 ▲ 。
A.分别达到A、B、C点时,反应时间为:t >t >t
B A C
高三化学试题 第4页(共6页)
{#{QQABTQAEggigQBBAAQgCAwkwCAGQkAECAIoORBAIoAAAwBFABAA=}#}B.A点时容器内压强为1.2p
C.B点H S的分解速率大于C点
2
D.高温时a、b两曲线重合的原因是温度升高反应速率加快
(5)A的压力转化率表示为: (p 为A初始压强,p 为A某时刻分压)。维持温
0 1
度和压强不变,一定量的H S 分解达到平衡时,用各组分的平衡分压(即组分的物质的量分数
2
×总压)表示的平衡常数K =p(S ),则平衡时H S的压力转化率 (H S)= ▲ 。
p 2 2 2
Ⅲ.(6)表面喷淋水的活性炭可用于吸附氧化H S,其原理可用下图表示。其它条件不变时,增大气
2
相压强和水膜pH均能提高H S的去除率,其可能的原因是 ▲ 。
2
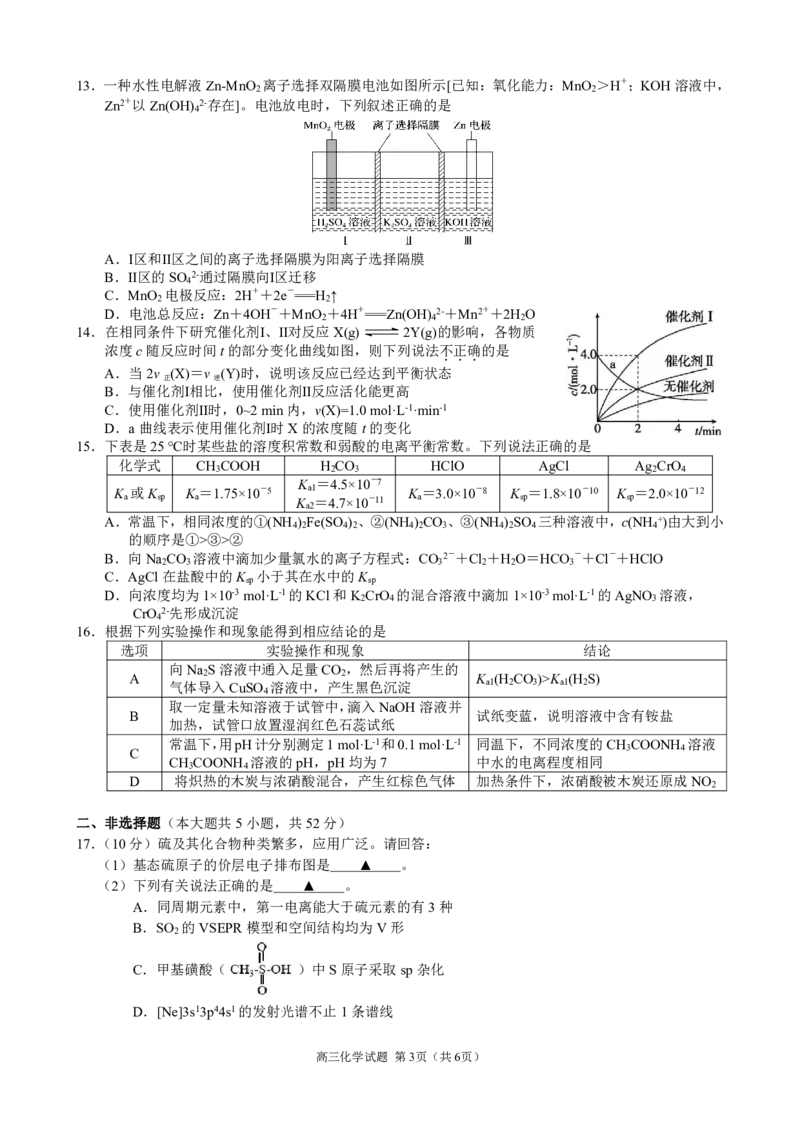
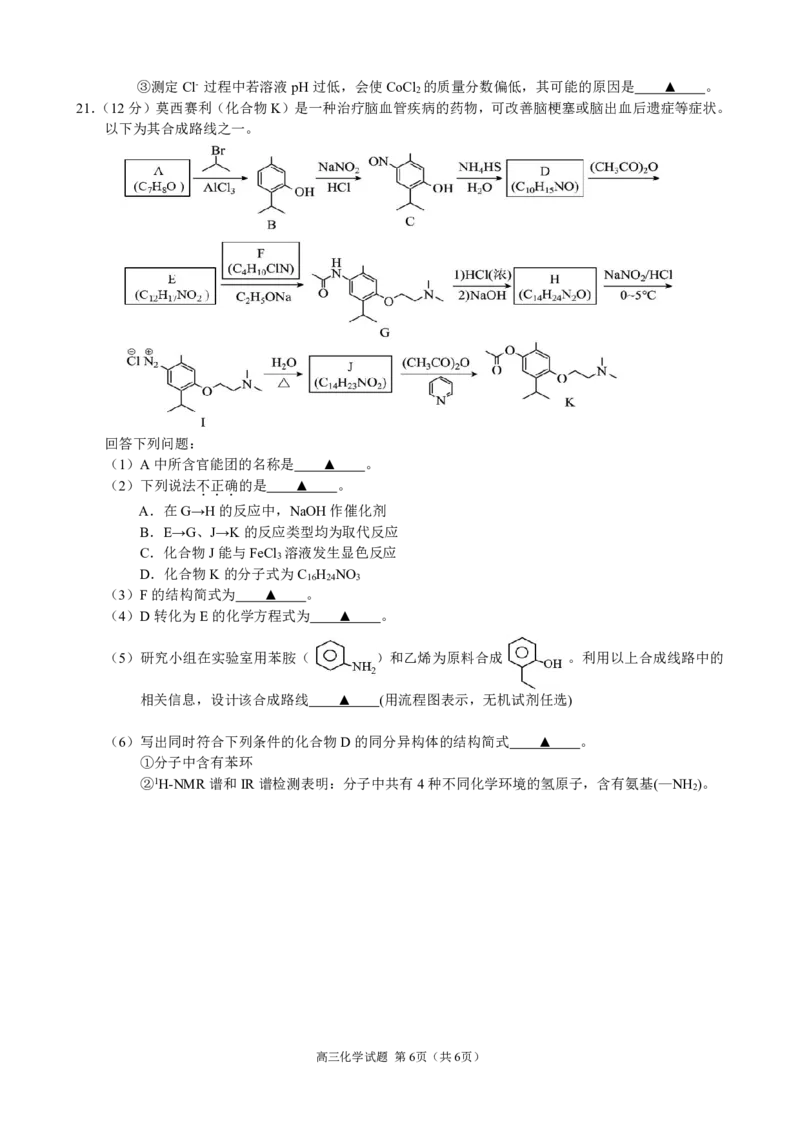
20.(10分)Ni、Co均是重要的战略性金属。从处理后的矿石硝酸浸取液(含Ni2+、Co2+、Mg2+)中,利
用氨浸工艺可提取Ni、Co,并获得高附加值化工产品。工艺流程如下:
Ⅱ Ⅳ
Ⅲ
Ⅰ
Ⅵ
Ⅴ
已知:①氨性溶液由NH ·H O、(NH ) SO 和(NH ) CO 配制。
3 2 4 2 3 4 2 3
②常温下,Ni2+、Co2+、Co3+均可与NH 形成可溶于水的配离子。
3
③常温下,K (NH ·H O)=10-4.7。
b 3 2
④Co(OH) 易被空气氧化为Co(OH) 。
2 3
请回答下列问题:
(1)“析晶”过程中通入的酸性气体A为 ▲ 。
(2)下列说法正确的是 ▲ 。
A.步骤Ⅰ的活性MgO也可替换成稀氨水,不影响后续主要产物及高附加值化工产品的生产
B.步骤Ⅱ,过滤得到的滤泥主要含Mg(OH) 、Ni(OH) 、Co(OH) 等
2 2 3
C.步骤Ⅵ,热解所得的固体氧化物为MgO
D.常温下,pH=9.0的氨性溶液中,c(NH ·H O)>c(NH +)
3 2 4
(3)“氨浸”时,由Co(OH) 转化为[Co(NH ) ]2+的离子方程式为 ▲ 。
3 3 6
(4)测定产品CoCl 的纯度。
2
准确称取0.600g样品,配成100mL溶液,移取25.00mL溶液于锥形瓶中,调pH=6.5~10.5,滴
加指示剂K CrO 溶液(Ag CrO 为红色沉淀)。在不断摇动下,用0.1000mol·L-1AgNO 标准溶
2 4 2 4 3
液滴定(假设杂质不参加反应)。平行测试3次,平均消耗AgNO 标准溶液22.50mL。
3
①达到滴定终点的现象为 ▲ 。
②产品CoCl 的质量分数为 ▲ 。
2
高三化学试题 第5页(共6页)
{#{QQABTQAEggigQBBAAQgCAwkwCAGQkAECAIoORBAIoAAAwBFABAA=}#}③测定Cl- 过程中若溶液pH过低,会使CoCl 的质量分数偏低,其可能的原因是 ▲ 。
2
21.(12分)莫西赛利(化合物K)是一种治疗脑血管疾病的药物,可改善脑梗塞或脑出血后遗症等症状。
以下为其合成路线之一。
回答下列问题:
(1)A中所含官能团的名称是 ▲ 。
(2)下列说法不 . 正 . 确 . 的是 ▲ 。
A.在G→H的反应中,NaOH作催化剂
B.E→G、J→K的反应类型均为取代反应
C.化合物J能与FeCl 溶液发生显色反应
3
D.化合物K的分子式为C H NO
16 24 3
(3)F的结构简式为 ▲ 。
(4)D转化为E的化学方程式为 ▲ 。
(5)研究小组在实验室用苯胺( )和乙烯为原料合成 。利用以上合成线路中的
相关信息,设计该合成路线 ▲ (用流程图表示,无机试剂任选)
(6)写出同时符合下列条件的化合物D的同分异构体的结构简式 ▲ 。
①分子中含有苯环
②1H-NMR谱和IR谱检测表明:分子中共有4种不同化学环境的氢原子,含有氨基(—NH )。
2
高三化学试题 第6页(共6页)
{#{QQABTQAEggigQBBAAQgCAwkwCAGQkAECAIoORBAIoAAAwBFABAA=}#}