文档内容
2023 年湖北省高三 9 月起点考试
高三化学参考答案、解析及评分标准
一、选择题(每小题3分,共45分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 D A A C B D A C B C B A B C D
1.【答案】D
【解析】防止塑料的老化应该添加防老剂,不是增塑剂,A项错误。生石灰能够吸水防潮,不能作脱氧
剂,B项错误。被保护金属作原电池正极,可保护金属不被腐蚀,C项错误。
2.【答案】A
【解析】鍮石是纯铜,假鍮石是铜锌合金,合金硬度比其成分金属的大,假鍮石硬度大相对不方便冲压
△
成型,C 项正确,A 项错误,是本题的答案。假鍮石炼制过程涉及反应:ZnCO ==ZnO+CO ↑、
3 2
△
2ZnO+C==2Zn+CO ↑等,B、D项正确。
2
3.【答案】A
【解析】苯环与碳碳双键以碳碳单键相连,碳碳单键可以旋转,所有碳原子不一定共平面,B项错误。
1mol该物质最多消耗10molH ,C项错误。该有机物含有醇羟基,能发生氧化反应,D项错误。
2
4.【答案】C
【解析】H+、SiO2-不能共存,A项错误。加入过量稀硫酸时,没有气体生成,B项错误。Fe3+有颜色,
3
不符合题意,D项错误。
5.【答案】B
【解析】Na S O +H SO =Na SO +S↓+SO ↑+H O,H SO 在反应中化合价未变化,体现的是酸性,A项
2 2 3 2 4 2 4 2 2 2 4
错误。反应生成的2,4,6-三溴苯酚溶解在过量的苯酚浓溶液中,无白色沉淀产生,C项错误。银表面有银
白色金属沉积,说明Ag是原电池的正极,D项错误。
6.【答案】D
【解析】X、Y、Z、W、M分别是H、O、Al、S、Cl元素。非金属性:H<O,A项错误。熔点:离子
晶体Al O >分子晶体AlCl ,B项错误。离子半径:Al3+<S2−,C项错误。非金属性:S<Cl,还原性H S
2 3 3 2
>HCl,D项正确。
7.【答案】A
【解析】实验中直形冷凝管用于冷凝分离乙醚,不能用球形冷凝管代替,否则冷凝的乙醚会残留在球形
冷凝管的玻璃球内,不利于分离乙醚,A项错误,是本题的答案。
8.【答案】C
【解析】PCl 中磷原子有1对孤对电子,BBr 中硼原子缺电子,Cl PBBr 中含有P→B配位键,A项正确。
3 3 3 3
PCl 和[PBr ]+的磷原子价层电子对数均为4,VSEPR模型是四面体形,B项正确。Cl PBBr 中磷原子价层
3 4 3 3
湖北省新高考联考协作体*化学答案(共6页)第1页电子对数为4,是sp3杂化,[PCl ]-中磷原子价层电子对数为6,不是sp3杂化,C项错误,是本题的答案。
6
PCl 和PBr 结构的差异是因为Cl-半径较小,可形成[PCl ]-,而Br-半径较大,无法形成[PBr ]-,D项正
5 5 6 6
确。
9.【答案】B
【解析】通常离子的浓度越高,溶液的导电能力越强。没有指明酸的浓度,强酸溶液的导电能力不一定
比弱酸溶液的强,B项错误,是本题的答案。
10.【答案】C
【解析】Be2+为硬酸,F-为硬碱,I-为软碱,稳定性BeF >BeI ,A项正确。同理,B项正确。Li+为硬
2 2
酸,F-为硬碱,I-为软碱,稳定性LiF>LiI,反应LiI+CsF=LiF+CsI能向右进行,C项错误,是本题的
答案。[Fe(SCN) ]3−转化为[FeF ]3−,说明[FeF ]3−更稳定,碱的“硬度”: F->SCN-,D项正确。
6 6 6
11.【答案】B
【解析】E→F的反应为:E+TFAA→F+CF CO H,是取代反应,A项正确。含C=C、C=N等结构的物
3 2
质可形成顺反异构,但是E、F均是以C=N与六元环对位碳连线为对称轴的对称结构,不能形成顺反异
构,B项错误,是本题的答案。C-F的极性大于C-H,导致CF CO H的羟基极性更大,更易电离出H+,
3 2
C项正确。G及其同分异构体有2个不饱和度,芳香族化合物至少有4个不饱和度,二者的氢原子数不
相等,G的同分异构体中不可能含有芳香族化合物,D项正确。
12.【答案】A
Cl
【解析】历程Ⅰ的总反应O +O=2O ,历程Ⅱ的总反应O +O==2O ,二者的ΔH相等,A项错误,是本题的
3 2 3 2
答案。Cl
2
(g)的相对能量为0,图中O
3
+O→O
3
+O+Cl的能量差为(E
2
-E
3
)kJ∙mol−1,可计算Cl-Cl键能为
2(E
2
-E
3
)kJ∙mol−1,B项正确。历程Ⅱ中第一步活化能大于第二步,所以控速步为第一步,方程式为:
O +Cl=O +ClO,C 项正确。历程Ⅱ中第二步的热化学方程式为:O(g)+ClO(g)=O (g)+Cl(g) ΔH=(E -
3 2 2 5
E
4
)kJ∙mol−1,D项正确。
13.【答案】B
【解析】电池工作时,右侧(阳极)的 H+通过离子交换膜进入左侧(阴极),参与阴极区反应
4Fe2++O +4H+=4Fe3++2H O,而阴极的电极反应为Fe3++e-=Fe2+,可见Fe3+起了催化剂的作用,降低了
2 2
通电
O 直接在电极上放电的活化能,该过程的总反应为O +4HCl=====2Cl +2H O。因此,A、C及D项正确。
2 2 2 2
O ~4e-,电路中转移1mol电子,需消耗5.6L标况下的O ,B项错误。
2 2
14.【答案】C
【解析】根据均摊法计算黑球1个,白球3个,花球1个,所以白球代表O,才能保证晶体阴阳离子的
电荷平衡。因为Al与O最小间距大于Co与O最小间距,所以黑球代表Al,花球代表Co,晶体的化学
式为AlCoO 。Co的化合价为+3,A项错误。Al3+的配位数为12,B项错误。晶胞沿z轴方向投影图可
3
48
表示为图b,C项正确。晶胞单位体积中含氧质量 g/cm3,D项错误。
(c×10−10)3×N
A
湖北省新高考联考协作体*化学答案(共6页)第2页15.【答案】D
【解析】Ga(OH) 的K =c(Ga3+)c3(OH-),将等式两边同取负对数可得:-lgK =pK =-lg[c(Ga3+)c3(OH
3 sp sp sp
-)]=-lgc(Ga3+)-lgc3(OH-)=pc(Ga3+)+3pOH,则pc(Ga3+)=pK -3pOH,构成了以pOH为横坐标,pc(Ga3+)
sp
为纵坐标的直线方程,同理,In(OH) 和Cu(OH) 的方程分别为:pc(In3+)=pK -3pOH、pc(Cu2+)=pK
3 2 sp sp
-2pOH,三条线的斜率Cu(OH) 的一条不同,即Ⅲ线代表Cu(OH) ,其K =10−7.7−6.0×2=10−19.7。又因为
2 2 sp
K [Ga(OH) ]<K [In(OH) ],代入图中坐标点可得,Ⅰ线代表Ga(OH) ,其K =10−17.2−6.0×3=10−35.2,Ⅱ
sp 3 sp 3 3 sp
线代表In(OH) ,其K =10−15.2−6.0×3=10−33.2。Ⅰ线、Ⅱ线斜率相同,相互平行,A、B项错误;由图可
3 sp
1 10−33.2
知,In3+恰好完全沉淀时,pOH≈9.5(也可准确计算:pOH=- lg =9.4),C项错误;Ga3+和Cu2+沉
3 10−5.0
3 10−35.2 10−19.7
淀时需要的c(OH-)分别为 ≈10−11.7、 ≈10−9.9,Ga(OH) 先沉淀,D项正确。
3
1 1
二、非选择题(共55分)
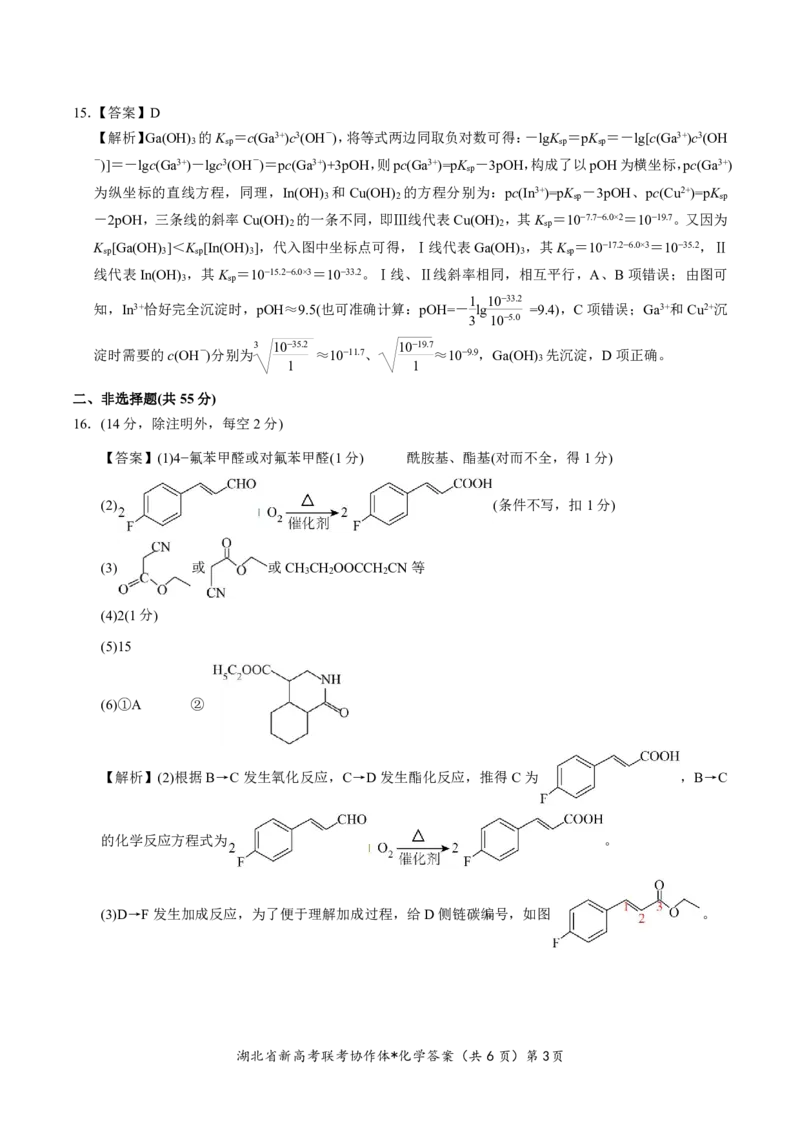
16.(14分,除注明外,每空2分)
【答案】(1)4−氟苯甲醛或对氟苯甲醛(1分) 酰胺基、酯基(对而不全,得1分)
(2) (条件不写,扣1分)
(3) 或 或CH CH OOCCH CN等
3 2 2
(4)2(1分)
(5)15
(6)①A ②
【解析】(2)根据B→C发生氧化反应,C→D发生酯化反应,推得C为 ,B→C
的化学反应方程式为 。
(3)D→F发生加成反应,为了便于理解加成过程,给D侧链碳编号,如图 。
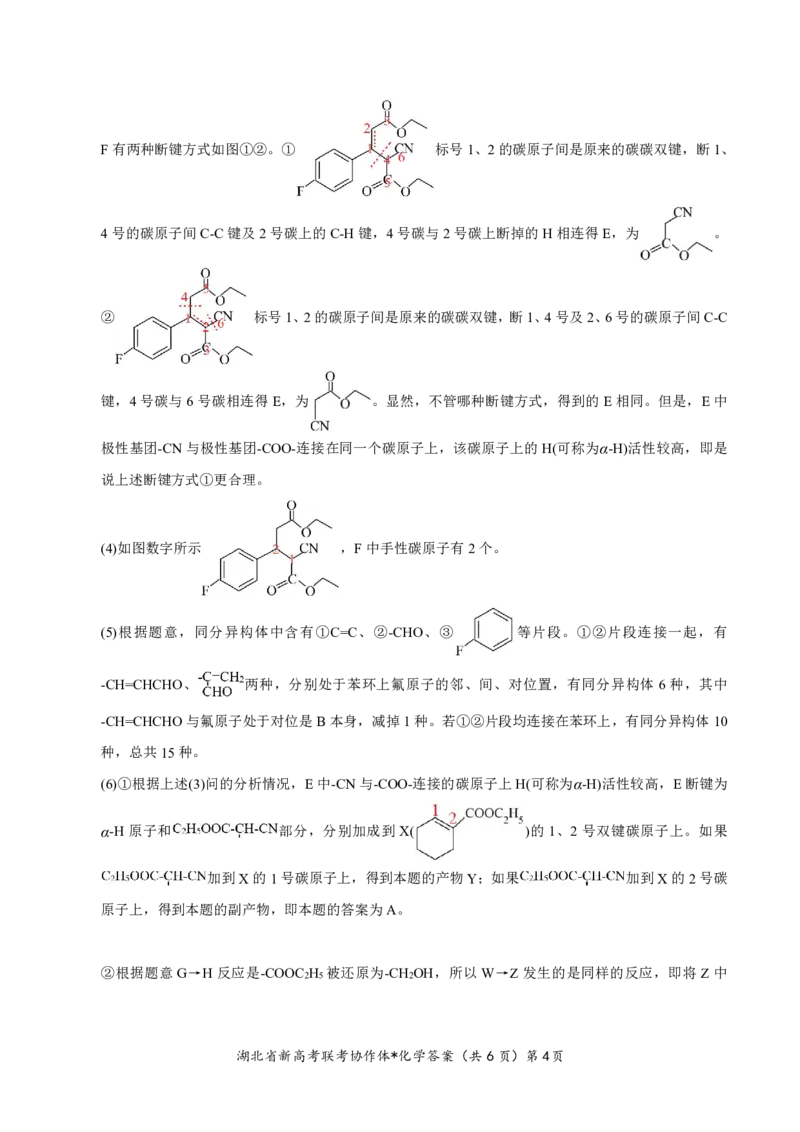
湖北省新高考联考协作体*化学答案(共6页)第3页F有两种断键方式如图①②。① 标号1、2的碳原子间是原来的碳碳双键,断1、
4号的碳原子间C-C键及2号碳上的C-H键,4号碳与2号碳上断掉的H相连得E,为 。
② 标号1、2的碳原子间是原来的碳碳双键,断1、4号及2、6号的碳原子间C-C
键,4号碳与6号碳相连得E,为 。显然,不管哪种断键方式,得到的E相同。但是,E中
极性基团-CN与极性基团-COO-连接在同一个碳原子上,该碳原子上的H(可称为α-H)活性较高,即是
说上述断键方式①更合理。
(4)如图数字所示 ,F中手性碳原子有2个。
(5)根据题意,同分异构体中含有①C=C、②-CHO、③ 等片段。①②片段连接一起,有
-CH=CHCHO、 两种,分别处于苯环上氟原子的邻、间、对位置,有同分异构体 6 种,其中
-CH=CHCHO与氟原子处于对位是B本身,减掉1种。若①②片段均连接在苯环上,有同分异构体10
种,总共15种。
(6)①根据上述(3)问的分析情况,E中-CN与-COO-连接的碳原子上H(可称为α-H)活性较高,E断键为
α-H 原子和 部分,分别加成到X( )的1、2 号双键碳原子上。如果
加到X的1号碳原子上,得到本题的产物Y;如果 加到X的2号碳
原子上,得到本题的副产物,即本题的答案为A。
②根据题意G→H反应是-COOC H 被还原为-CH OH,所以W→Z发生的是同样的反应,即将Z中
2 5 2
湖北省新高考联考协作体*化学答案(共6页)第4页-CH OH部位改写为-COOC H 即可,答案为 。
2 2 5
17.(14分,每空2分)
【答案】(1)CuS+MnO +2H SO =CuSO +MnSO +S+2H O
2 2 4 4 4 2
(2)SiO
2
、S(对而不全,得1分) PbCl4 2-
(3)抑制Bi3+离子水解(,防止其提前沉淀)(括号内容可不答出)
(4)c
(5)Bi3++Cl-+CO2-=BiOCl↓+CO ↑
3 2
(6)44.8%
【解析】(1)“浸铜”时有单质硫生成,而SO 2-较稳定,说明是CuS与MnO 发生了氧化还原反应,反应
4 2
为CuS+MnO +2H SO =CuSO +MnSO +S+2H O。
2 2 4 4 4 2
(2)含铋的化合物、SiO 、PbSO 、As O 及“浸铜”生成的S,不参与“浸铋”之前的反应,进入“浸铋”步骤,
2 4 2 3
根据已知信息①②,铋和砷转化为BiCl 、AsCl ,铅主要转化为PbCl2-,进入“除铅、砷”步骤,“浸渣1”
3 3 4
的主要成分为SiO 和S。
2
(3)已知信息①BiCl 极易水解,盐酸的作用为抑制Bi3+离子水解,防止其提前沉淀,影响BiOCl产率。
3
(4)最佳的液固比应该是铅、砷去除率尽量高,后续沉铋量尽量大,c为最佳。d相对于c,后续沉铋量
略有增大,但是铅去除率降低,液固比比c大,“浸铋”所得浸取液使用多,相对沉铋量小。
(5)Bi3+和CO 2-的双水解反应,根据原子及电荷守恒配平即可,反应为Bi3++Cl-+CO2-=BiOCl↓+CO ↑。
3 3 2
(6)Bi元素的总利用率=70%×80%×80%=44.8%。
18.(14分,除注明外,每空2分)
【答案】(1)Cu(OH)
2
(2) 沉淀溶解,得到无色溶液(1分)
CuCl+2NH =[Cu(NH ) ]++Cl-(或CuCl+2NH ·H O=[Cu(NH ) ]++Cl-+2H O)
3 3 2 3 2 3 2 2
溶液变为深蓝色(1分)
(3)CuSO
4
(4)有紫红色固体析出(,产生刺激性气味气体)(括号内容可不答出)
(5)2Cu2++4I-=2CuI↓+I (或2CuSO +4I-=2CuI+I +2SO2-) 盐酸和BaCl 溶液
2 3 2 3 2
【解析】(1)双水解反应生成的主要含铜产物为Cu(OH) 。
2
(2)根据信息③中 Cu+溶于浓氨水的信息,可回答出相关实验现象。第一步的离子反应为:
湖北省新高考联考协作体*化学答案(共6页)第5页CuCl+2NH =[Cu(NH ) ]++Cl-。
3 3 2
(3)实验探究一证明了Cu2+和SO 2-可以发生氧化还原反应,有Cl-时,产生了CuCl白色沉淀,其中棕
3
黄色沉淀与Cu2+和SO 2-的反应关系密切。因此,CuCl 溶液替换为等体积等浓度的CuSO 溶液最合适。
3 2 4
(4)实验2结论已经说明含有Cu
2
SO
3
,实验2即是含Cu
2
SO
3
的沉淀中加入一定量的稀硫酸,根据信息②
中Cu+酸性条件下歧化,以及SO 2-与酸的反应,可得实验现象为:有紫红色固体析出,产生刺激性气
3
味气体。
(5)实验3结论已经说明含有CuSO
3
,实验3即是含Cu
2
SO
3
、CuSO
3
的沉淀中加入一定量的KI溶液,信
息①告知CuI为白色沉淀,显然实验3中产生的白色沉淀A是CuI。若CuI是Cu
2
SO
3
与KI发生复分解
反应产生的,则上层清液含有SO
3
2-;若CuI是CuSO
3
与KI发生氧化还原反应反应产生的,则上层清液含
有I
2
和SO
3
2-,而实验3上层清液呈无色且不能使淀粉溶液变蓝,因此发生了反应2Cu2++4I-=2CuI↓+I
2
(或
2CuSO +4I-=2CuI+I +2SO2-)、I +SO2-+H O=2I-+SO2-+2H+,后续用盐酸和BaCl 溶液,才能检出白色
3 2 3 2 3 2 4 2
沉淀B是BaSO 。
4
19.(13分,除注明外,每空2分)
【答案】(1)+41(可不写“+”) 低温(1分)
(2)①劣于 ②c
③温度升高催化剂的活性降低或温度升高更有利于反应Ⅱ进行(答出1点即得2分,其他合理答案给分)
④BD(对而不全,得1分)
(3)0.25
【解析】(1)由盖斯定律可得ΔH
2
=+41kJ∙mol−1。反应ⅠΔH
1
<0,ΔS
1
<0,能自发进行的条件是低温。
(2)①相同温度时,催化剂M对应的CO 转化率低,C H 的选择性低,催化效果劣于N。
2 2 4
②催化效果M<N,对应反应的活化能E:M>N,对应反应的速率常数k:M<N。由速率常数M<N,
a
E
a、b图错误。根据公式lgk=- a+C,E 越大,直线斜率的绝对值越大,c图符合要求。
a
RT
③乙烯的选择性随温度升高而降低,可能原因是温度升高催化剂的活性降低或温度升高更有利于反应Ⅱ
进行。
④降低温度,反应速率下降,A项错误。增大压强,反应速率加快,反应Ⅰ平衡正移,反应Ⅱ平衡无影
响,提高了C H 选择性,B项正确。移走H O(g),反应速率下降,C项错误。更换适宜的催化剂,反
2 4 2
应速率加快,可提高C H 选择性,D项正确。
2 4
(3)在恒温恒容条件下,气体的物质的量与气体的压强成正比,所以平衡时,p(CO)=p(H O)=0.25MPa和
2
p(CO )=p(H )=0.5MPa,反应Ⅱ的K =
p(CO)·p(H
2
O)
=
0.252
=0.25。
2 2 p
p(CO
2
)·p(H
2
) 0.52
湖北省新高考联考协作体*化学答案(共6页)第6页