文档内容
机密★启用前
2024 年甘肃省普通高校招生统一考试
化学
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号框涂黑。如
需改动,用橡皮擦干净后,再选涂其它答案标号框。回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1. 下列成语涉及金属材料的是
A. 洛阳纸贵 B. 聚沙成塔 C. 金戈铁马 D. 甘之若饴
【答案】C
【解析】
【详解】A.纸的主要成分是纤维素,不是金属材料,A错误;
B.沙的主要成分是硅酸盐,不是金属材料,B错误;
C.金和铁都是金属,C正确;
D.甘之若饴意思是把它看成像糖那样甜,糖类是有机物,不是金属材料,D错误;
故选C。
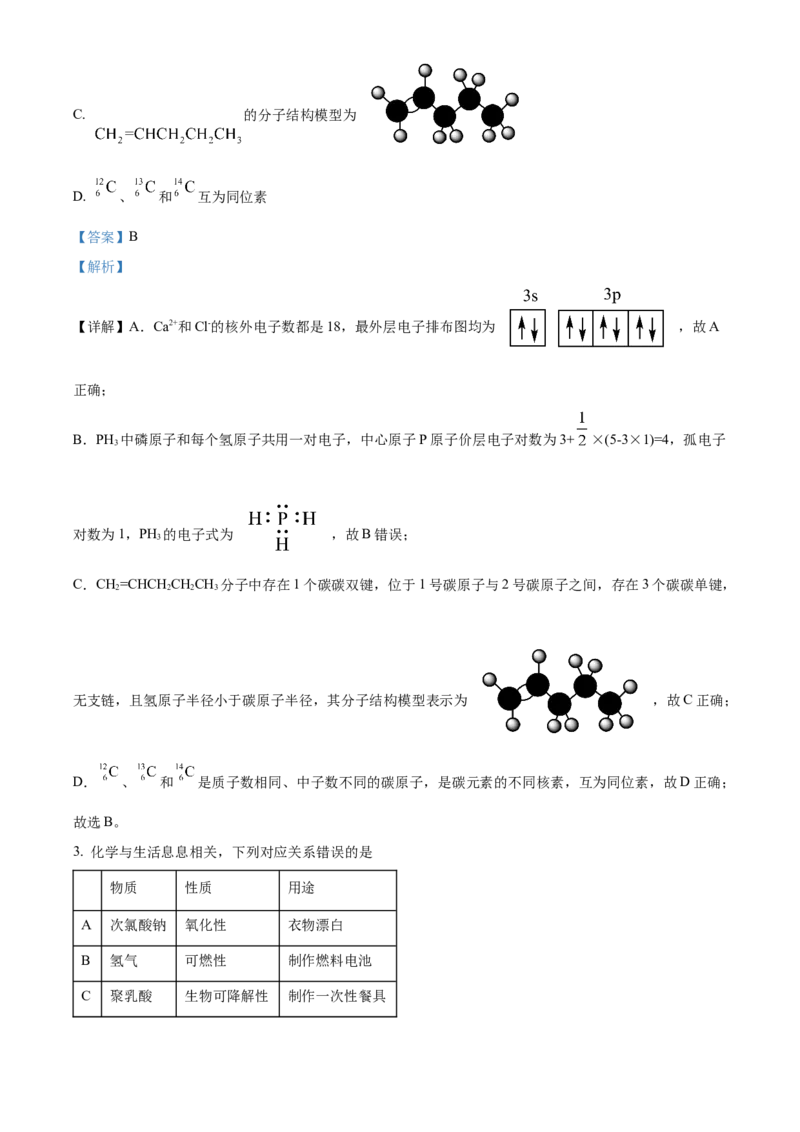
2. 下列化学用语表述错误的是
A. 和 的最外层电子排布图均为
B. 和 的电子式分别为 和C. 的分子结构模型为
D. 、 和 互为同位素
【答案】B
【解析】
【详解】A.Ca2+和Cl-的核外电子数都是18,最外层电子排布图均为 ,故A
正确;
B.PH 中磷原子和每个氢原子共用一对电子,中心原子P原子价层电子对数为3+ ×(5-3×1)=4,孤电子
3
对数为1,PH 的电子式为 ,故B错误;
3
C.CH=CHCHCHCH 分子中存在1个碳碳双键,位于1号碳原子与2号碳原子之间,存在3个碳碳单键,
2 2 2 3
无支链,且氢原子半径小于碳原子半径,其分子结构模型表示为 ,故C正确;
D. 、 和 是质子数相同、中子数不同的碳原子,是碳元素的不同核素,互为同位素,故D正确;
故选B。
3. 化学与生活息息相关,下列对应关系错误的是
物质 性质 用途
A 次氯酸钠 氧化性 衣物漂白
B 氢气 可燃性 制作燃料电池
C 聚乳酸 生物可降解性 制作一次性餐具D 活性炭 吸附性 分解室内甲醛
A. A B. B C. C D. D
【答案】D
【解析】
【详解】A.次氯酸钠有强氧化性,从而可以做漂白剂,用于衣物漂白,A正确;
B.氢气是可燃气体,具有可燃性,能被氧气氧化,可以制作燃料电池,B正确;
C.聚乳酸具有生物可降解性,无毒,是高分子化合物,可以制作一次性餐具,C正确;
D.活性炭有吸附性,能够有效吸附空气中的有害气体、去除异味,但无法分解甲醛,D错误;
故本题选D。
4. 下列措施能降低化学反应速率的是
A. 催化氧化氨制备硝酸时加入铂 B. 中和滴定时,边滴边摇锥形瓶
C. 锌粉和盐酸反应时加水稀释 D. 石墨合成金刚石时增大压强
【答案】C
【解析】
【详解】A.催化剂可以改变化学反应速率,一般来说,催化剂可以用来加快化学反应速率,故催化氧化
氨制备硝酸时加入铂可以加快化学反应速率,A项不符合题意;
B.中和滴定时,边滴边摇锥形瓶,可以让反应物快速接触,可以加快化学反应速率,B项不符合题意;
C.锌粉和盐酸反应时加水稀释会降低盐酸的浓度,会降低化学反应速率,C项符合题意;
D.石墨合成金刚石,该反应中没有气体参与,增大压强不会改变化学反应速率,D项不符合题意;
故选C。
5. X、Y、Z、W、Q为短周期元素,原子序数依次增大,最外层电子数之和为18。Y原子核外有两个单电
子,Z和Q同族,Z的原子序数是Q的一半,W元素的焰色试验呈黄色。下列说法错误的是
A. X、Y组成的化合物有可燃性 B. X、Q组成的化合物有还原性
C. Z、W组成的化合物能与水反应 D. W、Q组成的化合物溶于水呈酸性
【答案】D
【解析】
【分析】X、Y、Z、W、Q为短周期元素,W元素的焰色试验呈黄色,W为Na元素;Z和Q同族,Z的
原子序数是Q的一半,则Z为O、Q为S;Y原子核外有两个单电子、且原子序数小于Z,Y为C元素;
X、Y、Z、W、Q的最外层电子数之和为18,则X的最外层电子数为18-4-6-1-6=1,X可能为H或Li。
【详解】A.若X为H,H与C组成的化合物为烃,烃能够燃烧,若X为Li,Li与C组成的化合物也具有
可燃性,A项正确;B.X、Q组成的化合物中Q(即S)元素呈-2价,为S元素的最低价,具有还原性,B项正确;
C.Z、W组成的化合物为NaO、NaO ,NaO与水反应生成NaOH,NaO 与水反应生成NaOH和O ,C
2 2 2 2 2 2 2
项正确;
的
D.W、Q组成 化合物NaS属于强碱弱酸盐,其溶于水所得溶液呈碱性,D项错误;
2
答案选D。
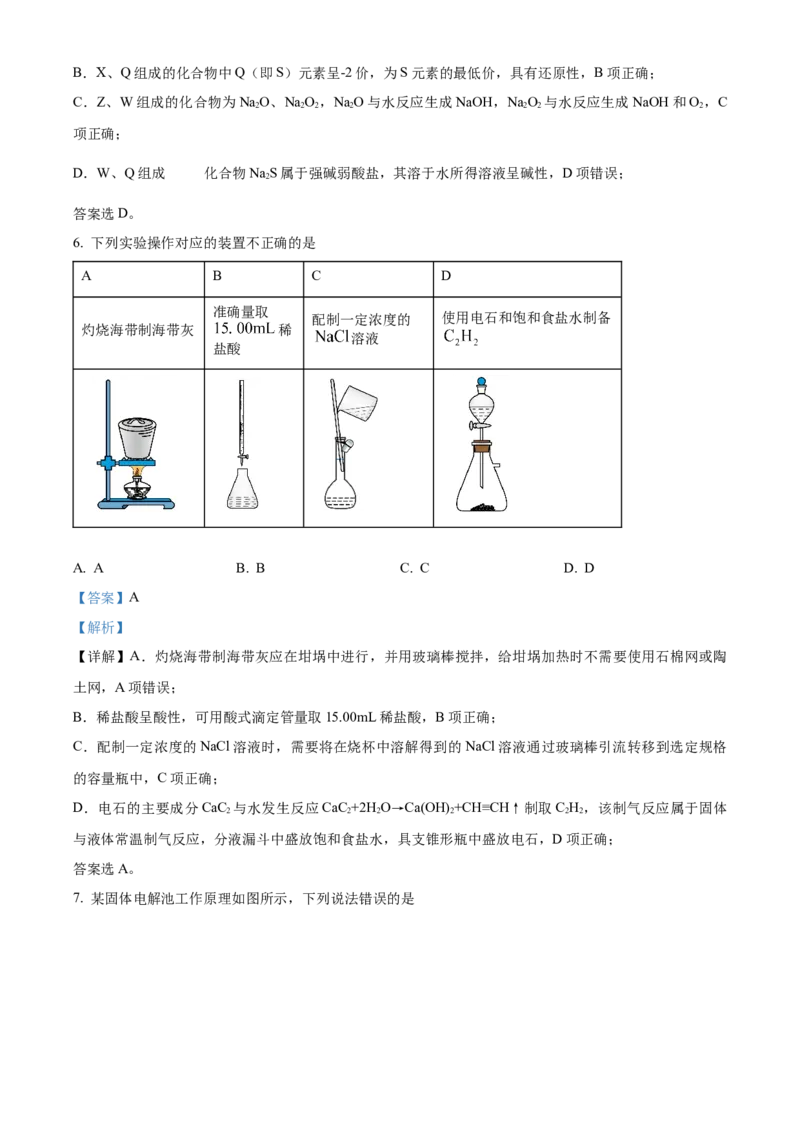
6. 下列实验操作对应的装置不正确的是
A B C D
准确量取
配制一定浓度的 使用电石和饱和食盐水制备
灼烧海带制海带灰 稀
溶液
盐酸
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.灼烧海带制海带灰应在坩埚中进行,并用玻璃棒搅拌,给坩埚加热时不需要使用石棉网或陶
土网,A项错误;
B.稀盐酸呈酸性,可用酸式滴定管量取15.00mL稀盐酸,B项正确;
C.配制一定浓度的NaCl溶液时,需要将在烧杯中溶解得到的NaCl溶液通过玻璃棒引流转移到选定规格
的容量瓶中,C项正确;
D.电石的主要成分CaC 与水发生反应CaC +2H O→Ca(OH) +CH≡CH↑制取C H ,该制气反应属于固体
2 2 2 2 2 2
与液体常温制气反应,分液漏斗中盛放饱和食盐水,具支锥形瓶中盛放电石,D项正确;
答案选A。
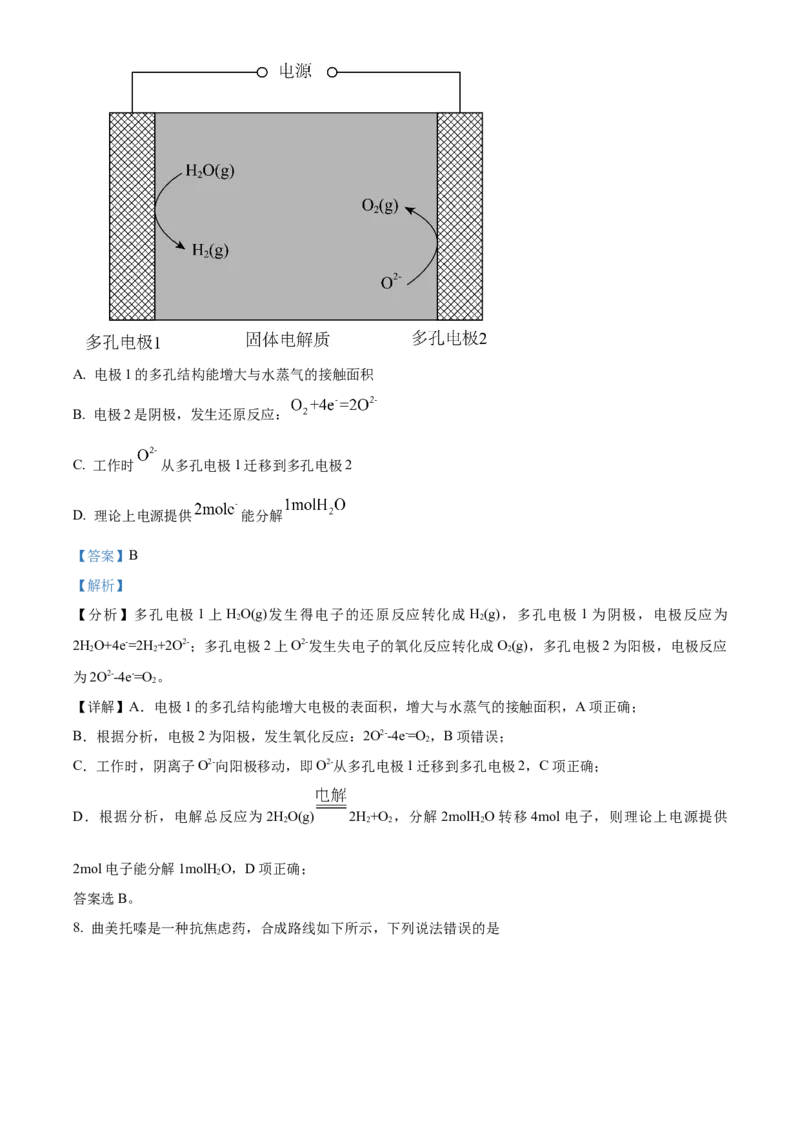
7. 某固体电解池工作原理如图所示,下列说法错误的是A. 电极1的多孔结构能增大与水蒸气的接触面积
B. 电极2是阴极,发生还原反应:
C. 工作时 从多孔电极1迁移到多孔电极2
D. 理论上电源提供 能分解
【答案】B
【解析】
【分析】多孔电极1上HO(g)发生得电子的还原反应转化成H(g),多孔电极1为阴极,电极反应为
2 2
2HO+4e-=2H +2O2-;多孔电极2上O2-发生失电子的氧化反应转化成O(g),多孔电极2为阳极,电极反应
2 2 2
为2O2--4e-=O 。
2
【详解】A.电极1的多孔结构能增大电极的表面积,增大与水蒸气的接触面积,A项正确;
B.根据分析,电极2为阳极,发生氧化反应:2O2--4e-=O ,B项错误;
2
C.工作时,阴离子O2-向阳极移动,即O2-从多孔电极1迁移到多孔电极2,C项正确;
D.根据分析,电解总反应为2HO(g) 2H+O ,分解2molH O转移4mol电子,则理论上电源提供
2 2 2 2
2mol电子能分解1molH O,D项正确;
2
答案选B。
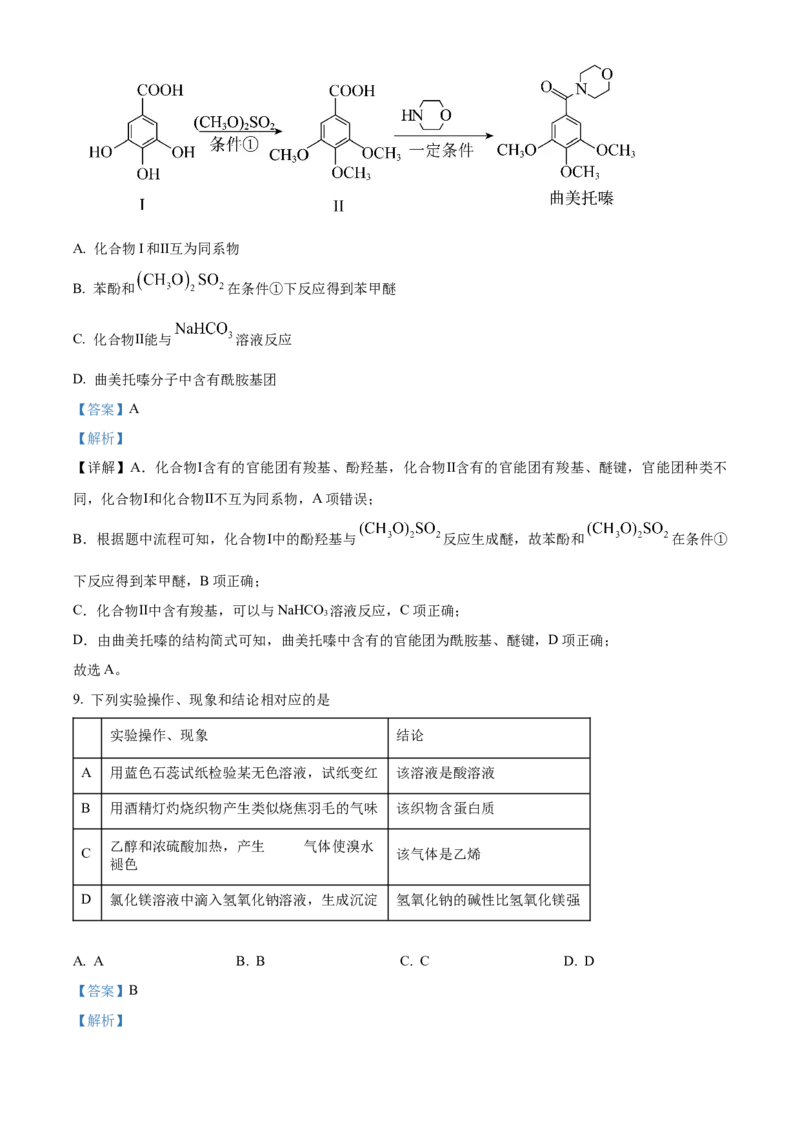
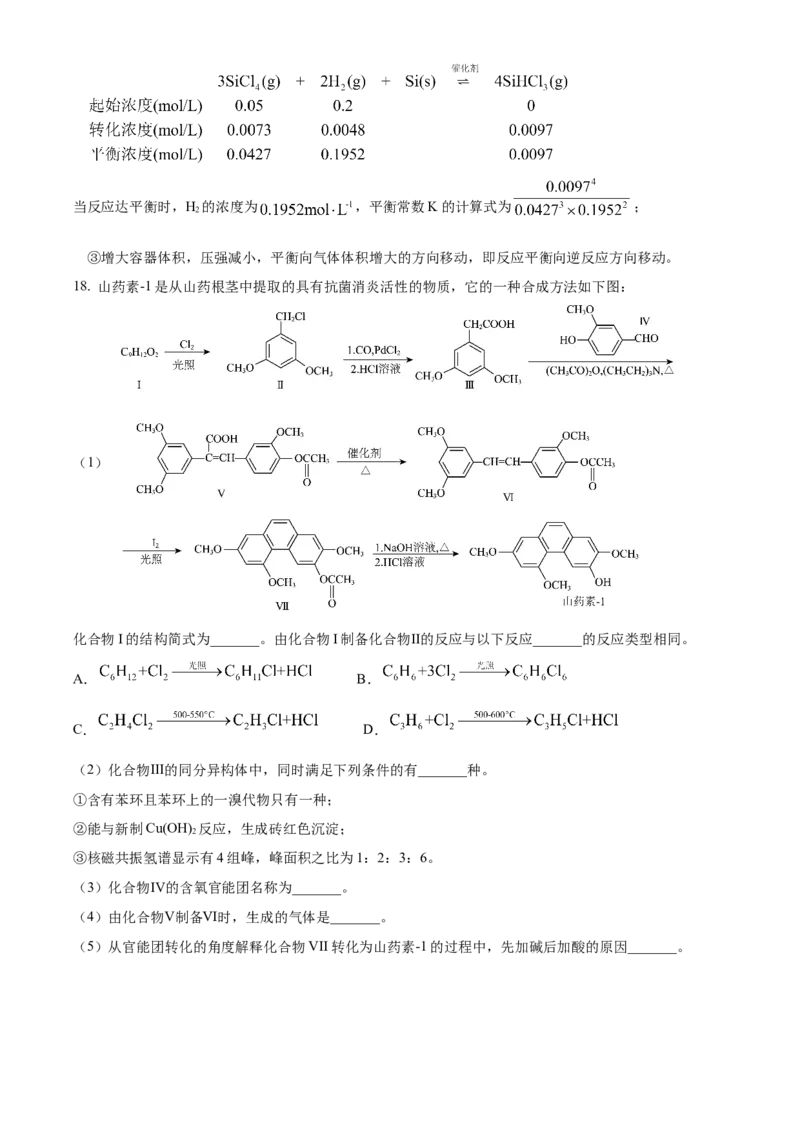
8. 曲美托嗪是一种抗焦虑药,合成路线如下所示,下列说法错误的是A. 化合物I和Ⅱ互为同系物
B. 苯酚和 在条件①下反应得到苯甲醚
C. 化合物Ⅱ能与 溶液反应
D. 曲美托嗪分子中含有酰胺基团
【答案】A
【解析】
【详解】A.化合物Ⅰ含有的官能团有羧基、酚羟基,化合物Ⅱ含有的官能团有羧基、醚键,官能团种类不
同,化合物Ⅰ和化合物Ⅱ不互为同系物,A项错误;
B.根据题中流程可知,化合物Ⅰ中的酚羟基与 反应生成醚,故苯酚和 在条件①
下反应得到苯甲醚,B项正确;
C.化合物Ⅱ中含有羧基,可以与NaHCO 溶液反应,C项正确;
3
D.由曲美托嗪的结构简式可知,曲美托嗪中含有的官能团为酰胺基、醚键,D项正确;
故选A。
9. 下列实验操作、现象和结论相对应的是
实验操作、现象 结论
A 用蓝色石蕊试纸检验某无色溶液,试纸变红 该溶液是酸溶液
B 用酒精灯灼烧织物产生类似烧焦羽毛的气味 该织物含蛋白质
乙醇和浓硫酸加热,产生 的气体使溴水
C 该气体是乙烯
褪色
D 氯化镁溶液中滴入氢氧化钠溶液,生成沉淀 氢氧化钠的碱性比氢氧化镁强
A. A B. B C. C D. D
【答案】B
【解析】【详解】A.用蓝色石蕊试纸检验某无色溶液,试纸变红,该溶液显酸性,但不一定是酸溶液,也有可能
是显酸性的盐溶液,A项不符合题意;
B.动物纤维主要成分是蛋白质,灼烧后有类似烧焦羽毛的味道,若用酒精灯灼烧织物产生类似烧焦羽毛
的味道,说明该织物含有动物纤维,含有蛋白质,B项符合题意;
C.乙醇和浓硫酸加热,会产生很多产物,如加热温度在170℃,主要产物为乙烯;如加热温度在140℃,
主要产物为二乙醚;同时乙醇可在浓硫酸下脱水生成碳单质,继续和浓硫酸在加热条件下产生二氧化碳、
二氧化硫等,其中的产物二氧化硫也能使溴水褪色,不能说明产生的气体就是乙烯,C项不符合题意;
D.氯化镁溶液中滴入氢氧化钠溶液,会发生复分解反应,生成难溶的氢氧化镁,与氢氧化钠和氢氧化镁
的碱性无关,不能由此得出氢氧化钠的碱性比氢氧化镁强,D项不符合题意;
故选B。
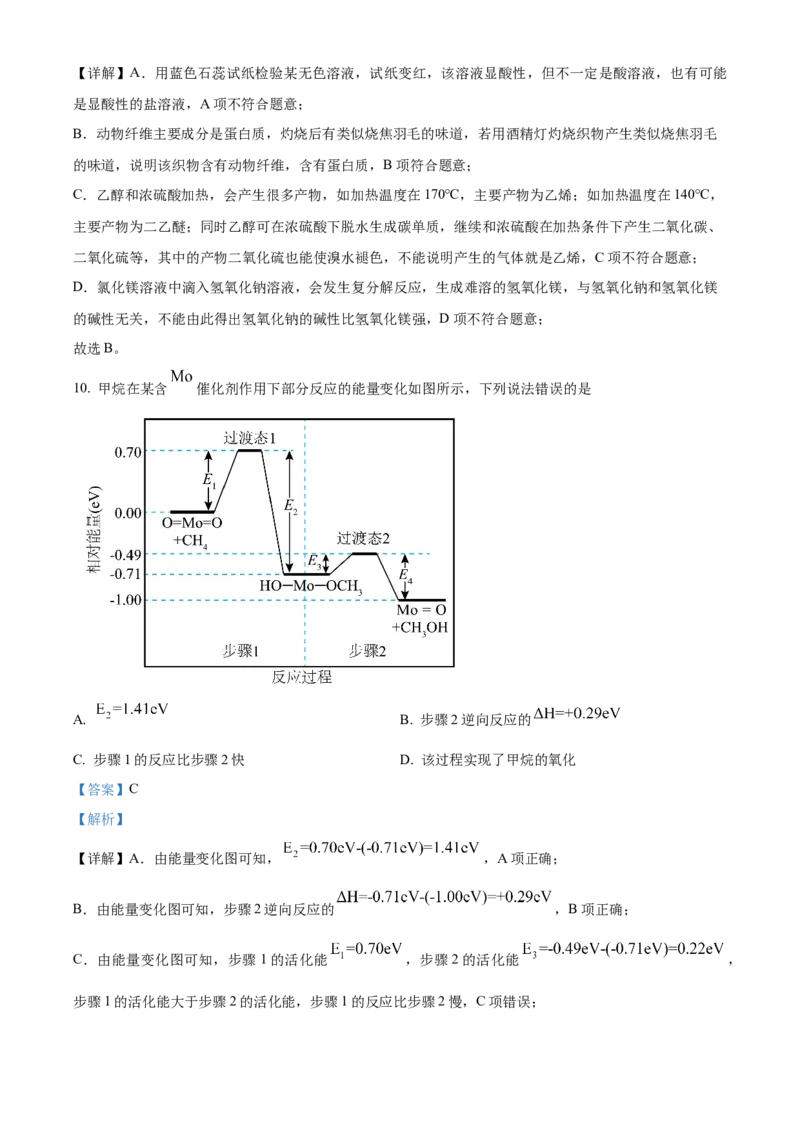
10. 甲烷在某含 催化剂作用下部分反应的能量变化如图所示,下列说法错误的是
A. B. 步骤2逆向反应的
C. 步骤1的反应比步骤2快 D. 该过程实现了甲烷的氧化
【答案】C
【解析】
【详解】A.由能量变化图可知, ,A项正确;
B.由能量变化图可知,步骤2逆向反应的 ,B项正确;
C.由能量变化图可知,步骤1的活化能 ,步骤2的活化能 ,
步骤1的活化能大于步骤2的活化能,步骤1的反应比步骤2慢,C项错误;D.该过程甲烷转化为甲醇,属于加氧氧化,该过程实现了甲烷的氧化,D项正确;
故选C。
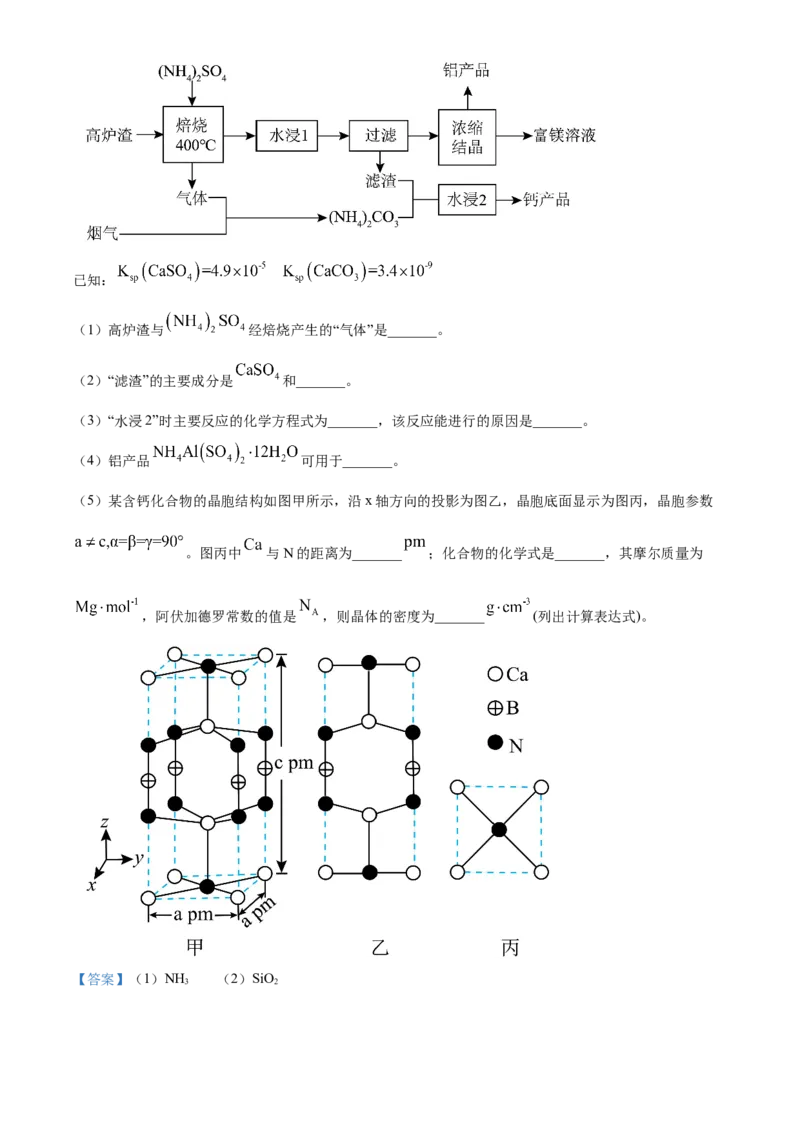
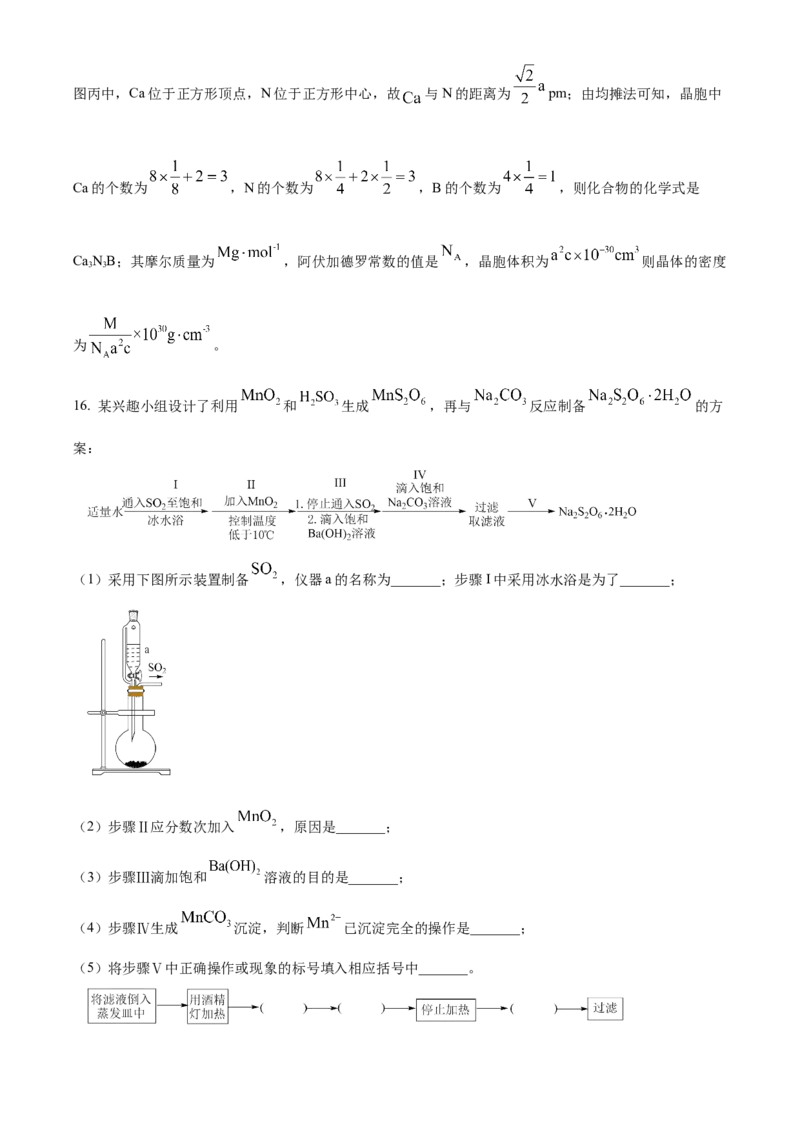
11. 兴趣小组设计了从 中提取 的实验方案,下列说法正确的是
A. 还原性:
B. 按上述方案消耗 可回收
C. 反应①的离子方程式是
D. 溶液①中的金属离子是
【答案】C
【解析】
【分析】从实验方案可知,氨水溶解了氯化银,然后用铜置换出银,滤液中加入浓盐酸后得到氯化铜和氯
化铵的混合液,向其中加入铁、铁置换出铜,过滤分铜可以循环利用,并通入氧气可将亚铁离子氧化为铁
离子。
【详解】A.金属活动性越强,金属的还原性越强,而且由题中的实验方案能得到证明,还原性从强到弱
的顺序为 Fe > Cu > Ag,A不正确;
B.由电子转移守恒可知,1 mol Fe可以置换1 mol Cu,而1 mol Cu可以置换2 mol Ag,因此,根据按上述
方案消耗1 mol Fe可回收2 mol Ag,B不正确;
C.反应①中,氯化四氨合铜溶液与浓盐酸反应生成氯化铜和氯化铵,该反应的离子方程式是
,C正确;
D.向氯化铜和氯化铵的混合液中加入铁,铁置换出铜后生成 ,然后 被通入的氧气氧化为 ,
氯化铵水解使溶液呈酸性,在这个过程中,溶液中的氢离子参与反应,因此氢离子浓度减少促进了铁离子
水解生成氢氧化铁沉淀,氢氧化铁存在沉淀溶解平衡,因此,溶液①中的金属离子是 ,D不正确;
综上所述,本题选C。
12. 晶体中,多个晶胞无隙并置而成的结构如图甲所示,其中部分结构显示为图乙,下列说法错误的是
A. 电负性: B. 单质 是金属晶体
C. 晶体中存在范德华力 D. 离子的配位数为3
【答案】D
【解析】
【详解】A.电负性越大的元素吸引电子的能力越强,活泼金属的电负性小于活泼非金属,因此,Mg的电
负性小于 Cl,A正确;
B.金属晶体包括金属单质及合金,单质Mg是金属晶体,B正确;
C.由晶体结构可知,该结构中存在层状结构,层与层之间存在范德华力,C正确;
D.由图乙中结构可知,每 个 与周围有6个 最近且距离相等,因此 , 的配位数为6,D错
误;
综上所述,本题选D。
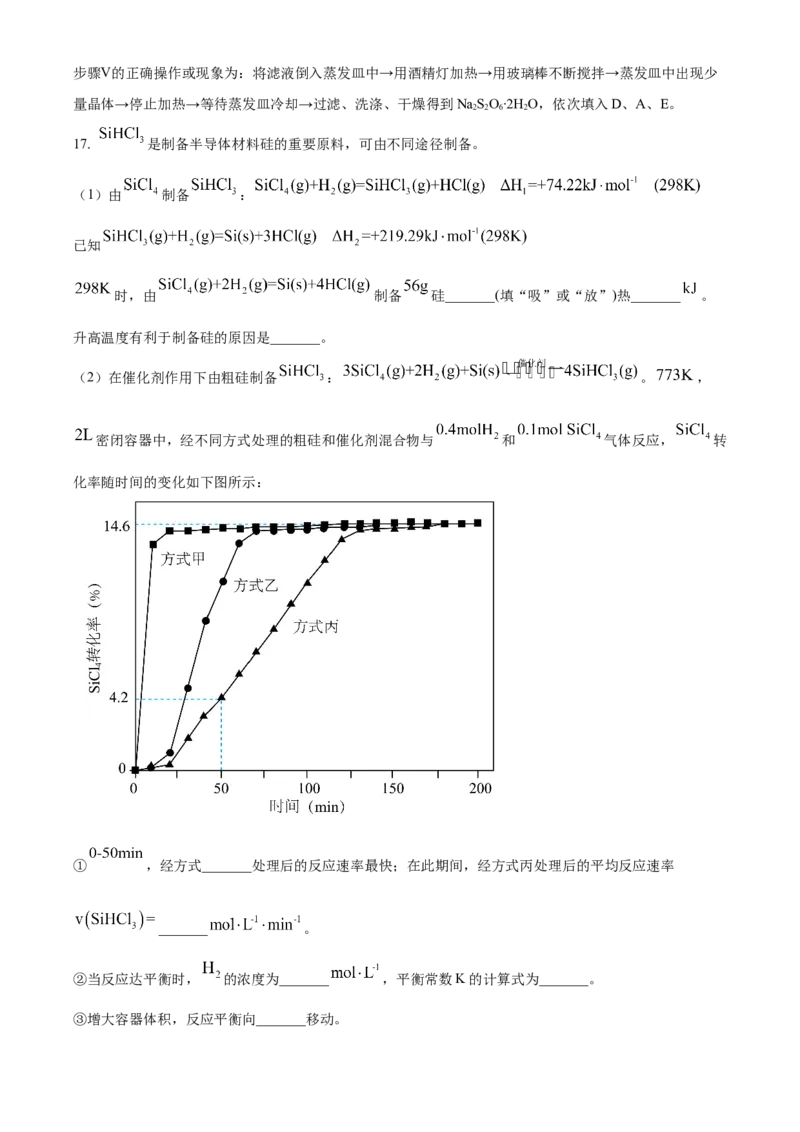
温室气体 在催化剂作用下可分解为 和 ,也可作为氧化剂氧化苯制苯酚。据此完成下面小题。
13. 下列说法错误的是
A. 原子半径: B. 第一电离能:
C. 在水中的溶解度:苯<苯酚 D. 苯和苯酚中C的杂化方式相同
14. 下列说法错误的是
A. 相同条件下 比 稳定 B. 与 的空间构型相同C. 中 键比 键更易断裂 D. 中 键和大 键的数目不相等
【答案】13. B 14. D
【解析】
【13题详解】
A. C 、N 、O都是第二周期的元素,其原子序数依次递增;同一周期的元素,从左到右原子半径依次减
小,因此,原子半径从小到大的顺序为O