文档内容
定远育才学校 2025-2026 学年高三上学期 1 月月考试卷
化学试题
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 K-39 Ca-40 Fe-56
一、选择题:本题共14小题,每小题3分,共42分.每小题只有一个选项符合题目要求.
1.生产生活中,盐类水解有着广泛的应用。下列做法错误的是( )
A. 洗餐具油污时,用热的纯碱溶液较冷的好
B. 用泡沫灭火剂灭火时,将 溶液和 溶液混和
NaHCO Al (SO )
3 2 4 3
C. 将TiCl 溶于大量水并加热制备TiO ⋅xH O
4 2 2
D. 为增加肥效将草木灰与铵态氮肥混合施用
2.发射“神舟七号”载人飞船的是我国自主研制的“长征二号F”运载火箭。该火箭的主要燃料是偏二甲
肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化
学方程式为C H N +2N O 3N +4H O+2CO ,下列叙述错误的是( )
2 8 2 2 4 2 2 2
A. 此反应是氧化还原反应
B. 反应瞬间产生大量的高温气体,推动火箭飞行
C. 在此反应中N O 作还原剂
2 4
D. N O 中N元素的化合价为+4
2 4
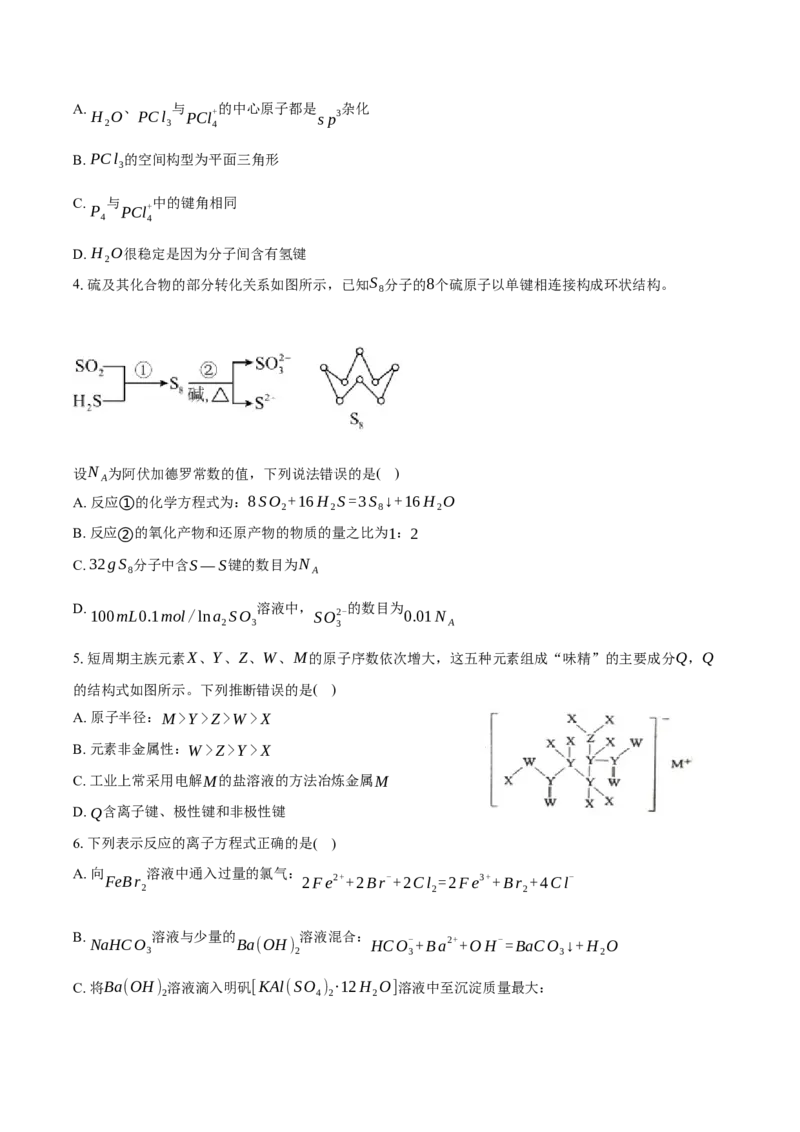
3.白磷(P ,结构见图)与Cl 反应得 PCl ,PCl 可继续与Cl 反应:
4 2 3 3 2
PCl (g)+Cl (g)=PCl (g)ΔH<0。固态 PCl 中含有PCl+ 、PCl- 两种离子。下列关于 H O、P 、
3 2 5 5 4 6 2 4
PCl 和PCl+ 的说法正确的是 ( )
3 4A. 、 与 的中心原子都是 杂化
H O PCl PCl+ sp3
2 3 4
B. PCl 的空间构型为平面三角形
3
C. 与 中的键角相同
P PCl+
4 4
D. H O很稳定是因为分子间含有氢键
2
4.硫及其化合物的部分转化关系如图所示,已知S 分子的8个硫原子以单键相连接构成环状结构。
8
设N 为阿伏加德罗常数的值,下列说法错误的是( )
A
A. 反应①的化学方程式为:8SO +16H S=3S ↓+16H O
2 2 8 2
B. 反应②的氧化产物和还原产物的物质的量之比为1:2
C. 32gS 分子中含S—S键的数目为N
8 A
D. 溶液中, 的数目为
100mL0.1mol/lna SO SO2- 0.01N
2 3 3 A
5.短周期主族元素X、Y、Z、W、M的原子序数依次增大,这五种元素组成“味精”的主要成分Q,Q
的结构式如图所示。下列推断错误的是( )
A. 原子半径:M>Y>Z>W>X
B. 元素非金属性:W>Z>Y>X
C. 工业上常采用电解M的盐溶液的方法冶炼金属M
D. Q含离子键、极性键和非极性键
6.下列表示反应的离子方程式正确的是( )
A. 向 溶液中通入过量的氯气:
FeBr 2Fe2++2Br-+2Cl =2Fe3++Br +4Cl-
2 2 2
B. 溶液与少量的 溶液混合:
NaHCO Ba(OH) HCO-+Ba2++OH-=BaCO ↓+H O
3 2 3 3 2
C. 将Ba(OH) 溶液滴入明矾[KAl(SO ) ·12H O]溶液中至沉淀质量最大:
2 4 2 2Al3++2SO2-+2Ba2++4OH-=2BaSO ↓+AlO-+2H O
4 4 2 2
D. 用醋酸和淀粉 溶液检验加碘盐中的 :
-KI IO- IO-+5I-+6H+=3I +3H O
3 3 2 2
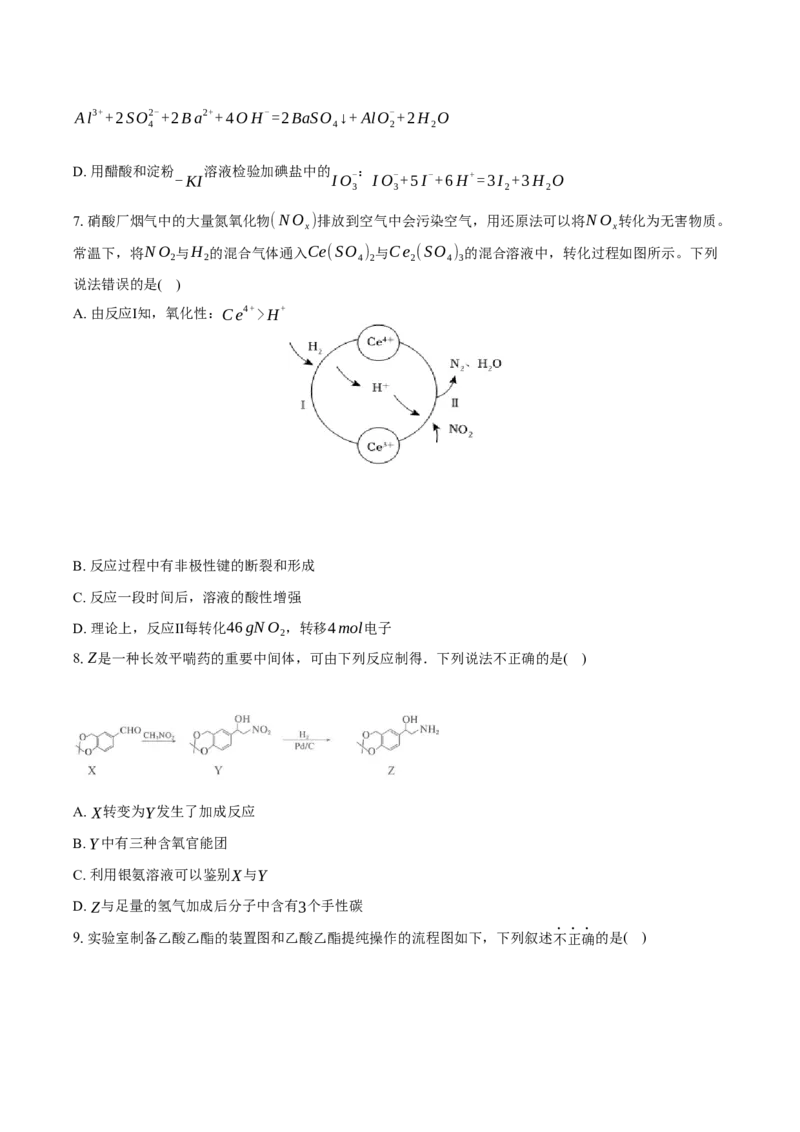
7.硝酸厂烟气中的大量氮氧化物(NO )排放到空气中会污染空气,用还原法可以将NO 转化为无害物质。
x x
常温下,将NO 与H 的混合气体通入Ce(SO ) 与Ce (SO ) 的混合溶液中,转化过程如图所示。下列
2 2 4 2 2 4 3
说法错误的是( )
A. 由反应Ⅰ知,氧化性:Ce4+>H+
B. 反应过程中有非极性键的断裂和形成
C. 反应一段时间后,溶液的酸性增强
D. 理论上,反应Ⅱ每转化46gNO ,转移4mol电子
2
8.Z是一种长效平喘药的重要中间体,可由下列反应制得.下列说法不正确的是( )
A. X转变为Y发生了加成反应
B. Y中有三种含氧官能团
C. 利用银氨溶液可以鉴别X与Y
D. Z与足量的氢气加成后分子中含有3个手性碳
9.实验室制备乙酸乙酯的装置图和乙酸乙酯提纯操作的流程图如下,下列叙述不正确的是( )A. 操作①为分液
B. 无水硫酸钠在流程中做吸水剂
C. 向试管中先加入冰醋酸,然后边振荡试管边慢慢加入浓硫酸,再加入乙醇
D. 试管b中饱和Na CO 溶液的作用是吸收蒸出的少量乙酸和乙醇,减小乙酸乙酯的溶解度
2 3
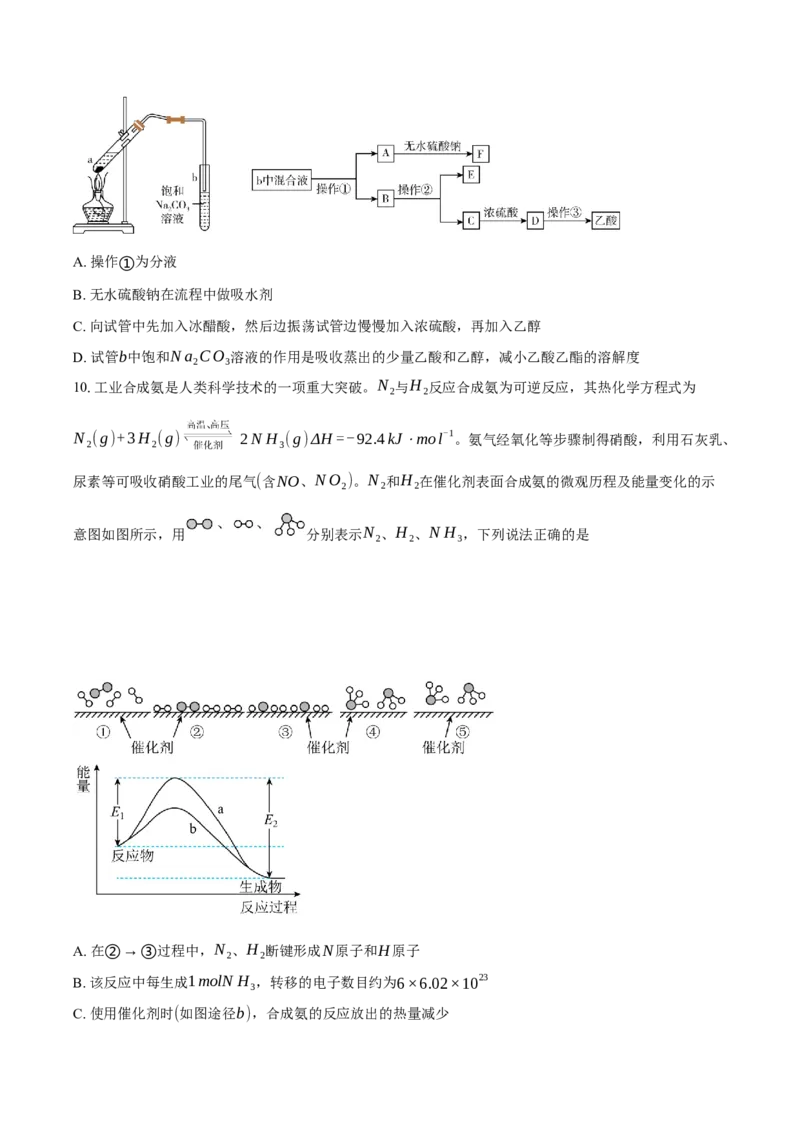
10.工业合成氨是人类科学技术的一项重大突破。N 与H 反应合成氨为可逆反应,其热化学方程式为
2 2
N (g)+3H (g) 2N H (g)ΔH=-92.4kJ⋅mol-1 。氨气经氧化等步骤制得硝酸,利用石灰乳、
2 2 3
尿素等可吸收硝酸工业的尾气(含NO、NO )。N 和H 在催化剂表面合成氨的微观历程及能量变化的示
2 2 2
意图如图所示,用 分别表示N 、H 、N H ,下列说法正确的是
2 2 3
A. 在②→③过程中,N 、H 断键形成N原子和H原子
2 2
B. 该反应中每生成1molN H ,转移的电子数目约为6×6.02×1023
3
C. 使用催化剂时(如图途径b),合成氨的反应放出的热量减少D. 合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
11.对下列实验现象解释正确的是( )
选项 实验 现象 解释
SO 通入BaCl 溶液,然后滴入稀硝 有不溶于稀硝酸的白
A 2 2 白色沉淀为BaSO
酸 色沉淀生成 4
得黑色蓬松的固体并
B 浓硫酸滴入蔗糖中,并搅拌 浓硫酸表现出脱水性和强酸性
有刺激性气味气体
C 向酸性FeCl 溶液中加入足量H O 有红褐色沉淀生成 H O 被还原成OH-沉淀了Fe3+
2 2 2 2 2
向淀粉溶液的水解液中滴加过量的
D 溶液未变蓝 淀粉已经水解完全
NaOH溶液后,滴加2滴碘水
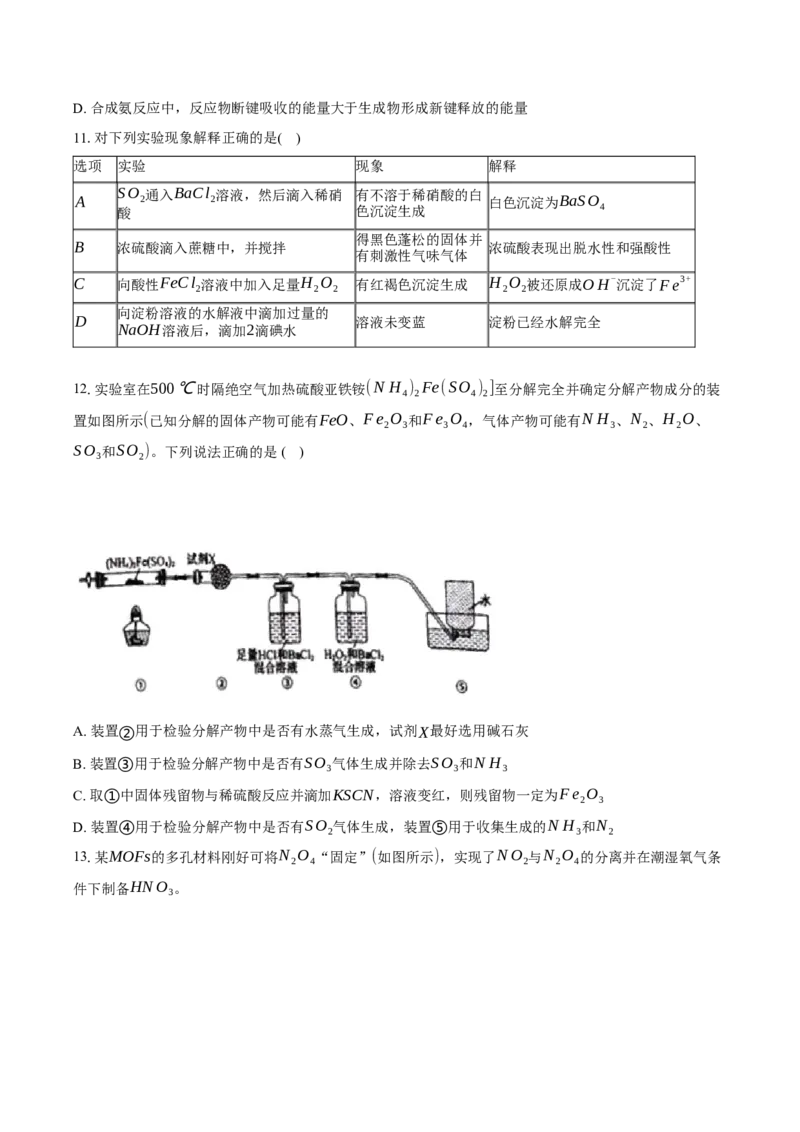
12.实验室在500℃时隔绝空气加热硫酸亚铁铵(N H ) Fe(SO ) ]至分解完全并确定分解产物成分的装
4 2 4 2
置如图所示(已知分解的固体产物可能有FeO、Fe O 和Fe O ,气体产物可能有N H 、N 、H O、
2 3 3 4 3 2 2
SO 和SO )。下列说法正确的是 ( )
3 2
A. 装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰
B. 装置③用于检验分解产物中是否有SO 气体生成并除去SO 和N H
3 3 3
C. 取①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则残留物一定为Fe O
2 3
D. 装置④用于检验分解产物中是否有SO 气体生成,装置⑤用于收集生成的N H 和N
2 3 2
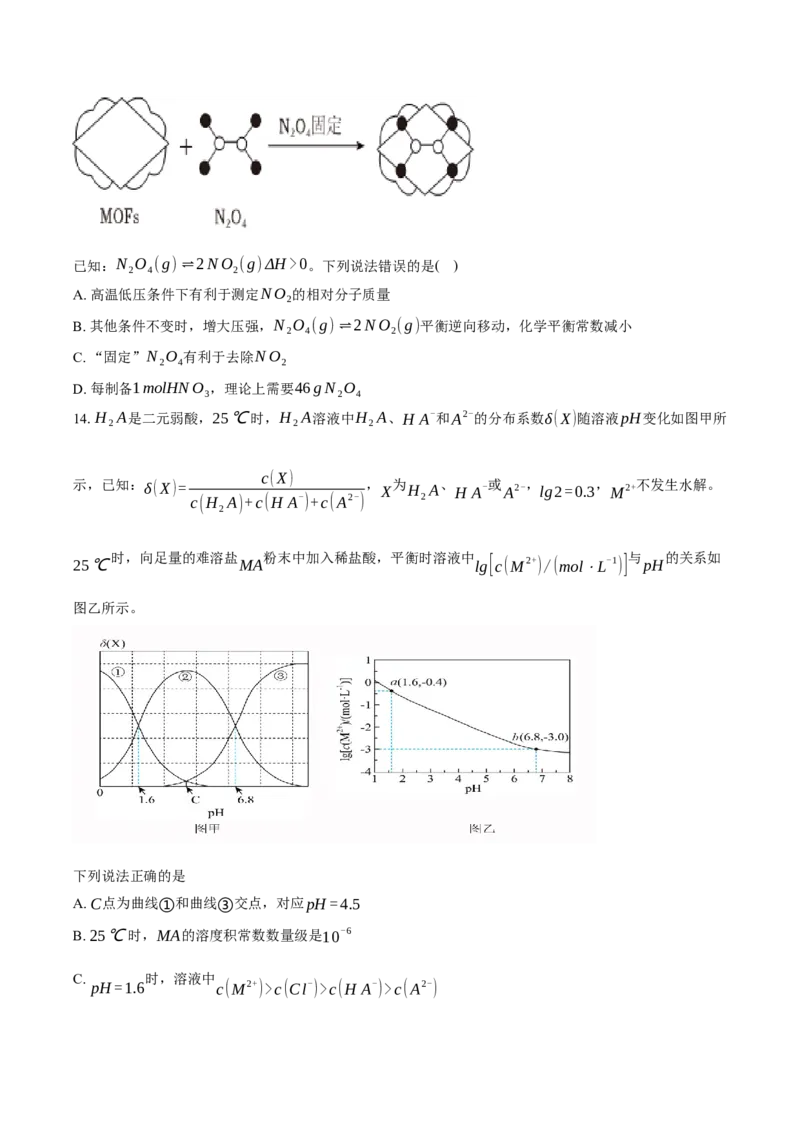
13.某MOFs的多孔材料刚好可将N O “固定”(如图所示),实现了NO 与N O 的分离并在潮湿氧气条
2 4 2 2 4
件下制备HNO 。
3已知:N O (g)⇌2NO (g)ΔH>0。下列说法错误的是( )
2 4 2
A. 高温低压条件下有利于测定NO 的相对分子质量
2
B. 其他条件不变时,增大压强,N O (g)⇌2NO (g)平衡逆向移动,化学平衡常数减小
2 4 2
C. “固定”N O 有利于去除NO
2 4 2
D. 每制备1molHNO ,理论上需要46gN O
3 2 4
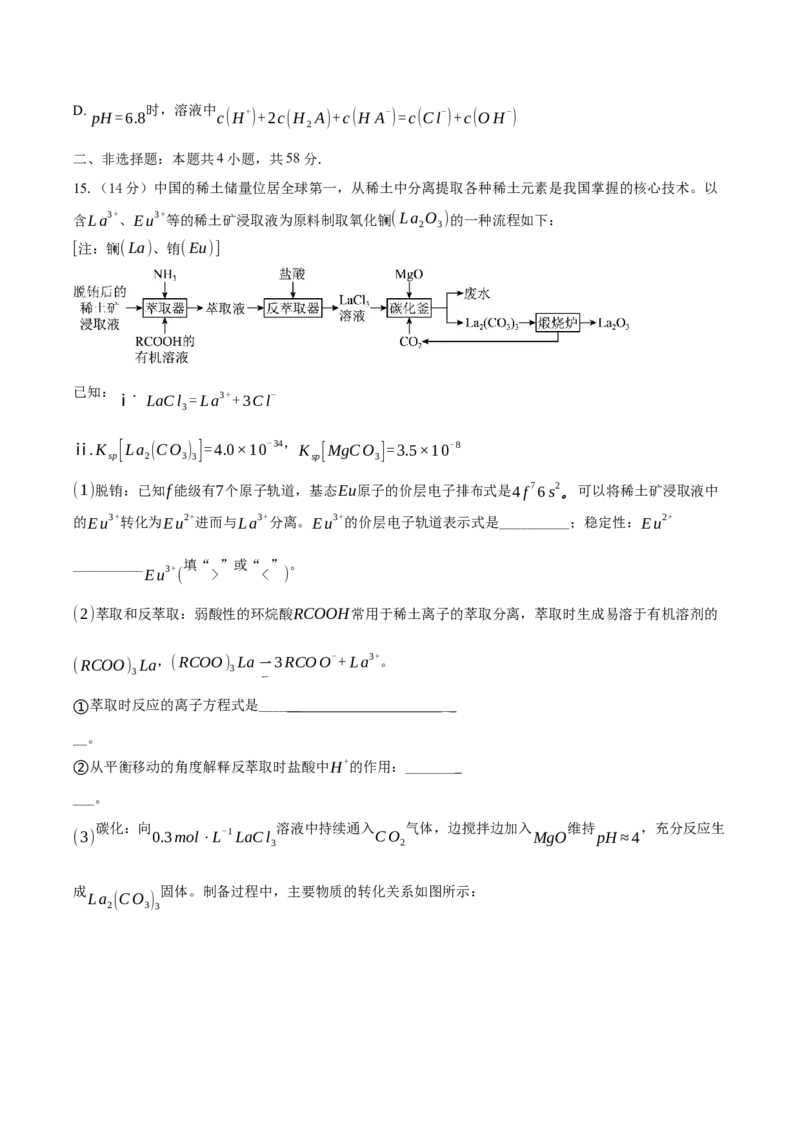
14.H A是二元弱酸,25℃时,H A溶液中H A、H A-和A2-的分布系数δ(X)随溶液pH变化如图甲所
2 2 2
c(X)
示,已知:δ(X)= ,
X
为
H A
、
H A-
或
A2-
,
lg2=0.3
,
M2+
不发生水解。
c(H A)+c(H A-)+c(A2-) 2
2
时,向足量的难溶盐 粉末中加入稀盐酸,平衡时溶液中 与 的关系如
25℃ MA lg[c(M2+)/(mol⋅L-1)] pH
图乙所示。
下列说法正确的是
A. C点为曲线①和曲线③交点,对应pH=4.5
B. 25℃时,MA的溶度积常数数量级是10-6
C. 时,溶液中
pH=1.6 c(M2+)>c(Cl-)>c(H A-)>c(A2-)D. pH=6.8 时,溶液中 c(H+)+2c(H A)+c(H A-)=c(Cl-)+c(OH-)
2
二、非选择题:本题共4小题,共58分.
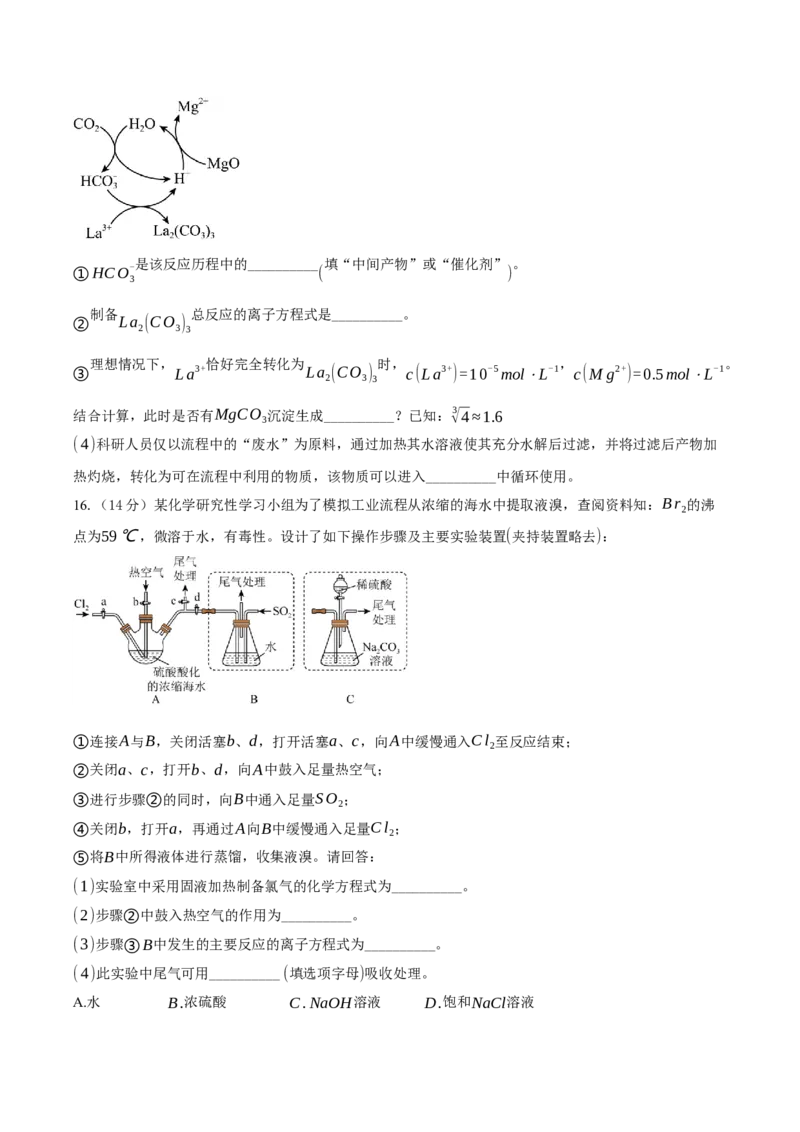
15.(14分)中国的稀土储量位居全球第一,从稀土中分离提取各种稀土元素是我国掌握的核心技术。以
含La3+、Eu3+等的稀土矿浸取液为原料制取氧化镧(La O )的一种流程如下:
2 3
[注:镧(La)、铕(Eu)]
已知: .
ⅰ LaCl =La3++3Cl-
3
ⅱ.K [La (CO ) ]=4.0×10-34, K [MgCO ]=3.5×10-8
sp 2 3 3 sp 3
(1)脱铕:已知f能级有7个原子轨道,基态Eu原子的价层电子排布式是4f76s2。可以将稀土矿浸取液中
的Eu3+转化为Eu2+进而与La3+分离。Eu3+的价层电子轨道表示式是__________;稳定性:Eu2+
__________ 填“ ”或“ ” 。
Eu3+ ( > < )
(2)萃取和反萃取:弱酸性的环烷酸RCOOH常用于稀土离子的萃取分离,萃取时生成易溶于有机溶剂的
(RCOO)
3
La,(RCOO)
3
La⇀3RCOO-+La3+。
↽
①萃取时反应的离子方程式是____ _ _ _
__。
②从平衡移动的角度解释反萃取时盐酸中H+的作用:_______
___。
碳化:向 溶液中持续通入 气体,边搅拌边加入 维持 ,充分反应生
(3) 0.3mol⋅L-1LaCl CO MgO pH≈4
3 2
成 固体。制备过程中,主要物质的转化关系如图所示:
La (CO )
2 3 3是该反应历程中的__________ 填“中间产物”或“催化剂” 。
①HCO-
( )
3
制备 总反应的离子方程式是__________。
② La (CO )
2 3 3
理想情况下, 恰好完全转化为 时, , 。
③ La3+ La (CO ) c(La3+)=10-5mol⋅L-1 c(M g2+)=0.5mol⋅L-1
2 3 3
结合计算,此时是否有MgCO 沉淀生成__________?已知:√3 4≈1.6
3
(4)科研人员仅以流程中的“废水”为原料,通过加热其水溶液使其充分水解后过滤,并将过滤后产物加
热灼烧,转化为可在流程中利用的物质,该物质可以进入__________中循环使用。
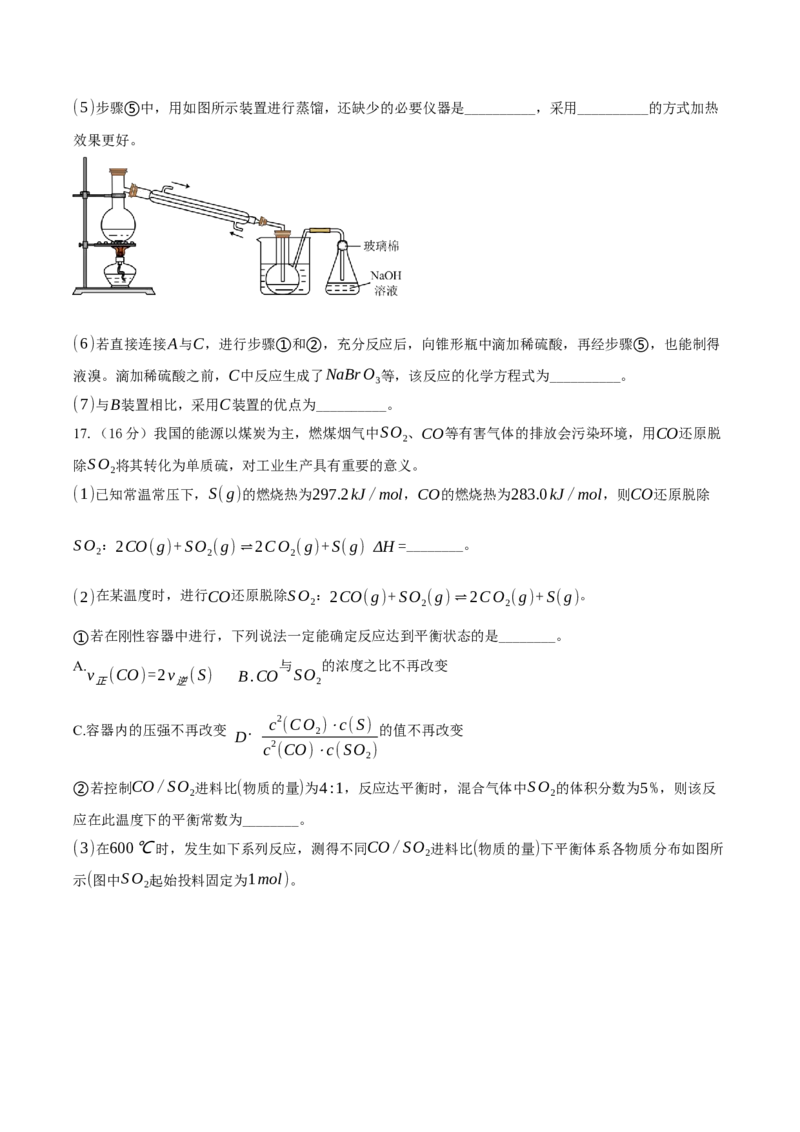
16.(14分)某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br 的沸
2
点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl 至反应结束;
2
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO ;
2
④关闭b,打开a,再通过A向B中缓慢通入足量Cl ;
2
⑤将B中所得液体进行蒸馏,收集液溴。请回答:
(1)实验室中采用固液加热制备氯气的化学方程式为__________。
(2)步骤②中鼓入热空气的作用为__________。
(3)步骤③B中发生的主要反应的离子方程式为__________。
(4)此实验中尾气可用__________ (填选项字母)吸收处理。
A.水 B.浓硫酸 C.NaOH溶液 D.饱和NaCl溶液(5)步骤⑤中,用如图所示装置进行蒸馏,还缺少的必要仪器是__________,采用__________的方式加热
效果更好。
(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得
液溴。滴加稀硫酸之前,C中反应生成了NaBrO 等,该反应的化学方程式为__________。
3
(7)与B装置相比,采用C装置的优点为__________。
17.(16分)我国的能源以煤炭为主,燃煤烟气中SO 、CO等有害气体的排放会污染环境,用CO还原脱
2
除SO 将其转化为单质硫,对工业生产具有重要的意义。
2
(1)已知常温常压下,S(g)的燃烧热为297.2kJ/mol,CO的燃烧热为283.0kJ/mol,则CO还原脱除
SO
2
:2CO(g)+SO
2
(g)⇌2CO
2
(g)+S(g) ΔH=________。
(2)在某温度时,进行CO还原脱除SO
2
:2CO(g)+SO
2
(g)⇌2CO
2
(g)+S(g)。
①若在刚性容器中进行,下列说法一定能确定反应达到平衡状态的是________。
A. 与 的浓度之比不再改变
v (CO)=2v (S) B.CO SO
正 逆 2
C.容器内的压强不再改变 D .
c2 (CO
2
)⋅c(S)
的值不再改变
c2 (CO)⋅c(SO )
2
②若控制CO/SO 进料比(物质的量)为4:1,反应达平衡时,混合气体中SO 的体积分数为5%,则该反
2 2
应在此温度下的平衡常数为________。
(3)在600℃时,发生如下系列反应,测得不同CO/SO 进料比(物质的量)下平衡体系各物质分布如图所
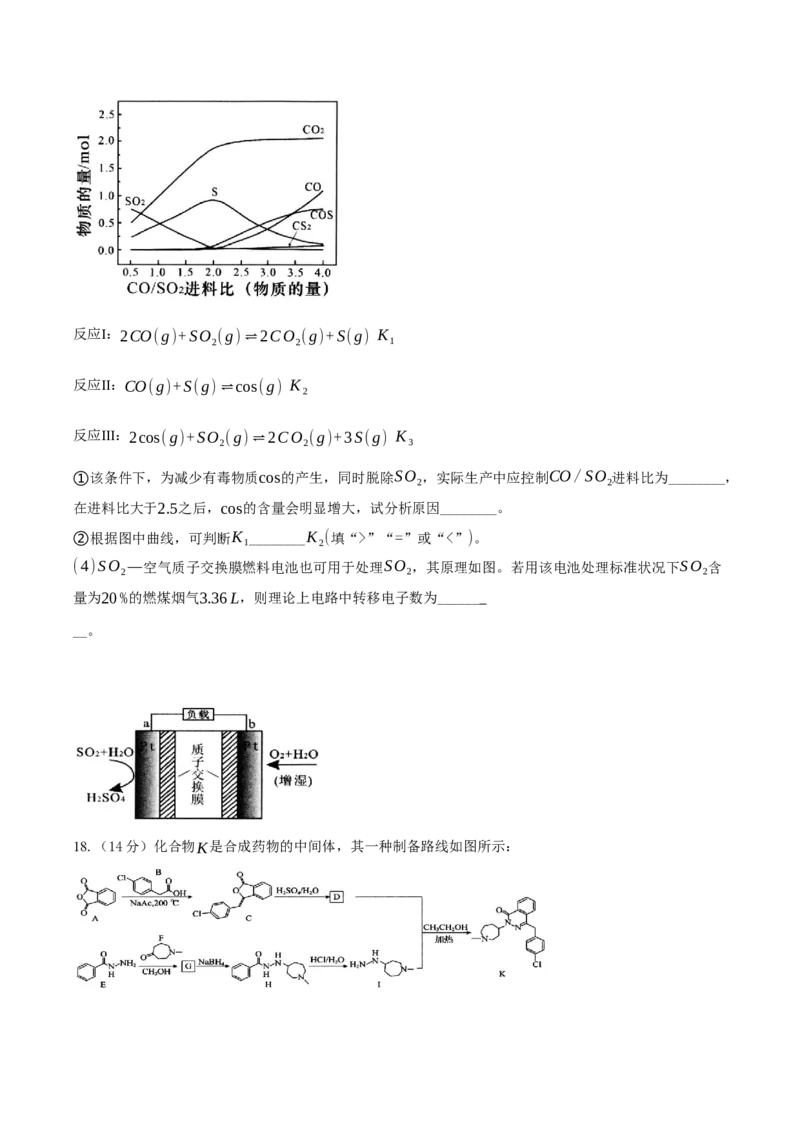
2
示(图中SO 起始投料固定为1mol)。
2反应Ⅰ:2CO(g)+SO
2
(g)⇌2CO
2
(g)+S(g) K
1
反应Ⅱ:CO(g)+S(g)⇌cos(g) K
2
反应Ⅲ:2cos(g)+SO
2
(g)⇌2CO
2
(g)+3S(g) K
3
①该条件下,为减少有毒物质cos的产生,同时脱除SO ,实际生产中应控制CO/SO 进料比为________,
2 2
在进料比大于2.5之后,cos的含量会明显增大,试分析原因________。
②根据图中曲线,可判断K ________K (填“>”“=”或“<”)。
1 2
(4)SO —空气质子交换膜燃料电池也可用于处理SO ,其原理如图。若用该电池处理标准状况下SO 含
2 2 2
量为20%的燃煤烟气3.36L,则理论上电路中转移电子数为______
__。
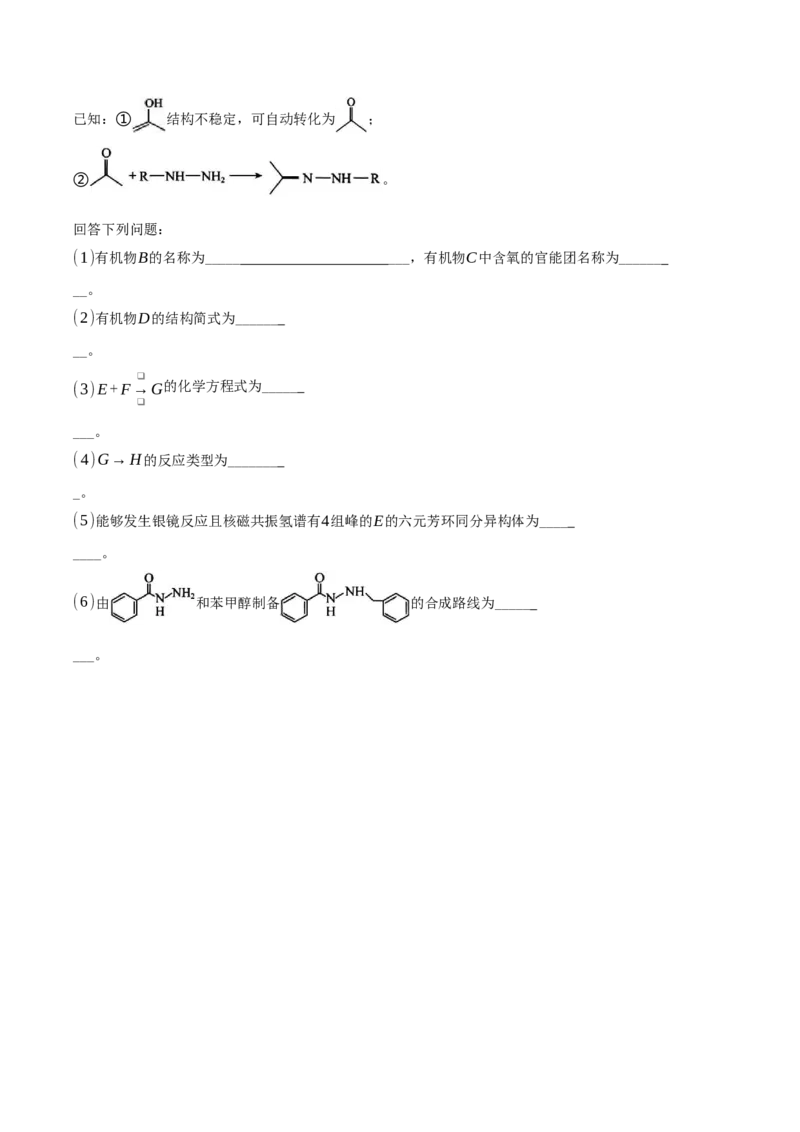
18.(14分)化合物K是合成药物的中间体,其一种制备路线如图所示:已知:① 结构不稳定,可自动转化为 ;
② 。
回答下列问题:
(1)有机物B的名称为_____ ___,有机物C中含氧的官能团名称为______
__。
(2)有机物D的结构简式为______
__。
❑
(3)E+F→G的化学方程式为_____
❑
___。
(4)G→H的反应类型为_______
_。
(5)能够发生银镜反应且核磁共振氢谱有4组峰的E的六元芳环同分异构体为____
____。
(6)由 和苯甲醇制备 的合成路线为_____
___。答案
1.D 2.C 3.A 4.D 5.C 6.C 7.C 8.D 9.C 10.A 11.A
12.B 13.B 14.D
15.(1) >
与 结合成弱酸 ,降低
(2) 3RCOOH+La3++3N H =(RCOO) La+3N H+ H+ RCOO- RCOOH
3 3 4
了 RCOO- 的浓度,使平衡 (RCOO)
3
La⇀3RCOO-+La3+ 正向移动, La3+ 溶解于水中
↽
(3)
中间产物
3MgO+2La3++3CO =La (CO ) +3M g2+
没有生成
MgCO
沉淀
2 2 3 3 3
(4)碳化釜
16.(1)MnO +4HCl(浓) MnCl +Cl ↑+2H O
2 2 2 2
(2) 使A中生成的Br 随空气流进入B中
2
(3) Br +SO +2H O=4H++2Br-+SO2-
2 2 2 4
(4)C
(5)温度计;水浴
(6)3Br +3Na CO =5NaBr+NaBrO +3CO ↑(或
2 2 3 3 2
3Br +6Na CO +3H O=5NaBr+NaBrO +6NaHCO )
2 2 3 2 3 3
(7)操作简单,污染小
17.(1)-268.8kJ/mol;
(2)①AD;②1.08;
(3)①2.0;进料比越大,CO相对较多,SO 相对较少,反应Ⅱ正向进行程度大而反应Ⅲ正向进行程度小;
2
②>;
(4)0.06N 。
A
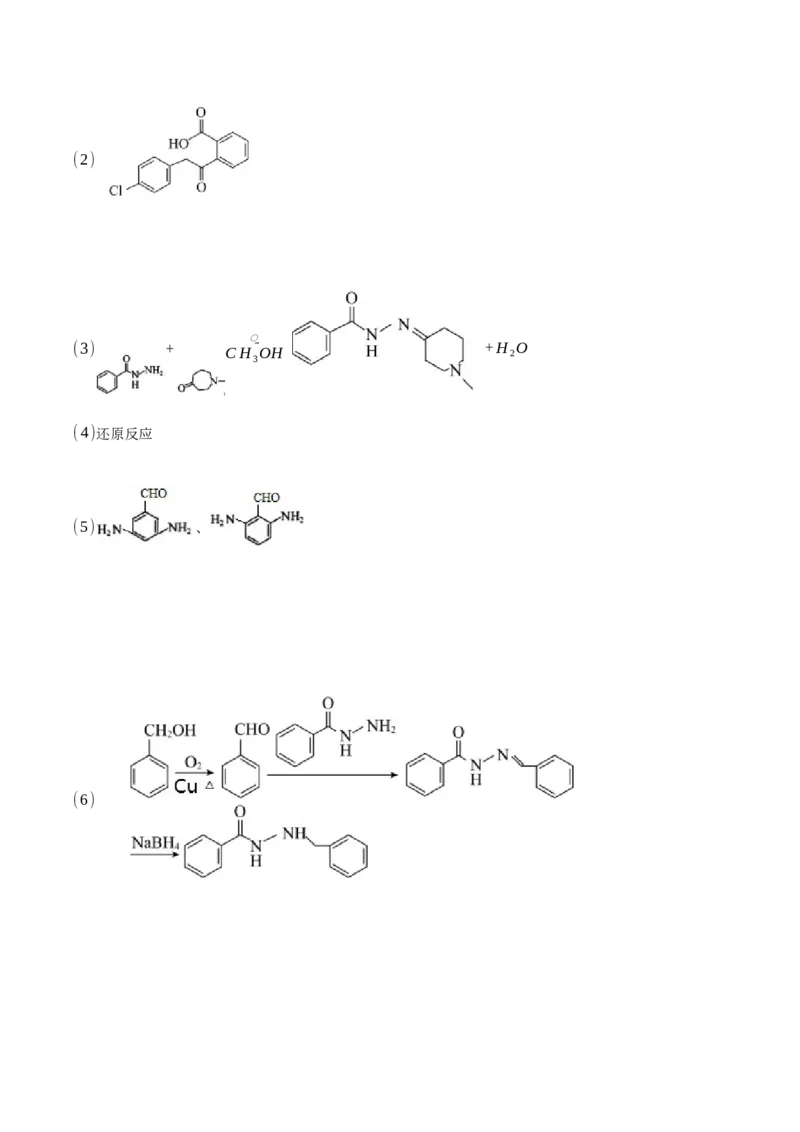
18.(1)对氯苯乙酸;酯基(2)
⃯(cid:2)
(3) +
CH OH
+H
2
O
3
(4)还原反应
(5) 、
(6)