文档内容
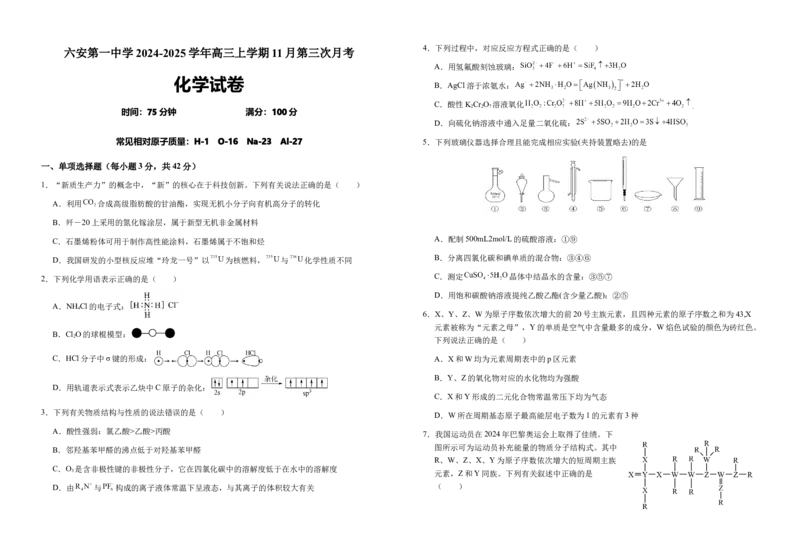
4.下列过程中,对应反应方程式正确的是( )
六安第一中学 2024-2025 学年高三上学期 11 月第三次月考
A.用氢氟酸刻蚀玻璃:
化学试卷
B.AgCl溶于浓氨水:
C.酸性K Cr O 溶液氧化
2 2 7
时间:75分钟 满分:100分
D.向硫化钠溶液中通入足量二氧化硫:
常见相对原子质量:H-1 O-16 Na-23 Al-27 5.下列玻璃仪器选择合理且能完成相应实验(夹持装置略去)的是
一、单项选择题(每小题3分,共42分)
1.“新质生产力”的概念中,“新”的核心在于科技创新。下列有关说法正确的是( )
A.利用 合成高级脂肪酸的甘油酯,实现无机小分子向有机高分子的转化
B.歼-20上采用的氮化镓涂层,属于新型无机非金属材料
A.配制500mL2mol/L的硫酸溶液:①⑨
C.石墨烯粉体可用于制作高性能涂料,石墨烯属于不饱和烃
B.分离四氯化碳和碘单质的混合物:③④⑥
D.我国研发的小型核反应堆“玲龙一号”以 为核燃料, 与 化学性质不同
C.测定 晶体中结晶水的含量:③⑤⑦
2.下列化学用语表示正确的是( )
D.用饱和碳酸钠溶液提纯乙酸乙酯(含少量乙酸):②⑤
A.NH Cl的电子式:
4
6.X、Y、Z、W为原子序数依次增大的前20号主族元素,且四种元素的原子序数之和为43,X
元素被称为“元素之母”,Y的单质是空气中含量最多的成分,W焰色试验的颜色为砖红色。
B.Cl O的球棍模型:
2
下列说法正确的是( )
C.HCl分子中σ键的形成: A.X和W均为元素周期表中的p区元素
B.Y、Z的氧化物对应的水化物均为强酸
D.用轨道表示式表示乙炔中C原子的杂化:
C.X和Y形成的二元化合物常温常压下均为气态
3.下列有关物质结构与性质的说法错误的是( )
D.W所在周期基态原子最高能层电子数为1的元素有3种
A.酸性强弱:氯乙酸>乙酸>丙酸
7.我国运动员在2024年巴黎奥运会上取得了佳绩。下
图所示可为运动员补充能量的物质分子结构式。其中
B.邻羟基苯甲醛的沸点低于对羟基苯甲醛
R、W、Z、X、Y为原子序数依次增大的短周期主族
C.O 是含非极性键的非极性分子,它在四氯化碳中的溶解度低于在水中的溶解度
3 元素,Z和Y同族。下列有关叙述中正确的是
D.由 与 构成的离子液体常温下呈液态,与其离子的体积较大有关 ( )A.键角: 8. 为阿伏加德罗常数的值,下列有关叙述正确的是( )
B.Y的最高价氧化物对应的水化物是一种中强酸 A.100mL0.5mol/L的NaOH溶液中含有 个H原子
C.第一电离能:
B.常温常压下,11.2L 中含有分子数小于
D.分子式为 的有机物一定能发生银镜反应
C. 分子中含有中子数为28N
A
阅读下列材料,完成下面小题。
D.3.2g 中含有共价键个数为
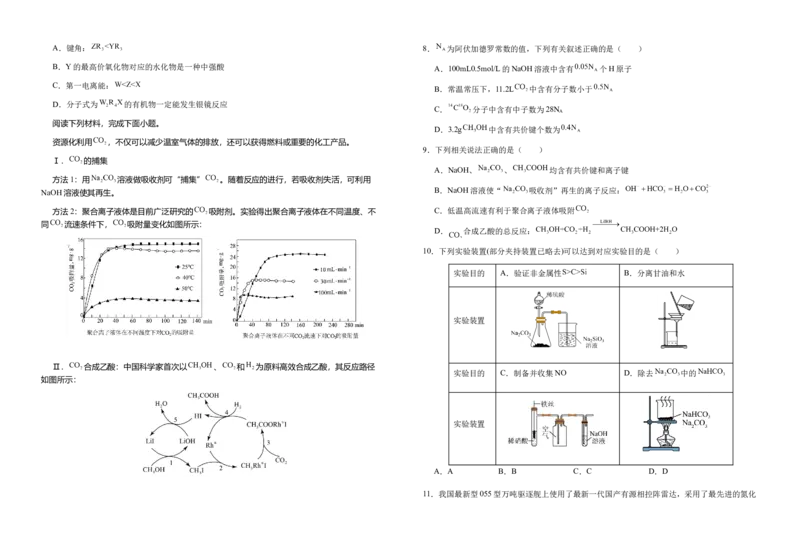
资源化利用 ,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
9.下列相关说法正确的是( )
Ⅰ. 的捕集
A.NaOH、 、 均含有共价键和离子键
方法1:用 溶液做吸收剂可“捕集” 。随着反应的进行,若吸收剂失活,可利用
NaOH溶液使其再生。
B.NaOH溶液使“ 吸收剂”再生的离子反应:
方法2:聚合离子液体是目前广泛研究的 吸附剂。实验得出聚合离子液体在不同温度、不 C.低温高流速有利于聚合离子液体吸附
同 流速条件下, 吸附量变化如图所示:
D. 合成乙酸的总反应:
10.下列实验装置(部分夹持装置已略去)可以达到对应实验目的是( )
实验目的 A.验证非金属性 B.分离甘油和水
实验装置
Ⅱ. 合成乙酸:中国科学家首次以 、 和 为原料高效合成乙酸,其反应路径
实验目的 C.制备并收集NO D.除去 中的
如图所示:
实验装置
A.A B.B C.C D.D
11.我国最新型055型万吨驱逐舰上使用了最新一代国产有源相控阵雷达,采用了最先进的氮化镓( )半导体技术。某工厂利用铝土矿(主要成分为 、 、 )为原料制备 A.电负性:H>Al>Na
的流程如下图所示。已知镓与铝同主族,其氧化物和氢氧化物均为两性化合物,能与强酸、
强碱溶液反应, 为阿伏加德罗常数的值,下列说法错误的是( )
B.Na+与 之间的最短距离为 nm
C.NaAlH 晶体中,与 紧邻且等距的 有6个
4
D.晶体的密度为 ( 表示阿伏加德罗常数的值)
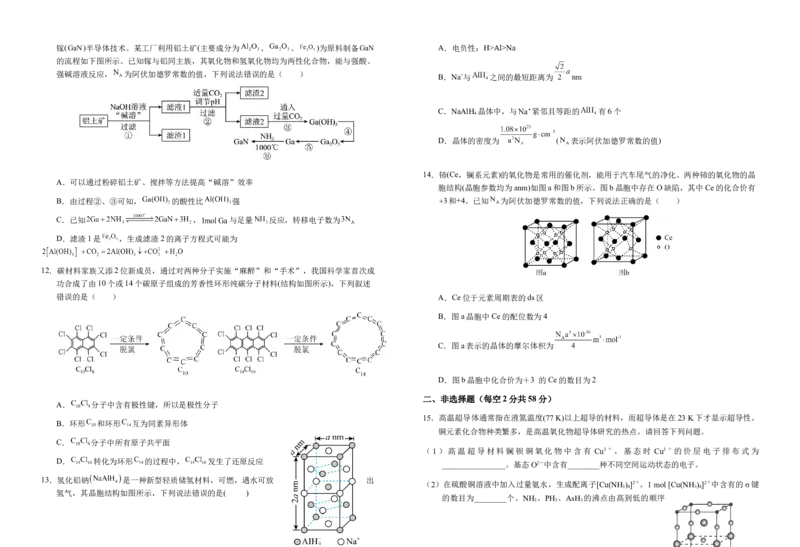
14.铈(Ce,镧系元素)的氧化物是常用的催化剂,能用于汽车尾气的净化。两种铈的氧化物的晶
A.可以通过粉碎铝土矿、搅拌等方法提高“碱溶”效率
胞结构(晶胞参数均为anm)如图a和图b所示。图b晶胞中存在O缺陷,其中Ce的化合价有
B.由过程②、③可知, 的酸性比 强 和+4。已知 为阿伏加德罗常数的值,下列说法正确的是( )
C.已知 , 与足量 反应,转移电子数为
D.滤渣1是 ,生成滤渣2的离子方程式可能为
12.碳材料家族又添2位新成员,通过对两种分子实施“麻醉”和“手术”,我国科学家首次成
功合成了由10个或14个碳原子组成的芳香性环形纯碳分子材料(结构如图所示),下列叙述
错误的是( ) A.Ce位于元素周期表的ds区
B.图a晶胞中Ce的配位数为4
C.图a表示的晶体的摩尔体积为
D.图b晶胞中化合价为+3 的Ce的数目为2
二、非选择题(每空2分共58分)
A. 分子中含有极性键,所以是极性分子
15.高温超导体通常指在液氮温度(77 K)以上超导的材料,而超导体是在23 K下才显示超导性。
B.环形 和环形 互为同素异形体
铜元素化合物种类繁多,是高温氧化物超导体研究的热点。请回答下列问题。
C. 分子中所有原子共平面
(1)高温超导材料镧钡铜氧化物中含有 Cu3+,基态时 Cu3+的价层电子排布式为
D. 转化为环形 的过程中, 发生了还原反应
________________。基态O2-中含有________种不同空间运动状态的电子。
13.氢化铝钠 是一种新型轻质储氢材料,可燃,遇水可放 出
(2)在硫酸铜溶液中加入过量氨水,生成配离子[Cu(NH ) ]2+。1 mol [Cu(NH ) ]2+中含有的σ键
3 4 3 4
氢气,其晶胞结构如图所示,下列说法错误的是( )
的数目为________个。NH 、PH 、AsH 的沸点由高到低的顺序
3 3 3为________ (填化学式)。 实验步骤:
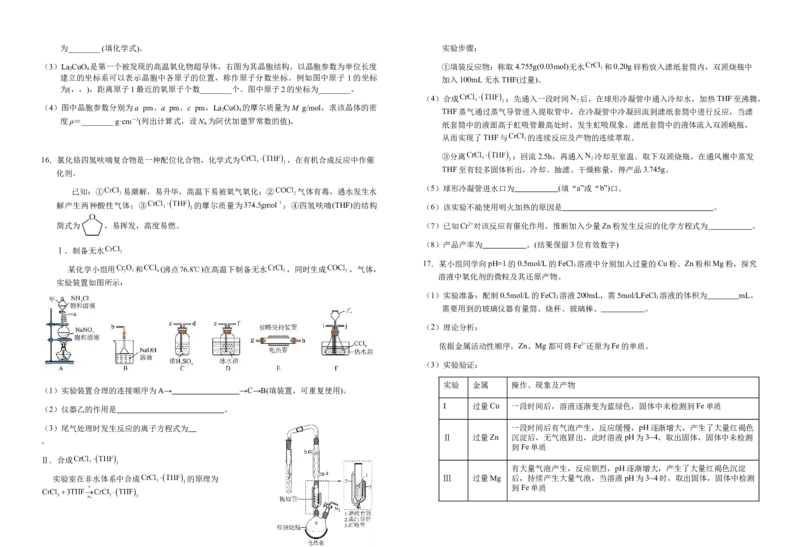
(3)La CuO 是第一个被发现的高温氧化物超导体,右图为其晶胞结构。以晶胞参数为单位长度 ①填装反应物:称取4.755g(0.03mol)无水 和0.20g锌粉放入滤纸套筒内,双颈烧瓶中
2 4
建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子 1的坐标 加入100mL无水THF(过量)。
为(,,),距离原子1最近的氧原子个数________个。图中原子2的坐标为________。
(4)合成 :先通入一段时间 后,在球形冷凝管中通入冷却水,加热THF至沸腾,
(4)图中晶胞参数分别为a pm、a pm、c pm,La CuO 的摩尔质量为M g/mol,求该晶体的密
2 4 THF蒸气通过蒸气导管进入提取管中,在冷凝管中冷凝回流到滤纸套筒中进行反应,当滤
度ρ=________ g·cm-3(列出计算式,设N 为阿伏加德罗常数的值)。
A 纸套筒中的液面高于虹吸管最高处时,发生虹吸现象,滤纸套筒中的液体流入双颈峣瓶,
从而实现了THF与 的连续反应及产物的连续萃取。
③分离 :回流2.5h,再通入 冷却至室温。取下双颈烧瓶,在通风榐中蒸发
16.氯化铬四氢呋喃复合物是一种配位化合物,化学式为 ,在有机合成反应中作催
THF至有较多固体析出,冷却、抽滤、干燥称量,得产品3.745g。
化剂。
(5)球形冷凝管进水口为 (填“a”或“b”)口。
已知:① 易潮解,易升华,高温下易被氧气氧化;② 气体有毒,遇水发生水
解产生两种酸性气体;③ 的摩尔质量为 ;④四氢呋喃(THF)的结构 (6)该实验不能使用明火加热的原因是 。
简式为 ,易挥发,高度易燃。 (7)已知Cr2+对该反应有催化作用,推断加入少量Zn粉发生反应的化学方程式为 。
(8)产品产率为 。(结果保留3位有效数字)
Ⅰ.制备无水
17.某小组同学向pH=1的0.5mol/L的FeCl 溶液中分别加入过量的Cu粉、Zn粉和Mg粉,探究
3
某化学小组用 和 (沸点 )在高温下制备无水 ,同时生成 ,气体,
溶液中氧化剂的微粒及其还原产物。
实验装置如图所示:
(1)实验准备:配制0.5mol/L的FeCl 溶液200mL,需5mol/LFeCl 溶液的体积为 mL。
3 3
需要用到的玻璃仪器有量筒、烧杯、玻璃棒、 。
(2)理论分析:
依据金属活动性顺序,Zn、Mg都可将Fe3+还原为Fe的单质。
(3)实验验证:
实验 金属 操作、现象及产物
(1)实验装置合理的连接顺序为A→ →C→B(填装置,可重复使用)。
I 过量Cu 一段时间后,溶液逐渐变为蓝绿色,固体中未检测到Fe单质
(2)仪器乙的作用是 。
(3)尾气处理时发生反应的离子方程式为 一段时间后有气泡产生,反应缓慢,pH逐渐增大,产生了大量红褐色
Ⅱ 过量Zn 沉淀后,无气泡冒出,此时溶液pH为3~4,取出固体,固体中未检测
。
到Fe单质
Ⅱ.合成
有大量气泡产生,反应剧烈,pH逐渐增大,产生了大量红褐色沉淀
实验室在非水体系中合成 的原理为 Ⅲ 过量Mg 后,持续产生大量气泡,当溶液pH为3~4时,取出固体,固体中检测
到Fe单质①分别取实验I、Ⅱ、Ⅲ中的少量溶液,滴加 溶液,均产生蓝色沉淀,证明都 ④资料显示 半价65pm、 半价69pm、半价74pm;
有Fe2+生成。请写出实验I产生Fe2+的离子方程式 。
⑤ 时,ZnS、PbS的 分别为 、 。
②实验Ⅱ、Ⅲ都有红褐色沉淀生成,用平衡移动原理解释原因 。
回答下列问题:
③对实验Ⅱ未检测到Fe单质进行分析及探究。
(1)“水解”步骤中对应的离子方程式为 。为了使水解趋于完
a.甲认为当Fe3+浓度较大时,即使Zn与Fe2+反应置换出少量Fe,Fe也会被Fe3+消耗。取实 全,可采取的措施有 (填一条)。
验II的少量溶液,滴加KSCN溶液, (填实验现象),证实了此条件下
(2)“热还原”步骤中使用石墨化炉高温加热装置( ), 的实际用量超过理论化
Fe3+几乎不存在。
学计量所要求的量,原因是 。仅增大配料中 的用量,产
b.乙认为在pH为3~4的溶液中即便生成Fe也会被H+消耗。设计实验
品中的杂质含量变化如图2所示。杂质TiC含量随 ( 量相对理论化学计量过量百分
(填实验操作和现象),证实了此条件下可忽略H+对Fe的消耗。 比)增大而降低的原因可能是 (用化学方程式解
释)。
c.丙认为产生的红褐色沉淀包裹在Zn粉上,阻碍了Zn与Fe2+的反应。实验证实了Zn粉被
包裹。
(4)对比实验Ⅱ和Ⅲ,解释实验Ⅲ的固体中检测到Fe单质的原因
。
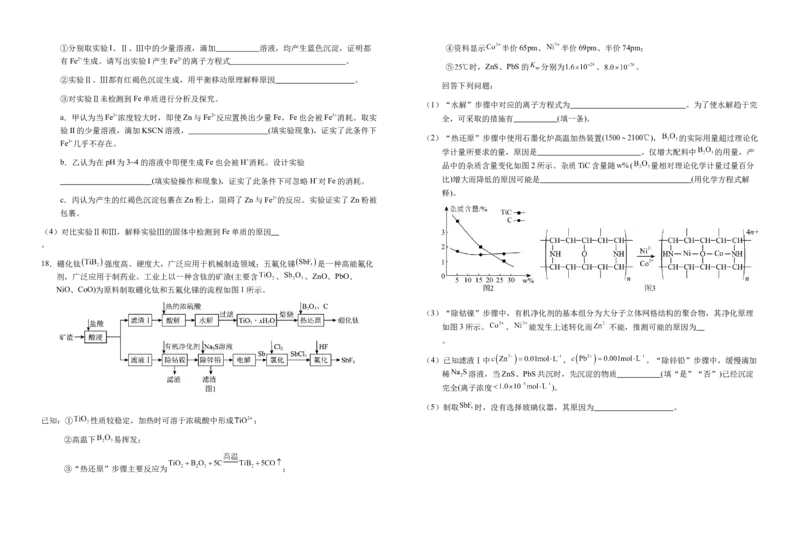
18.硼化钛 强度高、硬度大,广泛应用于机械制造领域;五氟化锑 是一种高能氟化
剂,广泛应用于制药业。工业上以一种含钛的矿渣(主要含 、 、ZnO、PbO、
NiO、CoO)为原料制取硼化钛和五氟化锑的流程如图1所示。
(3)“除钴镍”步骤中,有机净化剂的基本组分为大分子立体网格结构的聚合物,其净化原理
如图3所示。 、 能发生上述转化而 不能,推测可能的原因为
。
(4)已知滤液Ⅰ中 , 。“除锌铅”步骤中,缓慢滴加
稀 溶液,当ZnS、PbS共沉时,先沉淀的物质 (填“是”“否”)已经沉淀
完全(离子浓度 )。
(5)制取 时,没有选择玻璃仪器,其原因为 。
已知:① 性质较稳定,加热时可溶于浓硫酸中形成 ;
②高温下 易挥发;
③“热还原”步骤主要反应为 ;(3) K [Fe(CN) ]
3 6
六安第一中学 2024-2025 学年高三上学期 11 月第三次月考
水解方程式为 ,加入的Zn或Mg会消耗 ,促进 水解平衡
化学试卷参考答案
正向移动,使其转化为沉淀
溶液没有出现血红色 向pH为3~4的稀盐酸中加铁粉,一段时间后取出少量溶液,滴加
一、选择题(每小题3分共42分)
K[Fe(CN) ]溶液,不产生蓝色沉淀,即说明此条件下Fe未与 反应生成Fe2+
3 6
1-14 BCCDD DBBBA CACD
(4)加入镁粉后产生大量气泡,使镁粉不容易被 沉淀包裹18.(1)
二、非选择题(每空2分共58分) 加碱(或“加热”)
15.(1) 3d8 5
(2) 在高温下易挥发,反应不充分
(2) 16N NH 、AsH 、PH
A 3 3 3
(3) 6 (0,0,)
(3) 、 半径与有机净化剂网格孔径大小匹配,可形成配位键,而 不匹配
(4)
16.(1) C-F-E-D (4) 是 (5)反应时加入的HF腐蚀玻璃仪器
(2) 平衡压强
(3) (4)a
(5)THF易挥发,高度易燃,遇明火可能发生爆炸
(6)
(7) (答“ ”均可)
17.(1) 25.0 250mL容量瓶、胶头滴管