文档内容
湖南省长沙市第一中学 2023-2024 学年高三上学期月考(一)
化学试卷
一、选择题(本题共14个小题,每小题3分,共42分。每小题只有一项符合题目要求)
1.化学与生产、生活、科技、环境等关系密切。下列说法错误的是
A.丹霞地貌的岩层因含FeO而呈红色
B.为增强口罩的密封性,在口罩上放了鼻梁条,有的鼻梁条是铝合金的,铝合金属于金属材料
C.中国空间站使用的碳纤维,是一种新型有机高分子材料
D.光化学烟雾、臭氧层空洞、酸雨的形成都与NO有关
2.下列关于物质的结构或性质及解释均正确的是
3.亚铁氰化钾K [Fe(CN) ] 俗名黄血盐, 在烧制青花瓷时用于绘画。制 备方法为
4 6
Fe+6HCN+2~K CO =K [Fe(CN) ]+H ↑+2CO ↑+2¿2O 。设 N 为阿伏加德罗常数, 下列说
2 3 4 6 2 2 A
法正确的是
A. 27~gHCN 分子中含有 π 键数目为 N
A
B. 配合物 K [Fe(CN) ] 的中心离子价电子排布式为 3~d6, 该中心离子的 配位数为 6
4 6
C. 每生成 1~molCO 时, 反应过程中转移电子数目为 4N
2 A
D. K CO 中阴离子的空间结构为平面三角形, 其中碳原子的价层电子 对数目为 4
2 3
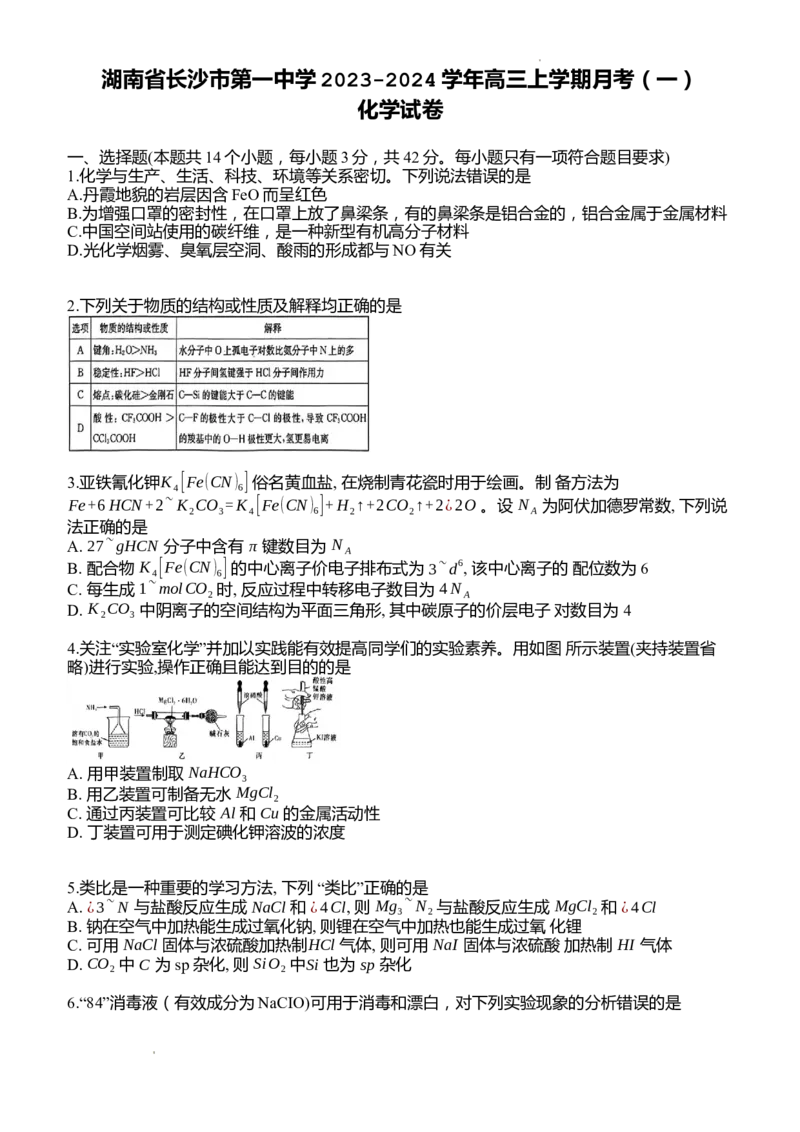
4.关注“实验室化学”并加以实践能有效提高同学们的实验素养。用如图 所示装置(夹持装置省
略)进行实验,操作正确且能达到目的的是
A. 用甲装置制取 NaHCO
3
B. 用乙装置可制备无水 MgCl
2
C. 通过丙装置可比较 Al 和 Cu 的金属活动性
D. 丁装置可用于测定碘化钾溶波的浓度
5.类比是一种重要的学习方法, 下列 “类比”正确的是
A. ¿3~N 与盐酸反应生成 NaCl 和 ¿4Cl, 则 Mg ~N 与盐酸反应生成 MgCl 和 ¿4Cl
3 2 2
B. 钠在空气中加热能生成过氧化钠, 则锂在空气中加热也能生成过氧 化锂
C. 可用 NaCl 固体与浓硫酸加热制HCl 气体, 则可用 NaI 固体与浓硫酸 加热制 HI 气体
D. CO 中 C 为 sp杂化, 则 SiO 中Si 也为 sp 杂化
2 2
6.“84”消毒液(有效成分为NaCIO)可用于消毒和漂白,对下列实验现象的分析错误的是
学科网(北京)股份有限公司A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应 ClO−+H+=HClO
B. 对比实验②和③, 溶液的 pH 可能会影响 ClO−的氧化性或 Cl−的还 原性
C. 实验③中产生的气体是 Cl , 由 HClO 分解得到: 2HClO=Cl ↑+¿2O
2 2
D. 加酸可以提高“ 84 ”消瑇液的漂白效果,但需要调控到合适的 pH 才能 安全使用
7.下列离子方程式正确的是
A. 1~mol⋅L−1 的 NaAlO 溶液和 2.5~mol⋅L−1 的 HCl 溶液等体积均匀 混合:
2
2AlO−+5H+=Al3++Al(OH) ↓+¿2O
2 3
B. Mg(HCO ) 溶液与足量的 NaOH 溶液反应: Mg2++HCO−+OH−=MgCO ↓+¿2O
3 2 3 3
C. 向次氯酸钙溶液中通入少量 SO :Ca2++2ClO−+SO +¿2O=CaSO ↓+2HCl
2 2 4
D. 向 200~mL2~mol⋅L−1 的 Fel 溶液中通入标准状况下 11.2~L 的氯气:
2
4Fe2++6I−+5Cl =4Fe3++3I +10Cl−
2 2
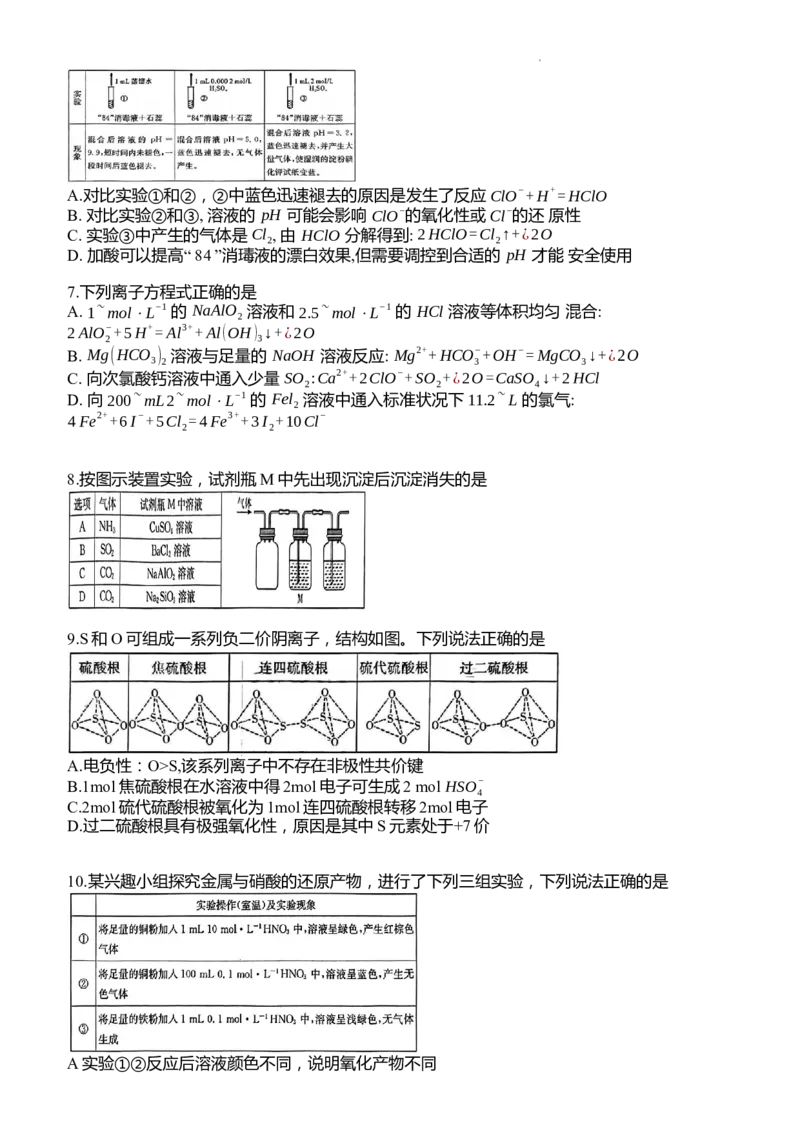
8.按图示装置实验,试剂瓶M中先出现沉淀后沉淀消失的是
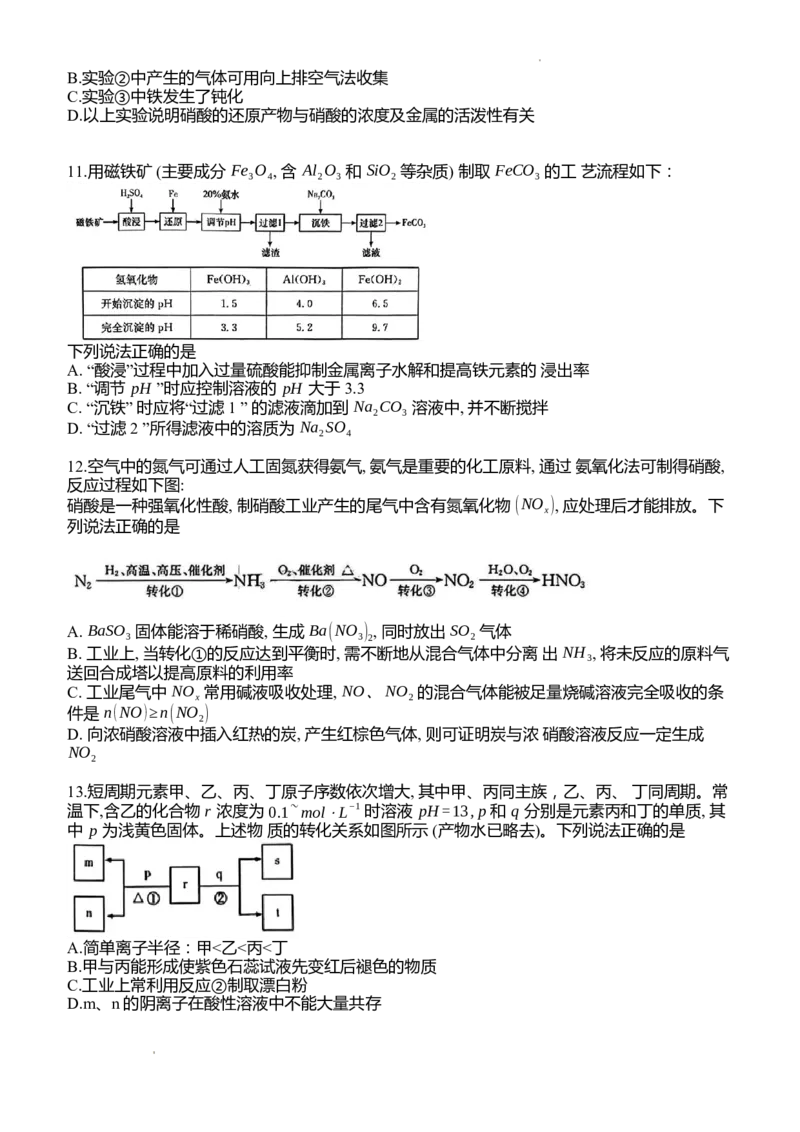
9.S和O可组成一系列负二价阴离子,结构如图。下列说法正确的是
A.电负性:O>S,该系列离子中不存在非极性共价键
B.1mol焦硫酸根在水溶液中得2mol电子可生成2 mol HSO−
4
C.2mol硫代硫酸根被氧化为1mol连四硫酸根转移2mol电子
D.过二硫酸根具有极强氧化性,原因是其中S元素处于+7价
10.某兴趣小组探究金属与硝酸的还原产物,进行了下列三组实验,下列说法正确的是
A实验①②反应后溶液颜色不同,说明氧化产物不同
学科网(北京)股份有限公司B.实验②中产生的气体可用向上排空气法收集
C.实验③中铁发生了钝化
D.以上实验说明硝酸的还原产物与硝酸的浓度及金属的活泼性有关
11.用磁铁矿 (主要成分 Fe O , 含 Al O 和 SiO 等杂质) 制取 FeCO 的工 艺流程如下:
3 4 2 3 2 3
下列说法正确的是
A. “酸浸”过程中加入过量硫酸能抑制金属离子水解和提高铁元素的 浸出率
B. “调节 pH ”时应控制溶液的 pH 大于 3.3
C. “沉铁” 时应将“过滤 1 ” 的滤液滴加到 Na CO 溶液中, 并不断搅拌
2 3
D. “过滤 2 ”所得滤液中的溶质为 Na SO
2 4
12.空气中的氮气可通过人工固氮获得氨气, 氨气是重要的化工原料, 通过 氨氧化法可制得硝酸,
反应过程如下图:
硝酸是一种强氧化性酸, 制硝酸工业产生的尾气中含有氮氧化物 (NO ), 应处理后才能排放。下
x
列说法正确的是
A. BaSO 固体能溶于稀硝酸, 生成 Ba(NO ) , 同时放出 SO 气体
3 3 2 2
B. 工业上, 当转化①的反应达到平衡时, 需不断地从混合气体中分离 出 NH , 将未反应的原料气
3
送回合成塔以提高原料的利用率
C. 工业尾气中 NO 常用碱液吸收处理, NO、NO 的混合气体能被足量烧碱溶液完全吸收的条
x 2
件是 n(NO)≥n(NO )
2
D. 向浓硝酸溶液中插入红热的炭, 产生红棕色气体, 则可证明炭与浓 硝酸溶液反应一定生成
NO
2
13.短周期元素甲、乙、丙、丁原子序数依次增大, 其中甲、丙同主族,乙、丙、 丁同周期。常
温下,含乙的化合物 r 浓度为 0.1~mol⋅L−1 时溶液 pH=13,p 和 q 分别是元素丙和丁的单质, 其
中 p 为浅黄色固体。上述物 质的转化关系如图所示 (产物水已略去)。下列说法正确的是
A.简单离子半径:甲<乙<丙<丁
B.甲与丙能形成使紫色石蕊试液先变红后褪色的物质
C.工业上常利用反应②制取漂白粉
D.m、n的阴离子在酸性溶液中不能大量共存
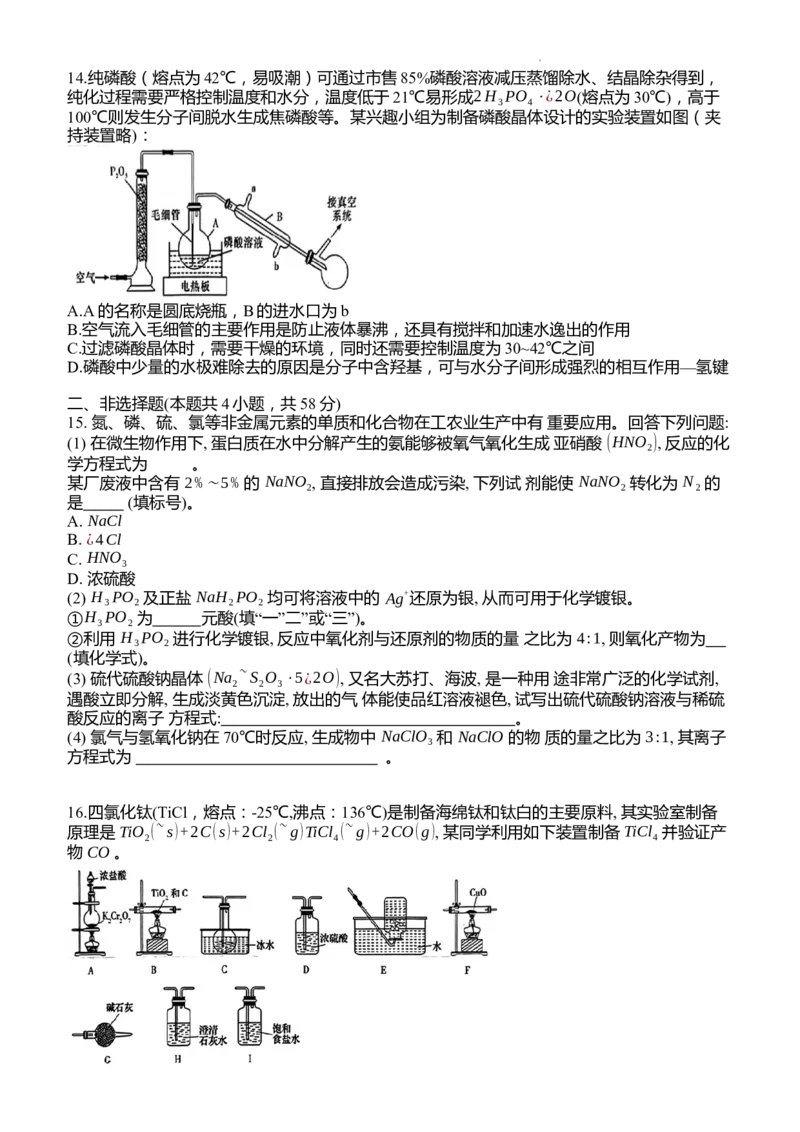
学科网(北京)股份有限公司14.纯磷酸(熔点为42℃,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,
纯化过程需要严格控制温度和水分,温度低于21℃易形成2H PO ⋅¿2O(熔点为30℃),高于
3 4
100℃则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如图(夹
持装置略):
A.A的名称是圆底烧瓶,B的进水口为b
B.空气流入毛细管的主要作用是防止液体暴沸,还具有搅拌和加速水逸出的作用
C.过滤磷酸晶体时,需要干燥的环境,同时还需要控制温度为30~42℃之间
D.磷酸中少量的水极难除去的原因是分子中含羟基,可与水分子间形成强烈的相互作用—氢键
二、非选择题(本题共4小题,共58分)
15. 氮、磷、硫、氯等非金属元素的单质和化合物在工农业生产中有 重要应用。回答下列问题:
(1) 在微生物作用下, 蛋白质在水中分解产生的氨能够被氧气氧化生成 亚硝酸 (HNO ), 反应的化
2
学方程式为 。
某厂废液中含有 2%∼5% 的 NaNO , 直接排放会造成污染, 下列试 剂能使 NaNO 转化为 N 的
2 2 2
是 (填标号)。
A. NaCl
B. ¿4Cl
C. HNO
3
D. 浓硫酸
(2) H PO 及正盐 NaH PO 均可将溶液中的 Ag+还原为银, 从而可用于化学镀银。
3 2 2 2
①H PO 为 元酸(填“一”二”或“三”)。
3 2
②利用 H PO 进行化学镀银, 反应中氧化剂与还原剂的物质的量 之比为 4:1, 则氧化产物为
3 2
(填化学式)。
(3) 硫代硫酸钠晶体 (Na ~S O ⋅5¿2O), 又名大苏打、海波, 是一种用 途非常广泛的化学试剂,
2 2 3
遇酸立即分解, 生成淡黄色沉淀, 放出的气 体能使品红溶液褪色, 试写出硫代硫酸钠溶液与稀硫
酸反应的离子 方程式: 。
(4) 氯气与氢氧化钠在 70℃时反应, 生成物中 NaClO 和 NaClO 的物 质的量之比为 3:1, 其离子
3
方程式为 。
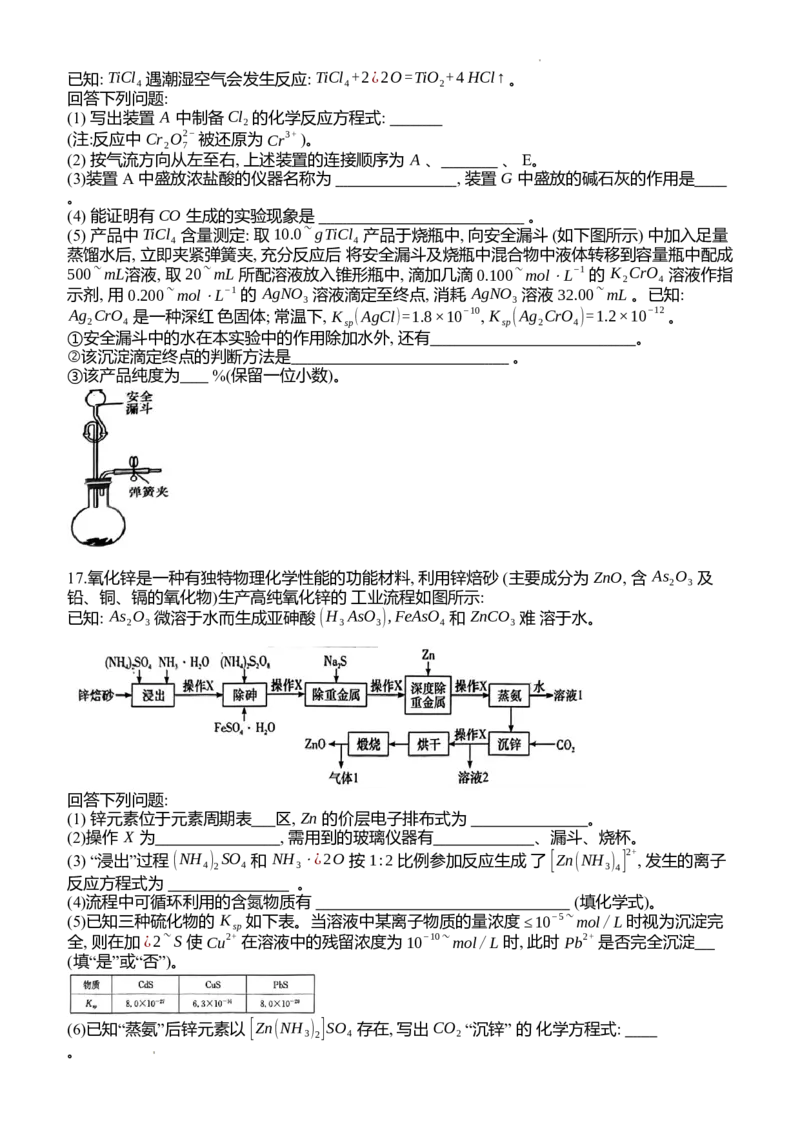
16.四氯化钛(TiCl,熔点:-25℃,沸点:136℃)是制备海绵钛和钛白的主要原料, 其实验室制备
原理是 TiO (~s)+2C(s)+2Cl (~g)TiCl (~g)+2CO(g), 某同学利用如下装置制备 TiCl 并验证产
2 2 4 4
物 CO 。
学科网(北京)股份有限公司已知: TiCl 遇潮湿空气会发生反应: TiCl +2¿2O=TiO +4HCl↑ 。
4 4 2
回答下列问题:
(1) 写出装置 A 中制备 Cl 的化学反应方程式:
2
(注:反应中 Cr O2− 被还原为 Cr3+ )。
2 7
(2) 按气流方向从左至右, 上述装置的连接顺序为 A 、 、 E。
(3)装置 A 中盛放浓盐酸的仪器名称为 , 装置 G 中盛放的碱石灰的作用是
。
(4) 能证明有 CO 生成的实验现象是 。
(5) 产品中 TiCl 含量测定: 取 10.0~gTiCl 产品于烧瓶中, 向安全漏斗 (如下图所示) 中加入足量
4 4
蒸馏水后, 立即夹紧弹簧夹, 充分反应后 将安全漏斗及烧瓶中混合物中液体转移到容量瓶中配成
500~mL溶液, 取 20~mL 所配溶液放入锥形瓶中, 滴加几滴 0.100~mol⋅L−1 的 K CrO 溶液作指
2 4
示剂, 用 0.200~mol⋅L−1 的 AgNO 溶液滴定至终点, 消耗 AgNO 溶液 32.00~mL 。已知:
3 3
Ag CrO 是一种深红 色固体; 常温下, K (AgCl)=1.8×10−10, K (Ag CrO )=1.2×10−12 。
2 4 sp sp 2 4
①安全漏斗中的水在本实验中的作用除加水外, 还有 。
②该沉淀滴定终点的判断方法是 。
③该产品纯度为 %(保留一位小数)。
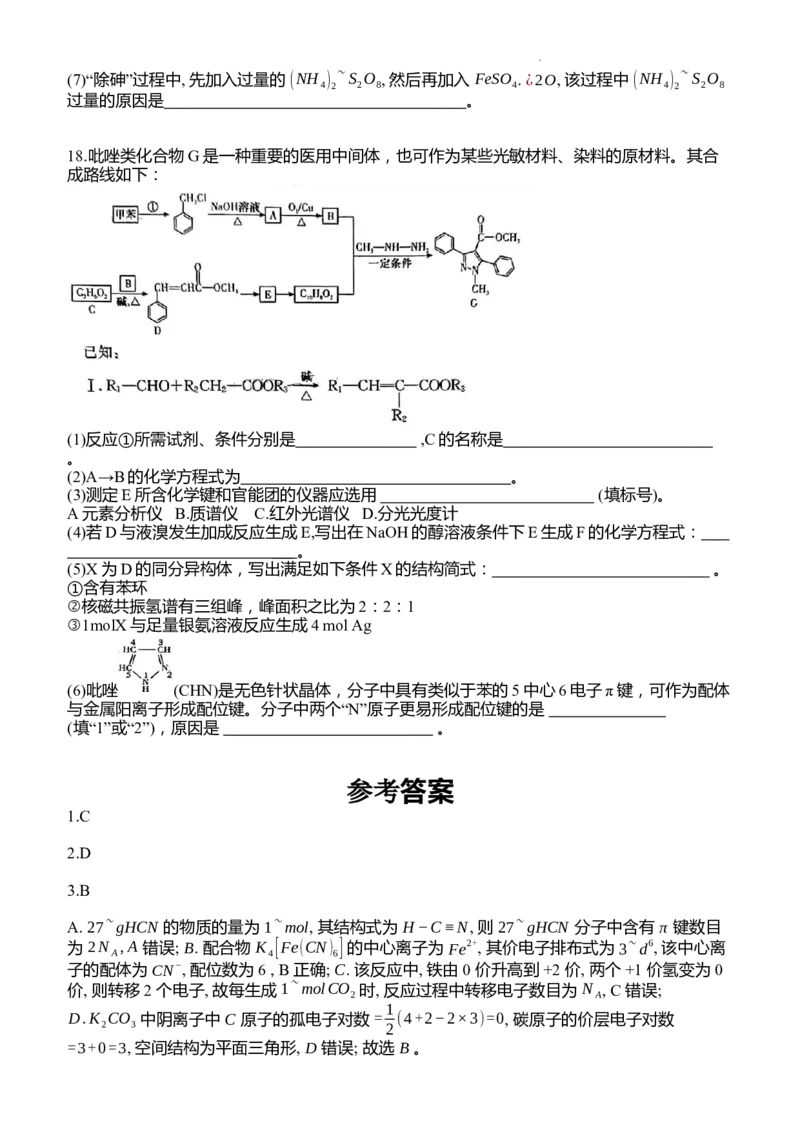
17.氧化锌是一种有独特物理化学性能的功能材料, 利用锌焙砂 (主要成分为 ZnO, 含 As O 及
2 3
铅、铜、镉的氧化物)生产高纯氧化锌的 工业流程如图所示:
已知: As O 微溶于水而生成亚砷酸 (H AsO ),FeAsO 和 ZnCO 难 溶于水。
2 3 3 3 4 3
回答下列问题:
(1) 锌元素位于元素周期表 区, Zn 的价层电子排布式为 。
(2)操作 X 为 , 需用到的玻璃仪器有 、漏斗、烧杯。
2+
(3) “浸出”过程 (NH ) SO 和 NH ⋅¿2O 按 1:2 比例参加反应生成 了 [Zn(NH ) ] , 发生的离子
4 2 4 3 3 4
反应方程式为 。
(4)流程中可循环利用的含氮物质有 (填化学式)。
(5)已知三种硫化物的 K 如下表。当溶液中某离子物质的量浓度 ≤10−5~mol/L 时视为沉淀完
sp
全, 则在加 ¿2~S 使 Cu2+ 在溶液中的残留浓度为 10−10~mol/L 时, 此时 Pb2+ 是否完全沉淀
(填“是”或“否”)。
(6)已知“蒸氨”后锌元素以 [Zn(NH ) ]SO 存在, 写出 CO “沉锌” 的 化学方程式:
3 2 4 2
。
学科网(北京)股份有限公司(7)“除砷”过程中, 先加入过量的 (NH ) ~S O , 然后再加入 FeSO . ¿2O, 该过程中 (NH ) ~S O
4 2 2 8 4 4 2 2 8
过量的原因是 。
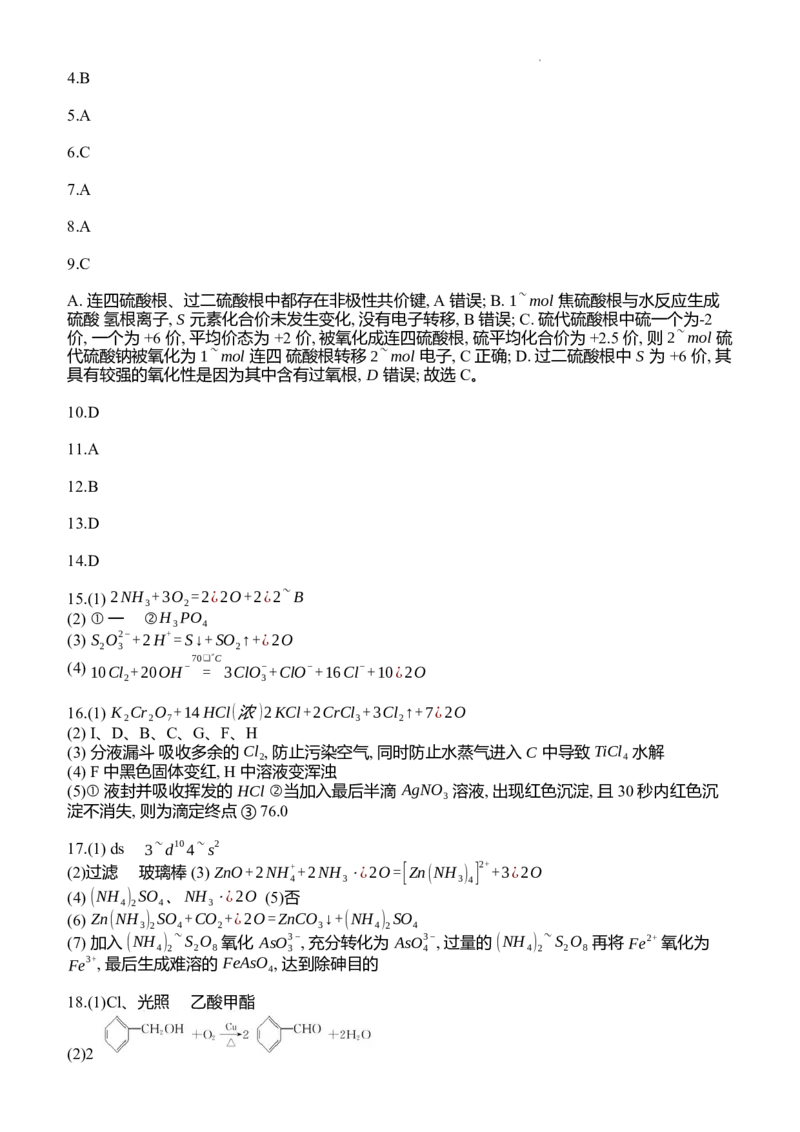
18.吡唑类化合物G是一种重要的医用中间体,也可作为某些光敏材料、染料的原材料。其合
成路线如下:
(1)反应①所需试剂、条件分别是 ,C的名称是
。
(2)A→B的化学方程式为 。
(3)测定E所含化学键和官能团的仪器应选用 (填标号)。
A元素分析仪 B.质谱仪 C.红外光谱仪 D.分光光度计
(4)若D与液溴发生加成反应生成E,写出在NaOH的醇溶液条件下E生成F的化学方程式:
。
(5)X为D的同分异构体,写出满足如下条件X的结构简式: 。
①含有苯环
②核磁共振氢谱有三组峰,峰面积之比为2:2:1
③1molX与足量银氨溶液反应生成4 mol Ag
(6)吡唑 (CHN)是无色针状晶体,分子中具有类似于苯的5中心6电子π键,可作为配体
与金属阳离子形成配位键。分子中两个“N”原子更易形成配位键的是
(填“1”或“2”),原因是 。
参考答案
1.C
2.D
3.B
A. 27~gHCN 的物质的量为 1~mol, 其结构式为 H−C≡N, 则 27~gHCN 分子中含有 π 键数目
为 2N ,A 错误; B. 配合物 K [Fe(CN) ] 的中心离子为 Fe2+, 其价电子排布式为 3~d6, 该中心离
A 4 6
子的配体为 CN−, 配位数为 6 , B 正确; C. 该反应中, 铁由 0 价升高到 +2 价, 两个 +1 价氢变为 0
价, 则转移 2 个电子, 故每生成 1~molCO 时, 反应过程中转移电子数目为 N , C 错误;
2 A
1
D.K CO 中阴离子中 C 原子的孤电子对数 = (4+2−2×3)=0, 碳原子的价层电子对数
2 3 2
=3+0=3, 空间结构为平面三角形, D 错误; 故选 B 。
学科网(北京)股份有限公司4.B
5.A
6.C
7.A
8.A
9.C
A. 连四硫酸根、过二硫酸根中都存在非极性共价键, A 错误; B. 1~mol 焦硫酸根与水反应生成
硫酸 氢根离子, S 元素化合价未发生变化, 没有电子转移, B 错误; C. 硫代硫酸根中硫一个为-2
价, 一个为 +6 价, 平均价态为 +2 价, 被氧化成连四硫酸根, 硫平均化合价为 +2.5 价, 则 2~mol 硫
代硫酸钠被氧化为 1~mol 连四 硫酸根转移 2~mol 电子, C 正确; D. 过二硫酸根中 S 为 +6 价, 其
具有较强的氧化性是因为其中含有过氧根, D 错误; 故选 C。
10.D
11.A
12.B
13.D
14.D
15.(1) 2NH +3O =2¿2O+2¿2~B
3 2
(2) ①一 ②H PO
3 4
(3) S O2−+2H+=S↓+SO ↑+¿2O
2 3 2
70❑∘C
(4) 10Cl +20OH− = 3ClO−+ClO−+16Cl−+10¿2O
2 3
16.(1) K Cr O +14HCl(浓)2KCl+2CrCl +3Cl ↑+7¿2O
2 2 7 3 2
(2) I、D、B、C、G、F、H
(3) 分液漏斗 吸收多余的 Cl , 防止污染空气, 同时防止水蒸气进入 C 中导致 TiCl 水解
2 4
(4) F 中黑色固体变红, H 中溶液变浑浊
(5)①液封并吸收挥发的 HCl ②当加入最后半滴 AgNO 溶液, 出现红色沉淀, 且 30 秒内红色沉
3
淀不消失, 则为滴定终点 ③76.0
17.(1) ds 3~d104~s2
(2)过滤 玻璃棒 (3) ZnO+2NH++2NH ⋅¿2O=[Zn(NH ) ] 2+ +3¿2O
4 3 3 4
(4) (NH ) SO 、NH ⋅¿2O (5)否
4 2 4 3
(6) Zn(NH ) SO +CO +¿2O=ZnCO ↓+(NH ) SO
3 2 4 2 3 4 2 4
(7) 加入 (NH ) ~S O 氧化 AsO3−, 充分转化为 AsO3−, 过量的 (NH ) ~S O 再将 Fe2+ 氧化为
4 2 2 8 3 4 4 2 2 8
Fe3+, 最后生成难溶的 FeAsO , 达到除砷目的
4
18.(1)Cl、光照 乙酸甲酯
(2)2
学科网(北京)股份有限公司(3)C
(4)
(5)
(6)2 1号氮原子提供一对电子形成5中心6电子π键,2号氮原子可提供孤电子对与金属阳离
子形成配位键
学科网(北京)股份有限公司