文档内容
重庆市拔尖强基联盟 2023-2024 学年高三十月联合考试
化学试题
(满分100分,75分钟)
注意事项:
1.答卷前,请考生务必将自己的姓名、班级、考号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改
动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上,写在
本试卷上无效。
3.考试结束后,请一定将答题卡上交。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Al 27 S 32 Fe 56 Co 59 Zn 65
Ga 70 Ba 137
一、选择题:本题共14个小题,每小题3分,共42分。在每小题给出的四个选项中,只有
一项是符合题目要求的。
1. 8月29日,华为Mate60 Pro横空出世,国产麒麟9000s芯片闪耀登场。华为的坚毅不屈成就了中国芯,
不仅值得我们骄傲,更值得我们每个中国人学习!大国制造彰显中国实力,化学材料助力科技成果的转化
与应用。下列说法错误的是
A. 制造5G芯片的氮化铝晶圆属于无机非金属材料
B. 高纯度的二氧化硅被广泛用于制作计算机芯片
C. 华为首创的液冷散热技术所用的石墨烯材料是新型无机非金属材料
D. Mate60 Pro部分机型后盖采用“锦纤”材质与合金完美契合,其中合金属于金属材料
【答案】B
【解析】
【详解】A.氮化铝(AlN)是一种无机物,所以是无机非金属材料,A正确;
B.计算机芯片的成分是硅单质,不是二氧化硅,B错误;
C.石墨烯是单层石墨结构,属于无机非金属材料,C正确;
D.合金属于金属材料,D正确;
故答案为:B。
2. 下列说法正确的是
A. Fe分别与Cl、S反应,产物中Fe的化合价相同
2
第1页/共23页
学科网(北京)股份有限公司B. Cu分别与浓硝酸、稀硝酸反应,生成的产物完全相同
C. CO 分别与NaO、CaO反应,反应类型相同
2 2 2
D. Be分别与盐酸、氢氧化钠溶液反应,生成的气体相同
【答案】D
【解析】
【详解】A.Fe与Cl 反应生成FeCl ,Fe为+3价,Fe与S反应生成FeS,Fe为+2价,A错误;
2 3
B.铜与浓硝酸反应生成NO ,与稀硝酸反应生成NO,生成的产物不完全相同,B错误;
2
C.CO 与CaO反应生成CaCO ,反应类型为化合反应,与NaO 反应生成碳酸钠和氧气,不是化合反应,
2 3 2 2
反应类型不同,C错误;
D.Be的化学性质与Al相似,Be与盐酸、氢氧化钠溶液反应,均生成氢气,D正确;
故答案选D。
3. 下列离子方程式书写错误的是
A. SO 通入双氧水中:
2
B. NaOH浓溶液与饱和NH Cl溶液:
4
C. Pb与Fe (SO ) 溶液:
2 4 3
D. Ca(HCO ) 与澄清石灰水:
3 2
【答案】A
【解析】
【详解】A.HSO 是强酸,离子方程式书写时要拆,故SO 通入双氧水中的离子方程式为:
2 4 2
,A错误;
B.NaOH浓溶液与饱和NH Cl溶液生成NH 和NaCl,故离子方程式为: ,B
4 3
正确;
C.Pb与Fe (SO ) 溶液生成PbSO 沉淀和FeSO ,故离子方程式为: ,
2 4 3 4 4
C正确;
D.Ca(HCO ) 与澄清石灰水生成CaCO 沉淀和HO,故离子方程式为:
3 2 3 2
,D正确;
第2页/共23页
学科网(北京)股份有限公司故答案为:A。
4. 已知: ,阿伏伽德罗常数的值为N 。若反应物
A
中HSO 消耗了3mol,则下列说法错误的是
2 4
A. 转移电子的数目为6N B. 标准状况下,生成HO27g
A 2
C. 生成还原产物的分子数为1N D. 产物AsH 为平面三角形
A 3
【答案】D
【解析】
【分析】As的化合价由+3降低到-3,Zn化合价由0升高到+2,则
,以此分析;
【详解】A.若反应物中HSO 消耗了3mol,转移电子的数目为6N ,A正确;
2 4 A
B.若反应物中HSO 消耗了3mol,生成1.5molH2O, ,B正确;
2 4
C.2AsH 为还原产物,若反应物中HSO 消耗了3mol,生成1molAsH,C正确;
3 2 4 3
为
D.As与N 同族元素,故AsH 为三角锥形,D错误;
3
故答案为:D。
的
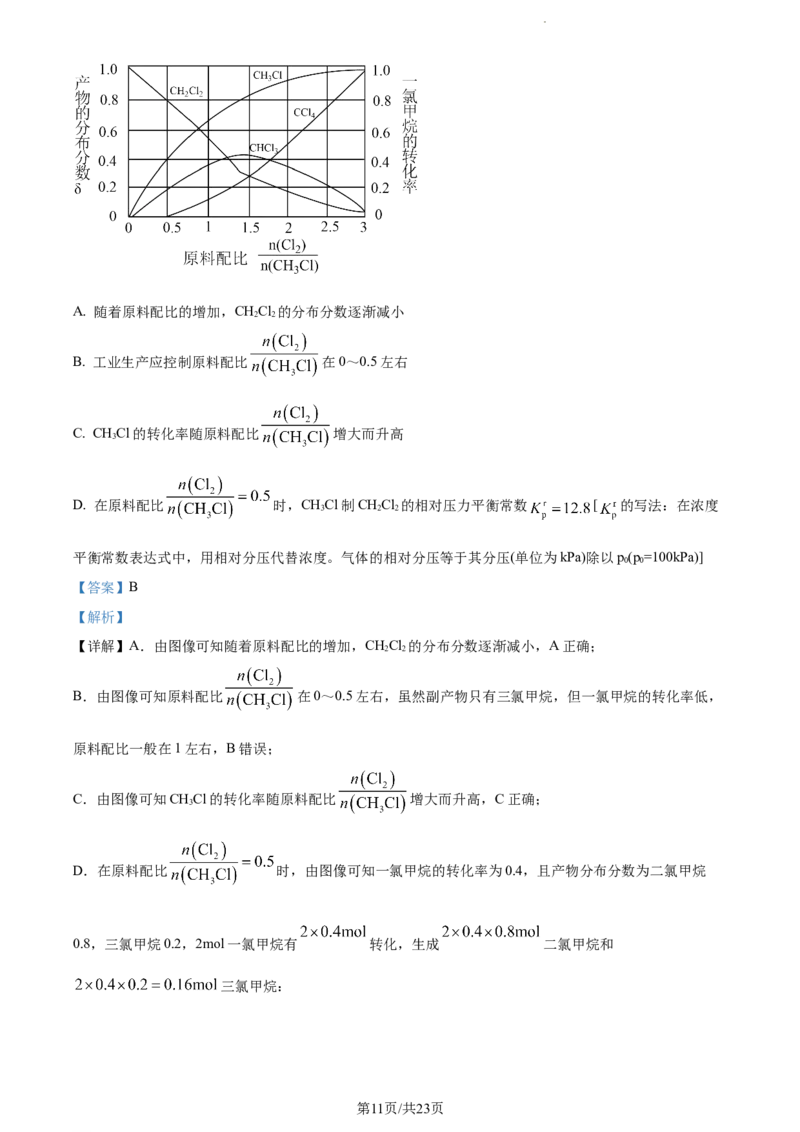
5. 实验装置、实验步骤 科学设计是实验达到预期目的的关键。下列说法正确的是
甲 乙 丙 丁
A. 用装置甲探究NaHCO 的稳定性
3
B. 用装置乙分离溴苯中溶解的少量苯
C. 用MnO 和浓HCl为原料制Cl 时,可在装置丙中进行
2 2
D. 由FeCl 溶液制备无水FeCl ,可在装置丁中进行
3 3
【答案】A
第3页/共23页
学科网(北京)股份有限公司【解析】
【详解】A.加热NaHCO 会分解生成二氧化碳气体,若澄清石灰水变浑浊,则说明碳酸氢钠受热易分解
3
A符合题意;
B.蒸馏是温度计水银球不能拆入液面以下,应该保持在蒸馏烧瓶支管口中下部,故用装置乙不能分离溴
苯中溶解的少量苯,B不合题意;
C.用MnO 和浓HCl为原料制Cl 时需要加热,故不能在装置丙中进行,C不合题意;
2 2
D.由于FeCl 易水解生成Fe(OH) 和HCl,HCl易挥发,故由FeCl 溶液制备无水FeCl 需在HCl的气流中
3 3 3 3
进行蒸发,即不可在装置丁中进行,D不合题意;
故答案为:A。
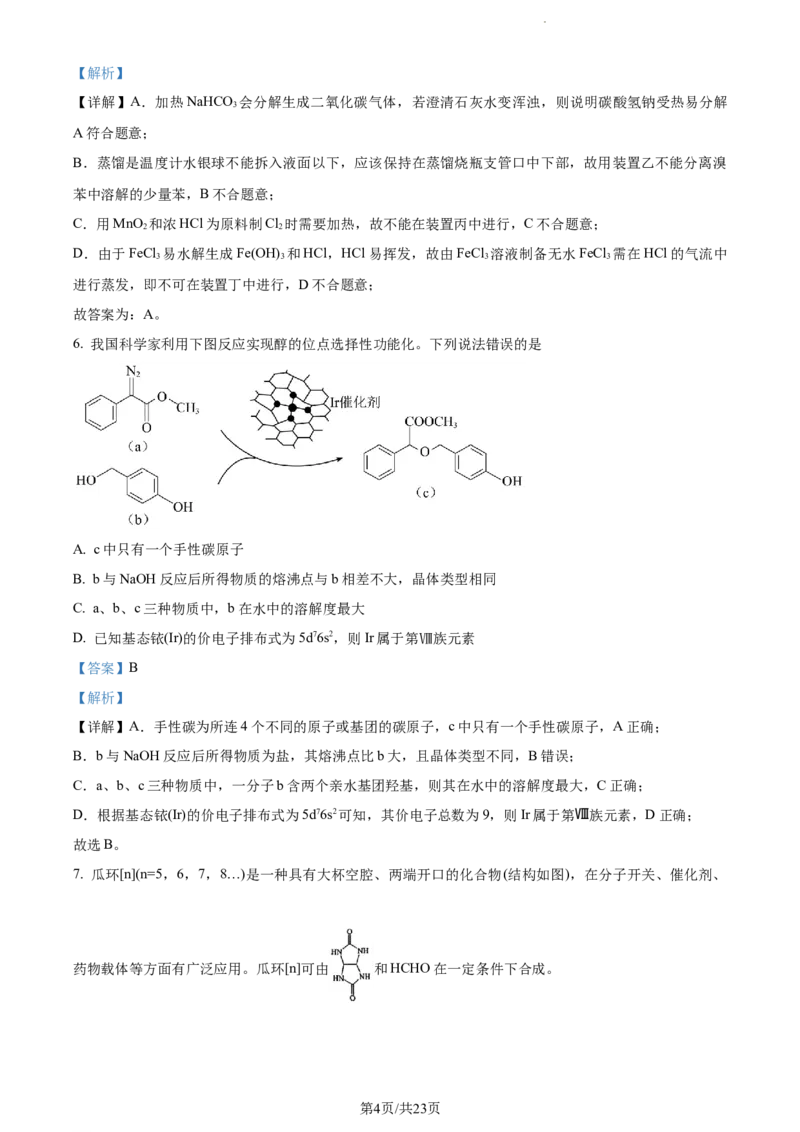
6. 我国科学家利用下图反应实现醇的位点选择性功能化。下列说法错误的是
A. c中只有一个手性碳原子
B. b与NaOH反应后所得物质的熔沸点与b相差不大,晶体类型相同
C. a、b、c三种物质中,b在水中的溶解度最大
D. 已知基态铱(Ir)的价电子排布式为5d76s2,则Ir属于第Ⅷ族元素
【答案】B
【解析】
【详解】A.手性碳为所连4个不同的原子或基团的碳原子,c中只有一个手性碳原子,A正确;
B.b与NaOH反应后所得物质为盐,其熔沸点比b大,且晶体类型不同,B错误;
C.a、b、c三种物质中,一分子b含两个亲水基团羟基,则其在水中的溶解度最大,C正确;
D.根据基态铱(Ir)的价电子排布式为5d76s2可知,其价电子总数为9,则Ir属于第Ⅷ族元素,D正确;
故选B。
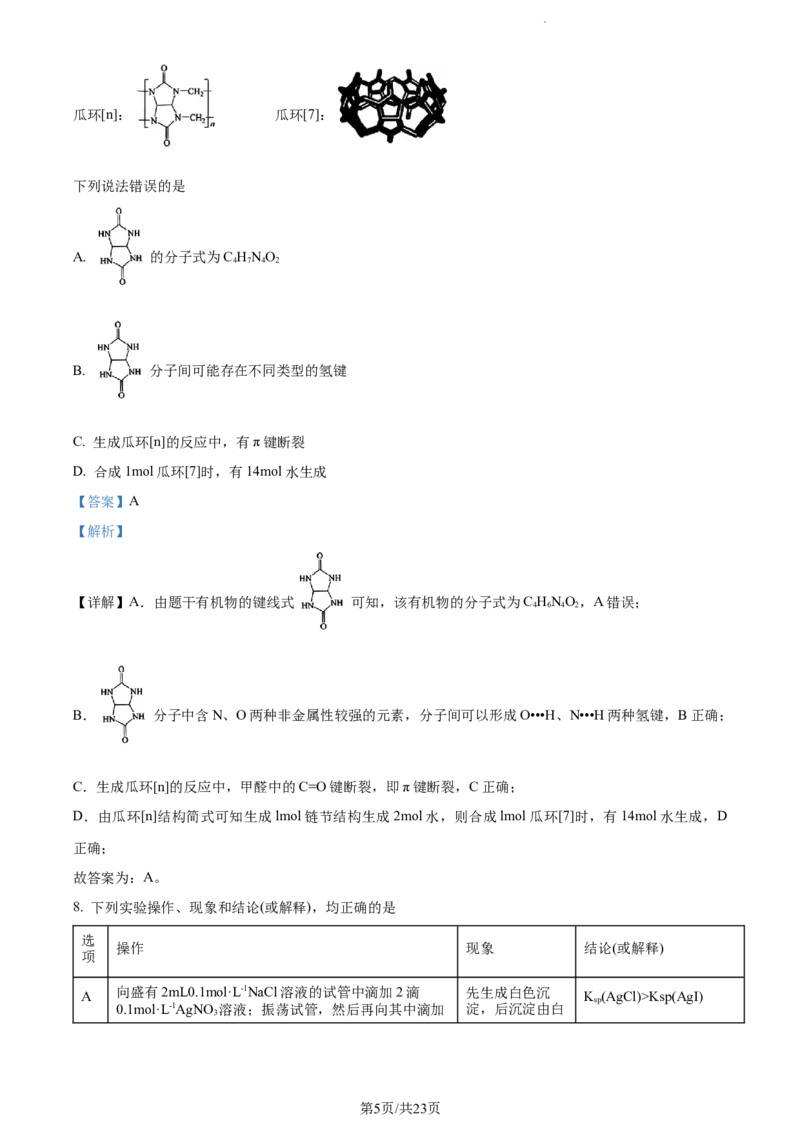
7. 瓜环[n](n=5,6,7,8…)是一种具有大杯空腔、两端开口的化合物(结构如图),在分子开关、催化剂、
药物载体等方面有广泛应用。瓜环[n]可由 和HCHO在一定条件下合成。
第4页/共23页
学科网(北京)股份有限公司瓜环[n]: 瓜环[7]:
下列说法错误的是
A. 的分子式为C HNO
4 7 4 2
B. 分子间可能存在不同类型的氢键
C. 生成瓜环[n]的反应中,有π键断裂
D. 合成1mol瓜环[7]时,有14mol水生成
【答案】A
【解析】
【详解】A.由题干有机物的键线式 可知,该有机物的分子式为C HNO,A错误;
4 6 4 2
B. 分子中含N、O两种非金属性较强的元素,分子间可以形成O•••H、N•••H两种氢键,B正确;
C.生成瓜环[n]的反应中,甲醛中的C=O键断裂,即π键断裂,C正确;
D.由瓜环[n]结构简式可知生成lmol链节结构生成2mol水,则合成lmol瓜环[7]时,有14mol水生成,D
正确;
故答案为:A。
8. 下列实验操作、现象和结论(或解释),均正确的是
选
操作 现象 结论(或解释)
项
A 向盛有2mL0.1mol·L-1NaCl溶液的试管中滴加2滴 先生成白色沉 K (AgCl)>Ksp(AgI)
sp
0.1mol·L-1AgNO 溶液;振荡试管,然后再向其中滴加 淀,后沉淀由白
3
第5页/共23页
学科网(北京)股份有限公司4滴0.1mol·L-1KI溶液 色变为黄色
取2mL某溶液于试管中,滴加少量稀硝酸,再滴加几
B 有血红色出现 原溶液中一定含有Fe3+
滴KSCN溶液
溶液从蓝色变为 稳定性:[CuCl ]2-
C 向CuSO 溶液中加入NaCl固体 4
4 黄色 <[Cu(H O) ]2+
2 4
取少量某溶液于试管中,加入NaOH浓溶液并加热。 蓝色石蕊试纸变
D 原溶液中一定含有
用湿润的蓝色石蕊试纸检验产生的气体 红
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.Cl-过量,先生成白色沉淀AgCl,后沉淀由白色变为黄色AgI ,能比较两种沉淀的K ,A正
sp
确;
B.原溶液中也可能含有Fe2+,滴加稀硝酸酸化,Fe2+变为Fe3+,再滴加几滴KSCN溶液,有血红色出现,
B错误;
C.向CuSO 溶液中有[Cu(H O) ]2+(蓝色),加入NaCl固体,部分[Cu(H O) ]2+(蓝色)转化为[CuCl ]2-
4 2 4 2 4 4
(黄色),溶液中同时有两种配离子,溶液变为黄绿色,故证明稳定性[CuCl ]2->[Cu(H O) ]2+,C错误;
4 2 4
D.应用湿润的红色石蕊试纸检验产生的气体NH ,试纸变为蓝色,D错误;
3
故答案为:A。
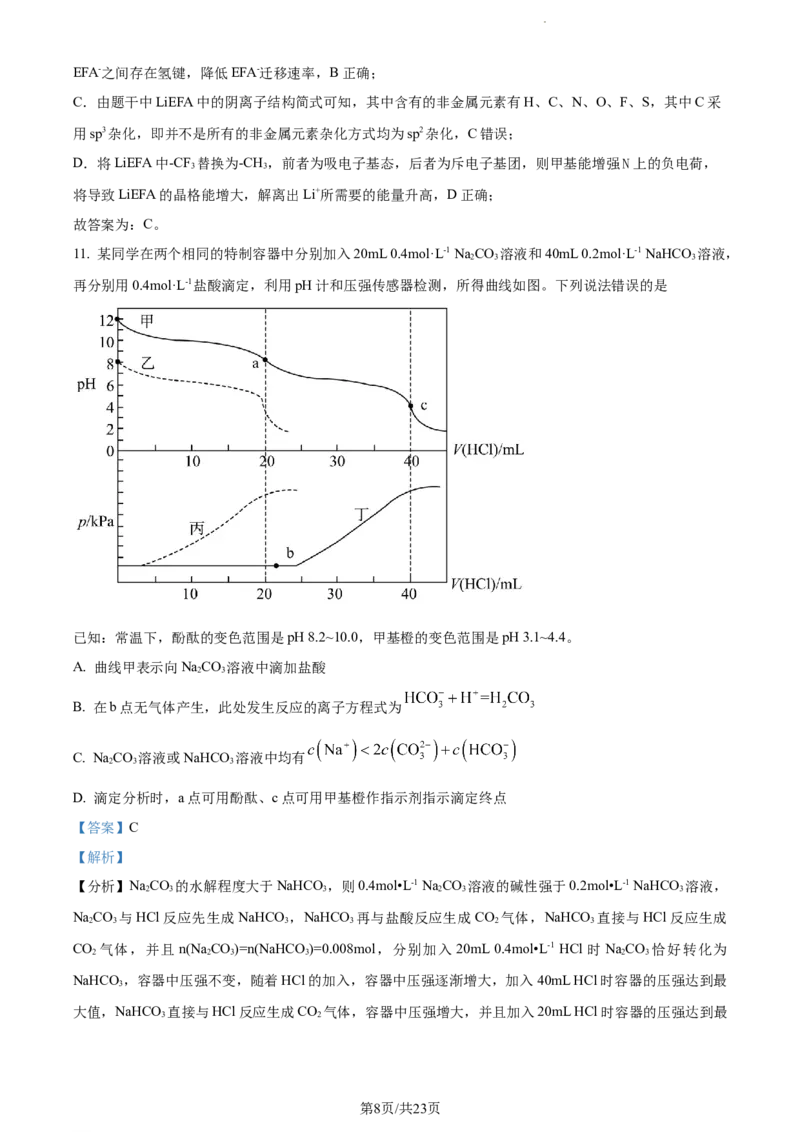
9. 为维护国家安全和利益,经国务院批准,决定对镓、锗相关物项实施出口管制。镓的某种化合物的晶胞
结构如下图所示(晶胞参数为a pm,1 pm=10-10cm,N 表示阿伏加德罗常数)。下列说法正确的是
A
A. Ga元素位于元素周期表的ds区
B. 晶体结构中N的配位数为6
C. 该物质的化学式为GaN
4 4
D. 该晶体的密度为
【答案】D
【解析】
第6页/共23页
学科网(北京)股份有限公司【详解】A.Ga元素为第31号元素,其价电子排布为4s24p1,位于元素周期表的p区,A错误;
B.有晶胞结构可知,每个N原子与4个Ga原子相连,则晶体结构中N的配位数为4,B错误;
C.由晶胞结构可知,Ga原子位于晶胞的顶点和面心上,则一个晶胞中含 个Ga原子,N
原子位于晶胞内部,则一个晶胞中含4个N原子,Ga原子和N原子个数比为1∶1,故该物质的化学式为
GaN,C错误;
D.1mol该晶胞的质量为 ,则一个晶胞的质量为 ,晶胞参数为a
pm ,则一个晶胞的体积 ,晶胞的密度为
,D正确;
故选D。
10. 一种固态聚合物金属锂电池中电解质(LiEFA)与聚合物基体(PEO)之间相互作用示意如图。
下列说法错误的是
A. PEO能传输Li+的原因是Li+与PEO的氧原子可形成微弱的配位键
B. PEO能降低EFA-迁移速率的原因是两者微粒间存在分子间氢键
C. LiEFA中所有的非金属元素杂化方式相同,均为sp2杂化
D. 将LiEFA中-CF,替换成-CH,LiEFA解离出Li+更难,所需能量更高
3 3
【答案】C
【解析】
【详解】A.Li+含有空轨道,PEO的氧原子含有孤对电子,两者之间能形成配位键,PEO能传输Li+的原
因是Li+与PEO的氧原子可形成微弱的配位键,A正确;
B.PEO中含有-OH能与EFA-离子中存在孤电子对的电负性较大的元素N、O、F形成氢键,即PEO与
第7页/共23页
学科网(北京)股份有限公司EFA-之间存在氢键,降低EFA-迁移速率,B正确;
C.由题干中LiEFA中的阴离子结构简式可知,其中含有的非金属元素有H、C、N、O、F、S,其中C采
用sp3杂化,即并不是所有的非金属元素杂化方式均为sp2杂化,C错误;
D.将LiEFA中-CF 替换为-CH,前者为吸电子基态,后者为斥电子基团,则甲基能增强N上的负电荷,
3 3
将导致LiEFA的晶格能增大,解离出Li+所需要的能量升高,D正确;
故答案为:C。
11. 某同学在两个相同的特制容器中分别加入20mL 0.4mol·L-1 NaCO 溶液和40mL 0.2mol·L-1 NaHCO 溶液,
2 3 3
再分别用0.4mol·L-1盐酸滴定,利用pH计和压强传感器检测,所得曲线如图。下列说法错误的是
已知:常温下,酚酞的变色范围是pH 8.2~10.0,甲基橙的变色范围是pH 3.1~4.4。
A. 曲线甲表示向NaCO 溶液中滴加盐酸
2 3
B. 在b点无气体产生,此处发生反应的离子方程式为
C. NaCO 溶液或NaHCO 溶液中均有
2 3 3
D. 滴定分析时,a点可用酚酞、c点可用甲基橙作指示剂指示滴定终点
【答案】C
【解析】
【分析】NaCO 的水解程度大于NaHCO ,则0.4mol•L-1 NaCO 溶液的碱性强于0.2mol•L-1 NaHCO 溶液,
2 3 3 2 3 3
NaCO 与HCl反应先生成NaHCO ,NaHCO 再与盐酸反应生成CO 气体,NaHCO 直接与HCl反应生成
2 3 3 3 2 3
CO 气体,并且 n(Na CO)=n(NaHCO )=0.008mol,分别加入 20mL 0.4mol•L-1 HCl 时NaCO 恰好转化为
2 2 3 3 2 3
NaHCO ,容器中压强不变,随着HCl的加入,容器中压强逐渐增大,加入40mL HCl时容器的压强达到最
3
大值,NaHCO 直接与HCl反应生成CO 气体,容器中压强增大,并且加入20mL HCl时容器的压强达到最
3 2
第8页/共23页
学科网(北京)股份有限公司大值、一直保持不变,所以图中甲、丁线表示向NaCO 溶液中滴加盐酸,乙、丙线表示向NaHCO 溶液中
2 3 3
滴加盐酸,据此分析解答。
【详解】A.由上述分析可知,图中甲线表示向NaCO 溶液中滴加盐酸,A正确;
2 3
B.在加入 20mL HCl 时 NaCO 转化为了 NaHCO ,NaHCO 与 HCl 反应生成了 CO 气体,则 b 点当
2 3 3 3 2
V(HCl)>20mL 时,碳酸氢根离子和氢离子反应,由图中曲线丁可知,发生的主要反应为
,B正确;
C.由题干图示信息可知,NaCO 溶液或NaHCO 溶液均显碱性,且两溶液中均存在电荷守恒式:c(Na+)
2 3 3
+c(H+)=c(OH-)+2c( )+c( ),故NaCO 溶液或NaHCO 溶液中均有c(Na+)>2c( )+c(
2 3 3
),C错误;
D.由图可知,滴定分析时,a点的pH在9左右,在酚酞的变色范围内,可选择酚酞作指示剂;c点的pH
在4左右,在甲基橙的变色范围内,可选择甲基橙作指示剂,D正确;
故答案为C。
12. 锂离子电池具有能量密度大、工作寿命长的特点,其原理如图所示。下列说法正确的是
A. 充电时A极发生反应
B. 充电时B极与电源正极相连
C. 每生成1molT时,转移2n mole-
D. 充放电过程中,O元素化合价发生变化
【答案】C
【解析】
【分析】由图可知,放电时B极S→T,S失去电子,发生氧化反应,则放电时B极为负极,A极为正极,
充电时,B极为阴极,A极为阳极。
【详解】A.充电时A极为阳极,发生氧化反应,则A极发生反应为 ,故A错误;
B.充电时,B极为阴极, B极与电源负极相连,故B错误;
第9页/共23页
学科网(北京)股份有限公司C.S和T为聚合物,聚合度为n,充电时,阴极反应式为T+2ne-+2nLi+=S,则每生成1molT时,转移2n
mole-,故C正确;
D.充放电过程中,C元素和I元素的化合价发生变化,O元素化合价不发生变化,故D错误;
故选C。
13. XYWR和XZWR两种物质组成元素相同,他们的相对分子质量相差5,XZWR有32个质子,X、
2 5 2 5 2 5
W、R三种元素同周期,X元素的最外层电子数为R电子数的一半。下列说法正确的是
A. 元素的第一电离能大小:W>R
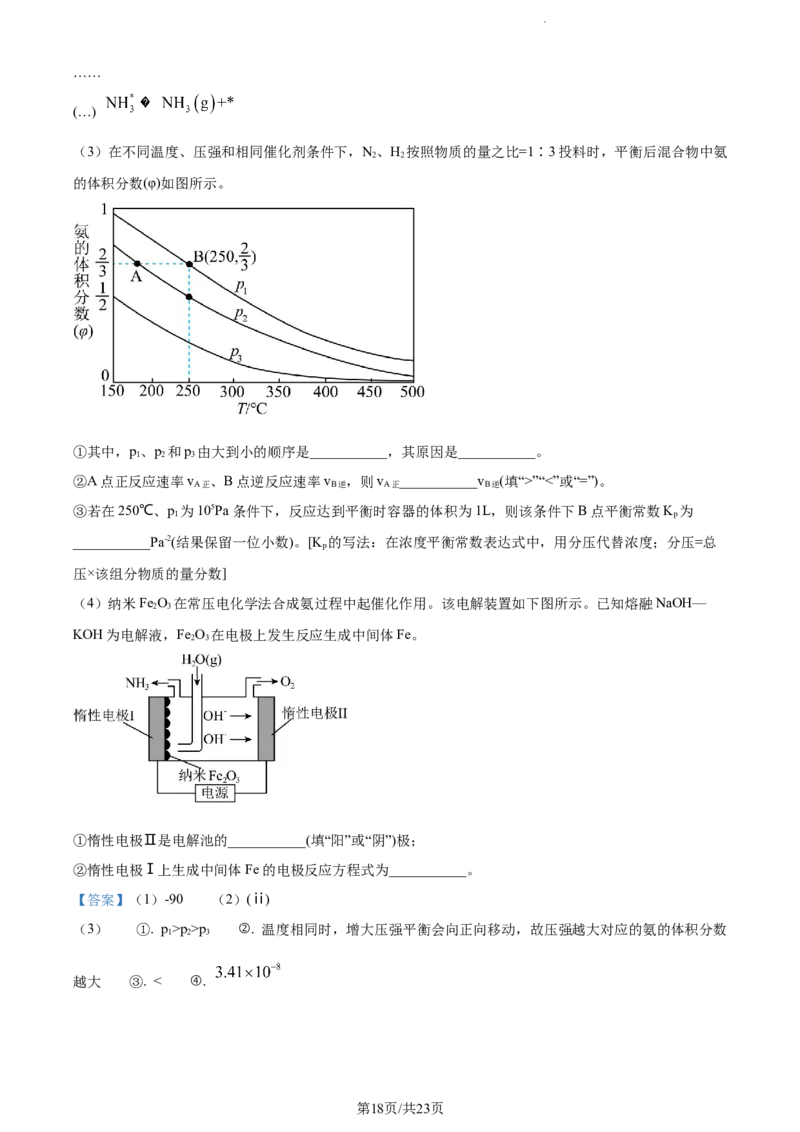
B. 原子半径:X”“<”或“=”)。
A正 B逆 A正 B逆
③若在250℃、p 为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点平衡常数K 为
1 p
___________Pa-2(结果保留一位小数)。[K 的写法:在浓度平衡常数表达式中,用分压代替浓度;分压=总
p
压×该组分物质的量分数]
(4)纳米Fe O 在常压电化学法合成氨过程中起催化作用。该电解装置如下图所示。已知熔融NaOH—
2 3
KOH为电解液,Fe O 在电极上发生反应生成中间体Fe。
2 3
①惰性电极Ⅱ是电解池的___________(填“阳”或“阴”)极;
②惰性电极Ⅰ上生成中间体Fe的电极反应方程式为___________。
【答案】(1)-90 (2)(ⅱ)
(3) ①. p>p>p ②. 温度相同时,增大压强平衡会向正向移动,故压强越大对应的氨的体积分数
1 2 3
越大 ③. < ④.
第18页/共23页
学科网(北京)股份有限公司(4) ①. 阳 ②.
【解析】
【小问1详解】
由图可知反应 的
;
【小问2详解】
活化能越高反应速率越慢,反应(ⅱ)需要断开键能高的氮氮三键,所需的能量最高,则速率控制步骤(即速
率最慢步骤)为(ⅱ);
【小问3详解】
①合成氨的反应 为反应前后气体物质的量减小的反应,增大压强平衡会向正
向移动,则压强越大对应的氨的体积分数越大,则压强由大到小为p>p>p;理由为反应为温度相同时,
1 2 3
增大压强平衡会向正向移动,故压强越大对应的氨的体积分数越大;
②温度越高,压强越大反应速率越大,B点温度更高,压强更大,则v