文档内容
2022-2023学年高三年级 TOP二十名校九月摸底考试
高三化学参考答案
1.【答案】 C
【解析】 航空燃油和柴油的主要成分都是烃,A正确;合金的硬度高于其成分金属,B正确;防腐
涂料利用物理方法保护金属不被腐蚀,C错误;环氧树脂属于有机高分子材料,D正确。
2.【答案】 A
【解析】 CO的结构式为OCO,A正确;HO是 V形分子,但原子半径:O>H,B错误;1个
2 2
12C18O和14C16O分子的中子数目均为 16,但该选项未说明两种分子个数是否相同,C错误;H和
2
D是同种物质,D错误。
2
3.【答案】 B
【解析】 NO溶于水生成 HNO和 NO,NO不是酸酐,HNO的酸酐是 NO,A错误;Fe和水蒸气
2 3 2 3 2 5
在高温条件下反应生成 FeO和 H,B正确;SiO溶于 NaOH溶液,再加入酸可得 HSiO,C错
3 4 2 2 2 3
误;电解精炼铜时,粗铜连接电源正极作电解池阳极,D错误。
4.【答案】 B
【解析】 外管温度较高,NaHCO置于外管时分解,不能说明 NaHCO的热稳定性较 NaHCO差,
3 3 3
应将 NaHCO置于内管,A错误;制备少量 H可用锌粒和稀硫酸,B正确;SO密度大于空气,不能
3 2 2
用向下排空气法收集,C错误;NaCO在高温条件下与 SiO 反应,不能用瓷坩埚灼烧,D错误。
2 3 2
5.【答案】 B
【解析】 丙烯和环丙烷的分子式均为 CH,4.2g混合气体物质的量为 0.1mol,所含原子数为
3 6
0.9N,A错误;氯水中的含氯微粒有 Cl、Cl-、ClO-、HClO,根据 Cl守恒可知,含氯微粒数目之和
A 2
小于2N,B正确;醋酸抑制水电离,pH=3的醋酸溶液中水电离的 H+浓度为10-11mol·L-1,不知
A
醋酸溶液体积,无法计算 H+数目,C错误;加入 1molCu(OH)可恢复至原 CuSO溶液,说明阳
2 4
极析出1molO,转移电子数为4N,D错误。
2 A
6.【答案】 A
【解析】 ClO有氧化性可以杀菌消毒,明矾不能杀菌消毒,A错误;氢氧化铝受热分解生成耐高
2
温材料氧化铝,覆盖在可燃物表面,可以实现阻燃作用,B正确;NaCO水解显碱性,可以除去废
2 3
钢材表面油污,NHCl水解显酸性,可以除去铁锈,C正确;氧化银受热分解可生成金属银,熔融
4
态 NaCl电解可生成金属钠,D正确。
7.【答案】 D
【解析】 +6价 Cr在碱性溶液中的存在形式为 CrO2-,A错误;Al(OH)可溶于强碱,不溶于
4 3
NH·HO,B错误;SO2-酸性歧化生成 S和 SO,C错误;向 Ba(OH)溶液中滴加 NHHSO,沉
3 2 2 3 2 2 4 4
淀完全时二者1∶1反应,生成 BaSO、NH·HO和 HO,D正确。
4 3 2 2
8.【答案】 C
【解析】 [18]轮烯属于烃,不溶于水,密度比水小,A正确;轮烯具有共轭双键结构,所有原子
可能共平面,B正确;[18]轮烯的分子式为 C H ,完全燃烧生成 CO和 HO的物质的量之比为
18 18 2 2
2∶1,C错误;与足量氢气加成后生成环十八烷,与环丙烷互为同系物,D正确。
9.【答案】 A
【解析】 反应过程中,Br元素化合价有升高也有降低,Br既作氧化剂又作还原剂,A正确;化合
2
价升高与降低的 Br的物质的量之比为1∶5,B错误;不知气体摩尔体积,不能计算 6.72LCO的
2 2
【高三化学参考答案 (第 1页 共6页)】
书书书物质的量,C错误;向 NaBr和 NaBrO混合溶液中加酸,可得 Br,D错误。
3 2
10.【答案】 C
【解析】 铜丝与浓硝酸反应生成红棕色气体 NO,A正确;NO 溶于水生成硝酸,可使紫色石蕊
2 2
试液变红,B正确;NO 溶于水生成的硝酸具有氧化性,可将 Fe2+氧化为 Fe3+,②处棉花颜色由
2
浅绿色变为黄色,体现了硝酸的氧化性,C错误;NaOH吸收 NO 和 NO尾气是氧化还原反应,D
2
正确。
11.【答案】 B
【解析】 根据四种元素的成键特点可知,X、Y、Z、W可分别形成1个、4个、2个、2个共价键,结
合 W和 Z同主族且质子数二倍关系,可以确定 X、Y、Z、W分别是 H、C、O、S。核外电子层数越
多原子半径越大,同周期元素核电荷数越大原子半径越小,原子半径:S>C>O>H,A错误;H
2
O有分子间氢键沸点最高,HS的相对分子质量大于 CH,沸点 HS高于 CH,则沸点 HO>H
2 4 2 4 2 2
S>CH,B正确;S和 C的含氧酸种类较多,非最高价含氧酸无法比较其酸性,C错误;甲和乙都
4
是共价化合物,C、O、S都满足8电子稳定结构,H不满足,D错误。
12.【答案】 D
【解析】 路路通酸中含有6个甲基,连在同一碳上的两个甲基化学环境相同,A错误;羧基能
发生酯化反应,碳碳双键能发生氧化反应,不能发生消去反应,B错误;酮羰基和碳碳双键均可
与 H加成,羧基不与 H 加成,故 1mol该有机物可与 2molH加成,C错误;六元环上共有 12
2 2 2
种 H,即一氯代物有12种,D正确。
13.【答案】 A
【解析】 醋酸与 NaOH滴定终点溶质为 CHCOONa,溶液呈碱性,甲基橙指示剂不能准确指示
3
滴定终点,A错误;Zn作原电池负极可以保护 Fe不被腐蚀,Fe电极区溶液检验不到 Fe2+,B正
确;将草酸溶液加热,草酸电离程度增大,pH减小,C正确;AgCl的 K 较大,等体积的饱和溶液
sp
中 Cl-的物质的量大于 Br-,生成沉淀的物质的量 AgCl>AgBr,D正确。
14.【答案】 C
【解析】 放电时,电极 A发生还原反应,作原电池正极,A错误;放电时,阳离子移向正极,应向
电极 A迁移,B错误;充电时,电极 B作阴极,发生还原反应 Zn2+ +2e-Zn,C正确;1mol
Zn2+过膜时,电路中转移2mol电子,充电时有2mol二茂铁被氧化,D错误。
15.【答案】 C
【解析】 由反应历程可知,苯酚和水的总能量低于 HO和苯的总能量,苯与 HO反应生成苯
2 2 2 2
OH
師師 師師 師師
酚是放热反应,A正确;反应历程中存在帨帨 +HO+O→帨帨 +HO,即帨帨 +O→
師師 2 師師 2 師師
OH
師師
帨帨 ,B正确;第一步和第二步中使用 PdNa+催化剂产物能量更高,不稳定,C错误;使用 Pd
師師
Na+催化剂后,每一步的活化能均比使用催化剂 Pd低,反应速率加快,单位时间内可生成更多
苯酚,D正确。
16.【答案】 D
【解析】 随着 NH浓度增大,含铜微粒由 Cu2+逐渐生成[Cu(NH)]2+,a、b、c、d、e曲线分别
3 3 4
对应 Cu2+、[Cu(NH)]2+、[Cu(NH)]2+、[Cu(NH)]2+、[Cu(NH)]2+,A正确;方程式相
3 3 2 3 3 3 4
【高三化学参考答案 (第 2页 共6页)】加,平衡常数相乘,Cu2++4NH幑帯帯幐[Cu(NH)]2+可由 K、K、K、K对应的反应相加得到,则
3 3 4 1 2 3 4
K =K·K·K·K,B正确;c(NH) =10-3mol·L-1即 lgc(NH) =-3时,由图可知
稳 1 2 3 4 3 3
c{[Cu(NH)]2+}=c{[Cu(NH)]2+}>c{[Cu(NH)]2+},C正确;M点是曲线 b和 e的交
3 3 3 3 4
点,c{[Cu(NH)]2+} =c{[Cu(NH)]2+},K·K·K =c-3(NH),即 lgc(NH) =
3 3 4 2 3 4 3 3
lgK +lgK +lgK
- 2 3 4,D错误。
3
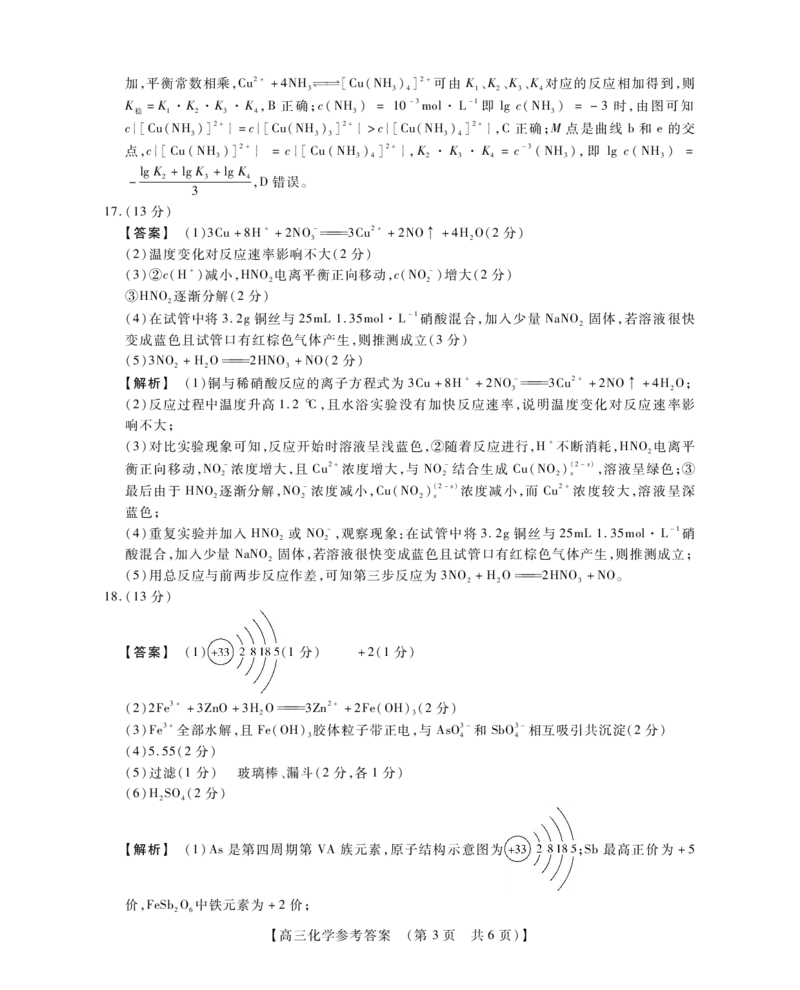
17.(13分)
【答案】 (1)3Cu+8H++2NO-3Cu2++2NO↑ +4HO(2分)
3 2
(2)温度变化对反应速率影响不大(2分)
(3)②c(H+)减小,HNO电离平衡正向移动,c(NO-)增大(2分)
2 2
③HNO逐渐分解(2分)
2
(4)在试管中将3.2g铜丝与25mL1.35mol·L-1硝酸混合,加入少量 NaNO 固体,若溶液很快
2
变成蓝色且试管口有红棕色气体产生,则推测成立(3分)
(5)3NO +HO2HNO +NO(2分)
2 2 3
【解析】 (1)铜与稀硝酸反应的离子方程式为3Cu+8H++2NO-3Cu2++2NO↑ +4HO;
3 2
(2)反应过程中温度升高1.2℃,且水浴实验没有加快反应速率,说明温度变化对反应速率影
响不大;
(3)对比实验现象可知,反应开始时溶液呈浅蓝色,②随着反应进行,H+不断消耗,HNO电离平
2
衡正向移动,NO-浓度增大,且 Cu2+浓度增大,与 NO-结合生成 Cu(NO)(2-x),溶液呈绿色;③
2 2 2 x
最后由于 HNO逐渐分解,NO-浓度减小,Cu(NO)(2-x)浓度减小,而 Cu2+浓度较大,溶液呈深
2 2 2 x
蓝色;
(4)重复实验并加入 HNO 或 NO-,观察现象:在试管中将 3.2g铜丝与 25mL1.35mol·L-1硝
2 2
酸混合,加入少量 NaNO 固体,若溶液很快变成蓝色且试管口有红棕色气体产生,则推测成立;
2
(5)用总反应与前两步反应作差,可知第三步反应为3NO +HO2HNO +NO。
2 2 3
18.(13分)
【答案】 (1) (1分) +2(1分)
(2)2Fe3++3ZnO+3HO3Zn2++2Fe(OH)(2分)
2 3
(3)Fe3+全部水解,且 Fe(OH)胶体粒子带正电,与 AsO3-和 SbO3-相互吸引共沉淀(2分)
3 4 4
(4)5.55(2分)
(5)过滤(1分) 玻璃棒、漏斗(2分,各1分)
(6)HSO(2分)
2 4
【解析】 (1)As是第四周期第 VA族元素,原子结构示意图为 ;Sb最高正价为 +5
价,FeSbO中铁元素为 +2价;
2 6
【高三化学参考答案 (第 3页 共6页)】(2)Fe3+水解生成H+,促进ZnO溶解生成Zn2+,离子方程式为2Fe3++3ZnO+3HO3Zn2++
2
2Fe(OH);
3
(3)pH=5~5.2时 Fe3+完全水解成 Fe(OH)胶体,且胶体粒子带正电,可以与阴离子 AsO3-和
3 4
SbO3-吸引共沉淀;
4
K [Zn(OH)]
(4)c(Zn2+)=1mol·L-1时,开始生成 Zn(OH) 2 时 c(OH-) = 槡 sp c(Zn2+) 2 =
1.2×10-17 1 1
槡 = 槡12×10-9mol·L-1,pOH=-lgc(OH-) =9- lg12=9- (lg3+2lg2)
1 2 2
=8.45,pH=14-pOH =5.55;
(5)酸浸后分离出滤渣的实验操作是过滤,实验室进行此操作时用到的玻璃仪器有烧杯、玻璃
棒、漏斗;
(6)电解 ZnSO溶液后,废电解液中含有 HSO可以循环使用。
4 2 4
19.(13分)
【答案】 (1)CH(g)+CO(g)幑帯帯幐2CO(g)+2H(g) ΔH =+193.3kJ·mol-1(2分)
4 2 2
大于(1分)
(2)①恒压体系加入无关气体可以降低反应物分压,促使主反应平衡正向移动,提高反应物的
转化率(2分)
②50%(2分) 1.4(2分)
(3)AD(2分,各1分)
(4)CH -8e-+10OH-CO2-+7HO(2分)
4 3 2
【解析】 (1)CH和 CO反应生成 H和 CO的热化学方程式为 CH(g)+CO(g)幑帯帯幐2CO(g)+
4 2 2 4 2
2H(g) ΔH = +193.3kJ·mol-1,ΔH>0即反应物的总键能大于生成物的总键能;
2
(2)①恒压体系加入无关气体相当于增大体积,对于气体分子数增大的反应,可以降低反应物
分压,促使平衡正向移动,提高转化率;
②设 CH和 CO初始投料各1mol,平衡转化率分别是60%和80%,可知二者分别消耗 0.6mol
4 2
和0.8mol,列出三段式:
主反应:CH(g)+CO(g)幑帯帯幐2CO(g)+2H(g)
4 2 2
转化量(mol) 0.6 0.6 1.2 1.2
副反应:CO(g)+H(g)幑帯帯幐CO(g)+HO(g)
2 2 2
转化量(mol) 0.2 0.2 0.2 0.2
平衡时,容器中有 n(CO)=1-0.6-0.2=0.2mol,n(H)=1.2-0.2=1mol,n(CH)=1-
2 2 4
0.6=0.4mol,n(CO)=1.2+0.2=1.4mol,和3molAr,理论 H产量为2mol,则 H的平衡产率
2 2
c(CO)×c(HO) n(CO)×n(HO) 1.4×0.2
为50%;副反应是气体分子数不变的反应,K= 2 = 2 = =
c(CO)×c(H) n(CO)×n(H) 0.2×1
2 2 2 2
1.4;
(3)反应过程中有非极性键的生成,没有断裂,A错误;由机理图可知,e-从 Ce原子转移到 W,
再转移到吸附在氧空位的 CO分子上,B正确;h+和 Rh附近的晶格氧结合,促进沉积在 Rh上
2
的 C快速被消耗移除,可以减少积碳,C正确;CO解离后在氧空位留下氧原子,可以迁移到新
2
的氧空位上,从而形成氧化还原循环,催化剂含氧量不变,D错误。
(4)碱性甲烷燃料电池负极的电极反应为 CH -8e-+10OH- CO2-+7HO。
4 3 2
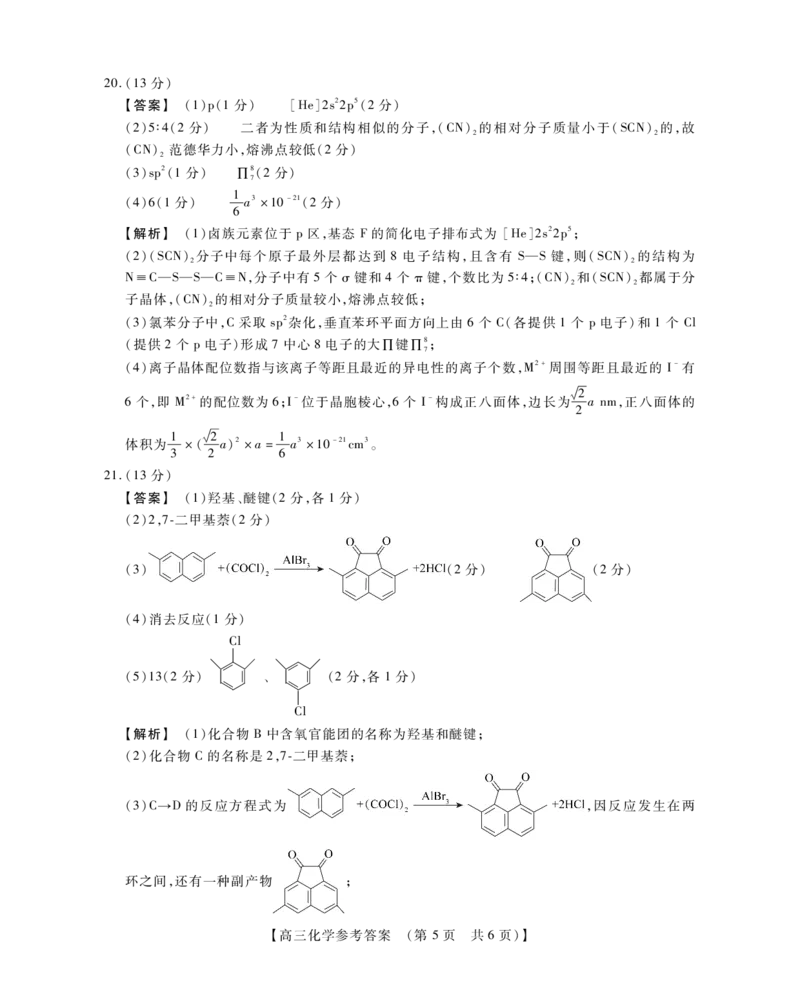
【高三化学参考答案 (第 4页 共6页)】20.(13分)
【答案】 (1)p(1分) [He]2s22p5(2分)
(2)5∶4(2分) 二者为性质和结构相似的分子,(CN)的相对分子质量小于(SCN)的,故
2 2
(CN) 范德华力小,熔沸点较低(2分)
2
(3)sp2(1分) ∏8(2分)
7
1
(4)6(1分) a3×10-21(2分)
6
【解析】 (1)卤族元素位于 p区,基态 F的简化电子排布式为 [He]2s22p5;
(2)(SCN)分子中每个原子最外层都达到 8电子结构,且含有 S—S键,则(SCN)的结构为
2 2
N≡C—S—S—C≡N,分子中有5个 σ键和4个 π键,个数比为5∶4;(CN)和(SCN)都属于分
2 2
子晶体,(CN)的相对分子质量较小,熔沸点较低;
2
(3)氯苯分子中,C采取 sp2杂化,垂直苯环平面方向上由6个 C(各提供 1个 p电子)和 1个 Cl
(提供2个 p电子)形成7中心8电子的大∏键∏8;
7
(4)离子晶体配位数指与该离子等距且最近的异电性的离子个数,M2+周围等距且最近的 I-有
6个,即 M2+的配位数为6;I-位于晶胞棱心,6个 I-构成正八面体,边长为
槡2
anm,正八面体的
2
体积为
1
×(
槡2
a)2×a=
1
a3×10-21cm3。
3 2 6
21.(13分)
【答案】 (1)羟基、醚键(2分,各1分)
(2)2,7二甲基萘(2分)
(3) (2分) (2分)
(4)消去反应(1分)
Cl
師師 師師
(5)13(2分) 帪帪 、 帪帪 (2分,各1分)
師師 師師
Cl
【解析】 (1)化合物 B中含氧官能团的名称为羟基和醚键;
(2)化合物 C的名称是2,7二甲基萘;
(3)C→D的反应方程式为 ,因反应发生在两
环之间,还有一种副产物 ;
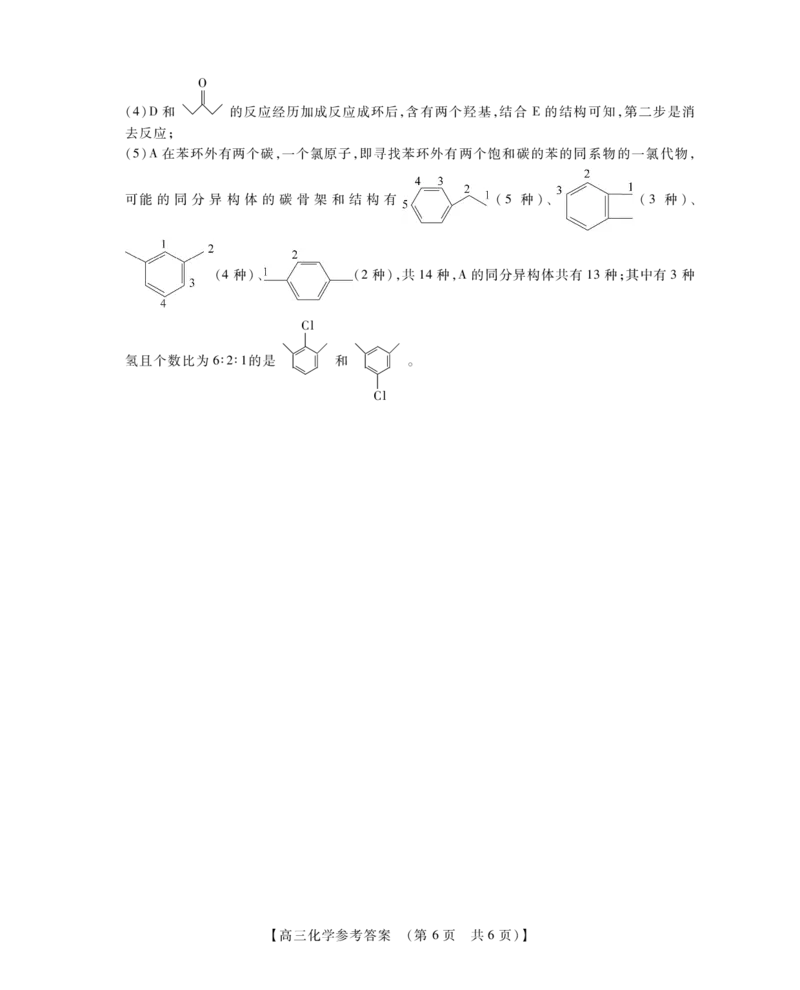
【高三化学参考答案 (第 5页 共6页)】(4)D和
【高三化学参考答案 (第 6页 共6页)】
O
的反应经历加成反应成环后,含有两个羟基,结合 E的结构可知,第二步是消
去反应;
(5)A在苯环外有两个碳,一个氯原子,即寻找苯环外有两个饱和碳的苯的同系物的一氯代物,
可能 的 同 分 异 构 体 的 碳 骨 架 和 结 构 有 (5种)、 (3种)、
(4种)、 (2种),共14种,A的同分异构体共有13种;其中有3种
Cl
師師 師師
氢且个数比为6∶2∶1的是 帪帪 和 帪帪 。
師師 師師
Cl