文档内容
绝密★启用前
化学参考答案
1.【答案】B
【解析】
A项,纸的主要成分是纤维素,属于有机高分子材料;
B项,香油的主要成分是油脂,不是有机高分子材料;
C项,刺绣中的“线”有棉麻的,主要成分是纤维素,属于有机高分子材料,也有是丝毛的,主要成分是
蛋白质,也属于有机高分子材料;
D项,“藤”的主要成分是纤维素,属于有机高分子材料。
2.【答案】C
【解析】
AB项,淀粉和纤维素都属于有机高分子,通式都是(C H O ) ,n值不同,故他们不互为同分异构体,AB
6 10 5 n
项正确;
C项,绿色植物的光合作用是在酶作用下进行的,二氧化碳进行淀粉合成,存在能量利用效率低、周期长
的特点。科学家使用催化剂使CO 合成淀粉除了步骤更少,还具有更高的能量转化效率与合成速度,因酶
2
与催化剂不同,故二者原理不同,C项错误;
D项,人工合成淀粉可对气候变化、粮食安全等人类面临的挑战提供解决手段,D项正确。
3.【答案】A
【解析】
A项,SiO 是酸性氧化物,但能与氢氟酸反应,A项错误;
2
B项,“水玻璃”是硅酸钠溶液,可由SiO 与氢氧化钠溶液反应制得,B项正确;
2
C项,普通玻璃的主要成分是硅酸钠、硅酸钙和二氧化硅,二氧化硅在高温下与碳酸钠反应生成硅酸钠和
二氧化碳,C项正确;
高温
D项,“从沙滩到用户”是工业上制取粗硅的反应原理,即SiO +2C Si(粗硅)+2CO↑,D项正确。
2
4.【答案】D
【解析】
A项,一个醋酸分子中含3个C-H键,1mol冰醋酸中C-H键数目为3N ,A项错误;
A
B项,标准状况下,HF呈液态,B项错误;
C项,Cl 溶解度小,不能完全溶于水,并且发生的反应也不彻底,所以22.4LCl(标准状况)通入1L水中,
2 2
转移的电子数远小于N ,C项错误;
A
化学参考答案 第 1 页(共 7 页)D项,生成lmolNH ,转移电子数等于3N ,D项正确。
3 A
5.【答案】B
【解析】
A项,随着反应进行,浓硫酸变稀,稀硫酸不与铜反应,A项错误;
B项,把铜丝换成亚硫酸钠,不加热,发生反应:Na
2
SO
3
+H
2
SO
4
(浓)===Na
2
SO
3
+SO
2
↑+H
2
O,也可以制备
二氧化硫气体,完成同样的实验,B项正确;
C项,石蕊试液变红但不褪色,说明二氧化硫的水溶液有酸性,二氧化硫不能漂白紫色石蕊试液,不能证
明二氧化硫没有漂白性,C项错误;
D项,品红溶液褪色,证明二氧化硫具有漂白性,若把品红溶液换成高锰酸钾溶液,高锰酸钾溶液紫色褪
去,可以验证二氧化硫的还原性,不是验证二氧化硫的相同性质,D项错误。
6.【答案】D
【解析】
A项,中子数为20的氯原子的质量数是20+17=37,可表示为37Cl,A项错误;
B项,钠离子结构示意图中核电荷数是11,核外电子总数是10,B项错误;
C项,CO 分子中C原子是sp杂化,直线型分子,C项错误;
2
D项,NaClO是离子化合物,电子式书写正确,D项正确。
7.【答案】B
【解析】根据结构式中成键关系,结合信息可推测X、Y、Z、W分别是H、O、F、S。
A项,原子半径:O>F,A项错误;
B项,常温下,水为液态,而H S为气态,沸点:H O>H S,B项正确;
2 2 2
C项,H SO 不是强酸,C项错误;
2 3
D项,非金属性:SH CO >HClO>HCO -,所以通入等物质的量的氯气,与水反应产生HCl和HClO,只有
2 3 3
HCl与碳酸钠反应生成碳酸氢钠,B项正确;
C项,亚硫酸钙溶于盐酸,该反应不能发生,C项错误;
D项,向H O 溶液中滴加少量FeCl ,Fe3+作催化剂,促进双氧水分解,D项正确。
2 2 3
13.【答案】D
【解析】
A项,玻璃棒中含有钠元素,有干扰,A项错误;
B项,需要测定同浓度的NaHX与NaY溶液的pH,B项错误;
化学参考答案 第 3 页(共 7 页)C项,酸性高锰酸钾溶液是用硫酸酸化的,溶液中原来有SO2,C项错误;
4
D项,若溶液变为红色,说明反应具有可逆性,D项正确。
14.【答案】D
【解析】
A项,通过表中数据可知,温度升高,NO的转化率先升高后降低,温度较低时反应较慢,因为温度不连
续,不能确定300℃时,是否为平衡状态,但可以确定400-500℃时一定为平衡状态,此时温度越高,NO
的转化率越低,即升温平衡逆向移动,则该反应是放热反应,ΔH<0,A项正确,D项错误;
B项,200℃时,反应没有达到平衡,延长反应时间能提高NO的转化率,B项正确;
C项,恒压条件下,O 的浓度增加,则NO的浓度减小,反应速率会减小,相同时间内NO的转化率有可
2
能会降低,C项正确。
15.【答案】B
【解析】
A项,电极X上CH CH OH氧化生成CH COOH,电极X是负极,A项正确;
3 2 3
B项,每1molCH CH OH被氧化,则有4mol电子转移,故当有0.001molCH CH OH反应,理论上有
3 2 3 2
0.004mol电子通过外电路,B项错误;
C项,正极上发生O 得电子生成H O的反应,C项正确;
2 2
D项,H+向正极迁移,即质子通过交换膜从左往右迁移,D项正确。
16.【答案】D
【解析】
A项,D点溶质为Na A,D点之后,碱过量,抑制水的电离,A项错误;
2
B项,V(NaOH溶液)=30mL 时生成NaHA和Na A的混合溶液,且两者物质的量之比是 1:1,根据H A
2 2
的pK =-lgK =7.2知,A2-的水解程度大于HA-的电离程度,使得c(HA-)>c(A2-), 而图中C点pH=7.2, 根
a2 a2
据HA-的电离表达式及pK =7.2推得c(HA-)>c(A2-),前后矛盾,B项错误;
a2
C项,图中B点恰好完全反应生成NaHA,溶液呈酸性,说明HA-的电离程度大于其水解程度,即c(A2-)>
c(H A),C项错误;
2
D项,图中D点恰好完全反应生成Na A,A2-发生水解反应:A2-+H O HA-+OH-,c(OH-)= K w mol/L,
2 2
10
a
K K w c(HA )c(OH ) , D 点时,c(A2-)≈ 0.1 mol/L,则 c(HA-)= 0.1 mol/L×10-a÷10-7.2= = 1 ×106.2-amol/L,D
h K a2 c(A2 ) 3 3 3
项正确。
17.(13分)
【答案】(1)bd(2分)
化学参考答案 第 4 页(共 7 页)△
(2)①MnO +4HCl(浓) MnCl +Cl ↑+2H O(2分)
2 2 2 2
②饱和NaCl溶液(1分) NaOH溶液(1分)
③取少量溶液于试管中,加入少量淀粉溶液,若溶液变蓝,说明有单质碘生成(2分)
过量的Cl 将滤液中的碘单质氧化(2分)
2
(3)2NO
2
+2I-+4H+ ===2NO↑+I
2
+2H
2
O(2分)
(4)254(1分)
【解析】(1)灼烧在坩埚中进行,因此用到的仪器有bd。
(2)②Cl 中的HCl杂质,可用饱和NaCl溶液除去;多余的Cl ,用NaOH溶液吸收。
2 2
③用淀粉溶液检验碘单质;不含碘单质,是因为Cl 将溶液中的I 氧化了,其反应方程式是:5Cl +I +
2 2 2 2
6H
2
O===2HIO
3
+10HCl。
3.010 6mol2127gmol 1
(4)ω(I)= 103g/kg103mg/g254mg/kg。
3g
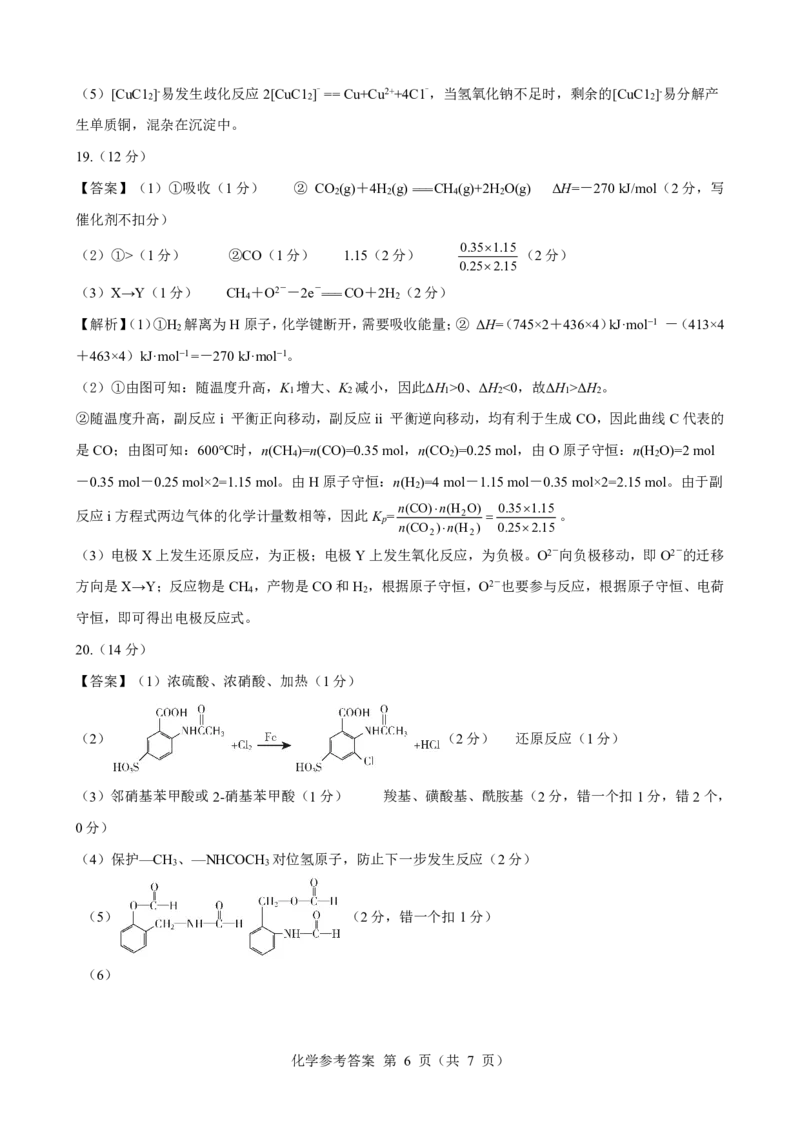
18.(13 分)
【答案】(1)沉淀Cu2+生成Cu(OH) (1分) 取代[CuCl ]-中Cl-生成CuOH(2分)
2 2
(2)取最后一次洗涤液少许于试管中,滴加少量硝酸银溶液,若无白色沉淀生成,则证明沉淀已洗涤干净
(2分)
(3)稀盐酸(1分) 蒸发浓缩(1分)
(4)0.25mol(1分) N H ·H O+4CuC1 +8NaOH==2Cu O+N ↑+8NaCl+7H O(2分)
2 4 2 2 2 2 2
(5)Cu或单质铜(1分) [CuC1 ]-易发生歧化反应 2[CuC1 ]-==Cu+Cu2++4C1-(2分)
2 2
【解析】铜离子在水溶液中是以配合物离子形式存在的,很难表现出氧化性,一般是将其转化为氢氧化铜
表现弱氧化性,根据流程图中铜离子的价态变化,可知水合肼做还原剂,氧化产物应该为氮气。根据已知
条件CuOH不稳定,易失水,2CuOH==Cu O+H O,所以首先由[CuC1 ]-转化为CuOH,再失水生成 Cu O 。
2 2 2 2
(1)第一次氢氧化钠溶液作用是沉淀Cu2+生成Cu(OH) ,第二次作用是取代[CuCl ]-中Cl-生成CuOH。
2 2
(2)根据反应原理,沉淀主要附着NaCl,所以验证是否洗涤干净,需要检验氯离子的存在,取最后一次
洗涤液少许于试管中,滴加少量硝酸银溶液,若无白色沉淀生成,则证明沉淀已洗涤干净。
(3)滤液中含有过量的氢氧化钠,所以需要加稀盐酸中和,从而提高氯化钠的纯度,从氯化钠溶液中提取
氯化钠,需要蒸发浓缩至少量溶液,用余热蒸干,得氯化钠固体,所以操作为蒸发浓缩。
(4)1molN H ·H O~1molN ~4mole-,1molCuC1 ~1mol[CuCl ]-~1mole-,所以每生成1mol[CuCl ]-消耗水合肼
2 4 2 2 2 2 2
的物质的量为0.25mol。反应物为氯化铜、水合肼、氢氧化钠,产物为氧化亚铜、氯化钠和水,氧化产物
为氮气,所以总反应方程式为N H ·H O+4CuC1 +8NaOH==2Cu O+N +8NaCl+7H O 。
2 4 2 2 2 2 2
化学参考答案 第 5 页(共 7 页)(5)[CuC1 ]-易发生歧化反应2[CuC1 ]-==Cu+Cu2++4C1-,当氢氧化钠不足时,剩余的[CuC1 ]-易分解产
2 2 2
生单质铜,混杂在沉淀中。
19.(12分)
【答案】(1)①吸收(1分) ② CO
2
(g)+4H
2
(g)===CH
4
(g)+2H
2
O(g) ΔH=-270kJ/mol(2分,写
催化剂不扣分)
0.351.15
(2)①>(1分) ②CO(1分) 1.15(2分) (2分)
0.252.15
(3)X→Y(1分) CH
4
+O2--2e- ===CO+2H
2
(2分)
【解析】(1)①H 解离为H原子,化学键断开,需要吸收能量;② ΔH=(745×2+436×4)kJ·mol−1 -(413×4
2
+463×4)kJ·mol−1=-270kJ·mol−1。
(2)①由图可知:随温度升高,K 增大、K 减小,因此ΔH >0、ΔH <0,故ΔH >ΔH 。
1 2 1 2 1 2
②随温度升高,副反应i 平衡正向移动,副反应ii 平衡逆向移动,均有利于生成CO,因此曲线C代表的
是CO;由图可知:600℃时,n(CH )=n(CO)=0.35mol,n(CO )=0.25mol,由O原子守恒:n(H O)=2mol
4 2 2
-0.35mol-0.25mol×2=1.15mol。由H原子守恒:n(H )=4mol-1.15mol-0.35mol×2=2.15mol。由于副
2
n(CO)n(H O) 0.351.15
反应i方程式两边气体的化学计量数相等,因此K = 2 。
p
n(CO )n(H ) 0.252.15
2 2
(3)电极X上发生还原反应,为正极;电极Y上发生氧化反应,为负极。O2-向负极移动,即O2-的迁移
方向是X→Y;反应物是CH ,产物是CO和H ,根据原子守恒,O2-也要参与反应,根据原子守恒、电荷
4 2
守恒,即可得出电极反应式。
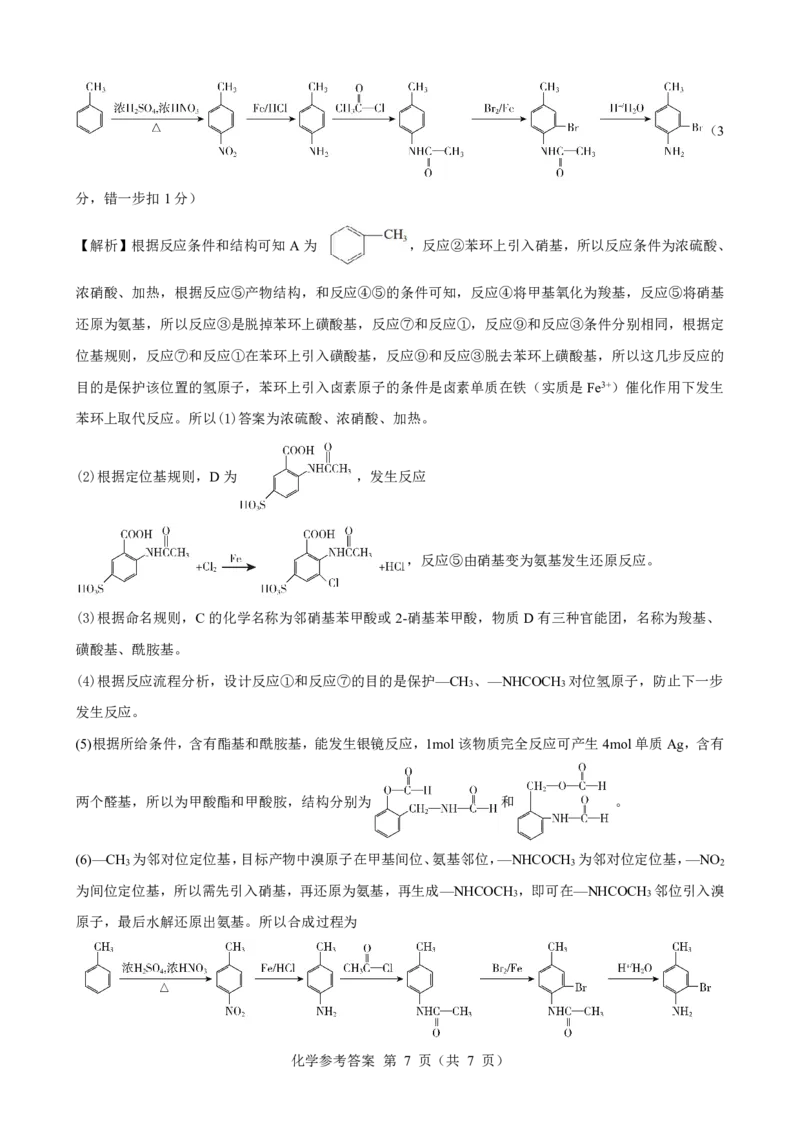
20.(14分)
【答案】(1)浓硫酸、浓硝酸、加热(1分)
(2) (2分) 还原反应(1分)
(3)邻硝基苯甲酸或2-硝基苯甲酸(1分) 羧基、磺酸基、酰胺基(2分,错一个扣1分,错2个,
0分)
(4)保护—CH 、—NHCOCH 对位氢原子,防止下一步发生反应(2分)
3 3
(5) (2分,错一个扣1分)
(6)
化学参考答案 第 6 页(共 7 页)(3
分,错一步扣1分)
【解析】根据反应条件和结构可知A为 ,反应②苯环上引入硝基,所以反应条件为浓硫酸、
浓硝酸、加热,根据反应⑤产物结构,和反应④⑤的条件可知,反应④将甲基氧化为羧基,反应⑤将硝基
还原为氨基,所以反应③是脱掉苯环上磺酸基,反应⑦和反应①,反应⑨和反应③条件分别相同,根据定
位基规则,反应⑦和反应①在苯环上引入磺酸基,反应⑨和反应③脱去苯环上磺酸基,所以这几步反应的
目的是保护该位置的氢原子,苯环上引入卤素原子的条件是卤素单质在铁(实质是Fe3+)催化作用下发生
苯环上取代反应。所以(1)答案为浓硫酸、浓硝酸、加热。
(2)根据定位基规则,D为 ,发生反应
,反应⑤由硝基变为氨基发生还原反应。
(3)根据命名规则,C的化学名称为邻硝基苯甲酸或2-硝基苯甲酸,物质D有三种官能团,名称为羧基、
磺酸基、酰胺基。
(4)根据反应流程分析,设计反应①和反应⑦的目的是保护—CH 、—NHCOCH 对位氢原子,防止下一步
3 3
发生反应。
(5)根据所给条件,含有酯基和酰胺基,能发生银镜反应,1mol该物质完全反应可产生4mol单质Ag,含有
两个醛基,所以为甲酸酯和甲酸胺,结构分别为 和 。
(6)—CH 为邻对位定位基,目标产物中溴原子在甲基间位、氨基邻位,—NHCOCH 为邻对位定位基,—NO
3 3 2
为间位定位基,所以需先引入硝基,再还原为氨基,再生成—NHCOCH ,即可在—NHCOCH 邻位引入溴
3 3
原子,最后水解还原出氨基。所以合成过程为
化学参考答案 第 7 页(共 7 页)