文档内容
牡丹江二中 2023—2024 学年度第一学期高三第二次阶段性考试
化学
考生注意:
1.本试卷分第 I 卷(选择题)和第Ⅱ卷(非选择题)两部分。满分 100分,考试时间 75分钟。
2.答题前,考生务必将密封线内项目填写清楚。考生作答时,请将答案答在答题卡上。必须在
题号所指示的答题区域作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
...........................
3.本试卷主要命题范围:必修第一册第一章、第二章。
4.可能用到的相对原子质量:H1 C12 N14 O16 Na23 S32 Cu64
第I 卷(选择题 共45分)
一、选择题(本题包括15小题,每小题 3分,共 45分。每小题只有一个选项符合题意)
1.化学与生活、科学、技术、社会、环境密切相关,下列说法正确的是
A.高温结构陶瓷、醋酸纤维、光导纤维都属于新型无机非金属材料
B.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
C.明矾净水的原理是水解出的氢氧化铝能凝聚水中的悬浮物、吸附色素并杀菌消毒
D.用飞机播撒AgI是实现人工增雨的方法之一
2.下列说法正确的是
A.HD、CuSO ·5H O都是化合物
4 2
B.浊液、胶体、溶液三种分散系的本质区别是分散质微粒直径的大小不同
C.NaHSO 在溶液中能电离出H+,所以NaHSO 是酸
4 4
D.由同种元素组成的物质一定是纯净物
3.下列叙述不
.
涉
.
及
.
氧化还原反应的是
A.碳素钢表面在潮湿空气中形成铁锈
B.泡沫灭火器中NaHCO 和Al SO
3 2 4 3
C.工业上以氢气和氯气为原料制备盐酸
D.《赋得古原草送别》中“野火烧不尽”涉及的变化
4.下列说法正确的是
A.同温同压下甲烷和氧气的密度之比为2:1
B.1g甲烷和1g氧气的原子数之比为5:1
C.等物质的量的甲烷和氧气的质量之比为2:1
D.在标准状况下等质量的甲烷和氧气的体积之比为1:2
5.用N 表示阿伏加德罗常数的值,下列叙述正确的是
A
A.标准状况下,22.4LH O含有的分子数为N
2 A
B.0.5mol·L-1的MgCl 溶液中含有的Cl-数为N
2 A
学科网(北京)股份有限公司C.通常状况下,N 个CO 分子占有的体积为22.4L
A 2
D.常温常压下,1.06gNa CO 含有的Na+数为0.02N
2 3 A
6.下列反应的离子方程式正确的是
A.铁与盐酸反应:2Fe6H 2Fe3 3H
2
B.FeSO 溶液在空气中变黄色:4Fe2 O 4H 4Fe3 2H O
4 2 2
C.向在NH HSO 溶液中缓缓滴入含等物质的量的NaOH溶液:NH OH NH H O
4 4 4 3 2
D.磁性氧化铁溶于盐酸:Fe O 8H 3Fe3 4H O
3 4 2
7.下列各组离子在指定溶液中一定能大量共存的是
A.能使甲基橙变红的溶液:Na+、NH、NO、CO2
4 3 3
B.加入苯酚显紫色的溶液:K+、NH、Cl-、SCN-
4
c
H
C.常温下, 11014的溶液:K+、Na+、AlO、HCO
c
OH 2 3
D.澄清透明的溶液:Cu2+、NH、NO、SO2
4 3 4
8.含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co O 6ClF 6CoF 3Cl 4X。
3 4 3 3 2
下列有关该反应的说法,正确的是
A.X与O 互为同位素 B.ClF 中氯元素为-3价
3 3
C.Co O 在反应中作氧化剂 D.1molCo O 参加反应转移9mol电子
3 4 3 4
9.在CuCl 溶液中逐滴加入过量KI溶液可能发生以下反应
2
反应I:2Cu2 4I 2CuI白色I
2
反应Ⅱ:2Cu2 2Cl 2I 2CuCl白色I
2
下列说法正确的是
A.反应I属于复分解反应
B.每生成1molI ,反应Ⅱ中转移4mol电子
2
C.CuI与NaOH溶液反应,产物可能只有CuO、NaI和H O
2
D.滴KI溶液前向溶液中加入一定量的苯能更好地观察白色沉淀
10.实验室可在酸性条件下用草酸还原法制备CIO ,反应原理为H C O ClO X CO ClO Y 。
2 2 2 4 3 2 2
其中微粒Y及其系数为
A.2H O B.2H+ C.6H O D.4H+
2 2
学科网(北京)股份有限公司11. NH S O 具有强氧化性,在酸性溶液中,可将Mn2+氧化为MnO,但一般情况下,该反应进行非常
4 2 2 8 4
缓慢,而加入AgNO
3
溶液后,混合液迅速变为紫红色。下列说法不
.
正
.
确
.
的是
A.AgNO 为该反应的催化剂
3
B.该反应中的还原产物为SO2
4
C.反应中氧化剂与还原剂物质的量之比为2:5
D.S O2中-1价O与-2价O的个数比为1:3
2 8
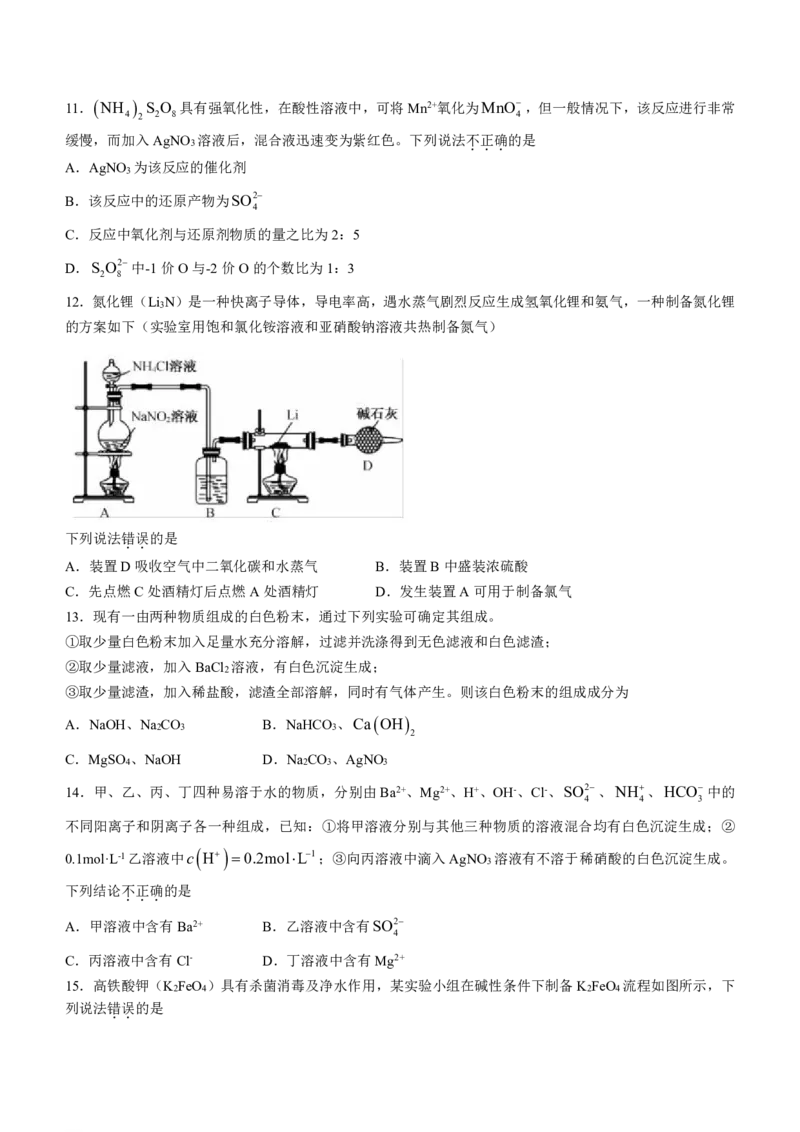
12.氮化锂(Li N)是一种快离子导体,导电率高,遇水蒸气剧烈反应生成氢氧化锂和氨气,一种制备氮化锂
3
的方案如下(实验室用饱和氯化铵溶液和亚硝酸钠溶液共热制备氮气)
下列说法错误的是
..
A.装置D吸收空气中二氧化碳和水蒸气 B.装置B中盛装浓硫酸
C.先点燃C处酒精灯后点燃A处酒精灯 D.发生装置A可用于制备氯气
13.现有一由两种物质组成的白色粉末,通过下列实验可确定其组成。
①取少量白色粉末加入足量水充分溶解,过滤并洗涤得到无色滤液和白色滤渣;
②取少量滤液,加入BaCl 溶液,有白色沉淀生成;
2
③取少量滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生。则该白色粉末的组成成分为
A.NaOH、Na CO B.NaHCO 、Ca OH
2 3 3
2
C.MgSO 、NaOH D.Na CO 、AgNO
4 2 3 3
14.甲、乙、丙、丁四种易溶于水的物质,分别由Ba2+、Mg2+、H+、OH-、Cl-、SO2、NH、HCO中的
4 4 3
不同阳离子和阴离子各一种组成,已知:①将甲溶液分别与其他三种物质的溶液混合均有白色沉淀生成;②
0.1mol·L-1乙溶液中c H 0.2molL1;③向丙溶液中滴入AgNO 溶液有不溶于稀硝酸的白色沉淀生成。
3
下列结论不正确的是
...
A.甲溶液中含有Ba2+ B.乙溶液中含有SO2
4
C.丙溶液中含有Cl- D.丁溶液中含有Mg2+
15.高铁酸钾(K FeO )具有杀菌消毒及净水作用,某实验小组在碱性条件下制备K FeO 流程如图所示,下
2 4 2 4
列说法错误的是
..
学科网(北京)股份有限公司A.1molK FeO 消毒能力相当于1.5molHClO
2 4
B.氧化反应:3NaClO2Fe NO 10NaOH 2Na FeO 3NaCl6NaNO 5H O
3 3 2 4 3 2
C.同温度时高铁酸钠溶解度大于高铁酸钾
D.提纯时,应用到的玻璃仪器有蒸发皿、玻璃棒、烧杯、酒精灯
第Ⅱ卷(非选择题 共 55分)
二、非选择题(本题包括 4小题,共 55分)
16.(14分)实验室需要配制0.1mol·L-1CuSO 溶液480mL。按下列操作步骤填上适当的文字,以使整个操作
4
完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、量筒、玻璃棒、
__________________、以及等质量的两片滤纸。
(2)计算,应选择下列_________。
A.需要CuSO 固体8.0g B.需要CuSO ·5H O晶体12.0g
4 4 2
C.需要CuSO ·5H O晶体12.5g D.需要CuSO 固体7.7g
4 2 4
(3)称量。所用砝码生锈则所配溶液的浓度会__________(填“偏高”、“偏低”或“无影响”)。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是_________。
(5)转移、洗涤。在转移时应使用_________引流,需要洗涤烧杯2~3次是为了_________。
(6)定容,摇匀。若定容时俯视刻度线,所配溶液浓度会__________(填“偏高”、“偏低”或“无影响”)。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间,溶液名称及浓度。
17.(15分)现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子
Al3+、Fe3+、Cu2+、Ba2+、K+和五种阴离子NO、OH-、Cl-、CO2、Xn(n1或2)中的一种。
3 3
(1)通过比较分析,无需检验就可判断其中必有的两种物质是__________和_________。
(2)物质C中含有离子Xn。为了确定Xn,现将(1)中的两种物质记为A和B,当C与A的溶液混合时
产生白色沉淀,继续加入过量A溶液白色沉淀部分溶解,然后将沉淀中滴入足量稀HCl,白色沉淀不溶解,
则C为__________(填化学式)。写出部分白色沉淀溶解的离子方程式:_________。
(3)将19.2gCu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H SO ,Cu逐渐溶解,管口附近有红
2 4
棕色气体出现,则物质D一定含有上述离子中的_________(填相应的离子符号),写出Cu溶解的离子方程式:
_________,若要将Cu完全溶解,至少加入H SO 的物质的量是__________。
2 4
(4)E溶液与氢碘酸反应时可生成使淀粉变蓝的物质,写出该反应的化学方程式为__________。
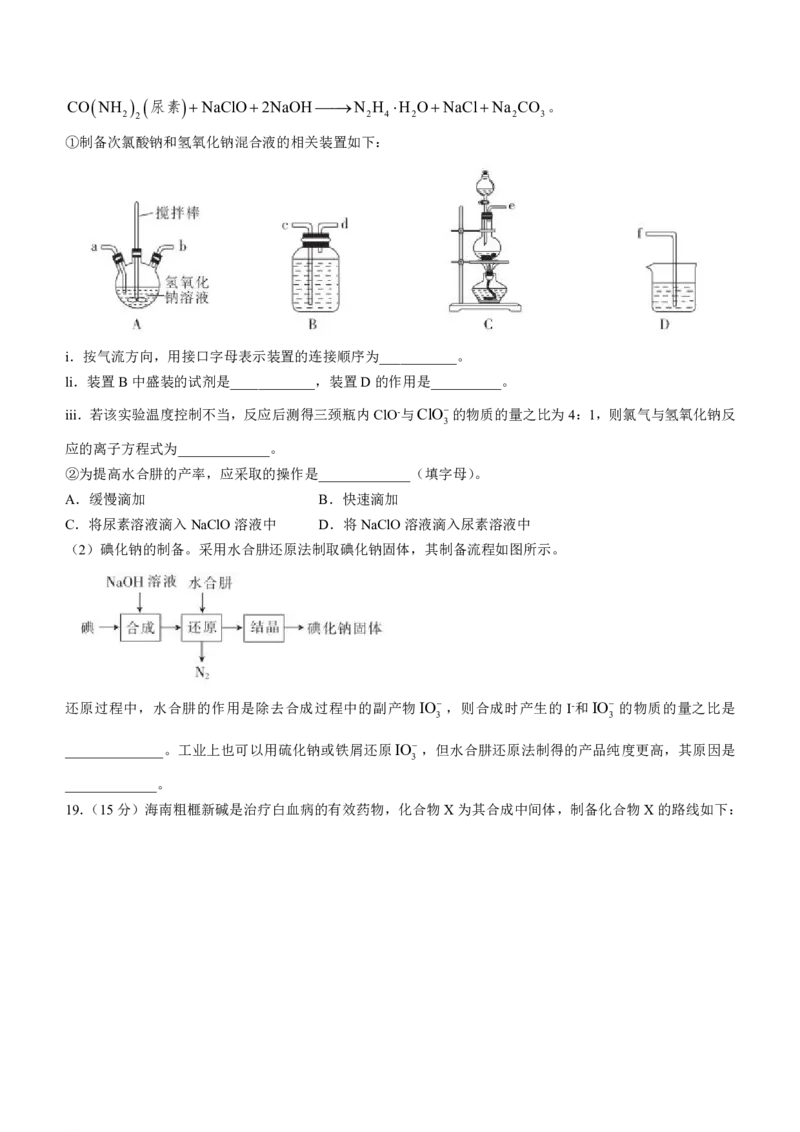
18.(14分)碘化钠是一种常用的分析试剂,也可用于医疗和照相业。某公司申请了专利:以NaOH、单质碘
和水合肼(N H ·H O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
2 4 2
(1)水合肼的制备。反应原理为
学科网(北京)股份有限公司CO NH 尿素NaClO2NaOHN H H ONaClNa CO 。
2 2 2 4 2 2 3
①制备次氯酸钠和氢氧化钠混合液的相关装置如下:
i.按气流方向,用接口字母表示装置的连接顺序为___________。
li.装置B中盛装的试剂是____________,装置D的作用是__________。
iii.若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO的物质的量之比为4:1,则氯气与氢氧化钠反
3
应的离子方程式为_____________。
②为提高水合肼的产率,应采取的操作是_____________(填字母)。
A.缓慢滴加 B.快速滴加
C.将尿素溶液滴入NaClO溶液中 D.将NaClO溶液滴入尿素溶液中
(2)碘化钠的制备。采用水合肼还原法制取碘化钠固体,其制备流程如图所示。
还原过程中,水合肼的作用是除去合成过程中的副产物IO ,则合成时产生的I-和IO 的物质的量之比是
3 3
______________。工业上也可以用硫化钠或铁屑还原IO,但水合肼还原法制得的产品纯度更高,其原因是
3
_____________。
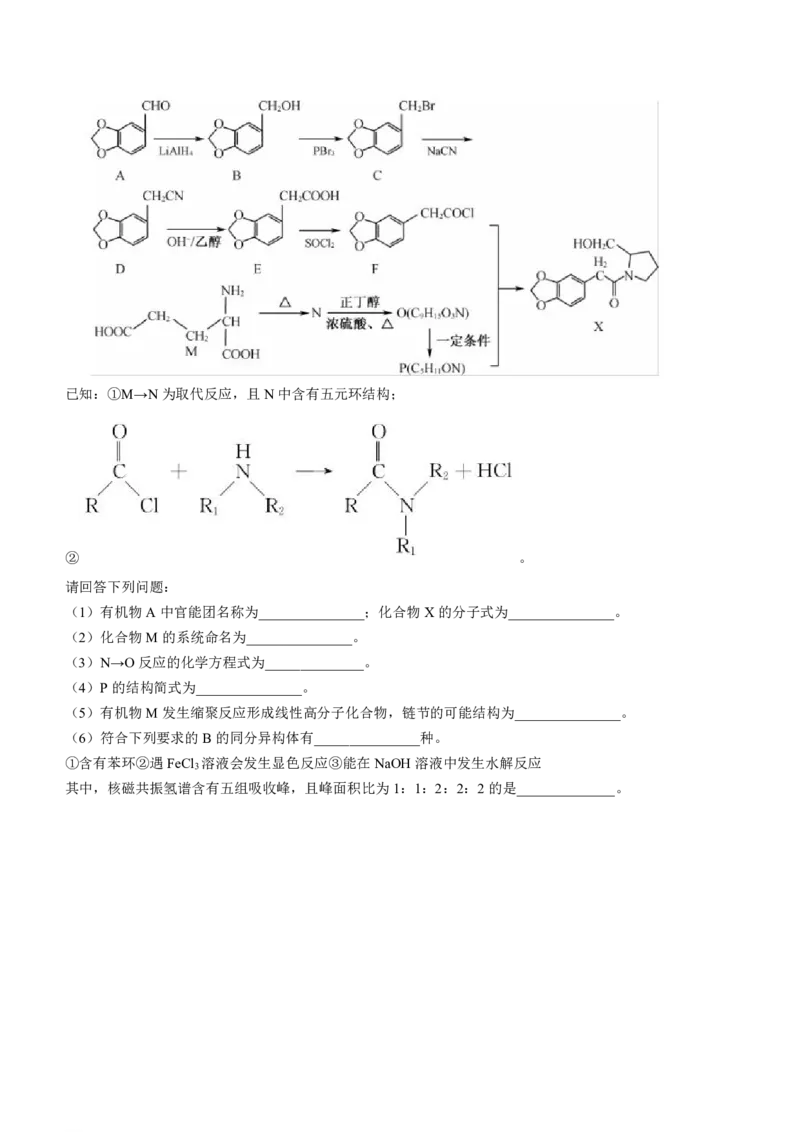
19.(15分)海南粗榧新碱是治疗白血病的有效药物,化合物X为其合成中间体,制备化合物X的路线如下:
学科网(北京)股份有限公司已知:①M→N为取代反应,且N中含有五元环结构;
② 。
请回答下列问题:
(1)有机物A中官能团名称为_______________;化合物X的分子式为_______________。
(2)化合物M的系统命名为_______________。
(3)N→O反应的化学方程式为______________。
(4)P的结构简式为_______________。
(5)有机物M发生缩聚反应形成线性高分子化合物,链节的可能结构为_______________。
(6)符合下列要求的B的同分异构体有_______________种。
①含有苯环②遇FeCl 溶液会发生显色反应③能在NaOH溶液中发生水解反应
3
其中,核磁共振氢谱含有五组吸收峰,且峰面积比为1:1:2:2:2的是______________。
学科网(北京)股份有限公司