文档内容
五年(2019-2023)年高考真题分项汇编
专题 10 水溶液中的离子反应与平衡
〖2023年高考真题〗
考点一 电离平衡
1.(2023·浙江卷)草酸( )是二元弱酸。某小组做如下两组实验:
实验I:往 溶液中滴加 溶液。
实验Ⅱ:往 溶液中滴加 溶液。
[已知: 的电离常数 ,溶液混合后体积变化忽略不
计],下列说法正确的是
A.实验I可选用甲基橙作指示剂,指示反应终点
B.实验I中 时,存在
C.实验Ⅱ中发生反应
D.实验Ⅱ中 时,溶液中
考点二 盐类的水解
2.(2023·北京卷)下列过程与水解反应无关的是
A.热的纯碱溶液去除油脂
B.重油在高温、高压和催化剂作用下转化为小分子烃
C.蛋白质在酶的作用下转化为氨基酸
D.向沸水中滴入饱和 溶液制备 胶体
考点三 沉淀溶解平衡
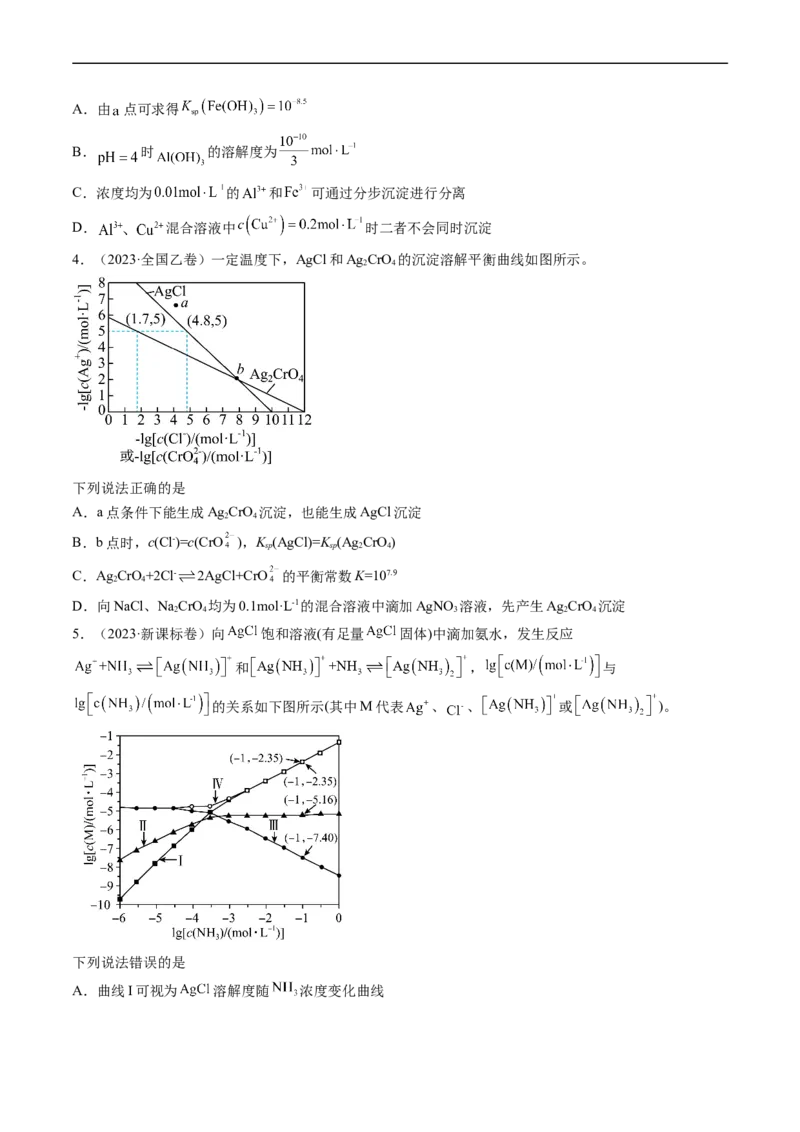
3.(2023·全国甲卷)下图为 和 在水中达沉淀溶解平衡时的 关系图(
; 可认为 离子沉淀完全)。下列叙述正确的是A.由 点可求得
B. 时 的溶解度为
C.浓度均为 的 和 可通过分步沉淀进行分离
D. 混合溶液中 时二者不会同时沉淀
4.(2023·全国乙卷)一定温度下,AgCl和Ag CrO 的沉淀溶解平衡曲线如图所示。
2 4
下列说法正确的是
A.a点条件下能生成Ag CrO 沉淀,也能生成AgCl沉淀
2 4
B.b点时,c(Cl-)=c(CrO ),K (AgCl)=K (Ag CrO)
sp sp 2 4
C.Ag CrO+2Cl- 2AgCl+CrO 的平衡常数K=107.9
2 4
D.向NaCl、NaCrO 均为0.1mol·L-1的混合溶液中滴加AgNO 溶液,先产生Ag CrO 沉淀
2 4 3 2 4
5.(2023·新课标卷)向 饱和溶液(有足量 固体)中滴加氨水,发生反应
和 , 与
的关系如下图所示(其中M代表 、 、 或 )。
下列说法错误的是
A.曲线I可视为 溶解度随 浓度变化曲线B. 的溶度积常数
C.反应 的平衡常数K的值为
D. 时,溶液中
6.(2023·辽宁卷)某废水处理过程中始终保持HS饱和,即 ,通过调节pH使 和
2
形成硫化物而分离,体系中 与 关系如下图所示,c为 和 的浓度,单位为
。已知 ,下列说法正确的是
A. B.③为 与 的关系曲线
C. D.
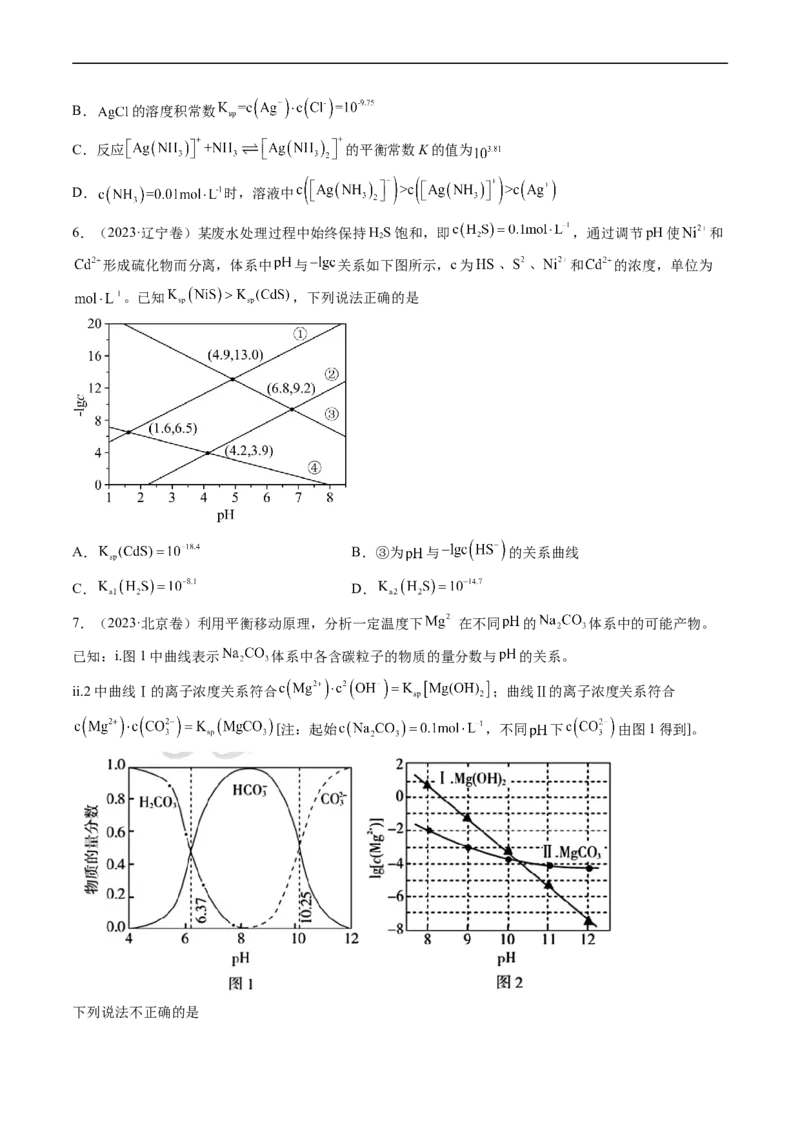
7.(2023·北京卷)利用平衡移动原理,分析一定温度下 在不同 的 体系中的可能产物。
已知:i.图1中曲线表示 体系中各含碳粒子的物质的量分数与 的关系。
ii.2中曲线Ⅰ的离子浓度关系符合 ;曲线Ⅱ的离子浓度关系符合
[注:起始 ,不同 下 由图1得到]。
下列说法不正确的是A.由图1,
B.由图2,初始状态 ,无沉淀生成
C.由图2,初始状态 ,平衡后溶液中存在
D.由图1和图2,初始状态 、 ,发生反应:
考点四 电解质溶液图像分析
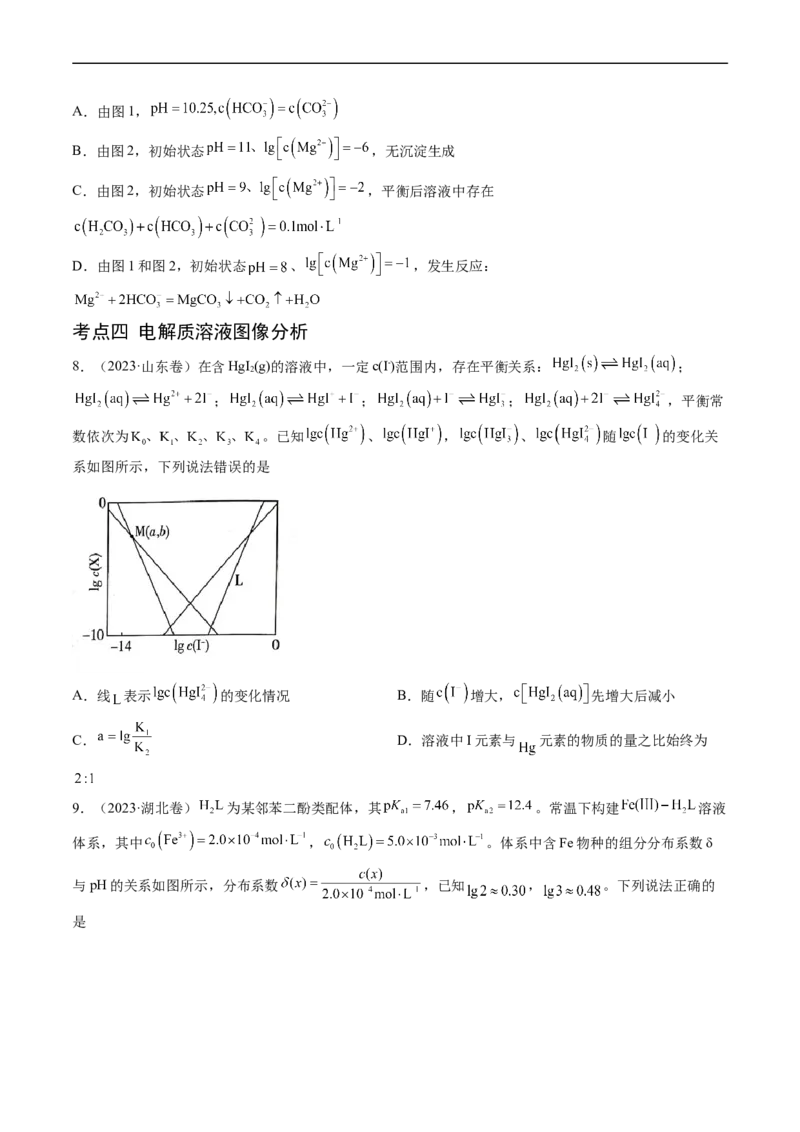
8.(2023·山东卷)在含HgI (g)的溶液中,一定c(I-)范围内,存在平衡关系: ;
2
; ; ; ,平衡常
数依次为 。已知 、 , 、 随 的变化关
系如图所示,下列说法错误的是
A.线 表示 的变化情况 B.随 增大, 先增大后减小
C. D.溶液中I元素与 元素的物质的量之比始终为
9.(2023·湖北卷) 为某邻苯二酚类配体,其 , 。常温下构建 溶液
体系,其中 , 。体系中含Fe物种的组分分布系数δ
与pH的关系如图所示,分布系数 ,已知 , 。下列说法正确的
是A.当 时,体系中
B.pH在9.5~10.5之间,含L的物种主要为
C. 的平衡常数的lgK约为14
D.当 时,参与配位的
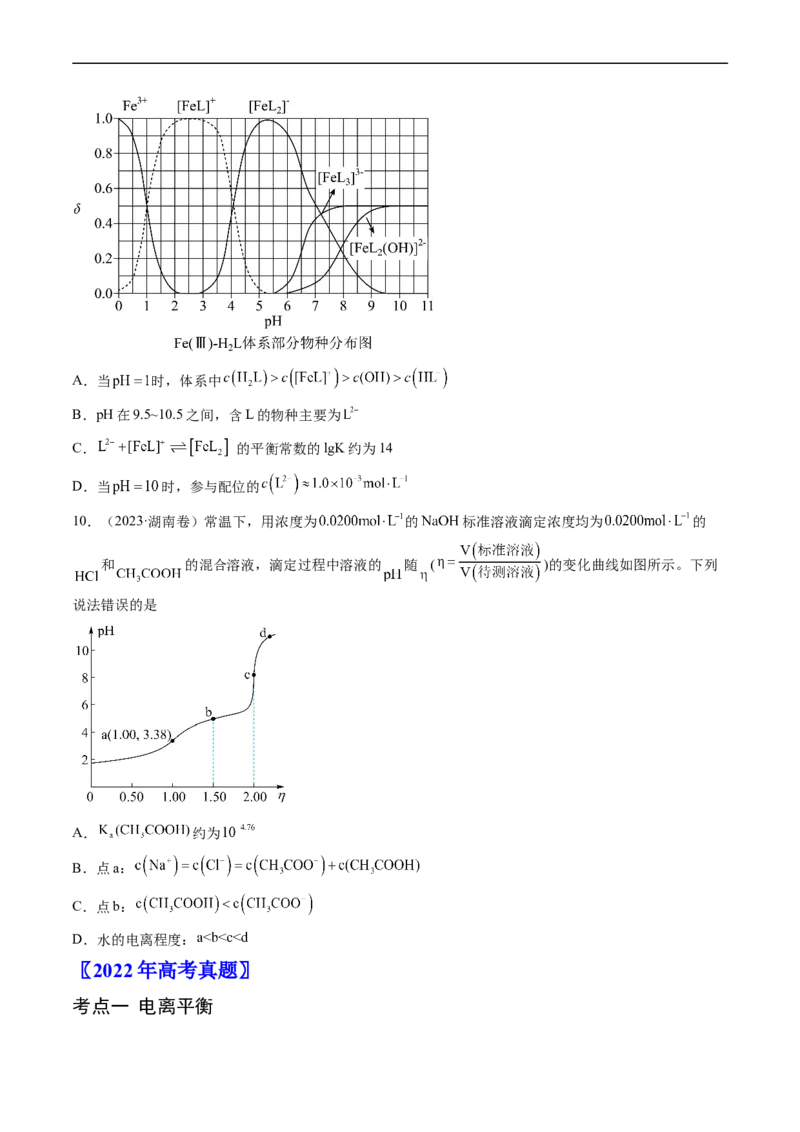
10.(2023·湖南卷)常温下,用浓度为 的 标准溶液滴定浓度均为 的
和 的混合溶液,滴定过程中溶液的 随 ( )的变化曲线如图所示。下列
说法错误的是
A. 约为
B.点a:
C.点b:
D.水的电离程度:
〖2022年高考真题〗
考点一 电离平衡11.(2022·全国乙卷)常温下,一元酸 的 。在某体系中, 与 离子不能穿过隔
膜,未电离的 可自由穿过该膜(如图所示)。
设溶液中 ,当达到平衡时,下列叙述正确的是
A.溶液Ⅰ中
B.溶液Ⅱ中的HA的电离度 为
C.溶液Ⅰ和Ⅱ中的 不相等
D.溶液Ⅰ和Ⅱ中的 之比为
12.(2022·福建卷)探究醋酸浓度与电离度 关系的步骤如下,与相关步骤对应的操作或叙述正确的
步骤 操作或叙述
A Ⅰ.用 标准溶液标定醋酸溶液浓度 滴定时应始终注视滴定管中的液面
B Ⅱ.用标定后的溶液配制不同浓度的醋酸溶液 应使用干燥的容量瓶
C Ⅲ.测定步骤Ⅱ中所得溶液的 应在相同温度下测定
D Ⅳ.计算不同浓度溶液中醋酸的电离度 计算式为
考点二 水的电离与pH计算
13.(2022·浙江卷) 时,向 浓度均为 的盐酸和醋酸的混合溶液中逐滴加入
的 溶液(酷酸的 ;用 的 溶液滴定 等浓度的盐酸,滴定终点的 突
跃范围4.3~9.7)。下列说法不正确的是
A.恰好中和时,溶液呈碱性
B.滴加 溶液至 的过程中,发生反应的离子方程式为:
C.滴定过程中,
D. 时,
考点三 盐类的水解14.(2022·北京卷)2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空
“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是
A.醋酸钠是强电解质
B.醋酸钠晶体与冰都是离子晶体
C.常温下,醋酸钠溶液的
D.该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出
15.(2022·海南卷)NaClO溶液具有添白能力,已知25℃时, 。下列关于NaClO溶
液说法正确的是
A.0.01mol/L溶液中,
B.长期露置在空气中,释放 ,漂白能力减弱
C.通入过量 ,反应的离子方程式为
D.25℃, 的NaClO和HClO的混合溶液中,
16.(2022·浙江卷) 时,苯酚 的 ,下列说法正确的是
A.相同温度下,等 的 和 溶液中,
B.将浓度均为 的 和 溶液加热,两种溶液的 均变大
C. 时, 溶液与 溶液混合,测得 ,则此时溶液中
D. 时, 的 溶液中加少量 固体,水的电离程度变小
17.(2022·江苏卷)一种捕集烟气中CO2的过程如图所示。室温下以0.1mol∙L-1KOH溶液吸收CO2,若
通入CO 所引起的溶液体积变化和HO挥发可忽略,溶液中含碳物种的浓度c =c(H CO)+c( )+c(
2 2 总 2 3
)。HCO 电离常数分别为K =4.4×10-7、K =4.4×10-11。下列说法正确的是
2 3 a1 a2
A.KOH吸收CO 所得到的溶液中:c(H CO)>c( )
2 2 3
B.KOH完全转化为KCO 时,溶液中:c(OH-)= c(H+)+c( )+c(H CO)
2 3 2 3
C.KOH溶液吸收CO,c =0.1mol∙L-1溶液中:c(H CO)>c( )
2 总 2 3
D.如图所示的“吸收”“转化”过程中,溶液的温度下降
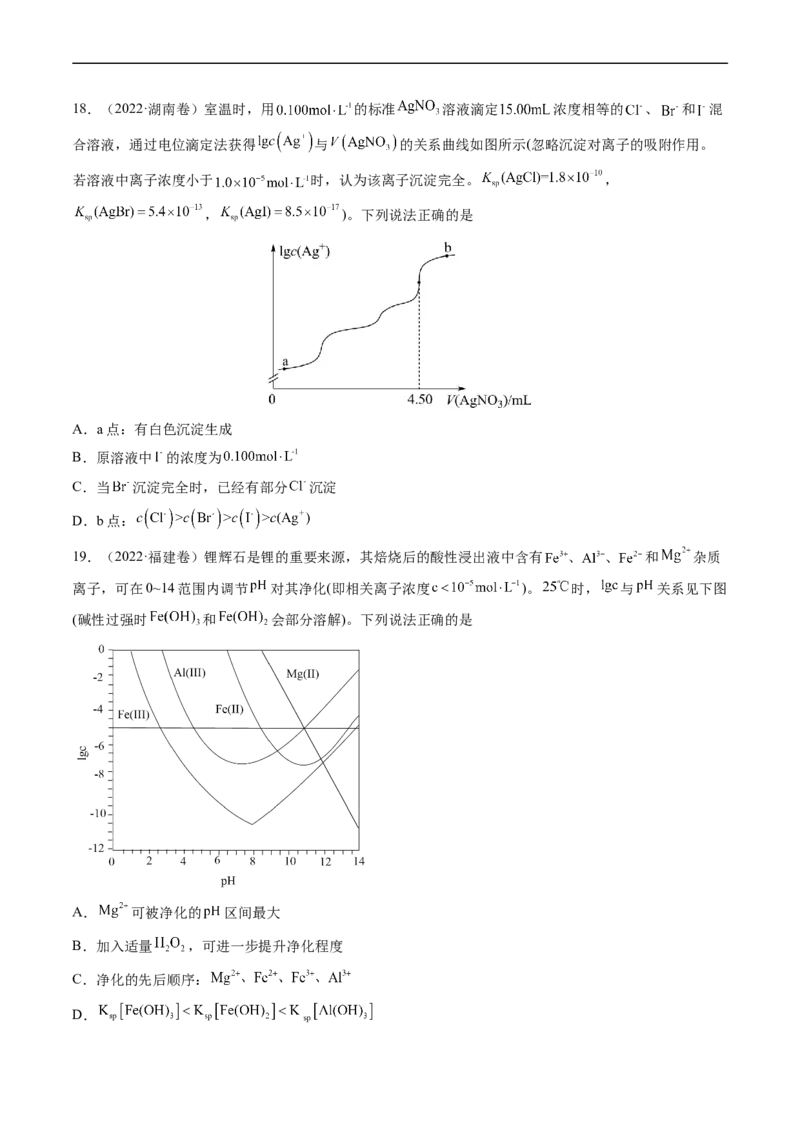
考点四 沉淀溶解平衡18.(2022·湖南卷)室温时,用 的标准 溶液滴定 浓度相等的 、 和 混
合溶液,通过电位滴定法获得 与 的关系曲线如图所示(忽略沉淀对离子的吸附作用。
若溶液中离子浓度小于 时,认为该离子沉淀完全。 ,
, )。下列说法正确的是
A.a点:有白色沉淀生成
B.原溶液中 的浓度为
C.当 沉淀完全时,已经有部分 沉淀
D.b点:
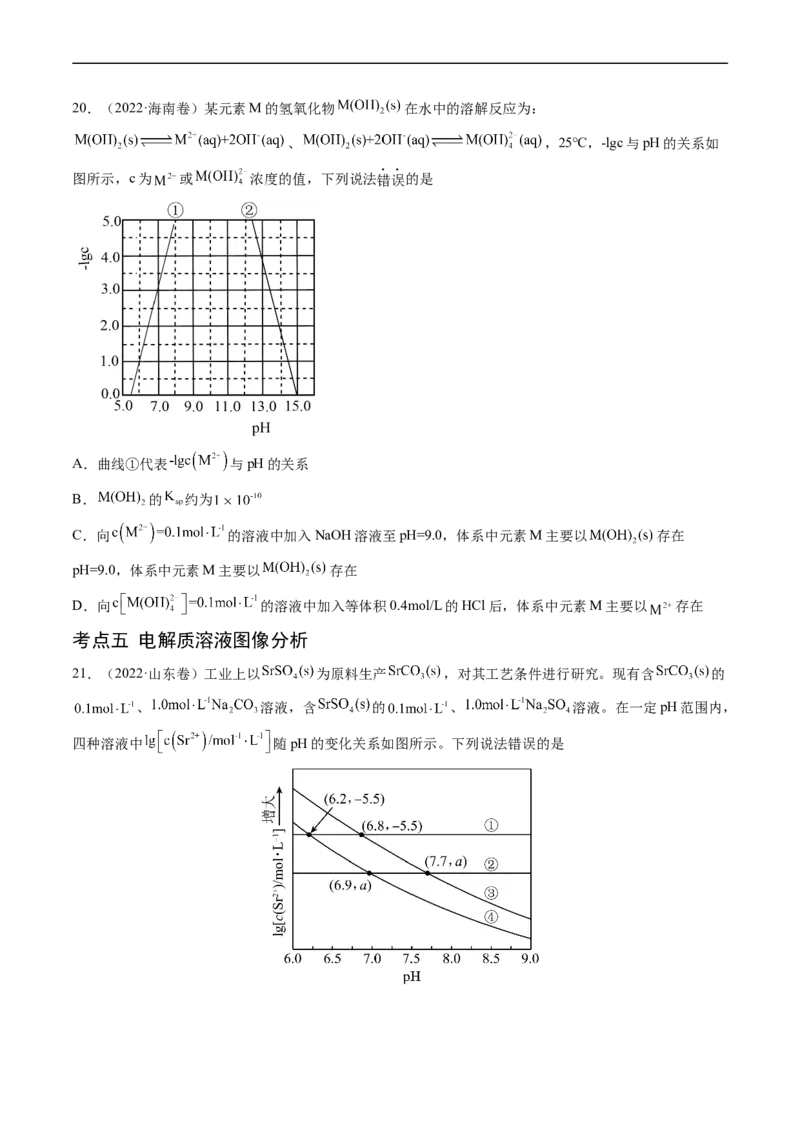
19.(2022·福建卷)锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有 和 杂质
离子,可在0~14范围内调节 对其净化(即相关离子浓度 )。 时, 与 关系见下图
(碱性过强时 和 会部分溶解)。下列说法正确的是
A. 可被净化的 区间最大
B.加入适量 ,可进一步提升净化程度
C.净化的先后顺序:
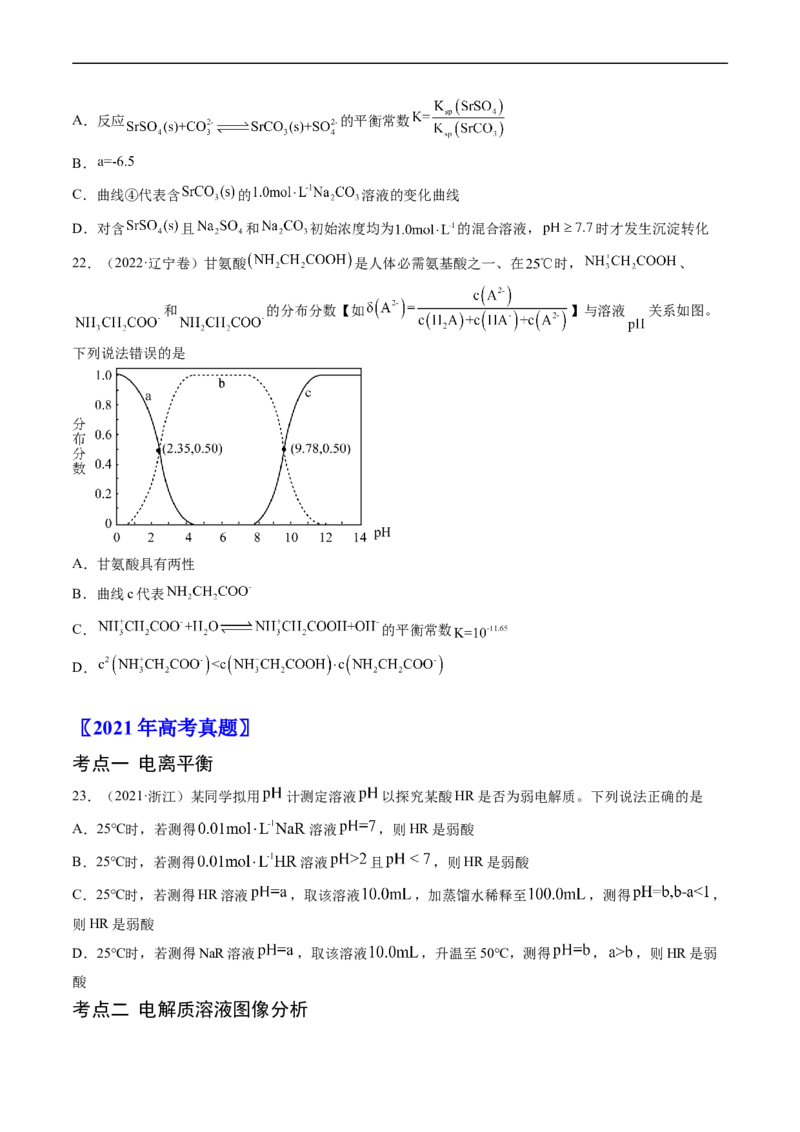
D.20.(2022·海南卷)某元素M的氢氧化物 在水中的溶解反应为:
、 ,25℃,-lgc与pH的关系如
图所示,c为 或 浓度的值,下列说法错误的是
A.曲线①代表 与pH的关系
B. 的 约为
C.向 的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以 存在
pH=9.0,体系中元素M主要以 存在
D.向 的溶液中加入等体积0.4mol/L的HCl后,体系中元素M主要以 存在
考点五 电解质溶液图像分析
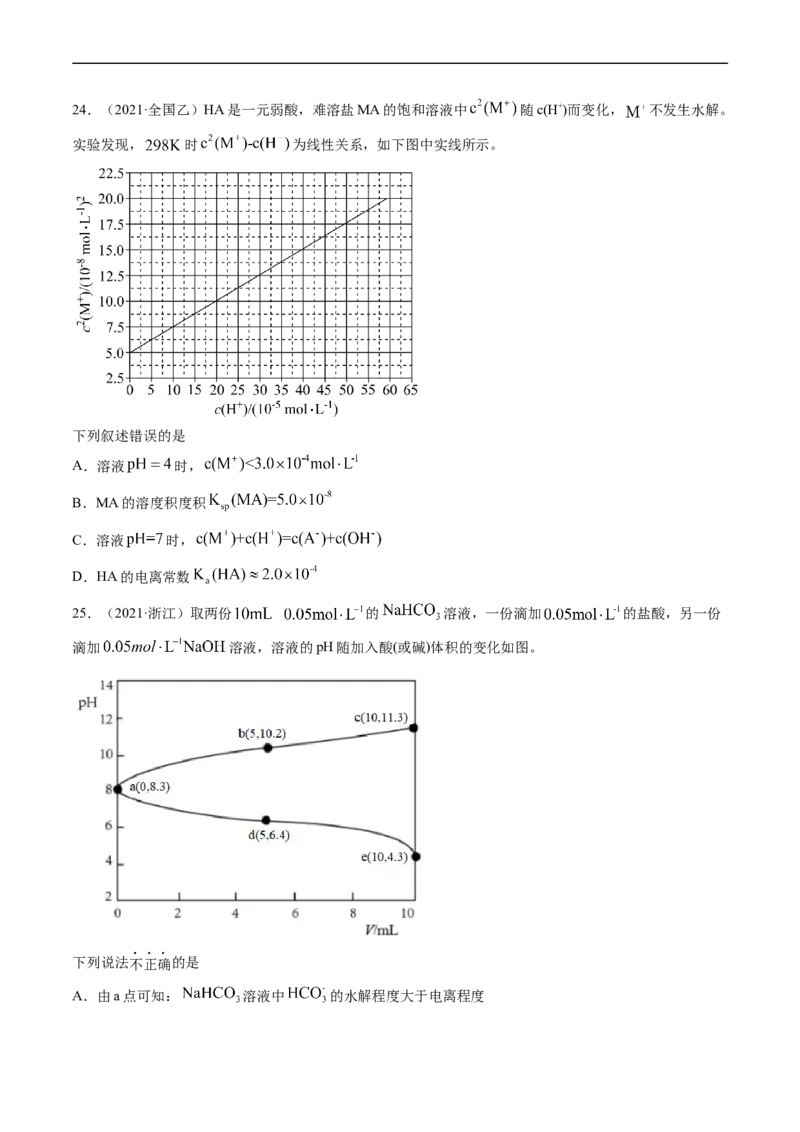
21.(2022·山东卷)工业上以 为原料生产 ,对其工艺条件进行研究。现有含 的
、 溶液,含 的 、 溶液。在一定pH范围内,
四种溶液中 随pH的变化关系如图所示。下列说法错误的是A.反应 的平衡常数
B.
C.曲线④代表含 的 溶液的变化曲线
D.对含 且 和 初始浓度均为 的混合溶液, 时才发生沉淀转化
22.(2022·辽宁卷)甘氨酸 是人体必需氨基酸之一、在 时, 、
和 的分布分数【如 】与溶液 关系如图。
下列说法错误的是
A.甘氨酸具有两性
B.曲线c代表
C. 的平衡常数
D.
〖2021年高考真题〗
考点一 电离平衡
23.(2021·浙江)某同学拟用 计测定溶液 以探究某酸HR是否为弱电解质。下列说法正确的是
A.25℃时,若测得 溶液 ,则HR是弱酸
B.25℃时,若测得 溶液 且 ,则HR是弱酸
C.25℃时,若测得HR溶液 ,取该溶液 ,加蒸馏水稀释至 ,测得 ,
则HR是弱酸
D.25℃时,若测得NaR溶液 ,取该溶液 ,升温至50℃,测得 , ,则HR是弱
酸
考点二 电解质溶液图像分析24.(2021·全国乙)HA是一元弱酸,难溶盐MA的饱和溶液中 随c(H+)而变化, 不发生水解。
实验发现, 时 为线性关系,如下图中实线所示。
下列叙述错误的是
A.溶液 时,
B.MA的溶度积度积
C.溶液 时,
D.HA的电离常数
25.(2021·浙江)取两份 的 溶液,一份滴加 的盐酸,另一份
滴加 溶液,溶液的pH随加入酸(或碱)体积的变化如图。
下列说法不正确的是
A.由a点可知: 溶液中 的水解程度大于电离程度B. 过程中: 逐渐减小
C. 过程中:
D.令c点的 ,e点的 ,则
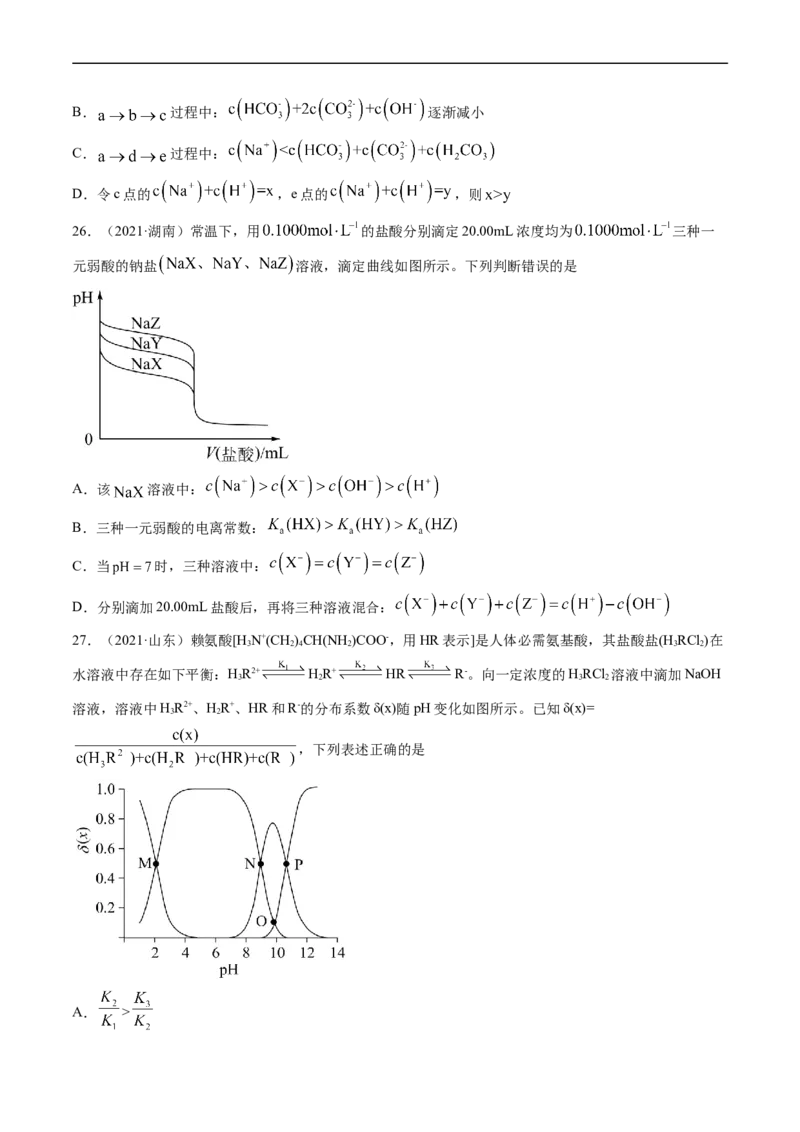
26.(2021·湖南)常温下,用 的盐酸分别滴定20.00mL浓度均为 三种一
元弱酸的钠盐 溶液,滴定曲线如图所示。下列判断错误的是
A.该 溶液中:
B.三种一元弱酸的电离常数:
C.当 时,三种溶液中:
D.分别滴加20.00mL盐酸后,再将三种溶液混合:
27.(2021·山东)赖氨酸[H N+(CH)CH(NH)COO-,用HR表示]是人体必需氨基酸,其盐酸盐(H RCl )在
3 2 4 2 3 2
水溶液中存在如下平衡:HR2+ HR+ HR R-。向一定浓度的HRCl 溶液中滴加NaOH
3 2 3 2
溶液,溶液中HR2+、HR+、HR和R-的分布系数δ(x)随pH变化如图所示。已知δ(x)=
3 2
,下列表述正确的是
A. >B.M点,c(Cl-) +c(OH-)+c(R-)=2c(H R+)+c(Na+)+c(H+)
2
C.O点,pH=
D.P点,c(Na+)>c(Cl-)>c(OH-)>c(H+)
〖2020年高考真题〗
考点一 水的电离与pH计算
28.(2020·浙江卷)下列说法不正确的是( )
A. 的盐酸中
B. 将KCl溶液从常温加热至80℃,溶液的pH变小但仍保持中性
C. 常温下,NaCN溶液呈碱性,说明HCN是弱电解质
D. 常温下,pH为3的醋酸溶液中加入醋酸钠固体,溶液pH增大
29.(2020·浙江卷)常温下,用 氨水滴定 浓度均为 的 和 的
混合液,下列说法不正确的是( )
A. 在氨水滴定前, 和 的混合液中
B. 当滴入氨水 时,
C. 当滴入氨水 时,
D. 当溶液呈中性时,氨水滴入量大于 ,
考点二 盐类的水解
30.(2020·天津卷)常温下,下列有关电解质溶液的说法错误的是
A. 相同浓度的 HCOONa和NaF两溶液,前者的pH较大,则
B. 相同浓度的CHCOOH和CHCOONa两溶液等体积混合后pH约为4.7,则溶液中
3 3
C. FeS溶于稀硫酸,而CuS不溶于稀硫酸,则
D. 在 溶液中,
31.(2020·江苏卷)室温下,将两种浓度均为 的溶液等体积混合,若溶液混合引起的体积变化
可忽略,下列各混合溶液中微粒物质的量浓度关系正确的是
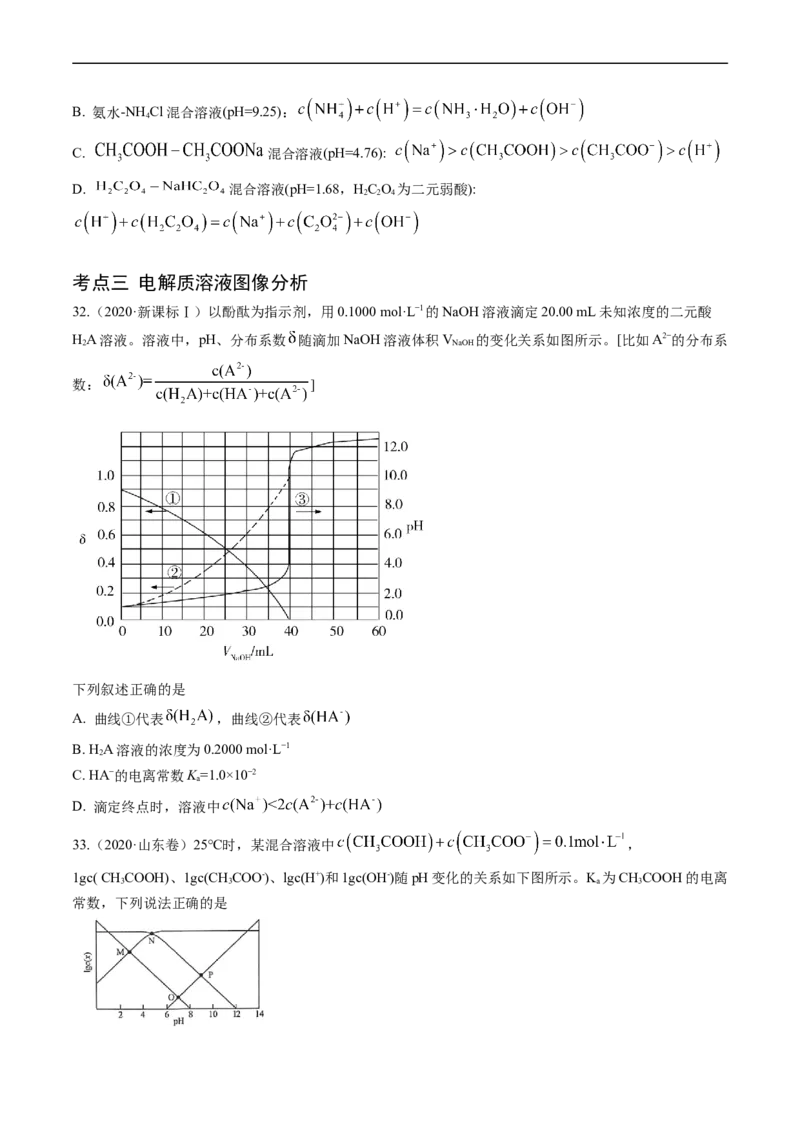
A. 混合溶液(pH=10.30):B. 氨水-NH Cl混合溶液(pH=9.25):
4
C. 混合溶液(pH=4.76):
D. 混合溶液(pH=1.68,HC O 为二元弱酸):
2 2 4
考点三 电解质溶液图像分析
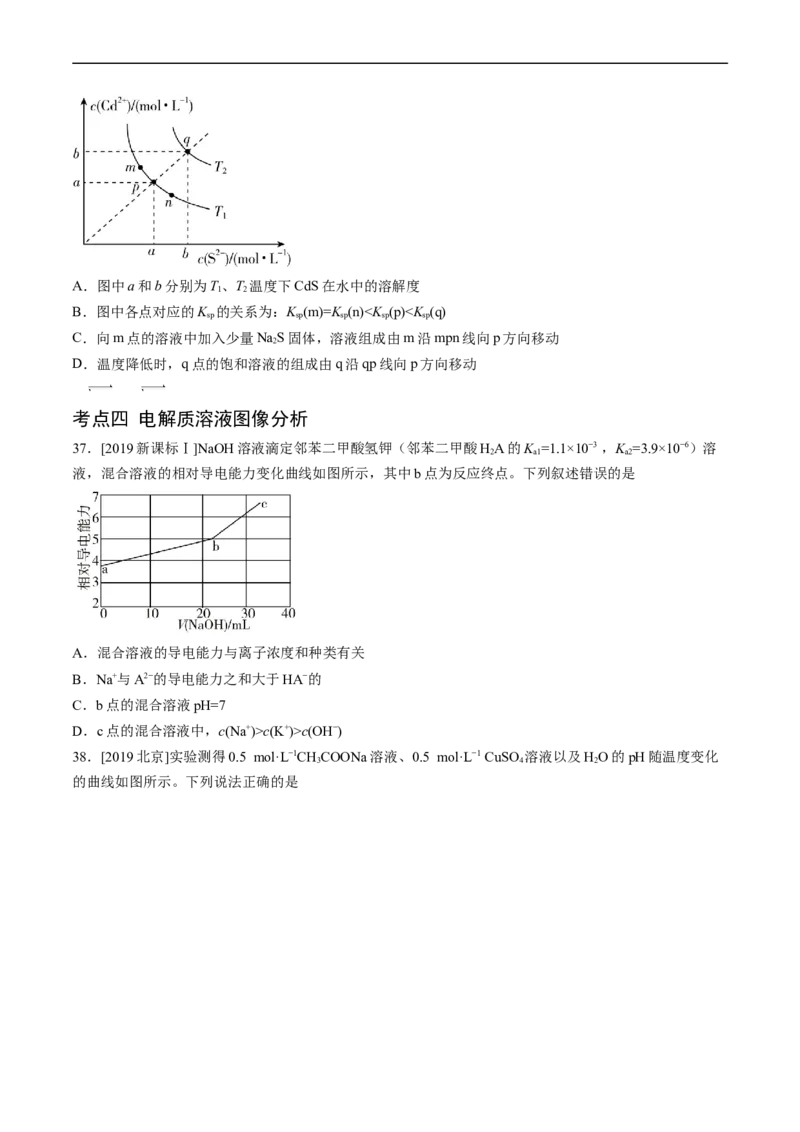
32.(2020·新课标Ⅰ)以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20.00 mL未知浓度的二元酸
HA溶液。溶液中,pH、分布系数 随滴加NaOH溶液体积V 的变化关系如图所示。[比如A2−的分布系
2 NaOH
数: ]
下列叙述正确的是
A. 曲线①代表 ,曲线②代表
B. HA溶液的浓度为0.2000 mol·L−1
2
C. HA−的电离常数K=1.0×10−2
a
D. 滴定终点时,溶液中
33.(2020·山东卷)25℃时,某混合溶液中 ,
1gc( CH COOH)、1gc(CHCOO-)、lgc(H+)和1gc(OH-)随pH变化的关系如下图所示。K 为CHCOOH的电离
3 3 a 3
常数,下列说法正确的是A. O点时,
B. N点时,
C. 该体系中,
D. pH由7到14的变化过程中, CHCOO-的水解程度始终增大
3
〖2019年高考真题〗
考点一 电离平衡
34.[2019新课标Ⅲ]设N 为阿伏加德罗常数值。关于常温下pH=2的HPO 溶液,下列说法正确的是
A 3 4
A.每升溶液中的H+数目为0.02N
A
B.c(H+)= c( )+2c( )+3c( )+ c(OH−)
C.加水稀释使电离度增大,溶液pH减小
D.加入NaH PO 固体,溶液酸性增强
2 4
考点二 盐类的水解
35.[2019江苏]室温下,反应 +H O HCO+OH−的平衡常数K=2.2×10−8。将NH HCO 溶液和
2 2 3 4 3
氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶
液中微粒物质的量浓度关系正确的是
A.0.2 mol·L−1氨水:c (NH ·H O)>c( )> c (OH−)> c (H+)
3 2
B.0.2 mol·L−1NH HCO 溶液(pH>7):c ( )> c ( )> c (H CO)> c (NH ·H O)
4 3 2 3 3 2
C.0.2 mol·L−1氨水和0.2 mol·L−1NH HCO 溶液等体积混合:c( )+c(NH ·H O)=c(H CO)+c ( )+
4 3 3 2 2 3
c( )
D.0.6 mol·L−1氨水和0.2 mol·L−1 NH HCO 溶液等体积混合:c (NH ·H O)+ c( )+ c(OH−)=
4 3 3 2
0.3 mol·L−1+ c (H CO)+ c (H+)
2 3
考点三 沉淀溶解平衡
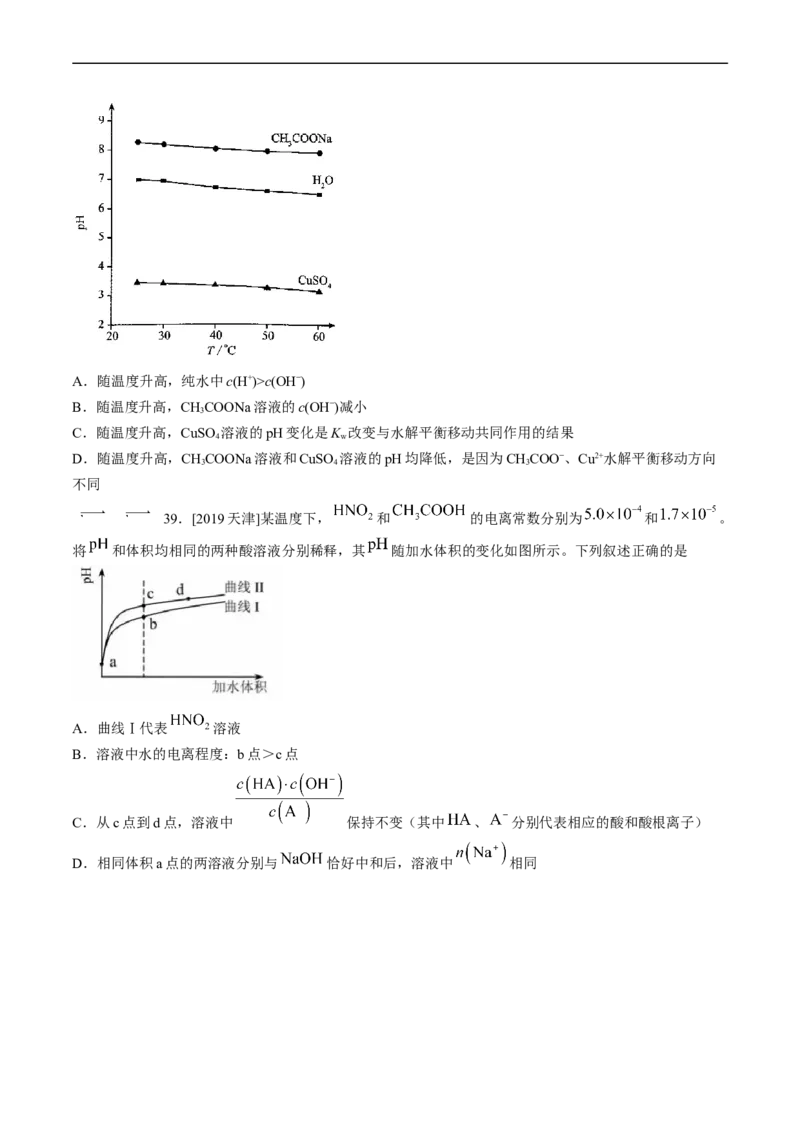
36.[2019新课标Ⅱ]绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶
于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是A.图中a和b分别为T、T 温度下CdS在水中的溶解度
1 2
B.图中各点对应的K 的关系为:K (m)=K (n)c(K+)>c(OH−)
38.[2019北京]实验测得0.5 mol·L−1CHCOONa溶液、0.5 mol·L−1 CuSO 溶液以及HO的pH随温度变化
3 4 2
的曲线如图所示。下列说法正确的是A.随温度升高,纯水中c(H+)>c(OH−)
B.随温度升高,CHCOONa溶液的c(OH−)减小
3
C.随温度升高,CuSO 溶液的pH变化是K 改变与水解平衡移动共同作用的结果
4 w
D.随温度升高,CHCOONa溶液和CuSO 溶液的pH均降低,是因为CHCOO−、Cu2+水解平衡移动方向
3 4 3
不同
39.[2019天津]某温度下, 和 的电离常数分别为 和 。
将 和体积均相同的两种酸溶液分别稀释,其 随加水体积的变化如图所示。下列叙述正确的是
A.曲线Ⅰ代表 溶液
B.溶液中水的电离程度:b点>c点
C.从c点到d点,溶液中 保持不变(其中 、 分别代表相应的酸和酸根离子)
D.相同体积a点的两溶液分别与 恰好中和后,溶液中 相同