文档内容
浙江省选考科目考试绍兴市适应性试卷(2024 年 4 月)
化学试题
注意事项:
考生考试时间90分钟,满分100分;
可能用到的相对原子质量:
一、选择题(本大题共16小题,每小题3分,共48分,每小题列出的四个备选项中只有一
个是符合题目要求的,不选、多选、错选均不得分)
1.下列物质中属于非电解质,且溶于水后能导电的是( )
A. B. C. D.蔗糖
2.工业上利用焦炭还原石英砂制备含有少量杂质的粗硅,将粗硅转化为三氯硅烷,再经氢气还原得到高纯
硅。下列说法不正确的是( )
A.石英砂的主要成分是
B.焦炭过多容易生成副产物
C.制备三氯硅烷的反应:
D.高纯硅导电性好,可用于制作计算机、通讯设备和家用电器等的芯片
3.下列表示不正确的是( )
A.硝化甘油的结构简式: B.中子数为20的氯离子:
C.2-丁烯的实验式: D. 的价层电子对互斥(VSEPR)模型:
4.关于反应 ,下列说法不正确的是( 为阿伏
加德罗常数的值)( )
A. 既是氧化产物又是还原产物 B. 中 的化合价为
C.生成22.4L 转移电子的数目为 D.该反应需要在隔绝空气的条件下进行
5.在溶液中能大量共存的离子组是( )
学科网(北京)股份有限公司A. 、 、 、 B. 、 、 、
C. 、 、 、 D. 、 、 、
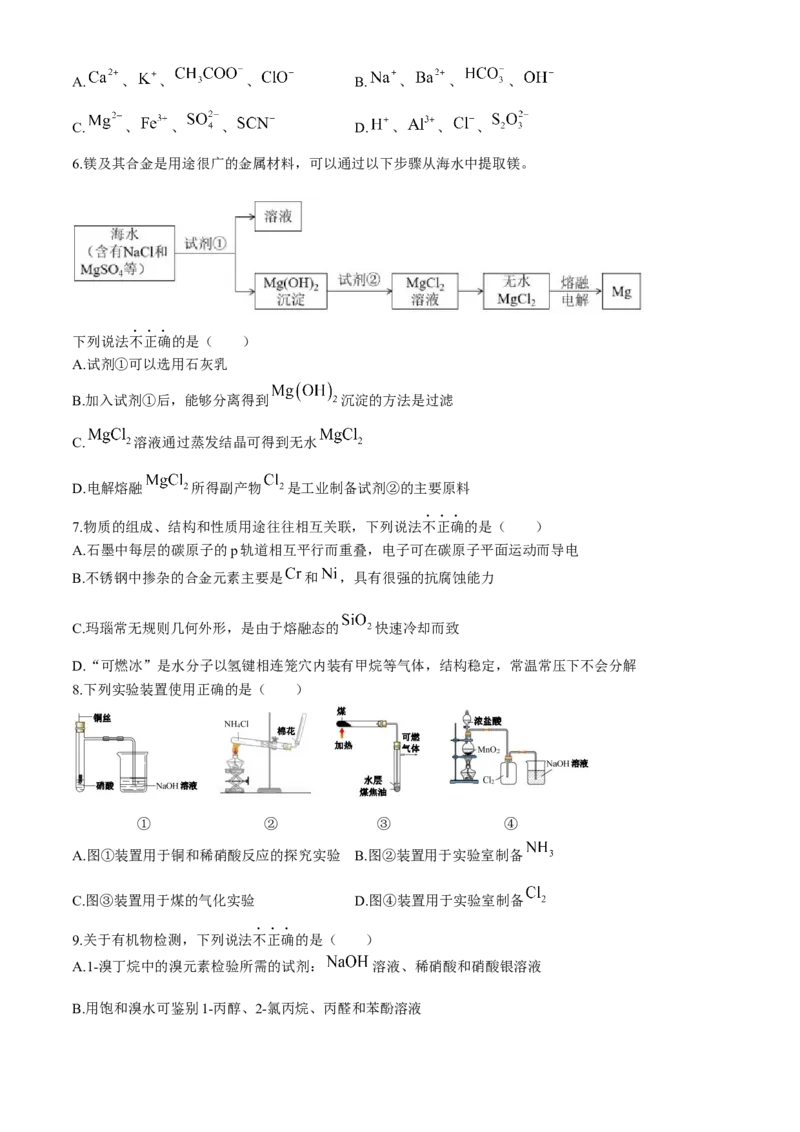
6.镁及其合金是用途很广的金属材料,可以通过以下步骤从海水中提取镁。
下列说法不正确的是( )
A.试剂①可以选用石灰乳
B.加入试剂①后,能够分离得到 沉淀的方法是过滤
C. 溶液通过蒸发结晶可得到无水
D.电解熔融 所得副产物 是工业制备试剂②的主要原料
7.物质的组成、结构和性质用途往往相互关联,下列说法不正确的是( )
A.石墨中每层的碳原子的p轨道相互平行而重叠,电子可在碳原子平面运动而导电
B.不锈钢中掺杂的合金元素主要是 和 ,具有很强的抗腐蚀能力
C.玛瑙常无规则几何外形,是由于熔融态的 快速冷却而致
D.“可燃冰”是水分子以氢键相连笼穴内装有甲烷等气体,结构稳定,常温常压下不会分解
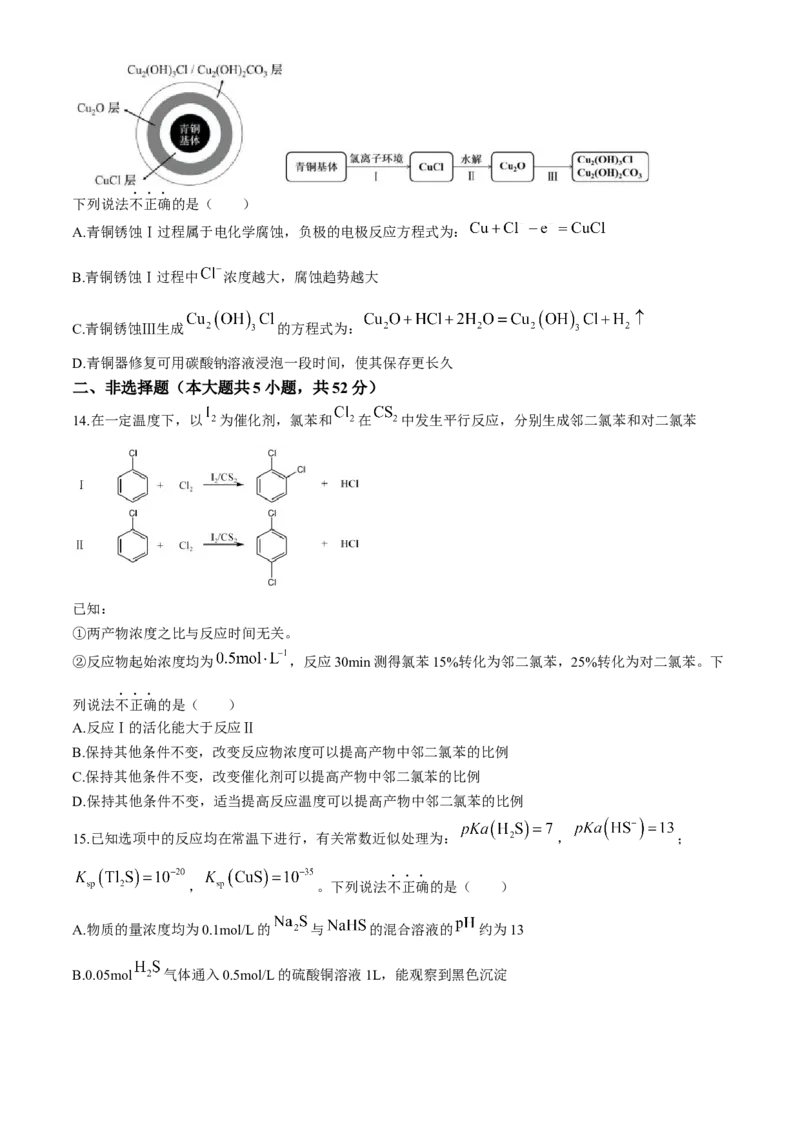
8.下列实验装置使用正确的是( )
① ② ③ ④
A.图①装置用于铜和稀硝酸反应的探究实验 B.图②装置用于实验室制备
C.图③装置用于煤的气化实验 D.图④装置用于实验室制备
9.关于有机物检测,下列说法不正确的是( )
A.1-溴丁烷中的溴元素检验所需的试剂: 溶液、稀硝酸和硝酸银溶液
B.用饱和溴水可鉴别1-丙醇、2-氯丙烷、丙醛和苯酚溶液
学科网(北京)股份有限公司C.通过核磁共振氢谱检测 ,谱图上呈现两组峰
D.可通过灼烧闻气味来区分衣物的材质属于蛋白质还是纤维素
10.下列化学反应与方程式不相符的是( )
A. 与足量 作用:
B.铜片上电镀银的总反应(银作阳极,硝酸银溶液作电镀液)
C. 溶液中加入少量 溶液:
D.苯酚钠溶液中通入少量 :
11.第尔斯-阿尔德反应可得到环加成产物,构建环状骨架。例如:
下列说法正确的是( )
A.X中所有原子共平面 B.Y难溶于水,密度比水大
C.该反应的另一产物为Z的对映异构体 D.Z分子中有3种官能团
12.X、Y、Z、M四种主族元素,原子序数依次增大,分别处于不同的前四周期,基态Y原子s能级电子
数是p能级的2倍,Z是同周期中电负性最大的元素,基态M原子核外无未成对电子,下列说法不正确的
是( )
A. 和 中阴阳离子个数比相同
B. 中含有3个 键和2个 键
C. 中所有Y原子可能在同一直线上
D.Y的氧化物的水化物的酸性可能比Z的氧化物的水化物的酸性强
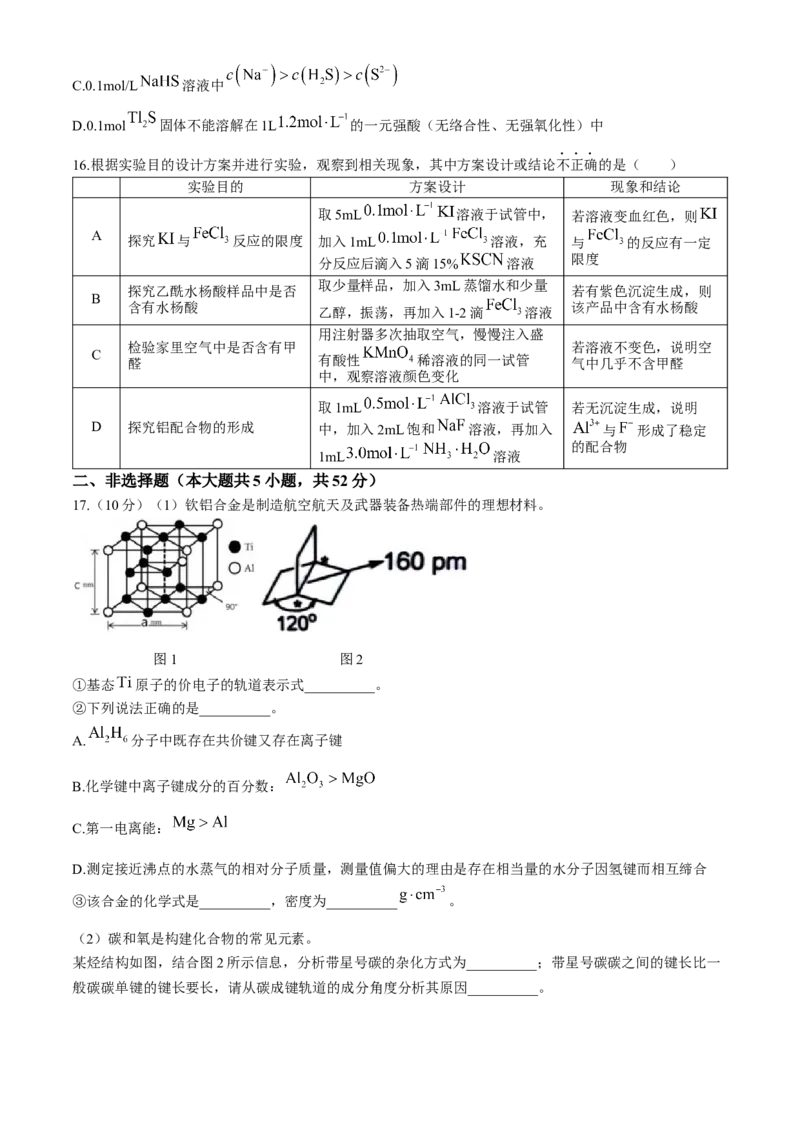
13.古代青铜器的出土,体现了古代中国对人类物质文明的巨大贡献。青铜器埋藏会产生多种锈蚀产物,其
中 结构致密,可以阻止内部青铜继续被腐蚀,而 结构疏松膨胀,可使锈蚀
很快蔓延。青铜锈蚀过程大致如下:
学科网(北京)股份有限公司下列说法不正确的是( )
A.青铜锈蚀Ⅰ过程属于电化学腐蚀,负极的电极反应方程式为:
B.青铜锈蚀Ⅰ过程中 浓度越大,腐蚀趋势越大
C.青铜锈蚀Ⅲ生成 的方程式为:
D.青铜器修复可用碳酸钠溶液浸泡一段时间,使其保存更长久
二、非选择题(本大题共5小题,共52分)
14.在一定温度下,以 为催化剂,氯苯和 在 中发生平行反应,分别生成邻二氯苯和对二氯苯
已知:
①两产物浓度之比与反应时间无关。
②反应物起始浓度均为 ,反应30min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。下
列说法不正确的是( )
A.反应Ⅰ的活化能大于反应Ⅱ
B.保持其他条件不变,改变反应物浓度可以提高产物中邻二氯苯的比例
C.保持其他条件不变,改变催化剂可以提高产物中邻二氯苯的比例
D.保持其他条件不变,适当提高反应温度可以提高产物中邻二氯苯的比例
15.已知选项中的反应均在常温下进行,有关常数近似处理为: , ;
, 。下列说法不正确的是( )
A.物质的量浓度均为0.1mol/L的 与 的混合溶液的 约为13
B.0.05mol 气体通入0.5mol/L的硫酸铜溶液1L,能观察到黑色沉淀
学科网(北京)股份有限公司C.0.1mol/L 溶液中
D.0.1mol 固体不能溶解在1L 的一元强酸(无络合性、无强氧化性)中
16.根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不正确的是( )
实验目的 方案设计 现象和结论
取5mL 溶液于试管中, 若溶液变血红色,则
A
探究 与 反应的限度 加入1mL 溶液,充 与 的反应有一定
限度
分反应后滴入5滴15% 溶液
取少量样品,加入3mL蒸馏水和少量
探究乙酰水杨酸样品中是否 若有紫色沉淀生成,则
B
含有水杨酸 该产品中含有水杨酸
乙醇,振荡,再加入1-2滴 溶液
用注射器多次抽取空气,慢慢注入盛
检验家里空气中是否含有甲 若溶液不变色,说明空
C
醛 有酸性 稀溶液的同一试管 气中几乎不含甲醛
中,观察溶液颜色变化
取1mL 溶液于试管 若无沉淀生成,说明
D 探究铝配合物的形成 中,加入2mL饱和 溶液,再加入 与 形成了稳定
的配合物
1mL 溶液
二、非选择题(本大题共5小题,共52分)
17.(10分)(1)钦铝合金是制造航空航天及武器装备热端部件的理想材料。
图1 图2
①基态 原子的价电子的轨道表示式__________。
②下列说法正确的是__________。
A. 分子中既存在共价键又存在离子键
B.化学键中离子键成分的百分数:
C.第一电离能:
D.测定接近沸点的水蒸气的相对分子质量,测量值偏大的理由是存在相当量的水分子因氢键而相互缔合
③该合金的化学式是__________,密度为__________ 。
(2)碳和氧是构建化合物的常见元素。
某烃结构如图,结合图2所示信息,分析带星号碳的杂化方式为__________;带星号碳碳之间的键长比一
般碳碳单键的键长要长,请从碳成键轨道的成分角度分析其原因__________。
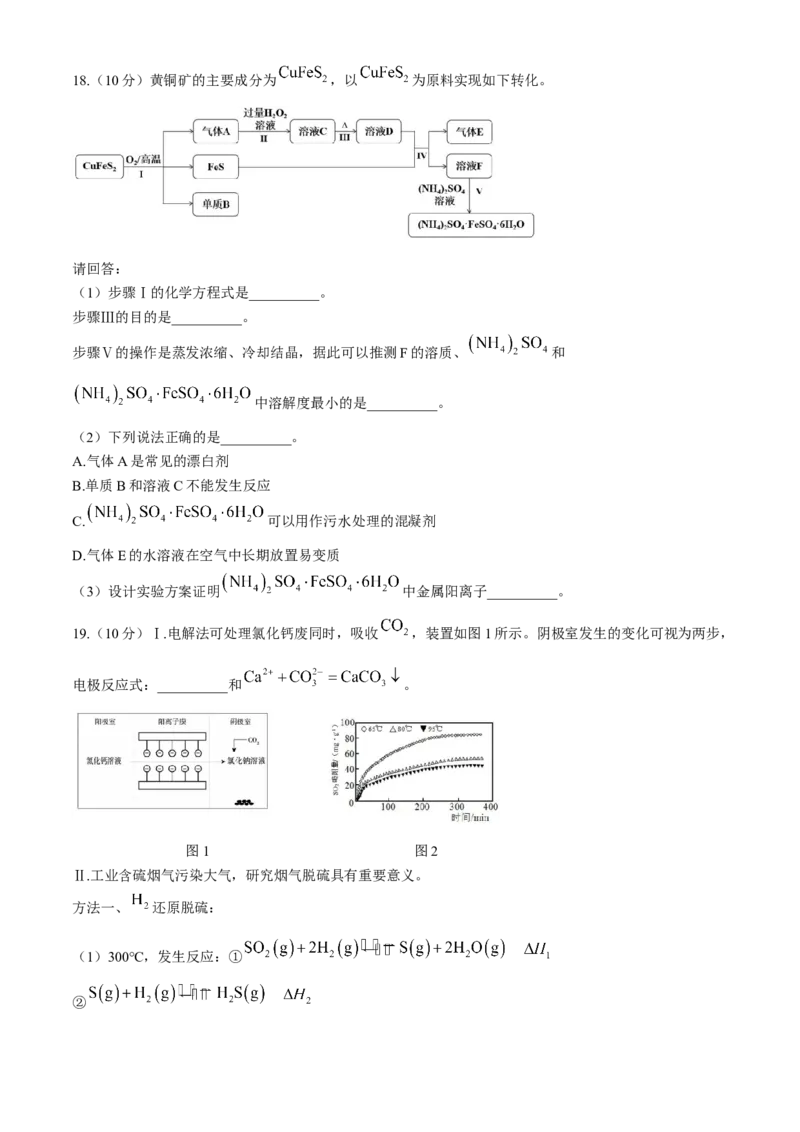
学科网(北京)股份有限公司18.(10分)黄铜矿的主要成分为 ,以 为原料实现如下转化。
请回答:
(1)步骤Ⅰ的化学方程式是__________。
步骤Ⅲ的目的是__________。
步骤Ⅴ的操作是蒸发浓缩、冷却结晶,据此可以推测F的溶质、 和
中溶解度最小的是__________。
(2)下列说法正确的是__________。
A.气体A是常见的漂白剂
B.单质B和溶液C不能发生反应
C. 可以用作污水处理的混凝剂
D.气体E的水溶液在空气中长期放置易变质
(3)设计实验方案证明 中金属阳离子__________。
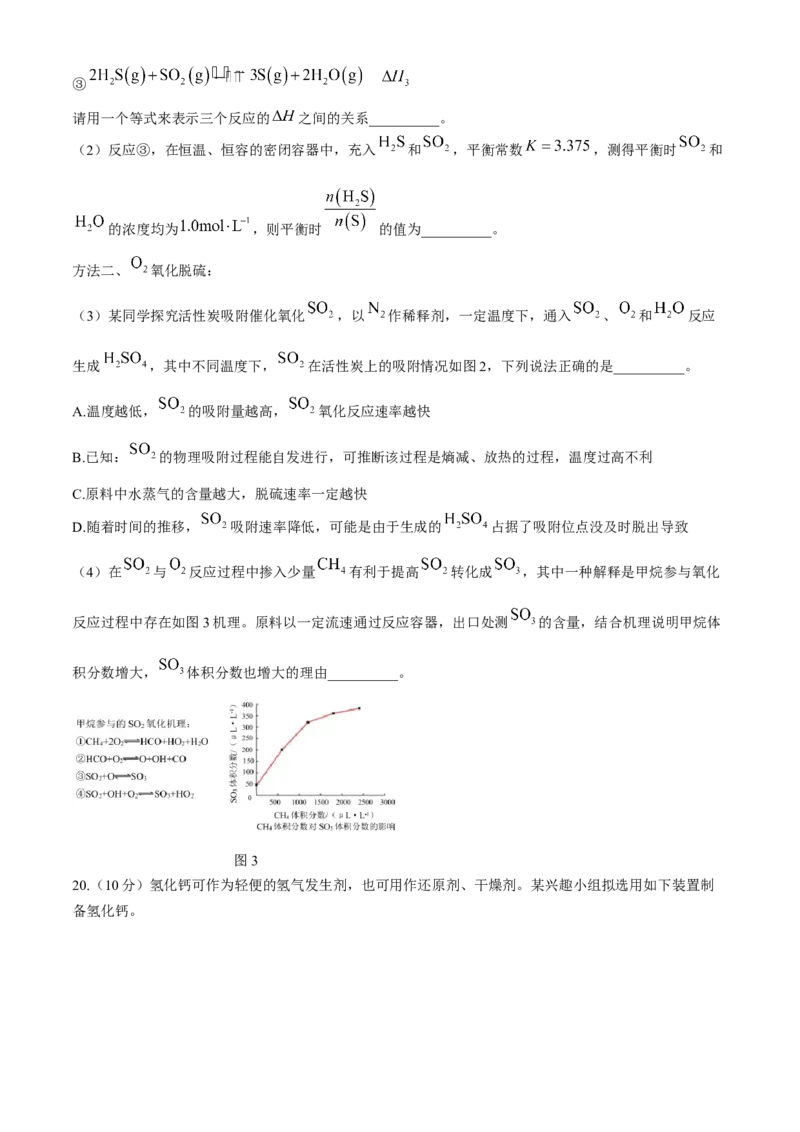
19.(10分)Ⅰ.电解法可处理氯化钙废同时,吸收 ,装置如图1所示。阴极室发生的变化可视为两步,
电极反应式:__________和 。
图1 图2
Ⅱ.工业含硫烟气污染大气,研究烟气脱硫具有重要意义。
方法一、 还原脱硫:
(1)300℃,发生反应:①
②
学科网(北京)股份有限公司③
请用一个等式来表示三个反应的 之间的关系__________。
(2)反应③,在恒温、恒容的密闭容器中,充入 和 ,平衡常数 ,测得平衡时 和
的浓度均为 ,则平衡时 的值为__________。
方法二、 氧化脱硫:
(3)某同学探究活性炭吸附催化氧化 ,以 作稀释剂,一定温度下,通入 、 和 反应
生成 ,其中不同温度下, 在活性炭上的吸附情况如图2,下列说法正确的是__________。
A.温度越低, 的吸附量越高, 氧化反应速率越快
B.已知: 的物理吸附过程能自发进行,可推断该过程是熵减、放热的过程,温度过高不利
C.原料中水蒸气的含量越大,脱硫速率一定越快
D.随着时间的推移, 吸附速率降低,可能是由于生成的 占据了吸附位点没及时脱出导致
(4)在 与 反应过程中掺入少量 有利于提高 转化成 ,其中一种解释是甲烷参与氧化
反应过程中存在如图3机理。原料以一定流速通过反应容器,出口处测 的含量,结合机理说明甲烷体
积分数增大, 体积分数也增大的理由__________。
图3
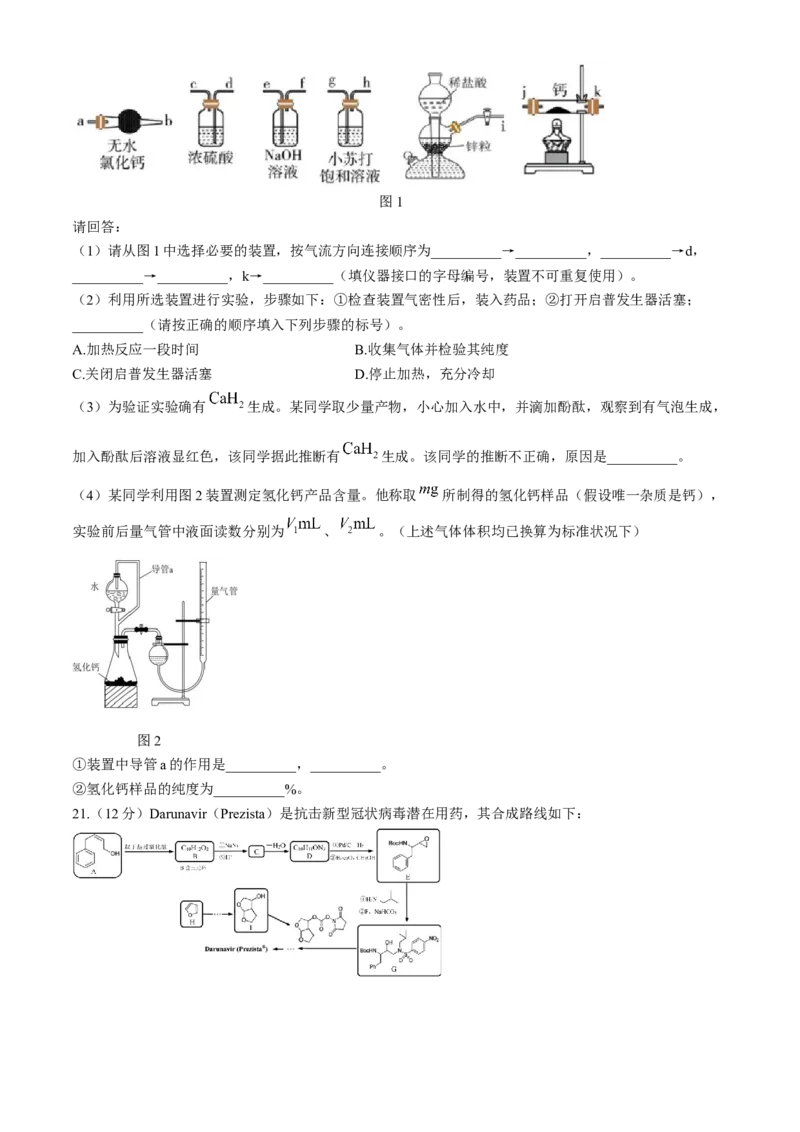
20.(10分)氢化钙可作为轻便的氢气发生剂,也可用作还原剂、干燥剂。某兴趣小组拟选用如下装置制
备氢化钙。
学科网(北京)股份有限公司图1
请回答:
(1)请从图1中选择必要的装置,按气流方向连接顺序为__________→__________,__________→d,
__________→__________,k→__________(填仪器接口的字母编号,装置不可重复使用)。
(2)利用所选装置进行实验,步骤如下:①检查装置气密性后,装入药品;②打开启普发生器活塞;
__________(请按正确的顺序填入下列步骤的标号)。
A.加热反应一段时间 B.收集气体并检验其纯度
C.关闭启普发生器活塞 D.停止加热,充分冷却
(3)为验证实验确有 生成。某同学取少量产物,小心加入水中,并滴加酚酞,观察到有气泡生成,
加入酚酞后溶液显红色,该同学据此推断有 生成。该同学的推断不正确,原因是__________。
(4)某同学利用图2装置测定氢化钙产品含量。他称取 所制得的氢化钙样品(假设唯一杂质是钙),
实验前后量气管中液面读数分别为 、 。(上述气体体积均已换算为标准状况下)
图2
①装置中导管a的作用是__________,__________。
②氢化钙样品的纯度为__________%。
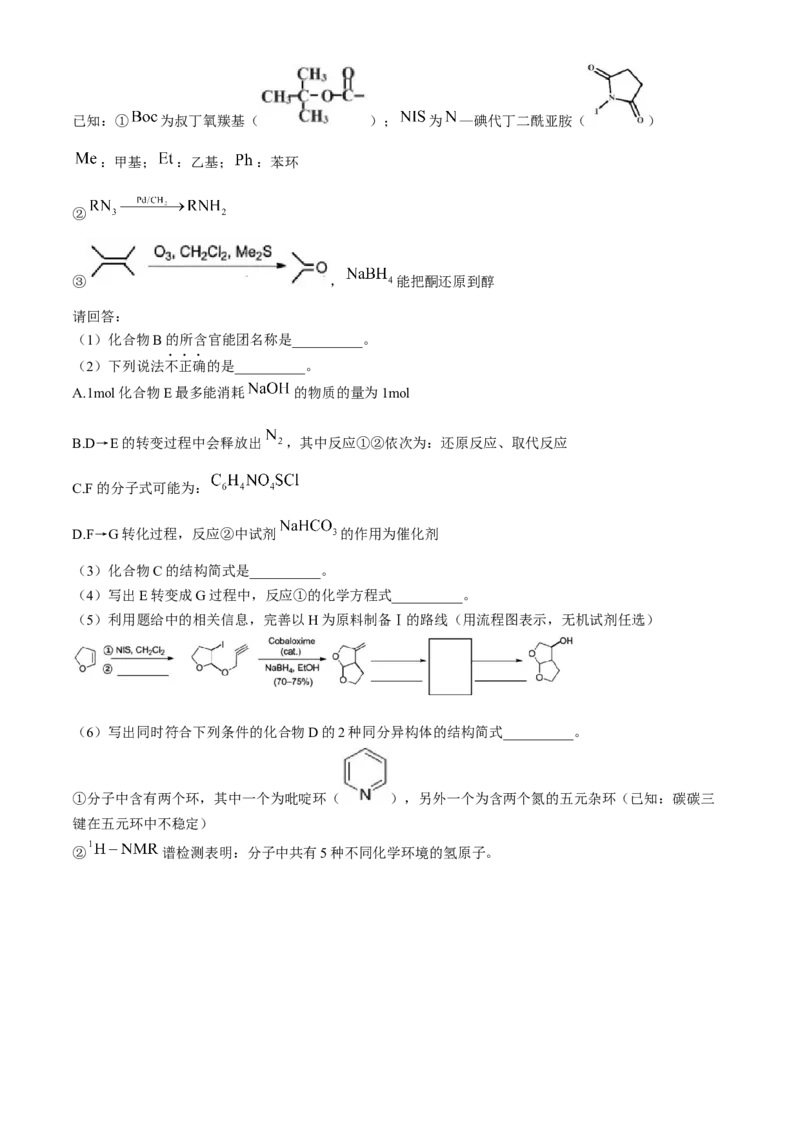
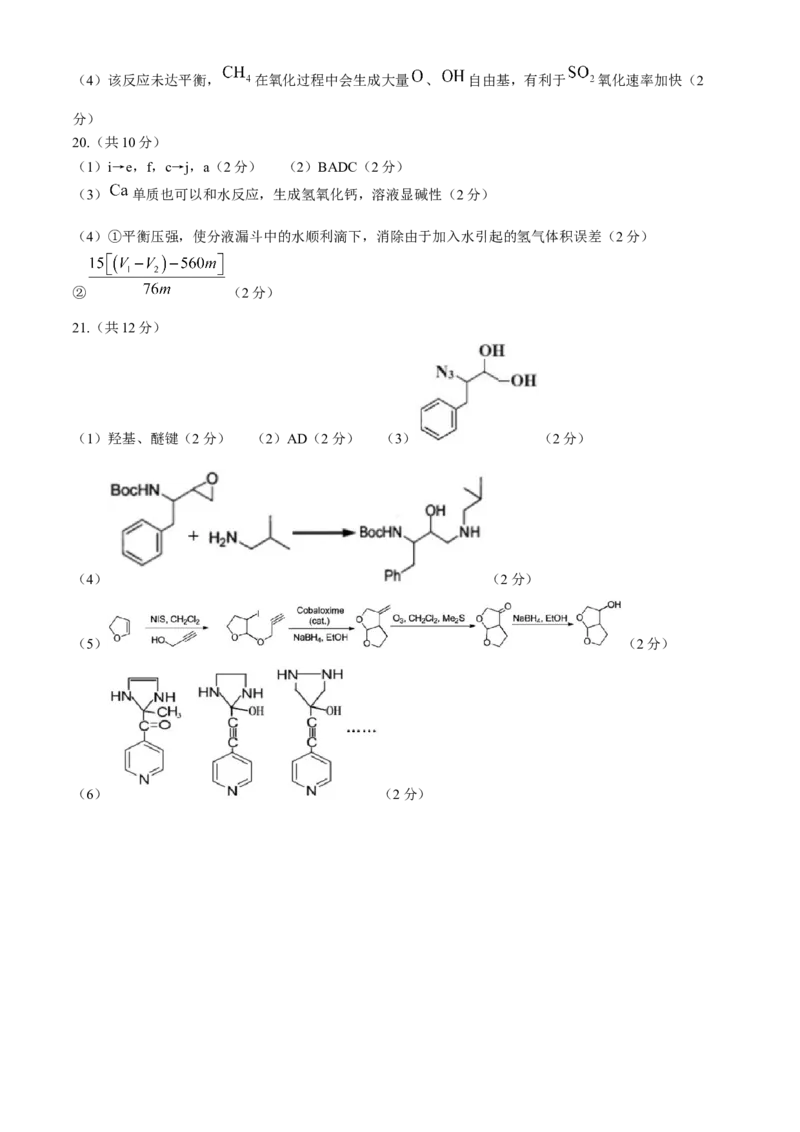
21.(12分)Darunavir(Prezista)是抗击新型冠状病毒潜在用药,其合成路线如下:
学科网(北京)股份有限公司已知:① 为叔丁氧羰基( ); 为 —碘代丁二酰亚胺( )
:甲基; :乙基; :苯环
②
③ , 能把酮还原到醇
请回答:
(1)化合物B的所含官能团名称是__________。
(2)下列说法不正确的是__________。
A.1mol化合物E最多能消耗 的物质的量为1mol
B.D→E的转变过程中会释放出 ,其中反应①②依次为:还原反应、取代反应
C.F的分子式可能为:
D.F→G转化过程,反应②中试剂 的作用为催化剂
(3)化合物C的结构简式是__________。
(4)写出E转变成G过程中,反应①的化学方程式__________。
(5)利用题给中的相关信息,完善以H为原料制备Ⅰ的路线(用流程图表示,无机试剂任选)
(6)写出同时符合下列条件的化合物D的2种同分异构体的结构简式__________。
①分子中含有两个环,其中一个为吡啶环( ),另外一个为含两个氮的五元杂环(已知:碳碳三
键在五元环中不稳定)
② 谱检测表明:分子中共有5种不同化学环境的氢原子。
学科网(北京)股份有限公司浙江省选考科目考试绍兴市适应性试卷(2024 年 4 月)
化学参考答案
一、选择题(每小题3分,共16小题,共48分)
题号 1 2 3 4 5 6 7 8
答案 B D A C A C D D
题号 9 10 11 12 13 14 15 16
答案 C D C A C B D B
二、非选择题(共5小题,共52分)
17.(共10分)
(1)① (2分)
②CD(2分) ③ (2分)
(2) 杂化(2分)
并环的碳碳单价是通过未杂化的两个p轨道形成的 键,一般的碳碳单键是 杂化轨道头碰头形成,p
轨道比 轨道要伸展的更长,因此带星号碳碳之间的键长长。(2分)
18.(共10分)
(1) (2分)
除去 ,防止后续过程中氧化 等还原性微粒。(2分)
(2分)
(2)ACD(2分)
(3)取样品少量于试管中,加水溶解,加入 溶液,无明显变化,再加入双氧水,显红色,说明有
(2分。其他合理答案也给分。)
19.(共10分)
Ⅰ. (2分)
Ⅱ.(1) (2分) (2) (2分) (3)BD(2分)
学科网(北京)股份有限公司(4)该反应未达平衡, 在氧化过程中会生成大量 、 自由基,有利于 氧化速率加快(2
分)
20.(共10分)
(1)i→e,f,c→j,a(2分) (2)BADC(2分)
(3) 单质也可以和水反应,生成氢氧化钙,溶液显碱性(2分)
(4)①平衡压强,使分液漏斗中的水顺利滴下,消除由于加入水引起的氢气体积误差(2分)
② (2分)
21.(共12分)
(1)羟基、醚键(2分) (2)AD(2分) (3) (2分)
(4) (2分)
(5) (2分)
(6) (2分)
学科网(北京)股份有限公司