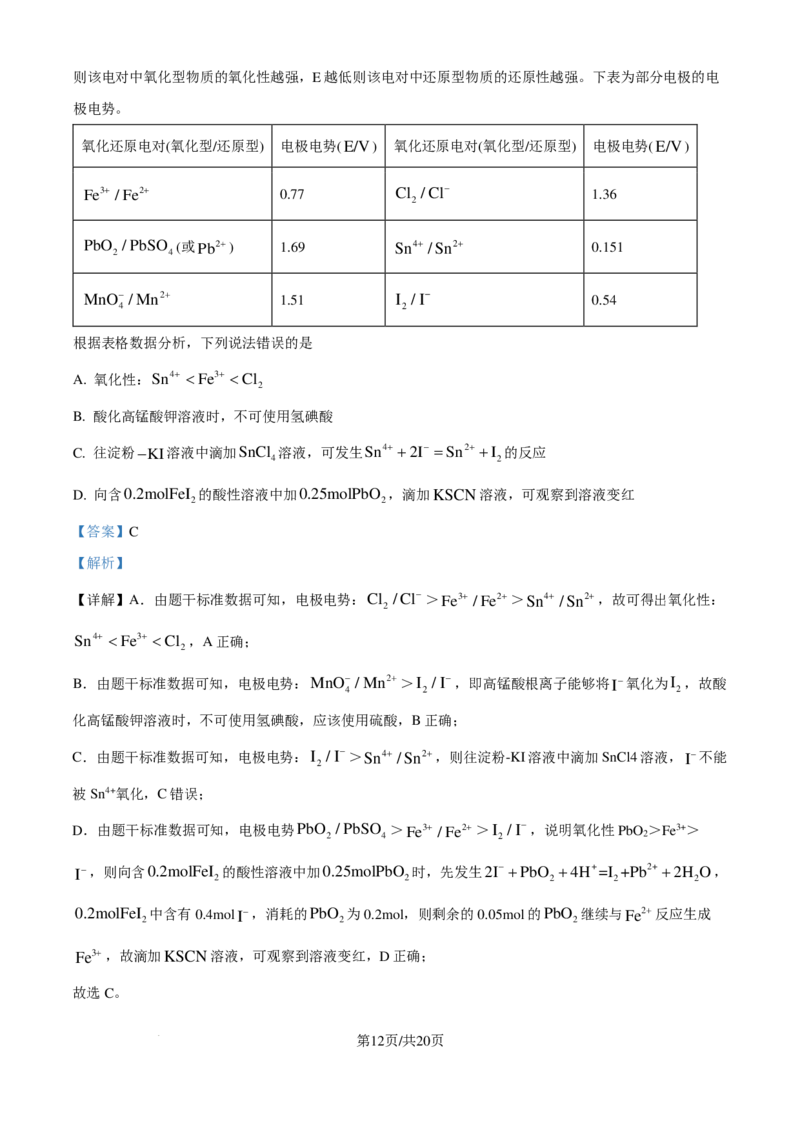文档内容
河南省许昌高级中学 2024-2025 学年高三上学期 8 月月考
化学试题
注意事项:
1.答卷前,考生务必将自己的姓名和座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改
动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡的相应位
置上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
一、选择题(共 15小题,每题 3分,共 45分)
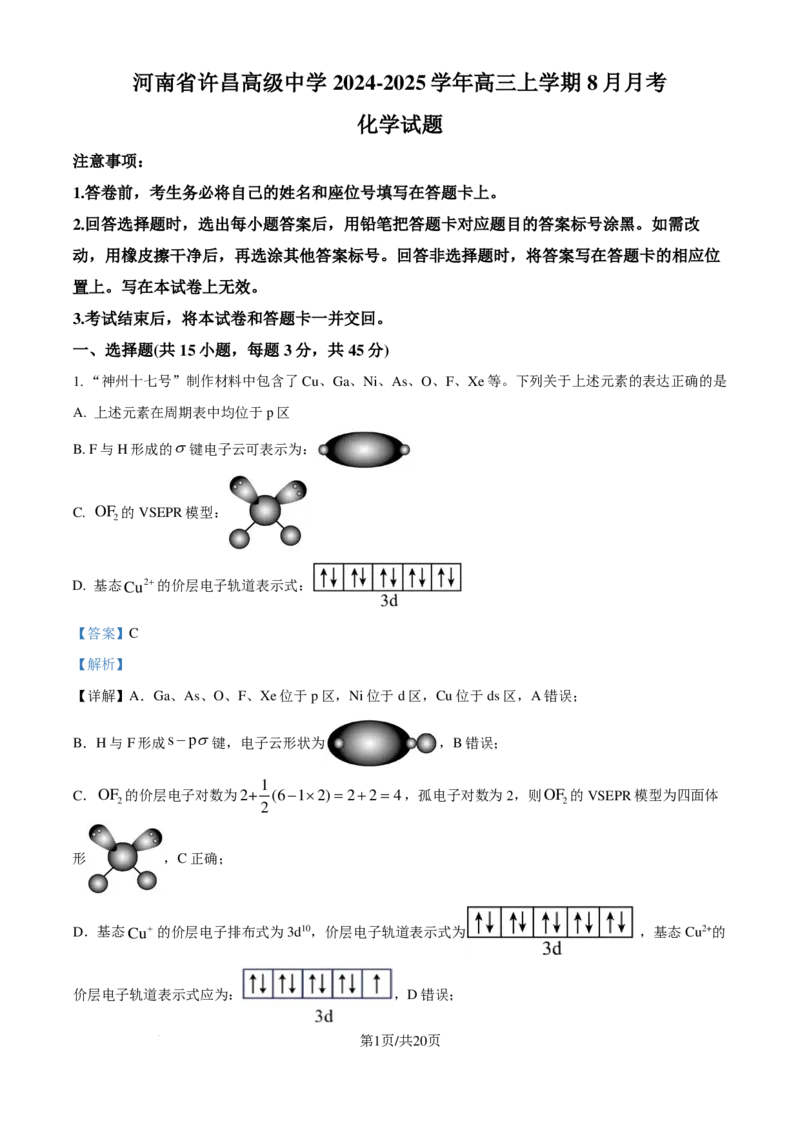
1. “神州十七号”制作材料中包含了Cu、Ga、Ni、As、O、F、Xe等。下列关于上述元素的表达正确的是
A. 上述元素在周期表中均位于p区
B.
F与H形成的σ键电子云可表示为:
C. OF 的VSEPR模型:
2
D. 基态Cu2+的价层电子轨道表示式:
【答案】C
【解析】
【详解】A.Ga、As、O、F、Xe位于p区,Ni位于d区,Cu位于ds区,A错误;
B.H与F形成s−pσ键,电子云形状为 ,B错误;
1
C.OF 的价层电子对数为2+ (6−1×2)=2+2=4,孤电子对数为2,则OF 的VSEPR模型为四面体
2 2
2
形 ,C正确;
D.基态Cu+的价层电子排布式为3d10,价层电子轨道表示式为 ,基态Cu2+的
价层电子轨道表示式应为: ,D错误;
第1页/共20页
学科网(北京)股份有限公司故答案选C。
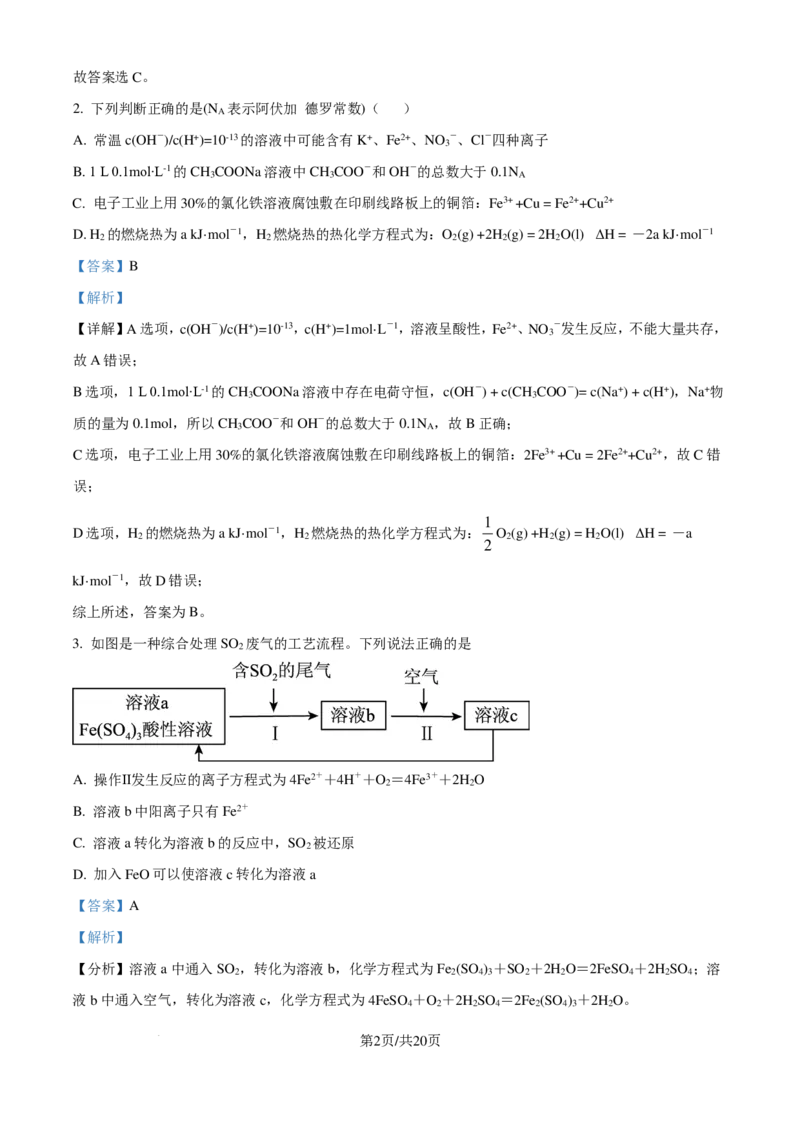
2. 下列判断正确的是(N 表示阿伏加 德罗常数)( )
A
A. 常温c(OH-)/c(H+)=10-13的溶液中可能含有K+、Fe2+、NO -、Cl-四种离子
3
B. 1 L 0.1mol∙L-1的CH COONa溶液中CH COO-和OH-的总数大于0.1N
3 3 A
C. 电子工业上用30%的氯化铁溶液腐蚀敷在印刷线路板上的铜箔:Fe3+ +Cu = Fe2++Cu2+
D. H 的燃烧热为a kJ·mol-1,H 燃烧热的热化学方程式为:O (g) +2H (g) = 2H O(l) ΔH = -2a kJ·mol-1
2 2 2 2 2
【答案】B
【解析】
【详解】A选项,c(OH-)/c(H+)=10-13,c(H+)=1mol·L-1,溶液呈酸性,Fe2+、NO -发生反应,不能大量共存,
3
故A错误;
B选项,1 L 0.1mol∙L-1的CH COONa溶液中存在电荷守恒,c(OH-) + c(CH COO-)= c(Na+) + c(H+),Na+物
3 3
质的量为0.1mol,所以CH COO-和OH-的总数大于0.1N ,故B正确;
3 A
C选项,电子工业上用30%的氯化铁溶液腐蚀敷在印刷线路板上的铜箔:2Fe3+ +Cu = 2Fe2++Cu2+,故C错
误;
1
D选项,H 的燃烧热为a kJ·mol-1,H 燃烧热的热化学方程式为: O (g) +H (g) = H O(l) ΔH = -a
2 2 2 2 2
2
kJ·mol-1,故D错误;
综上所述,答案为B。
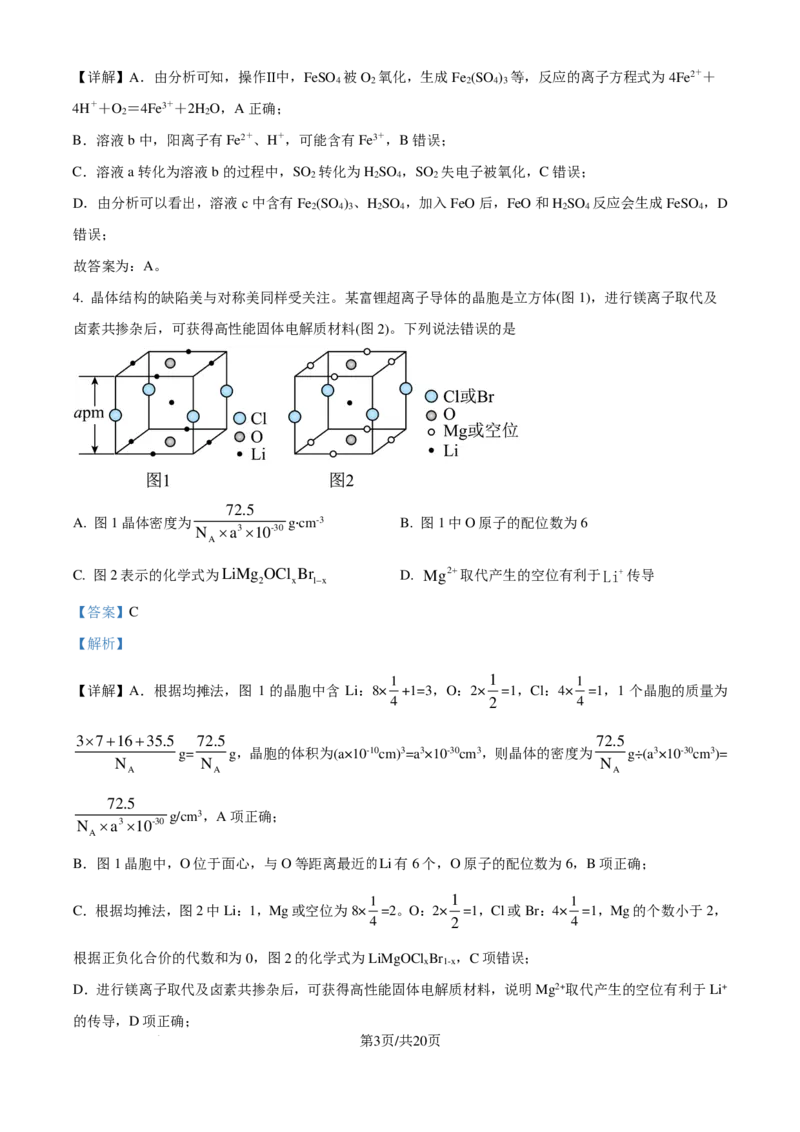
3. 如图是一种综合处理SO 废气的工艺流程。下列说法正确的是
2
A. 操作Ⅱ发生反应的离子方程式为4Fe2++4H++O =4Fe3++2H O
2 2
B. 溶液b中阳离子只有Fe2+
C. 溶液a转化为溶液b的反应中,SO 被还原
2
D. 加入FeO可以使溶液c转化为溶液a
【答案】A
【解析】
【分析】溶液a中通入SO ,转化为溶液b,化学方程式为Fe (SO ) +SO +2H O=2FeSO +2H SO ;溶
2 2 4 3 2 2 4 2 4
液b中通入空气,转化为溶液c,化学方程式为4FeSO +O +2H SO =2Fe (SO ) +2H O。
4 2 2 4 2 4 3 2
第2页/共20页
学科网(北京)股份有限公司【详解】A.由分析可知,操作Ⅱ中,FeSO 被O 氧化,生成Fe (SO ) 等,反应的离子方程式为4Fe2++
4 2 2 4 3
4H++O =4Fe3++2H O,A正确;
2 2
B.溶液b中,阳离子有Fe2+、H+,可能含有Fe3+,B错误;
C.溶液a转化为溶液b的过程中,SO 转化为H SO ,SO 失电子被氧化,C错误;
2 2 4 2
D.由分析可以看出,溶液c中含有Fe (SO ) 、H SO ,加入FeO后,FeO和H SO 反应会生成FeSO ,D
2 4 3 2 4 2 4 4
错误;
故答案为:A。
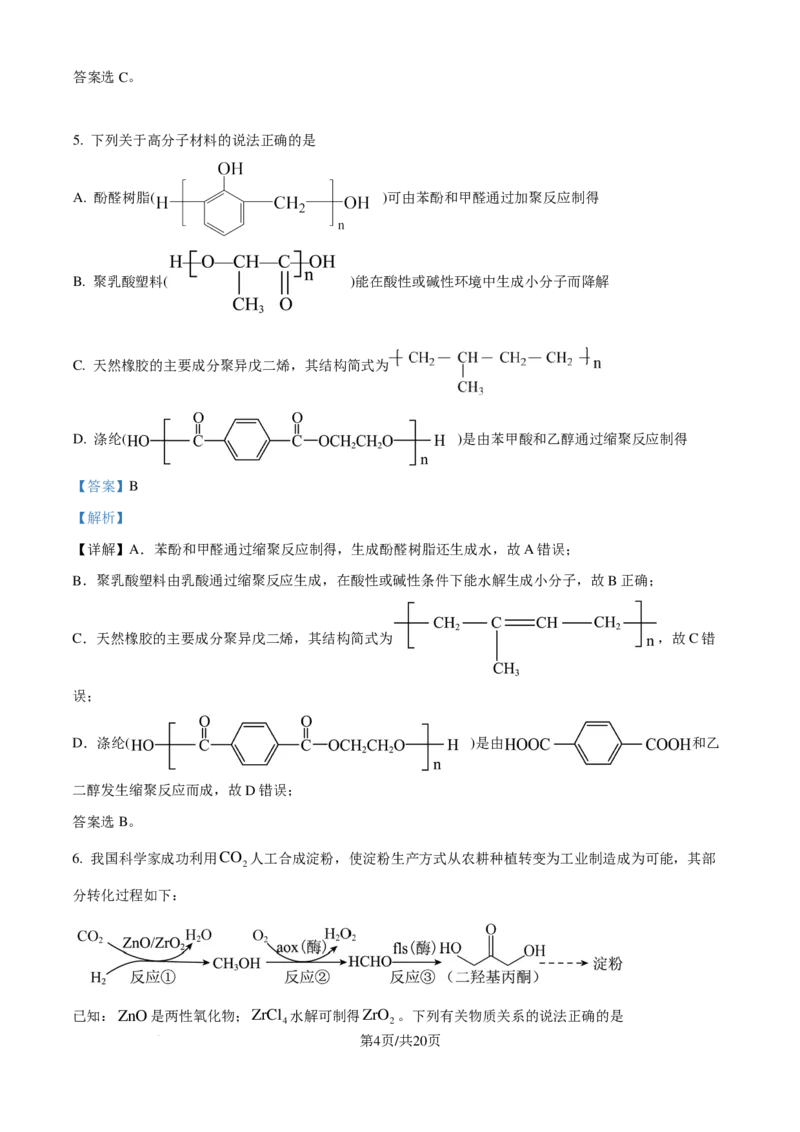
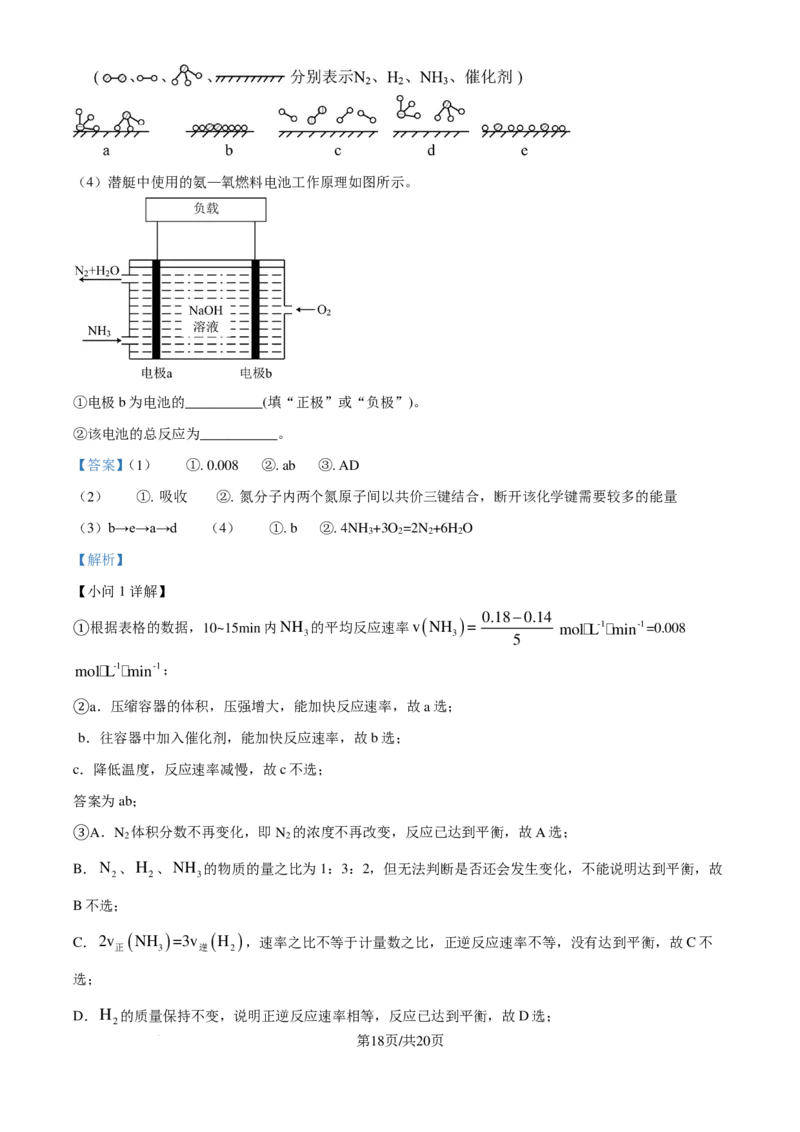
4. 晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及
卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是
72.5
A. 图1晶体密度为 gcm-3 B. 图1中O原子的配位数为6
N ×a3×10-30
A
∙
C. 图2表示的化学式为LiMg OCl Br D. Mg2+取代产生的空位有利于Li+传导
2 x 1−x
【答案】C
【解析】
1 1 1
【详解】A.根据均摊法,图 1 的晶胞中含 Li:8× +1=3,O:2× =1,Cl:4× =1,1 个晶胞的质量为
4 2 4
3×7+16+35.5 72.5 72.5
g= g,晶胞的体积为(a×10-10cm)3=a3×10-30cm3,则晶体的密度为 g÷(a3×10-30cm3)=
N N N
A A A
72.5
g/cm3,A项正确;
N ×a3×10-30
A
B.图1晶胞中,O位于面心,与O等距离最近的Li有6个,O原子的配位数为6,B项正确;
1 1 1
C.根据均摊法,图2中Li:1,Mg或空位为8× =2。O:2× =1,Cl或Br:4× =1,Mg的个数小于2,
4 2 4
根据正负化合价的代数和为0,图2的化学式为LiMgOCl Br ,C项错误;
x 1-x
D.进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料,说明Mg2+取代产生的空位有利于Li+
的传导,D项正确;
第3页/共20页
学科网(北京)股份有限公司答案选C。
5. 下列关于高分子材料的说法正确的是
A. 酚醛树脂( )可由苯酚和甲醛通过加聚反应制得
B. 聚乳酸塑料( )能在酸性或碱性环境中生成小分子而降解
C. 天然橡胶的主要成分聚异戊二烯,其结构简式为
D. 涤纶( )是由苯甲酸和乙醇通过缩聚反应制得
【答案】B
【解析】
【详解】A.苯酚和甲醛通过缩聚反应制得,生成酚醛树脂还生成水,故A错误;
B.聚乳酸塑料由乳酸通过缩聚反应生成,在酸性或碱性条件下能水解生成小分子,故B正确;
C.天然橡胶的主要成分聚异戊二烯,其结构简式为 ,故C错
误;
D.涤纶( )是由 和乙
二醇发生缩聚反应而成,故D错误;
答案选B。
6. 我国科学家成功利用CO 人工合成淀粉,使淀粉生产方式从农耕种植转变为工业制造成为可能,其部
2
分转化过程如下:
已知:ZnO是两性氧化物;ZrCl 水解可制得ZrO 。下列有关物质关系的说法正确的是
4 2
第4页/共20页
学科网(北京)股份有限公司A. 反应①~③在高温下速率更快
B. 反应③中发生了取代反应
C. 等物质的量的CH OH和H O 分子,含有相同的电子数
3 2 2
D. 反应①中n
(
CO
)
:n
(
H
)=1:4
2 2
【答案】C
【解析】
【详解】A.酶在高温条件下易失去活性,高温下速率会减慢,故A错误;
B.反应③中发生了加成反应,故B错误;
C.CH OH和H O 都含有18个电子,等物质的量的CH OH和H O 分子,含有相同的电子数,故C
3 2 2 3 2 2
正确;
D.反应①方程式为CO +3H =CH OH+H O,n
(
CO
)
:n
(
H
)=1:3,故D错误;
2 2 3 2 2 2
选C。
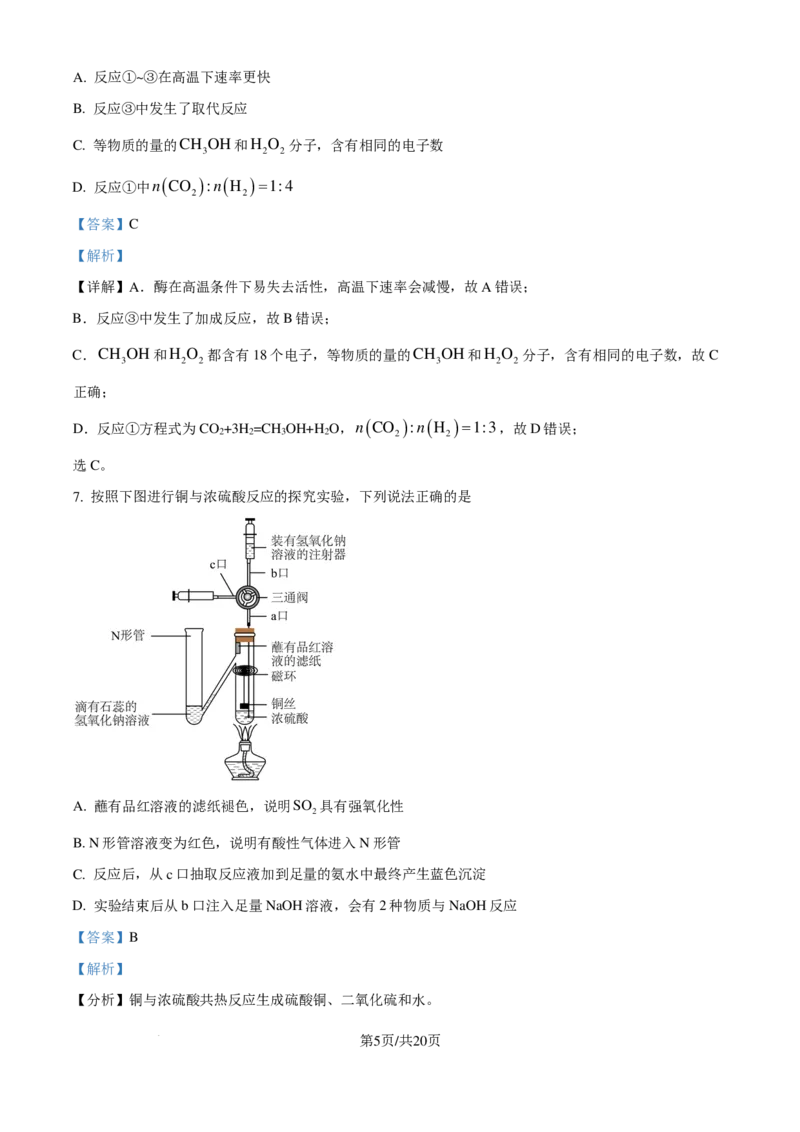
7. 按照下图进行铜与浓硫酸反应的探究实验,下列说法正确的是
A. 蘸有品红溶液的滤纸褪色,说明SO 具有强氧化性
2
B. N形管溶液变为红色,说明有酸性气体进入N形管
C. 反应后,从c口抽取反应液加到足量的氨水中最终产生蓝色沉淀
D. 实验结束后从b口注入足量NaOH溶液,会有2种物质与NaOH反应
【答案】B
【解析】
【分析】铜与浓硫酸共热反应生成硫酸铜、二氧化硫和水。
第5页/共20页
学科网(北京)股份有限公司【详解】A.蘸有品红溶液的滤纸褪色,说明二氧化硫具有漂白性,故A错误;
B.滴有石蕊的氢氧化钠溶液呈蓝色,则N形管溶液变为红色,说明溶液中氢氧化钠与通入的二氧化硫完
全反应,过量的二氧化硫使溶液呈酸性,故B正确;
C.反应后,从c口抽取反应液加到足量的氨水中发生的反应为硫酸铜溶液与足量氨水反应得到深蓝色的
硫酸四氨合铜溶液,不可能得到氢氧化铜蓝色沉淀,故C错误;
D.浓硫酸与铜共热反应时硫酸浓度会减小变为稀硫酸,稀硫酸与铜共热不反应,则反应中浓硫酸不可能
完全反应,所以实验结束后从b口注入足量氢氧化钠溶液,氢氧化钠溶液能与反应生成的硫酸铜、二氧化
硫反应,也能与未反应的稀硫酸反应,所以会有3种物质与氢氧化钠反应,故D错误;
故选B。
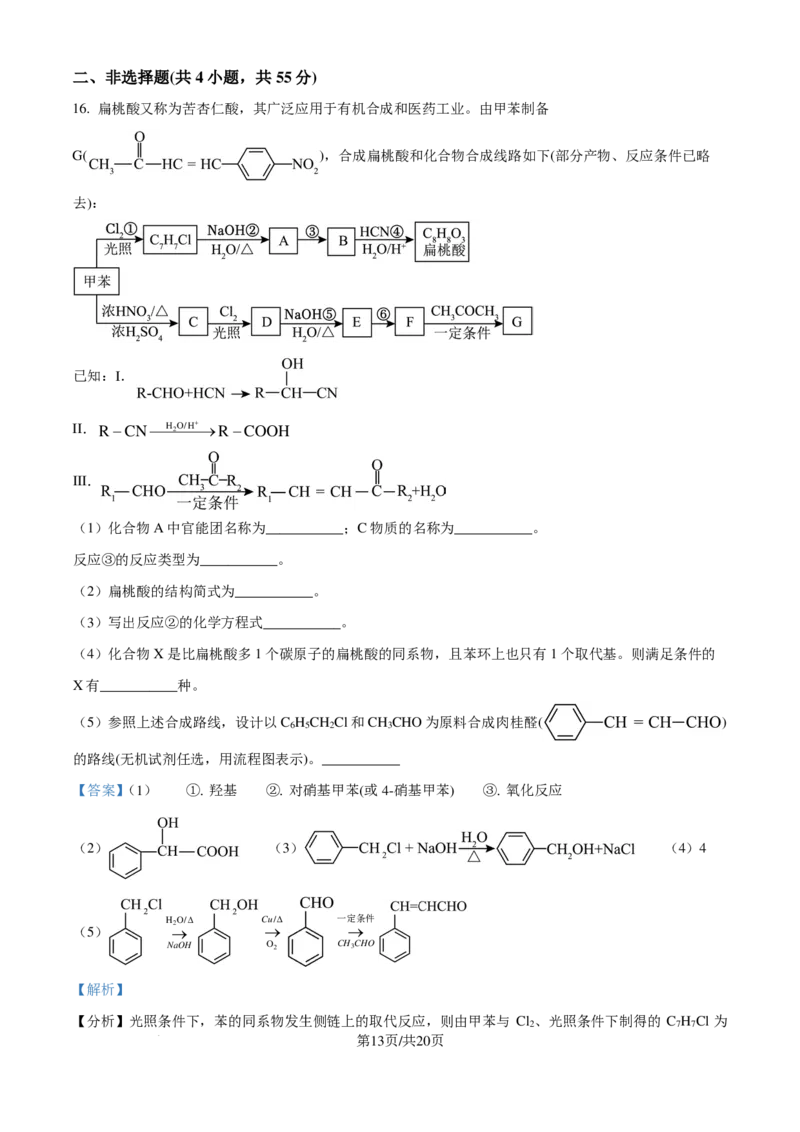
8. 对羟基苯甲醛是一种用途极为广泛的有机合成中间体。主要工业合成路线有以下两种:
下列说法错误的是
A. ①的反应类型为加成反应
B. 两种途径获得的对羟基苯甲醛中都可能引入副产物
C. 对羟基苯甲醛和对甲基苯酚可以用饱和溴水、银氨溶液鉴别
D. 对甲基苯酚的同分异构体中含有苯环的有4种(不包括其本身)
【答案】C
【解析】
【详解】A.根据物质分子结构的变化可知:反应①是甲醛的酮羰基断开双键中较活泼的碳氧键,苯酚羟
基对位上碳氢键断裂,氢原子和碳原子分别连在碳氧双键两端的原子上,故该反应类型为加成反应,故A
正确;
B.由于对羟基苯甲醇和对甲基苯酚中都含有酚羟基,在②、③转化过程中酚羟基易被氧化,从而产生副
产物,故B正确;
C.对羟基苯甲醛和对甲基苯酚中都含有酚羟基,且羟基邻位上有氢原子,故都可以与饱和溴水反应产生
白色沉淀,故不能用饱和溴水鉴别两种物质,故C错误;
D.对甲基苯酚的同分异构体中含有苯环的还有:邻甲基苯酚、间甲基苯酚、苯甲醇、苯甲醚,共4种,
第6页/共20页
学科网(北京)股份有限公司故D正确;
答案选C。
9. 在有机合成中,常会将官能团消除或增加,下列相关过程中反应类型及相关产物不合理的是
A. 乙烯→乙二醇:CH =CH 加成→ 取代→
2 2
B. 溴乙烷→乙醇:CH CH Br水解→CH =CH 加成→CH CH OH
3 2 2 2 3 2
C. 1-溴丁烷→1-丁炔:CH CH CH CH Br消去→CH CH CH=CH 加成→ 消去→
3 2 2 2 3 2 2
CH CH C≡CH
3 2
D. 乙烯→乙炔:CH =CH 加成→ 消去→CH≡CH
2 2
【答案】B
【解析】
【详解】A.乙烯与 Br 发生加成反应产生 1,2-二溴乙烷,然后与 NaOH 水溶液共热,发生取代反应产生
2
乙二醇,两步实现物质转化,合成路线简洁,故A不符合题意;
B.溴乙烷是卤代烃,可以与NaOH水溶液共热,发生取代反应产生乙醇,一步就可以实现物质的转化,因
此上述题干的转化步骤不简洁,故B符合题意;
C.1-溴丁烷与 NaOH 的乙醇溶液共热发生消去反应产生 1-丁烯 CH CH CH=CH ,CH CH CH=CH 与 Br
3 2 2 3 2 2 2
水发生加成反应产生1,2-二溴丁烷,1,2-二溴丁烷再与NaOH的乙醇溶液共热发生消去反应产生1-丁炔,
反应步骤简洁,故C不符合题意;
D.乙烯与Br 水发生加成反应产生1,2-二溴乙烷,1,2-二溴乙烷再与NaOH的乙醇溶液共热发生消去反
2
应产生乙炔,反应步骤简洁,故D不符合题意;
答案选B。
10. 谷氨酸单钠是味精的主要成分,利用发酵法制备该物质的流程如下。下列说法不正确的是
A. 可用碘水检验淀粉是否完全水解
B. 可用红外光谱仪测定谷氨酸中所含官能团的种类
C. 1个谷氨酸分子中含有2个手性碳原子
D. “中和”时需严格控制 Na CO 的用量
2 3
第7页/共20页
学科网(北京)股份有限公司【答案】C
【解析】
【详解】A.淀粉遇碘变蓝色,所以可以用碘水检验淀粉是否完全水解,A正确;
B.红外光谱仪主要检测物质所含的官能团的种类以及其所处的化学环境,可用红外光谱仪测定谷氨酸中
所含官能团的种类,B正确;
C.手性碳原子是指与四个各不相同原子或基团相连的碳原子,谷氨酸中手性碳原子有
,故1个谷氨酸分子中含有1个手性碳原子,C错误;
D.谷氨酸中含有2个羧基,若Na CO 过多,可能生成 ,故“中和”时需严格
2 3
控制 Na CO 的用量,D正确;
2 3
故选C。
11. 已知E的分子式为C H O ,从A制备E的合成路线及B与D反应制备E的实验装置如图所示。下列
4 8 2
说法错误的是
A. 图中存在氧化、取代和加成三种有机反应类型
B. 试管甲中加试剂的顺序是先加浓硫酸,再加乙醇、乙酸及碎瓷片
C. B、D、E三种物质可以用饱和Na CO 溶液鉴别
2 3
D. 试管乙中导气管要在液面的上方,目的是防止倒吸发生危险
【答案】B
【解析】
【分析】A为乙烯,与水发生加成反应生成乙醇 B,乙醇氧化生成 C乙醛,乙醛氧化生成 D乙酸,B与 D
发生酯化反应生成E。
【详解】A. 由分析:图中存在B变C变为D的氧化反应、B与D生成E的取代反应和A到B加成反应三
第8页/共20页
学科网(北京)股份有限公司种有机反应类型,故A正确;
B. 浓硫酸与其他液体混合时会放出大量的热,所以应先加入碎瓷片、酒精、浓硫酸,再慢慢加入乙酸,
故B错误;
C. B、D、E三种物质可以用饱和Na CO 溶液鉴别,现象分别为:溶解、溶解产生气泡、分为上下
2 3
两层,故C正确;
D. 如果导气管伸入到饱和碳酸钠溶液液面以下,可能引起倒吸,试管乙中导气管要在液面的上方,目的
是防止倒吸发生危险,故D正确;
故选B。
12. 如图所示是几种常见的化学电源示意图,有关说法不正确的是
A. 上述电池分别属于一次电池、二次电池和燃料电池
B. 干电池工作时,Cl-向锌筒移动
C. 铅蓄电池工作过程中,负极质量增加
D. 甲醇燃料电池的正极反应是:O +4e-+2H O=4OH-
2 2
【答案】D
【解析】
【详解】A.干电池属于一次电池,铅蓄电池是可充电电池属于二次电池,甲醇燃料电池属于燃料电池,
A正确;
B.锌筒为负极,干电池工作时,Cl-向负极移动,B正确;
C.铅蓄电池工作过程中,负极反应为Pb-2e-+SO2−=PbSO,负极质量增加,C正确;
4 4
D.酸性甲醇燃料电池的正极反应是:O +4e-+4H+=2H O,D错误;
2 2
故答案为D。
13. 由软锰矿(主要成分MnO ,及少量CaO、MgO)制备MnO 的工艺流程如下:
2 2
第9页/共20页
学科网(北京)股份有限公司已知:“沉锰”所得MnCO 在空气中“焙烧”时转化为MnO 、Mn O 、MnO的混合物,酸性条件下
3 2 2 3
Mn O 易发生歧化反应。下列说法正确的是
2 3
A. “浸取”时利用了Na SO 的还原性,反应中氧化剂与还原剂物质的量之比为1:1
2 3
B. “除杂”后的溶液中主要存在的阳离子有Na+、H+、Mg2+、Mn2+、Ca2+
C. “沉锰”时反应的离子方程式为Mn2+ +CO2− =MnCO ↓
3 3
D. “酸浸”时每反应1molMn O 转移电子为2mol
2 3
【答案】A
【解析】
【分析】软锰矿(主要成分MnO ,及少量CaO、MgO)制备MnO 流程:MnO 具有氧化性,Na SO 具有还
2 2 2 2 3
原性,软锰矿中加入Na SO 、H SO 发生氧化还原反应生成MnSO ,反应为
2 3 2 4 4
MnO +Na SO +H SO =MnSO +Na SO +H O,CaO、MgO都和硫酸反应生成CaSO 、MgSO ,加入NaF除
2 2 3 2 4 4 2 4 2 4 4
去Ca2+、Mg2+,反应的离子方程式为Ca2++2F-=CaF ↓、Mg2++2F-=MgF ↓,过滤除去不溶物,得到含
2 2
MnSO 、Na SO 的滤液,向滤液中加入NH HCO 沉锰得到MnCO 沉淀,离子方程式为Mn2++2HCO-
4 2 4 4 3 3 3
=MnCO ↓+CO ↑+H O,在空气中焙烧MnCO 得到MnO 、Mn O 、MnO的混合物,再加入硫酸酸浸得到
3 2 2 3 2 2 3
MnO 、Mn2+溶液,发生的反应为Mn O +H SO =MnSO +MnO +H O,过滤得到MnSO 溶液和MnO ,据
2 2 3 2 4 4 2 2 4 2
此分析作答。
【详解】A. Na SO 具有还原性,软锰矿中加入Na SO 、H SO 发生氧化还原反应生成MnSO ,反应为
2 3 2 3 2 4 4
MnO +Na SO +H SO =MnSO +Na SO +H O,MnO 是氧化剂,Na SO 是还原剂,氧化剂与还原剂物质的
2 2 3 2 4 4 2 4 2 2 2 3
量之比为1:1,故A正确;
B.加入NaF的目的是除去Mg2+、Ca2+,所以第一次“除杂”后的溶液中主要存在的阳离子有Na+、H+、
Mn2+,故B错误;
C.加入NH HCO 沉锰得到MnCO 沉淀,离子方程式为Mn2++2HCO- =MnCO ↓+CO ↑+H O,故C错
4 3 3 3 3 2 2
误;
D.“酸浸”时反应为Mn O +H SO =MnSO +MnO +H O,1molMn O 反应转移1mole-,故D错误;
2 3 2 4 4 2 2 2 3
第10页/共20页
学科网(北京)股份有限公司答案选A。
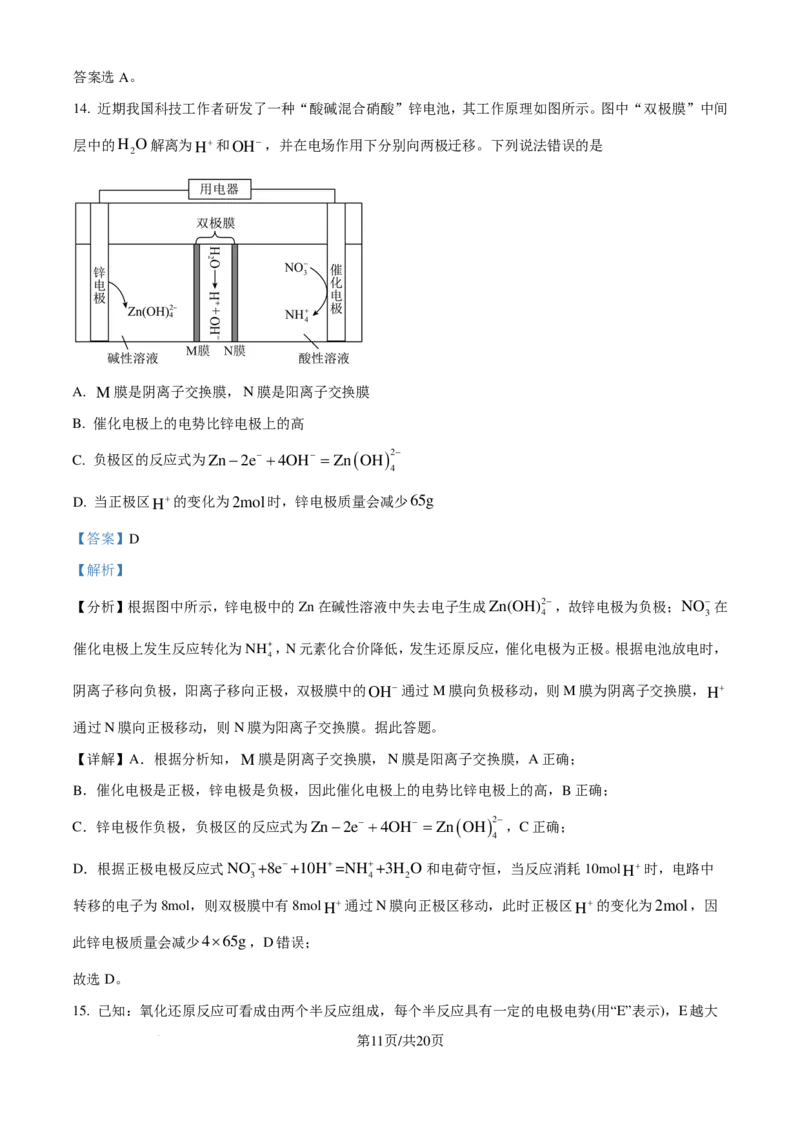
14. 近期我国科技工作者研发了一种“酸碱混合硝酸”锌电池,其工作原理如图所示。图中“双极膜”中间
层中的H O解离为H+和OH−,并在电场作用下分别向两极迁移。下列说法错误的是
2
A. M膜是阴离子交换膜,N膜是阳离子交换膜
B. 催化电极上的电势比锌电极上的高
C. 负极区的反应式为Zn−2e− +4OH− =Zn ( OH )2−
4
D. 当正极区H+的变化为2mol时,锌电极质量会减少65g
【答案】D
【解析】
【分析】根据图中所示,锌电极中的Zn在碱性溶液中失去电子生成Zn(OH)2−,故锌电极为负极;NO−在
4 3
催化电极上发生反应转化为NH+,N元素化合价降低,发生还原反应,催化电极为正极。根据电池放电时,
4
阴离子移向负极,阳离子移向正极,双极膜中的OH−通过M膜向负极移动,则M膜为阴离子交换膜,H+
通过N膜向正极移动,则N膜为阳离子交换膜。据此答题。
【详解】A.根据分析知,M膜是阴离子交换膜,N膜是阳离子交换膜,A正确;
B.催化电极是正极,锌电极是负极,因此催化电极上的电势比锌电极上的高,B正确;
C.锌电极作负极,负极区的反应式为Zn−2e− +4OH− =Zn ( OH )2− ,C正确;
4
D.根据正极电极反应式NO−+8e−+10H+=NH++3H O和电荷守恒,当反应消耗10molH+时,电路中
3 4 2
转移的电子为8mol,则双极膜中有8molH+通过N膜向正极区移动,此时正极区H+的变化为2mol,因
此锌电极质量会减少4×65g,D错误;
故选D。
15. 已知:氧化还原反应可看成由两个半反应组成,每个半反应具有一定的电极电势(用“E”表示),E越大
第11页/共20页
学科网(北京)股份有限公司则该电对中氧化型物质的氧化性越强,E越低则该电对中还原型物质的还原性越强。下表为部分电极的电
极电势。
氧化还原电对(氧化型/还原型) 电极电势(E/V) 氧化还原电对(氧化型/还原型) 电极电势(E/V)
Fe3+ /Fe2+ 0.77 Cl /Cl− 1.36
2
PbO /PbSO (或Pb2+) 1.69 Sn4+ /Sn2+ 0.151
2 4
MnO− /Mn2+ 1.51 I /I− 0.54
4 2
根据表格数据分析,下列说法错误的是
A. 氧化性:Sn4+