文档内容
第五章 化工生产中的重要非金属元素
第2节 氮及其化合物
(第1课时 氮气与氮的氧化物 )
一、选择题
1.下列关于N 的叙述错误的是( )
2
A.N 既可作氧化剂又可做还原剂
2
B.雷雨天,空气中的N 和O 可反应生成NO
2 2
C.氮的固定是将N 转化成含氮化合物
2
D.1molN 可与3molH 完全反应生成2molNH
2 2 3
【答案】D
【详解】
A.N 中N元素的化合价可以降低变成NH ,也可以升高生成NO等,故N 既可作氧化剂
2 3 2
又可做还原剂,A选项正确;
B.雷雨天时,发生自然固氮,空气中N 和O 可反应生成NO,B选项正确;
2 2
C.氮的固定是将空气中游离态的氮(N )转化为含氮化合物的过程,C选项正确;
2
D.N 和H 在高温高压催化剂的条件下生成NH ,反应方程式为N+3H
2 2 3 2 2
2NH ,此反应是可逆反应,1 molN 与3 molH 反应生成的NH 小于2mol,D选项错误;
3 2 2 3
答案选D。
2.下列说法正确的是
A.实验室能用排空气法收集N、NO和NO
2 2
B.NO为红棕色气体,NO 为无色气体
2
C.除去NO中的NO 气体可以使混合气体通过蒸馏水
2
D.NO、NO 、NO、NO 都属于酸性氧化物
2 2 4 2 5
【答案】C
【详解】
A.N 的密度与空气接近,容易混合,不能使用排空气方法收集;NO与O 反应产生
2 2
NO ,也不能使用排空气方法收集,A错误;
2
B.NO为无色气体,NO 为红棕色气体,B错误;
2
学科网(北京)股份有限公司C.NO 与水反应产生HNO 和NO,因此除去NO中的NO 气体可以使混合气体通过蒸馏
2 3 2
水,C正确;
D.NO是不成盐氧化物;NO 、NO 与水反应时N元素化合价会发生变化,也不是酸性氧
2 2 4
化物;只有NO 属于酸性氧化物,D错误;
2 5
故合理选项是C。
3.在NO 与水的反应中( )
2
A.氮元素的化合价不发生变化 B.NO 只是氧化剂
2
C.NO 只是还原剂 D.NO 既是氧化剂又是还原剂
2 2
【答案】D
【详解】
NO 和水反应的方程式为3NO+HO=2HNO+NO,在反应中2mol被氧化生成2mol硝酸,
2 2 2 3
1mo被还原,生成NO,即NO 既是氧化剂,又是还原剂。答案选D。
2
4.下列反应属于固氮反应的是
A.8NH +6NO 7N+12H O
3 2 2 2
B.O +2NO=2NO
2 2
C.NH +HCl=NH Cl
3 4
D.N+3H 2NH
2 2 3
【答案】D
【详解】
固氮反应是指游离态的氮气变为化合态的氮,A、B、C反应物都是化合态的氮,D是游离
态的氮气变为化合态的氮,故D符合题意。
综上所述,答案为D。
5.工业尾气中的NO、NO 可用火碱溶液吸收,有关化学反应为:
2
① ;
② 。
下列说法错误的是
A.反应①、②均为氧化还原反应
B.反应①中氧化产物与还原产物的物质的量之比为1:1
学科网(北京)股份有限公司C.若尾气可以被完全吸收,则尾气中 与NO的体积之比可能大于1:1
D.反应②中,生成2 mol 共转移电子的物质的量为2 mol
【答案】D
【详解】
A. 反应①、②中均有元素化合价变化,均为氧化还原反应,故A正确;
B. 反应①中氧化产物 与还原产物 的物质的量之比为1:1,故B正确;
C. 若尾气可以被完全吸收,则尾气中 与NO的体积之比可能大于1:1或等于1:
1,故C正确;
D. 反应②中,生成2 mol 共转移电子的物质的量为1 mol,故D错误;
故选D。
6.氮是各种生物体生命活动不可缺少的重要元素,氮的循环为生物体提供氮元素。下列过
程属于氮的固定的是
A.工业利用氮气和氢气合成氨气 B.氨气和硫酸反应制取铵态氮肥
C.氨基酸合成人体所需的蛋白质 D.硝酸盐在细菌作用下生成氮气
【答案】A
【解析】
A.工业利用氮气和氢气合成氨气,氮元素由游离态转化为化合态,属于氮的固定,故选
A;
B.氨气和硫酸反应制取铵态氮肥,氮元素不是由游离态转化为化合态,不属于氮的固定,
故不选B;
C.氨基酸合成人体所需的蛋白质,氮元素不是由游离态转化为化合态,不属于氮的固定,
故不选C;
D.硝酸盐在细菌作用下生成氮气,氮元素由化合态转化为游离态,不属于氮的固定,故
不选D;
选A。
7.下列物质不属于碱性氧化物的是
A. B.CaO C. D.
学科网(北京)股份有限公司【答案】D
【详解】
A.NaO与水反应生成氢氧化钠、与酸反应生成钠盐和水,属于碱性氧化物,故A不选;
2
B. CaO与水反应生成氢氧化钙、能够与酸反应生成盐和水,是碱性氧化物,故B不选;
C. Fe O 能够与酸反应生成盐和水,是碱性氧化物,故C不选;
2 3
D. NO 与水反应生成硝酸和NO,发生了氧化还原反应,不属于碱性氧化物,故D选;
2
答案选D。
8.硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境
问题也日益受到关注,下列说法正确的是
A.NO 和SO 均为酸性氧化物,是酸雨的主要成因
2 2
B.汽车尾气中产生NO的原因是汽车燃料油中含氮,NO是其燃烧产物
C.植物直接吸收利用空气中的NO和NO 作为肥料,实现氮的固定
2
D.工业废气中的SO 可采用石灰法进行脱除
2
【答案】D
【详解】
A.NO 与碱反应生成硝酸盐、亚硝酸盐和水,发生了氧化还原反应,NO 不属于酸性氧化
2 2
物,SO 属于酸性氧化物,是酸雨的主要成因,A错误;
2
B.汽车燃油的成分是烃类,不含N元素,而汽车尾气中产生NO的原因是空气中的N 和
2
O 在高温条件下反应生成了NO,B错误;
2
C.氮的固定是指将游离态的氮转化为化合态的过程,C错误;
D.工业废气中的SO 可采用石灰法进行脱除,原理为2CaO+2SO+O 2CaSO,减少
2 2 2 4
SO 的排放,D正确;
2
故答案为:D。
9.尾号限行制度是为了缓解城市交通压力、改善空气质量而催生的一种交通制度。下列气
体中,主要来自汽车尾气并能形成“酸雨”的是
A.O B.N C.CO D.NO
2 2 2 2
【答案】D
【详解】
A.O 是空气的成分,不会造成环境污染,A不符合题意;
2
B.N 是空气的成分,不会造成环境污染,B不符合题意;
2
C.CO 是空气的成分,空气中CO 含量过多会形成温室效应,而不会造成环境污染,C不
2 2
学科网(北京)股份有限公司符合题意;
D.空气中的N 与 O 在汽车的气缸中,在高温下反应产生NO,NO 再被O 氧化产生
2 2 2 2
NO ,由汽车的尾气排放管排入空气中,NO 与空气中的水反应产生HNO 和NO,因此会
2 2 3
形成酸雨,D符合题意;
故合理选项是D。
10.由NO、H、CO 组成的混合气体,通过足量的Na O 粉末充分反应后,再用电火花引
2 2 2 2
燃使其充分反应,最终得到质量分数为70%的硝酸,且无任何气体剩余。则原混合气体中
NO、H、CO 的体积比为
2 2
A.2:4:5 B.2:4:7 C.2:4:9 D.3:5:8
【答案】B
【详解】
设得到70%的硝酸100g,70%的硝酸中n(HNO)= = mol,n(H O)= =
3 2
mol,其中n(H):n(N):n(O)=(2× mol+ mol):
mol:( mol+3× mol)=4:1:4.5,通过足量NaO 后,n(O )= n(CO),n(H ):n(NO):
2 2 2 2 2
n(O )= :1: =2:1:1.75,则n(H ):n(NO):n(CO)=2:1:3.5,即:n(NO):
2 2 2
n(H ):n(CO)=2:4:7,故答案为:B。
2 2
二、非选择题
11.汽车尾气中含有CO、NO等多种污染物,已成为城市空气的主要污染源。汽油和柴油
中基本不含氮元素,那么汽车尾气中的NO是如何产生的?请推测可能的原因______,并
写出有关反应的化学方程式_______。
【答案】在点火和燃烧条件下,空前中的氮气和氧气发生反应生成NO
【详解】
空气中存在大量的氮气和氧气,虽然汽油和柴油中基本不含氮元素,但是在点火和燃烧条
学科网(北京)股份有限公司件下,空前中的氮气和氧气发生反应生成NO,反应的化学方程式: 。
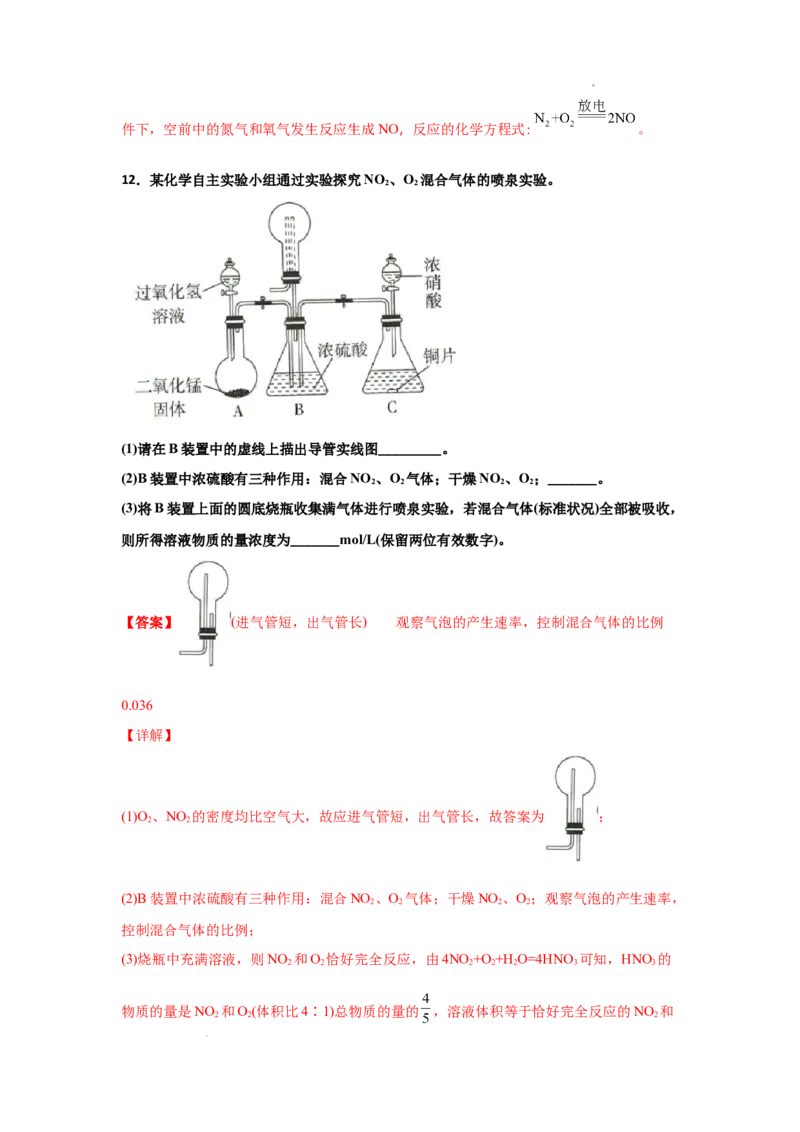
12.某化学自主实验小组通过实验探究NO 、O 混合气体的喷泉实验。
2 2
(1)请在B装置中的虚线上描出导管实线图_________。
(2)B装置中浓硫酸有三种作用:混合NO 、O 气体;干燥NO 、O;_______。
2 2 2 2
(3)将B装置上面的圆底烧瓶收集满气体进行喷泉实验,若混合气体(标准状况)全部被吸收,
则所得溶液物质的量浓度为_______mol/L(保留两位有效数字)。
【答案】 (进气管短,出气管长) 观察气泡的产生速率,控制混合气体的比例
0.036
【详解】
(1)O 、NO 的密度均比空气大,故应进气管短,出气管长,故答案为 ;
2 2
(2)B装置中浓硫酸有三种作用:混合NO 、O 气体;干燥NO 、O;观察气泡的产生速率,
2 2 2 2
控制混合气体的比例;
(3)烧瓶中充满溶液,则NO 和O 恰好完全反应,由4NO +O +H O=4HNO 可知,HNO 的
2 2 2 2 2 3 3
物质的量是NO 和O(体积比4∶1)总物质的量的 ,溶液体积等于恰好完全反应的NO 和
2 2 2
学科网(北京)股份有限公司O 的总体积,设烧瓶中恰好完全反应的NO 和O 的总体积为V,则所得溶液浓度为
2 2 2
。
学科网(北京)股份有限公司学科网(北京)股份有限公司