文档内容
腾冲市第八中学2024--2025学年下学期高一年级期中考试 A.酸雨的 :
化学试卷 B.盛放 溶液的试剂瓶不能用玻璃塞:2OH- + SiO = +H ↑
2 2
可能用到的相对原子质量:H—1 C—1 2N—14 O—16 S—32 Cr—52 Fe—
C.过量铁粉与稀硝酸反应,产生无色气体:
56
D.实验室用 溶液吸收 尾气:
第Ⅰ卷(选择题 共42分)
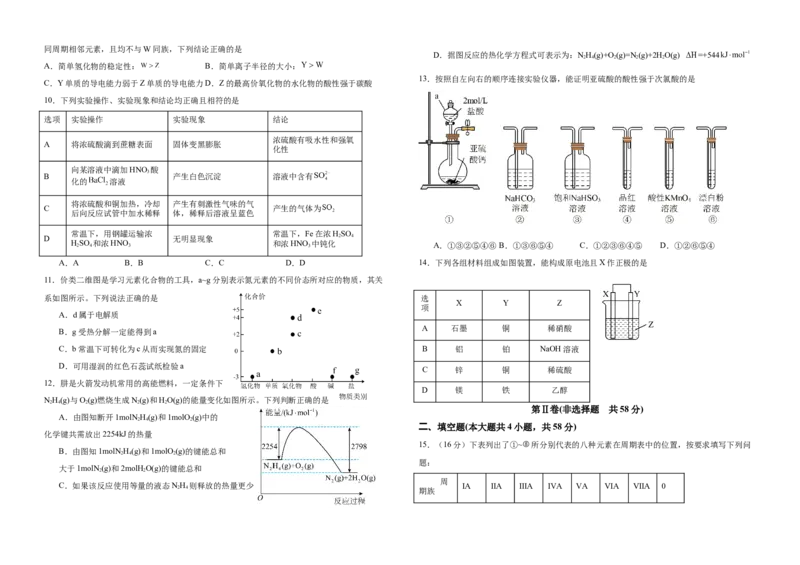
6.在给定条件下,下列选项中所示的物质间转化均能实现的是
一、单项选择题(本大题共14小题,每小题3分,共42分。在每小题所给的四个选
项中,只有一项是符合题目要求的。)
A.
1.下列关于SO 和SO 的有关说法错误的是
2 3
A.食品工业用SO 作抗氧化剂,是利用其还原性
2
B.
B.SO 和SO 都有氧化性,都可以被HS还原
2 3 2
C.硫在空气中燃烧主要生成SO ,同时有少量SO
3 2
C.
D.SO 和SO 都是酸性氧化物,都能与水反应
2 3
2.能贮存在带磨口塞的玻璃试剂瓶中的试剂是
D.
A.KOH溶液 B.浓HSO C.水玻璃 D.氢氟酸
2 4
3.下列变化中属于吸热反应的是 7.物质的性质决定用途,下列两者对应关系不正确的是
①干冰升华 ②将胆矾加热变为白色粉末 ③苛性钠固体溶于水 A.氧化钙易吸水,可用作干燥剂 B.Si具有半导体性能,可用作芯片
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 C.过氧化钠能与二氧化碳反应生成氧气,可作潜水艇中的供氧剂
A.①②④ B.②④ C.③⑤ D.①② D.小苏打受热易分解,可用于治疗胃酸过多
8.一定温度下向容器中加入A发生反应如下:①A→B,②A→C,③B C.反应体系中
4.设 为阿伏加德罗常数的值,下列说法错误的是
A、B、C的浓度随时间t的变化曲线如图所示。下列说法错误的是
A.标准状况下, 含有的原子数为 A.反应开始至t 时,化学反应速率①>②
1
B.t 时,B的消耗速率大于生成速率
2
B.加热条件下,64克的铜与足量的硫黄完全反应转移的电子数为
C.t 时,c(C)=c -c(B)
3 0
C. 和 在一定条件下充分反应,生成 分子的数目小于
D.t 后,反应停止了
3
9.我国嫦娥五号探测器带回1.731kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中
D. 和 的固体混合物中含有的阳离子数为
含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15,X、Y、Z为
5.下列化学或离子方程式正确的是同周期相邻元素,且均不与W同族,下列结论正确的是
D.据图反应的热化学方程式可表示为:NH(g)+O(g)=N(g)+2HO(g) =+544
2 4 2 2 2
A.简单氢化物的稳定性: B.简单离子半径的大小:
13.按照自左向右的顺序连接实验仪器,能证明亚硫酸的酸性强于次氯酸的是
C.Y单质的导电能力弱于Z单质的导电能力D.Z的最高价氧化物的水化物的酸性强于碳酸
10.下列实验操作、实验现象和结论均正确且相符的是
选项 实验操作 实验现象 结论
浓硫酸有吸水性和强氧
A 将浓硫酸滴到蔗糖表面 固体变黑膨胀
化性
向某溶液中滴加HNO 酸
3
B 产生白色沉淀 溶液中含有
化的 溶液
将浓硫酸和铜加热,冷却 产生有刺激性气味的气
C 产生的气体为
后向反应试管中加水稀释 体,稀释后溶液呈蓝色
常温下,用钢罐运输浓 常温下,Fe在浓HSO
D 无明显现象 2 4
H 2 SO 4 和浓HNO 3 和浓HNO 3 中钝化 A.①③②⑤④⑥ B.①③⑥⑤④ C.①②③⑥④⑤ D.①②⑥⑤④
A.A B.B C.C D.D 14.下列各组材料组成如图装置,能构成原电池且X作正极的是
11.价类二维图是学习元素化合物的工具,a~g分别表示氮元素的不同价态所对应的物质,其关
系如图所示。下列说法正确的是 选
X Y Z
项
A.d属于电解质
A 石墨 铜 稀硝酸
B.g受热分解一定能得到a
C.b常温下可转化为c从而实现氮的固定 B 铝 铂 NaOH溶液
D.可用湿润的红色石蕊试纸检验a
C 锌 铜 稀硫酸
12.肼是火箭发动机常用的高能燃料,一定条件下
D 镁 铁 乙醇
NH(g)与O(g)燃烧生成N(g)和HO(g)的能量变化如图所示。下列判断正确的是
2 4 2 2 2
第Ⅱ卷(非选择题 共58分)
A.由图知断开1molN H(g)和1molO (g)中的
2 4 2
二、填空题(本大题共4小题,共58分)
化学键共需放出2254kJ的热量
15.(16分)下表列出了①~⑧所分别代表的八种元素在周期表中的位置,按要求填写下列问
B.由图知1molN H(g)和1molO (g)的键能总和
2 4 2
题:
大于1molN (g)和2molH O(g)的键能总和
2 2
周
C.如果该反应使用等量的液态NH 则释放的热量更少 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 4 期族1 ①
②
2 ② ③ 则CO与水蒸气反应的热化学反应方程式为 。
3 ④ ⑤ ⑥ (4) 是一种绿色燃料,已知:键能是指气态分子中1mol化学键解离成气态原子所吸收的能量。
4 ⑦ ⑧
(1)①~⑧八种元素中,非金属性最强的元素是 (填写元素符号)。
(2)元素②与①组成的某化合物,其分子为18电子体,分子中两种元素原子个数的最简比为 ,
化学键 H−H H−O
则该分子的电子式为 。
键能/( ) 436 x 463
(3)④、⑥、⑦三种元素形成的离子,半径由大到小的顺序为 (用离子符号表示)。
(4)Mg和元素④的单质作电极材料,氢氧化钠溶液作电解质溶液,能设计成原电池,则该电池 已知 的燃烧热为286kJ·mol-1,则 的键能x= kJ·mol-1.
负极反应式为 。
(5)用 稀 与 溶液在如图所示的装置中进行反应测
(5)写出碳单质与元素②最高价氧化物对应水化物的浓溶液在加热条件下反应的化学方程式
。 定中和热。
(6)工业生产上常采用二氧化硫作还原剂吸收⑧的单质,写出其离子方程式 。 ①图中缺少的一种仪器是 。
(7)⑤的氧化物是一种酸性氧化物,能与强碱溶液反应,写出其离子方程式 。 ②若上述实验所测中和热数值偏大,产生偏差的原因可
16、(12分)资源、能源等是当今社会重要的研究主题,人类从自然界中开发资源,并转化 能是 (填序号)。
为可供人类生活使用的能源,如热能、电能等,请回答下列相关的问题。 a.使用铜制搅拌器
(1)已知8gCH 燃烧放出的热量为445KJ。
4 b.量筒量取 溶液的体积时仰视读数
甲烷燃烧热的热化学方程式为 。
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
(2)下列反应中,属于放热反应的是 (填字母)。
d.配制NaOH溶液定容时俯视刻度线
A.灼热的碳与二氧化碳反应 B.盐酸与
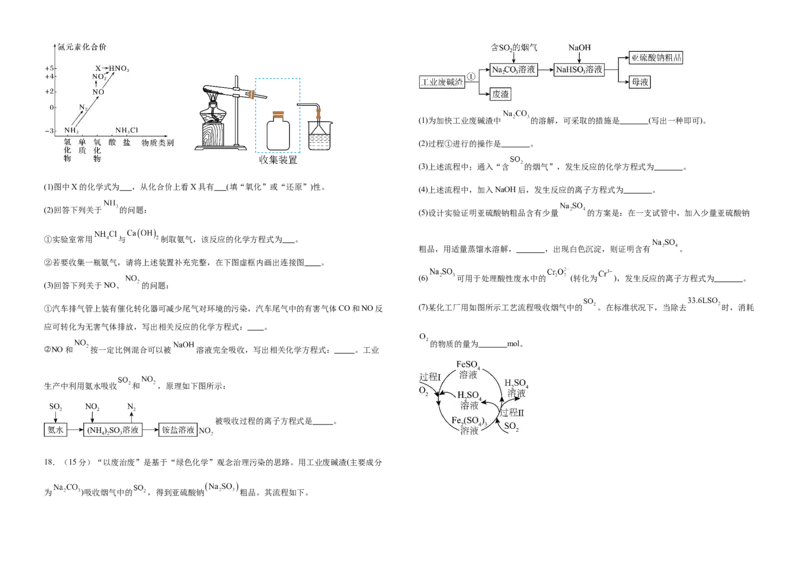
17.(15分)依据下图中氮元素及其化合物的转化关系,回答问题:
C.铝和盐酸反应 D.葡萄糖在人体内氧化分解
E.
(3)已知:①(1)为加快工业废碱渣中 的溶解,可采取的措施是 (写出一种即可)。
(2)过程①进行的操作是 。
(3)上述流程中;通入“含 的烟气”,发生反应的化学方程式为 。
(1)图中X的化学式为 ,从化合价上看X具有 (填“氧化”或“还原”)性。
(4)上述流程中,加入NaOH后,发生反应的离子方程式为 。
(2)回答下列关于 的问题:
(5)设计实验证明亚硫酸钠粗品含有少量 的方案是:在一支试管中,加入少量亚硫酸钠
①实验室常用 与 制取氨气,该反应的化学方程式为 。
粗品,用适量蒸馏水溶解, ,出现白色沉淀,则证明含有 。
②若要收集一瓶氨气,请将上述装置补充完整,在下图虚框内画出连接图 。
(6) 可用于处理酸性废水中的 (转化为 ),发生反应的离子方程式为 。
(3)回答下列关于NO、 的问题:
①汽车排气管上装有催化转化器可减少尾气对环境的污染,汽车尾气中的有害气体CO和NO反 (7)某化工厂用如图所示工艺流程吸收烟气中的 。在标准状况下,当除去 时,消耗
应可转化为无害气体排放,写出相关反应的化学方程式: 。
的物质的量为 mol。
②NO和 按一定比例混合可以被 溶液完全吸收,写出相关化学方程式: 。工业
生产中利用氨水吸收 和 ,原理如下图所示:
被吸收过程的离子方程式是 。
18.(15分)“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分
为 )吸收烟气中的 ,得到亚硫酸钠 粗品。其流程如下。参考答案 ;
题号 1 2 3 4 5 6 7 8 9 10
(5)碳单质与元素②最高价氧化物对应水化物的浓溶液浓硝酸,在加热条件下反应生成二氧
答案 C B B A D C D D A D
题号 11 12 13 14
答案 D C A A
15.(1)F
化氮、二氧化碳和水,化学方程式: ;
(2)
(6)用二氧化硫作还原剂吸收溴单质,两者发生氧化还原反应生成HBr和硫酸,反应为:
(3)Cl->K+>Al3+
;
(4)
(7)⑤的氧化物二氧化硅是一种酸性氧化物,能与强碱溶液反应生成硅酸根离子和水,
(5) 。
16.(1)CH (g)+2O(g)=CO (g)+2HO(l) =-890.0kJ/mol
4 2 2 2
(6)
(2)CD
(3)CO(g)+H O(g)=CO(g)+H(g) ΔH=−41.3 kJ∙mol−1
(7) 2 2 2
(4)496kJ∙mol−1
【详解】(1)同周期从左到右,金属性减弱,非金属性变强;同主族由上而下,金属性增强,
(5) 玻璃搅拌器 b
非金属性变弱;①~⑧八种元素中,非金属性最强的元素是F;
【详解】(1)8gCH 为0.5mol,燃烧放出的热量为445kJ。则1mol甲烷燃烧放出热量为890
4
(2)
kJ,故甲烷燃烧热的热化学方程式为:CH(g)+2O(g)=CO (g)+2HO(l) =-890.0kJ/mol;
4 2 2 2
元素②与①组成的某化合物,其分子为18电子体,分子中两种元素原子个数的最简比为 ,
(2)A.碳为还原剂的氧化还原反应(燃烧除外)是吸热反应即灼热的碳与二氧化碳反应是吸热
反应,故A不符合题意;
则该分子为NH,电子式为 ;
2 4 B.盐酸与 是吸热反应,故B不符合题意;
(3)电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小;④、⑥、⑦三种元 C.一般金属和酸或水的反应是放热反应即铝和盐酸反应是放热反应,故C符合题意;
素形成的离子,半径由大到小的顺序为Cl->K+>Al3+; D.一般缓慢氧化反应是放热反应即葡萄糖在人体内氧化分解是放热反应,故D符合题意;
(4)Mg和Al的单质作电极材料,氢氧化钠溶液作电解质溶液,氢氧化钠和镁不反应、和铝反
E. 是吸热反应,故E不符合题意;
应生成四羟基合铝酸钠和氢气,则Al失去电子发生氧化反应为负极,则该电池负极反应式为:
故选CD。(3)将第二个方程式减去第一个方程式得到CO与水蒸气反应的热化学反应方程式为:CO(g)
(3) 2NO+2CO N+2CO NO+NO +2NaOH=2NaNO+HO
+H O(g)=CO(g)+H(g),故ΔH=(+90 kJ∙mol−1)-(+131.3 kJ∙mol−1)=−41.3 kJ∙mol−1; 2 2 2 2 2
2 2 2
(4)根据题中化学键键能得到燃烧生成气态水的热化学方程式为 O(g)+H(g)= H O(g),ΔH=
2 2 2
(436 kJ∙mol−1+ x)-(463×2 )kJ∙mol−1;则 的燃烧热的热化学反应方程式为: O(g) 【详解】(1)X中氮元素化合价是+5,氧化物的化学式为 NO,氮元素处于最高价,因此X
2 2 5
具有氧化性。
+H (g)= H O(l) ΔH=(436 kJ∙mol−1+ x)-(463×2 )kJ∙mol−1+(-44 kJ∙mol−1)=-286kJ·mol-1,故
2 2
(2)①NH Cl与Ca(OH) 反应生成氯化钙、氨和水,化学方程式为:Ca(OH) +2NH Cl
4 2 2 4
x=496kJ∙mol−1;
(5)①观察图中装置可知缺少了环形玻璃搅拌器; CaCl +2NH ↑+2HO;
2 3 2
②a.使用铜制搅拌器,铜是金属有导热性,会造成热量散失,测的数值偏小,a不符合题意; ②氨气极易溶于水,比空气轻,收集方法只能用向下排空气法收集,导气管位置短进长出,即
b.量筒量取 溶液的体积时仰视读数,硫酸的量偏多,与过量氢氧化钠反应放出更多的热
量,测得数值偏大,b符合题意;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,过程中会造成热量损失造成测得数值偏小,
c不符合题意;
d.配制NaOH溶液定容时俯视刻度线,NaOH溶液浓度偏高,反应放出的热量以硫酸的量进行
为 。
计算,对中和热数值无影响,d不符合题意;
故选b。
17.(1) N O 氧化性
2 5
(3)①CO和NO反应可转化为无害气体,无害气体为氮气,故反应的方程式为2NO+2CO
N+2CO;
2 2
(2) Ca(OH) +2NH Cl CaCl +2NH ↑+2HO
2 4 2 3 2
②NO和NO 按一定比例与NaOH溶液反应生成亚硝酸钠,反应的方程式为NO+NO +
2 2
2NaOH=2NaNO+HO;
2 2
反应物是亚硫酸铵、二氧化氮,生成物是硫酸铵和氮气,则NO 被吸收过程的离子方程式是
2。 加入 溶液。
18.(1)搅拌(粉碎、加热)
(6)1mol 得6mol电子,1mol 失2mol电子,根据得失电子守恒及元素守恒得反应离
(2)溶解、过滤
(3) 子方程式: ,故答案为:
(4)
。
(5)加入过量稀盐酸,再加入 溶液
(7)标准状况下,当利用上述工艺流程除去33.6LSO 时, ,
2
(6)
, ,根据
(7)0.75
【详解】(1)为加快工业废碱渣中 的溶解,可将废碱渣粉碎增大接触面积,或者升高
SO ~2FeSO ~ O,则消耗O 的物质的量为0.75mol,故答案为:0.75。
2 4 2 2
温度,加快溶解速率,故答案为:搅拌(粉碎、加热)。
(2)过程①实现固液分离,应采用过滤操作,故答案为:溶解、过滤。
(3)通入“含 的烟气”,发生反应的化学方程式为:
,故答案为: 。
(4)加入NaOH与溶液中 反应生成亚硫酸钠,离子方程式为
,故答案为: 。
(5)证明亚硫酸钠粗品含有少量 ,应先用足量盐酸除去亚硫酸钠,再加氯化钡观察白
色沉淀,具体操作:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,加足量盐酸
酸化,再加氯化钡溶液,出现白色沉淀,则证明含有 ,故答案为:加入过量稀盐酸,再