文档内容
静海一中2024-2025第二学期高一化学(3月)
学生学业能力调研试卷
考生注意:
本试卷分第Ⅰ卷基础题(78分)和第Ⅱ卷提高题(19分)两部分,共97分。
3分卷面分。
知 识 与 技 能 学习能力(学法)
内容 硫 氮 硅 反应热 易混易错 规律提炼
分数 40 41 8 8 10 4
相对原子质量:H:1 N:14 O:16 Cu:64
第Ⅰ卷 基础题(共78分)
一、选择题: 每小题2分,共30分。
1.下列说法中不正确的是
A. 动力电池和超轻海绵使用了石墨烯材料,该材料不是新型无机非金属材料
B. 传统硅酸盐材料包括陶瓷、水泥、普通玻璃
C. 氢氟酸可用于蚀刻普通玻璃
D. 北斗导航系统计算机的芯片材料是单质硅
2.下列说法不正确的是
A. 硫是一种黄色的难溶于水,微溶于酒精,易溶于CS 的固体
2
B. 硫的化合物常存在于火山喷出的气体中和矿泉水里
C. 硫易燃烧,其燃烧产物是大气污染物之一
D. 二氧化硫不能用来漂白食品,但可以用作葡萄酒的防腐剂和抗氧化剂
3.下列变化过程,属于放热反应的是
①液态水变成水蒸气 ②Ba(OH) ·8H O与NH Cl反应 ③Al与Fe O 高温下反应
2 2 4 3 4
④固体NaOH溶于水 ⑤H 在Cl 中燃烧 ⑥食物腐败
2 2
A.②⑤⑥ B.②③④ C.③④⑤ D.③⑤⑥
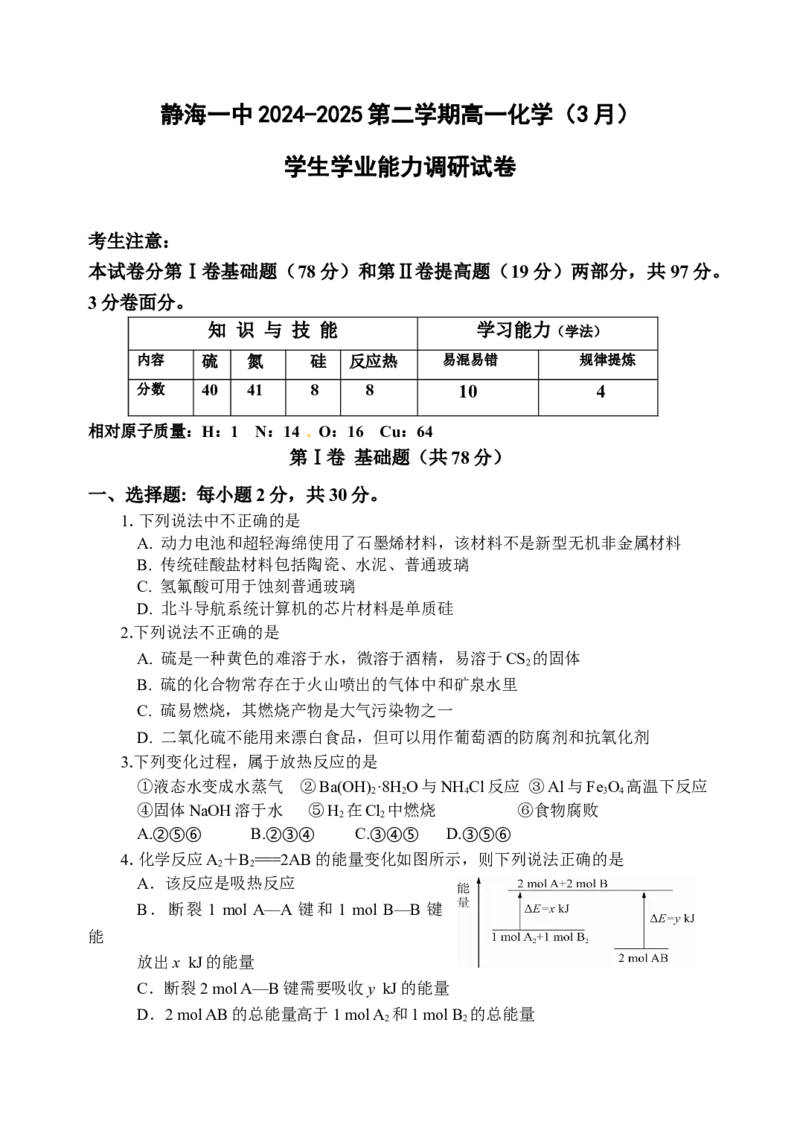
4.化学反应A+B ===2AB的能量变化如图所示,则下列说法正确的是
2 2
A.该反应是吸热反应
B.断裂 1 mol A—A 键和 1 mol B—B 键
能
放出x kJ的能量
C.断裂2 mol A—B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A 和1 mol B 的总能量
2 25.下列有关氮元素的单质及其化合物的说法错误的是
①氮气与足量的氧气在放电条件下可直接生成NO
2
②铵盐都不稳定,受热分解都生成氨气
③向Fe(NO ) 溶液中滴加稀盐酸,无明显的变化
3 2
④氨的催化氧化生成NO ,是工业制硝酸的基础
2
⑤NH 易液化,液氨常用作制冷剂
3
A. ①②③④ B. ①③⑤ C. ①④⑤ D. ①③④
6.下列关于浓硫酸与稀硫酸的说法中不正确的是
A.浓硫酸使硫酸铜晶体变白,体现了浓硫酸的吸水性
B.浓硫酸有氧化性,稀硫酸没有氧化性
C.用玻璃棒各蘸少许涂在纸上,可以区别浓硫酸和稀硫酸
D.常温下,浓硫酸和稀硫酸都不能与铜反应
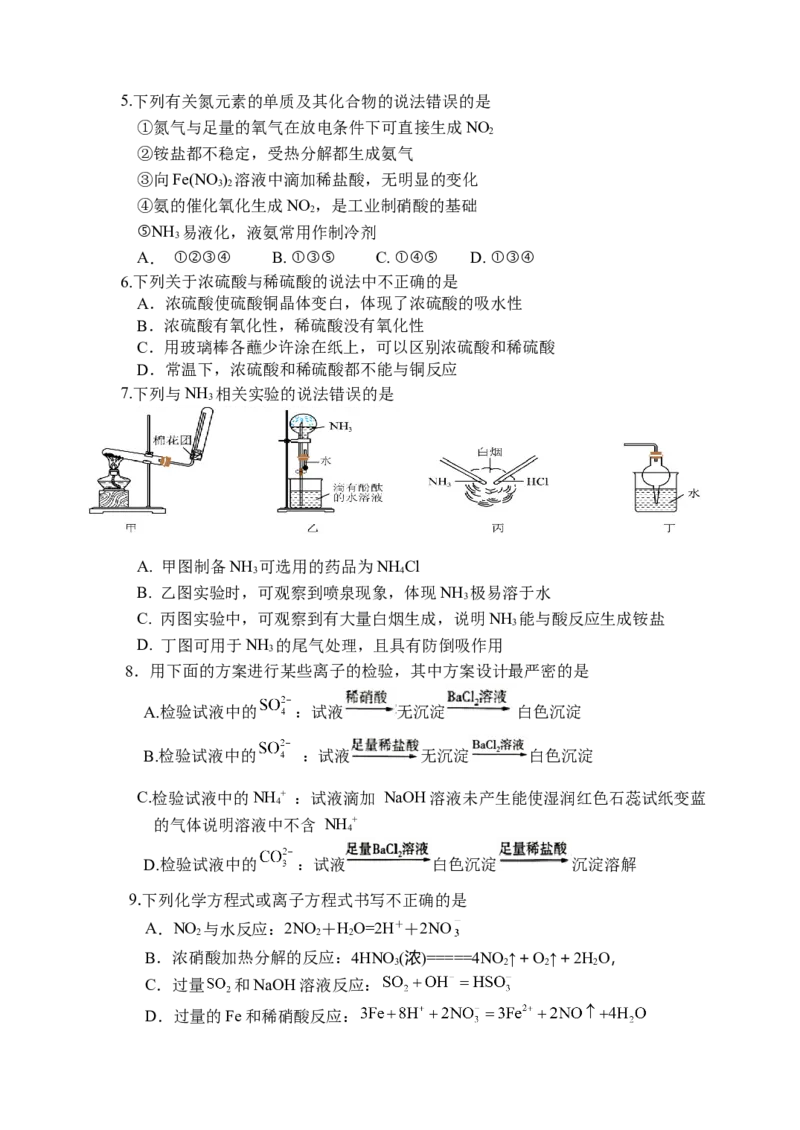
7.下列与NH 相关实验的说法错误的是
3
A. 甲图制备NH 可选用的药品为NH Cl
3 4
B. 乙图实验时,可观察到喷泉现象,体现NH 极易溶于水
3
C. 丙图实验中,可观察到有大量白烟生成,说明NH 能与酸反应生成铵盐
3
D. 丁图可用于NH 的尾气处理,且具有防倒吸作用
3
8.用下面的方案进行某些离子的检验,其中方案设计最严密的是
A.检验试液中的 :试液 无沉淀 白色沉淀
B.检验试液中的 :试液 无沉淀 白色沉淀
C.检验试液中的NH + :试液滴加 NaOH溶液未产生能使湿润红色石蕊试纸变蓝
4
的气体说明溶液中不含 NH +
4
D.检验试液中的 :试液 白色沉淀 沉淀溶解
9.下列化学方程式或离子方程式书写不正确的是
A.NO 与水反应:2NO +HO=2H++2NO
2 2 2
B.浓硝酸加热分解的反应:4HNO(浓)=====4NO ↑+O↑+2HO,
3 2 2 2
C.过量 和NaOH溶液反应:
D.过量的Fe和稀硝酸反应:10.下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是
物质(括号内为杂质) 除杂试剂
A NH (H O) 浓HSO
3 2 2 4
B CO(SO ) KMnO 溶液
2 2 4
C SO (H SO ) 饱和NaHSO、浓HSO
2 2 4 3 2 4
D NO(NO ) HO、无水CaCl
2 2 2
11.下列物质中,能用两种单质直接化合而成的是
①NO ②FeCl ③CuS ④HCl ⑤SO ⑥FeS
2 3 3
A.①②④ B.②④⑥ C.③④⑤ D.①③⑤
12.硫黄在空气中燃烧生成气体甲,甲溶于水得乙溶液,向乙溶液中滴加双氧水,
乙溶液变成丙溶液。向丙溶液里加入NaS生成气体丁,把丁通入乙溶液中得到
2
沉
淀戊。甲、乙、丙、丁、戊均含有硫元素,则它们分别为
A.SO 、HSO 、HSO 、HS、S B.SO 、HSO 、HSO 、S、HS
3 2 4 2 3 2 2 2 3 2 4 2
C.SO 、HSO 、HSO 、S、HS D.SO 、HSO 、HSO 、HS、S
3 2 4 2 3 2 2 2 3 2 4 2
13.已知断裂 1 mol 共价键所需要吸收的能量分别为 H-H 键:436 kJ;I-I 键:153
kJ;H-I 键:299 kJ。下列对反应 H(g)+I(g) 2HI(g)的判断中错误的是
2 2 ⇌
A. 该反应是放出能量的反应 B. 该反应是吸收能量的反应
C. 该反应是氧化还原反应
D. I 与 H 具有的总能量大于生成的 HI 具有的总能量
2 2
14.某小组探究浓硫酸性质,向试管①、②中加入等量的98%的浓硫酸,实验如下。
实验1 实验2 实验3
装置
溶液颜色无明显变化;把 溶液变黄;把湿润的品 溶液变深紫色
现象 蘸浓氨水的玻璃棒靠近试 红试纸靠近试管口,试 (经检验溶液含
管口,产生白烟 纸褪色 单质碘)
下列对实验的分析不合理的是
A.实验1中,白烟是NH Cl B.根据实验1和实验2判断还原性:Br->Cl-
4
C.根据实验3判断还原性:I->Br-
D.上述实验体现了浓HSO 的强氧化性、难挥发性等性质
2 4的
15. 某浓度稀HNO 与金属M反应时,能得到+2价硝酸盐,反应时M与HNO 物
3 3
质的量之比为5 ∶12,则反应时HNO 的还原产物是
3
A. NHNO B. N C. NO D. NO
4 3 2 2
二、填空题:共3小题,共34分.
16.概念辨析(4分)(括号内画“√”或“×”,正确的横线处不填,错误的说明原
因)
(1)自然界中存在大量游离态的硅( )
(2) 中硅的化合价为+4,具有氧化性,能发生 ( )
(3) 属于两性氧化物,能与氢氧化钠溶液反应,也能与氢氟酸反应( )
(4)工业上将氨转化为硝酸和其他含氮化合物的过程被称之为人工固氮( )
17.(20分)依据图1和图2,回答下列问题。
(1)图1能反映出氮元素及其化合物的转化关系。
①X的化学式为 ,X转化为硝酸 (填“是”或“不是”)氧化还原反
应。
②在完成氨气的催化氧化实验时,先用酒精喷灯预热催化剂,然后通入反应气体,
当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达700℃以上。说
明反应过程中断键的总能量 (填“大于”、“小于”或“等于”)成键的总能
量。
③若要将NH 转化为N,从原理上分析,下列试剂可行的是 (填字母)。
3 2
A.O B.Na C.NH Cl D.NO
2 4 2
(2)(易混易错)NO 与水反应的化学方程式为_________________。
2
该反应中氧化剂和还原剂的物质的量之比为___________。
(学法题)如何根据元素的化合价判断其性质
(3)(规律提炼)根据物质的性质可进行分离提纯,用化学沉淀法可以去除粗盐中
的杂质离子,比如向粗盐水中滴加过量的BaCl ,使SO 2-沉淀,检验SO 2-沉淀完全
2 4 4
的方法 。
(4)图2为实验室制取氨气的实验装置。若要收集一瓶氨气,请将上述装置补充完整,在图2虚框内画出连接图 。
(5)氯碱工业中可用氨气检查氯气管道是否泄漏,泄漏的氯气遇到氨气会产生白烟,
反
应的化学方程式为 。
18.(10分)A、B、C、是中学化学中常见的物质,它们之间的转化关系如图所示(部
分产物已略去),请回答下列问题:
(1)若X是强氧化性单质,则A不可能是_____(填序号)。
a.C b.N c.S d.Na e.Mg
2
(2)若B是能使品红试液褪色的无色气体,则B转化为C的化学方程式为:_____。
(3)若A、B、C三种化合物的水溶液均呈酸性,写出A和B反应的化学方程式:
_____。C溶于水会生成D,D的浓溶液与铜加热时反应产生了1.12L气体(标况
下),则被还原的D的物质的量是_____mol,转移的电子数是_____个。
三、实验题:共1小题,共14分.
19.氮的氧化物(NO )是大气污染物之一,工业上在一定温度和催化剂条件下用NH
x 3
将NO 还原生成N。某同学在实验室中对NH 与NO 反应进行了探究。
x 2 3 2
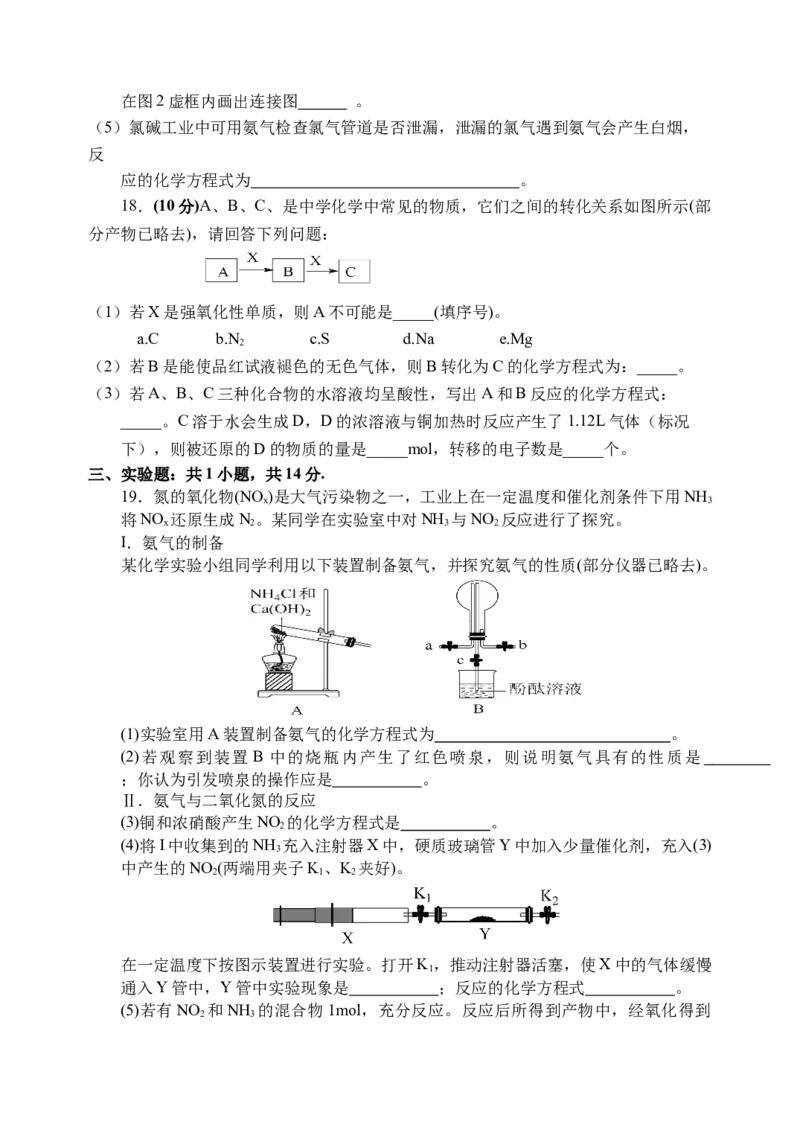
I.氨气的制备
某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。
(1)实验室用A装置制备氨气的化学方程式为 。
(2)若观察到装置 B 中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是
;你认为引发喷泉的操作应是 。
Ⅱ.氨气与二氧化氮的反应
(3)铜和浓硝酸产生NO 的化学方程式是 。
2
(4)将I中收集到的NH 充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入(3)
3
中产生的NO (两端用夹子K、K 夹好)。
2 1 2
在一定温度下按图示装置进行实验。打开K,推动注射器活塞,使X中的气体缓慢
1
通入Y管中,Y管中实验现象是 ;反应的化学方程式 。
(5)若有NO 和NH 的混合物1mol,充分反应。反应后所得到产物中,经氧化得到
2 3的N 比经还原得到的N 多1.4g,则反应混合物中NO 与NH 的体积比是
2 2 2 3
第Ⅱ卷 提高题(共19分)
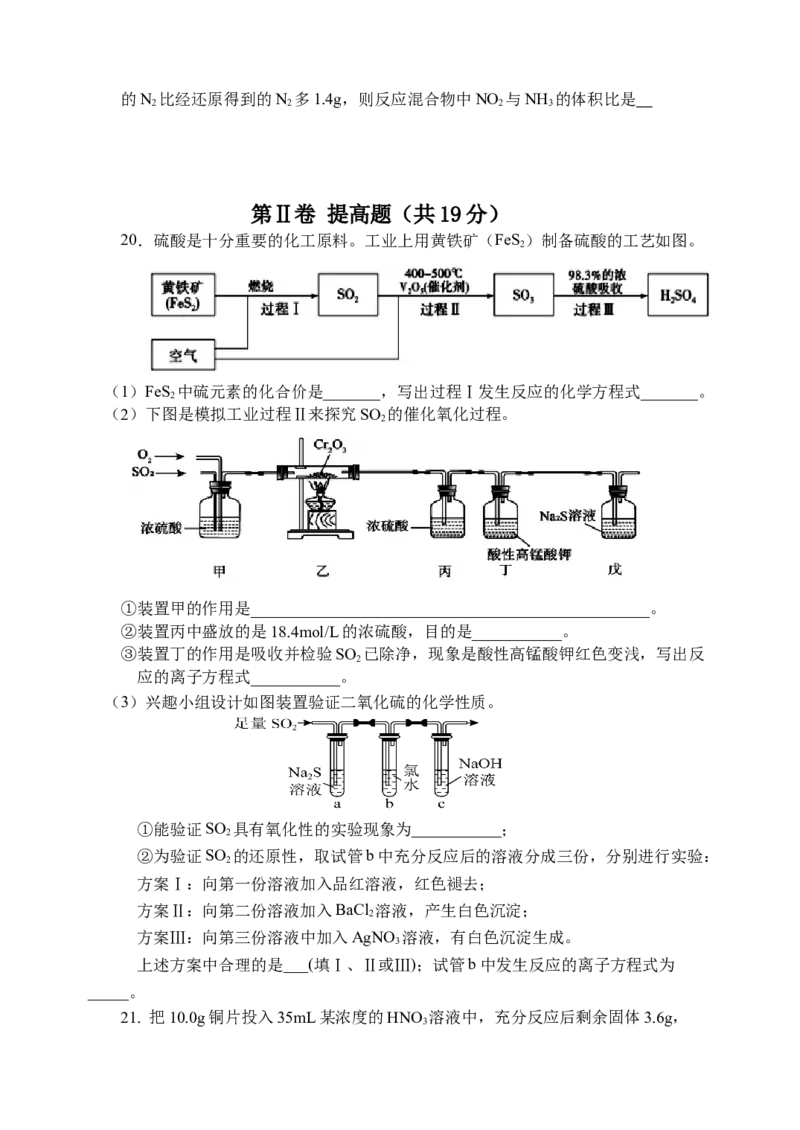
20.硫酸是十分重要的化工原料。工业上用黄铁矿(FeS)制备硫酸的工艺如图。
2
(1)FeS 中硫元素的化合价是_______,写出过程Ⅰ发生反应的化学方程式_______。
2
(2)下图是模拟工业过程Ⅱ来探究SO 的催化氧化过程。
2
①装置甲的作用是_________________________________________________。
②装置丙中盛放的是18.4mol/L的浓硫酸,目的是___________。
③装置丁的作用是吸收并检验SO 已除净,现象是酸性高锰酸钾红色变浅,写出反
2
应的离子方程式___________。
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。
①能验证SO 具有氧化性的实验现象为___________;
2
②为验证SO 的还原性,取试管b中充分反应后的溶液分成三份,分别进行实验:
2
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去;
方案Ⅱ:向第二份溶液加入BaCl 溶液,产生白色沉淀;
2
方案Ⅲ:向第三份溶液中加入AgNO 溶液,有白色沉淀生成。
3
上述方案中合理的是___(填Ⅰ、Ⅱ或Ⅲ);试管b中发生反应的离子方程式为
_____。
21. 把10.0g铜片投入35mL某浓度的HNO 溶液中,充分反应后剩余固体3.6g,
3产生NO 和NO的混合气体为0.15mol。若不考虑NO 的存在,则
2 2 4
(1)原HNO 溶液的物质的量浓度为 mol/L
3
(2)将盛有混合气体的试管倒扣在水槽中,通入标况下的 O ,恰好使气体完全溶
2
于水中,则通入O 的体积是 mL
2
静海一中2024-2025第二学期高一化学(3月)
答案
一、选择题: 每小题2分,共30分.
题号 1 2 3 4 5 6 7 8
答案 A B D C A B A B
题号 9 10 11 12 13 14 15
答案 A C B D B C B
二、填空题:共3小题,共34分.
16.(4分)(1)× 自然界的硅元素主要以硅酸盐和氧化物的形式存在。
(2)√ (3)× 二氧化硅不是两性氧化物。
(4)× 氮的固定是指将游离态的氮转化为化合态。(每题1分)
17.(20分)(1)①NO 不是 ②小于 ③AD
2 5
(2) 3NO+HO==2HNO+NO 1:2 (学法)最高正价只具氧化性,最低负价只具还原
2 2 3
性,中间价态既有氧化性又有还原性
(3)静置后,向上层清液中继续滴加BaCl,若溶液中不出现浑浊,表明SO2-已沉淀
2 4
完全。
(4) (5)3Cl+8NH=6NHCl+N (每空2分)
2 3 4 2
18.(10 分)(1)e (2)2SO+O 2SO (3)2HS+ SO=3S+2HO 0.05
2 2 3 2 2 2
0.1N
A
( 每空2分)
19.(14分)(1) Ca(OH)+2NHCl CaCl+2NH↑+2HO
2 4 2 3 2
(2) 极易溶于水且与水反应生成碱性物质 打开止水夹,用手(或热毛巾等)将
烧瓶捂热,氨气受热膨胀,使氨气与酚酞溶液接触,即产生喷泉
(3)Cu+4HNO(浓)=Cu(NO)+2NO↑+2HO
3 3 2 2 2
(4) Y管中红棕色变淡(或消失) 8NH+6NO 7N+12HO
3 2 2 2
(5) 3:7或者3:2 (每空2分)
燃烧
20.(15分)(1)-1 (1分) 4FeS+11O===2FeO+8SO
2 2 2 3 2(2)干燥气体、混合气体、通过观察气泡调节气体流速 吸收SO
3
5SO+2MnO-+2HO==5SO2-+2Mn2++4H+
2 4 2 4
(3)有浅黄色沉淀生成或出现浑浊
(4)Ⅱ SO+Cl+2HO=4H++SO +2Cl- (除标注外每空2分)
2 2 2
21.(4分)(1)10mol/L (2)1120(每空2分)