文档内容
静海一中2025-2026第一学期高一化学(12月)
学生学业能力调研试卷
考生注意:
本试卷分第Ⅰ卷基础题(77分)和第Ⅱ卷提高题(23分)两部分,含3分卷
面分,满分共100分。
知 识 与 技 能 学习能力(学法)
内容 钠和氯 物质的量 金属材料 原子结构 易混易错 规律提炼
分数 30 25 36 6 11 8
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Fe 56
Cl 35.5 Cu 64
第Ⅰ卷 基础题(共77分)
一、选择题: 每小题3分,共36分.
1. 我国古代冶金技术享誉世界,下列关于古代合金的说法,错误的是
A. 《考工记》“六分其金而锡居一,为钟鼎之齐”——铜锡合金(青铜)熔点低于纯
铜,易铸造,故可制礼器
B. 汉代“铁犁牛耕”推广——生铁(铁碳合金)硬度大于纯铁,强度高,能适配农耕
时翻土需求
C. 战国“司南”(磁石勺+铜底座)稳定指示——纯铜磁性优于青铜(铜锡合金),
能辅助磁石定位,故底座选用纯铜而非青铜
D. 唐代银器盛行,“925银”广泛用于首饰——银铜合金硬度大于纯银,不易变形,
更适配首饰加工与使用
2.下列叙述正确的是
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两原子,如果核外电子排布相同,则一定属于同种元素
D.只有在原子中,质子数才与核外电子数相等
3.2025年10月,中国对稀土出口实施更严格的管制措施。铈( )是稀土元素中丰度最
高的元素,广泛应用于医药、玻璃、纺织等工业。下列关于 和 的说法中正
确的是
A. 和 互为同位素 B. 和 都含有58个中子C. 和 含有不同的质子数 D. 和 含有不同的电子数
4.下列说法不正确的是
A.Fe O 常用作红色油漆的原料 B.所有的不锈钢都只含有金属元素
2 3
C.镁合金的硬度和强度均高于纯镁 D.三价铁盐可作净水剂
5.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.紫色石蕊试液呈红色:
B. 大量存在的溶液中:
C.与Al反应能放出氢气:HCO、 、 、
D.酸性透明的溶液中:
6.劳动开创未来。下列劳动项目与所述的化学知识相关联的是
选项 劳动项目 化学知识
A 用“84”消毒液清洁家居用品 具有氧化性
B 焙制蛋糕时加入小苏打作膨松剂 可与酸反应
C 工人用明矾处理废水 是两性氢氧化物
用氢氧化钠固体和铝粉制成疏通剂,疏通被油
D 氢氧化钠固体具有吸水性
脂、毛发、菜渣等堵塞的管道
7. 下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,
其
中所加试剂正确的一组是
选项 A B C D
X 溶液 溶液
Y
Z 溶液 溶液
A.A B.B C.C D.D
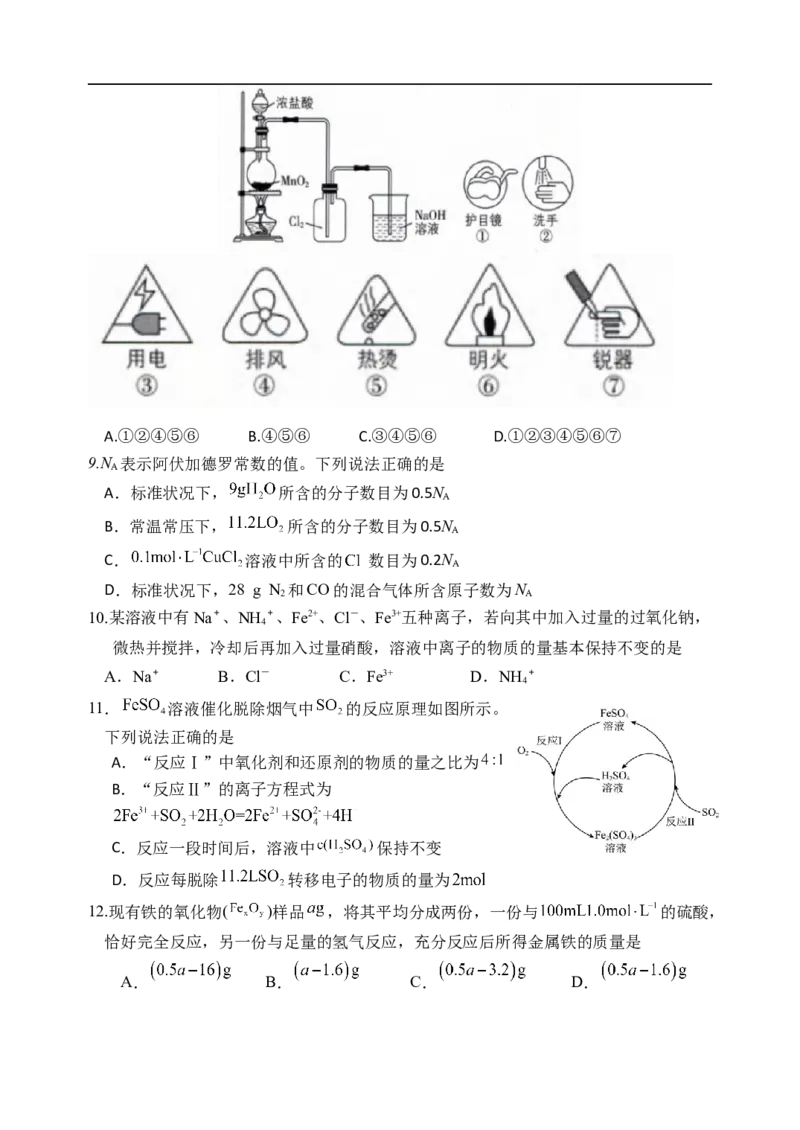
8. Cl 是一种有毒气体,可用如图装置制取。下列实验提示图标需要用到的是
2A.①②④⑤⑥ B.④⑤⑥ C.③④⑤⑥ D.①②③④⑤⑥⑦
9.N 表示阿伏加德罗常数的值。下列说法正确的是
A
A.标准状况下, 所含的分子数目为0.5N
A
B.常温常压下, 所含的分子数目为0.5N
A
C. 溶液中所含的 数目为0.2N
A
D.标准状况下,28 g N 和CO的混合气体所含原子数为N
2 A
10.某溶液中有Na+、NH +、Fe2+、Cl-、Fe3+五种离子,若向其中加入过量的过氧化钠,
4
微热并搅拌,冷却后再加入过量硝酸,溶液中离子的物质的量基本保持不变的是
A.Na+ B.Cl- C.Fe3+ D.NH +
4
11. 溶液催化脱除烟气中 的反应原理如图所示。
下列说法正确的是
A.“反应Ⅰ”中氧化剂和还原剂的物质的量之比为
B.“反应Ⅱ”的离子方程式为
C.反应一段时间后,溶液中 保持不变
D.反应每脱除 转移电子的物质的量为
12.现有铁的氧化物( )样品 ,将其平均分成两份,一份与 的硫酸,
恰好完全反应,另一份与足量的氢气反应,充分反应后所得金属铁的质量是
A. B. C. D.二、填空题:共41分.
13.(概念辨析)(5分)下列说法是否正确(正确的打“√”,不正确的打“×”)若
不正确请说明理由。
(1)N层为最外层时,最多容纳32个电子。( )
理由
(2)1 mol Fe 与水蒸气高温下反应转移 mole-( )
理由
(3)7.8gNaO 与足量CO 完全反应,转移的电子数为0.2N 。( )
2 2 2 A
理由
(4)将62gNaO溶于1L水中,所得溶质的物质的量浓度为1mol/L( )
2
理由
(5)FeO、Fe O Fe O 均为碱性氧化物,均可与盐酸反应( )
2 3、 3 4
理由
14.(易混易错题组)(11分)
现有4种物质:①Cl ②盐酸 ③熔融NaOH ④ 固体。回答下列问题:
2
(1)上述物质中,属于电解质且能导电的是 (填序号)。
(2)工业上利用①制备漂白液的离子方程式为 。
(3)用物质④的饱和溶液制备胶体的离子方程式为 。
(4)废旧铝罐可与家用烧碱溶液反应制备氢气离子方程式 。
(5)电子工业常用30%的④溶液腐蚀敷在绝缘板上的铜箔,从而制造印刷电路板,写
出此过程的离子方程式 。某研究人员向上述印刷电路板的
废液中加入一定量铁粉,充分反应后,过滤并收集滤渣。此时,滤渣的成分不可能是
(填选项字母)。
A.只有Cu B.有Cu和Fe C.只有Fe
(学法题)在书写离子方程式时,需要注意
15.(规律提炼)(8分)关于物质的量浓度的计算
(1)用质量分数为98%的浓H SO (密度为1.84 g·cm-3)配制成4.6mol·L-1的稀H SO 。现
2 4 2 4
实验室仅需要这种 H SO 100 mL,试回答下列问题:经计算需要_______mL 浓
2 4
H SO 。
2 4
(2)将标准状况下体积为V L的HCl气体溶于1 L水中,所得溶液的密度为ρ g·cm-3,
计算所得溶液中溶质的物质的量浓度为 mol/L。
(3)已知:溶液呈电中性的原因是溶液中阴、阳离子所带的负、正电荷总数相等。在
KCl、CaCl 、Ca(NO ) 形成的混合溶液中,c(K+)=0.2 mol·L-1,c(Ca2+)=0.5 mol·L-1,
2 3 2
c(Cl-)=0.4 mol·L-1,则c(NO -)为 mol/L
3
(学法题)归纳溶液物质的量浓度的计算方法 (写出两种计算公式)
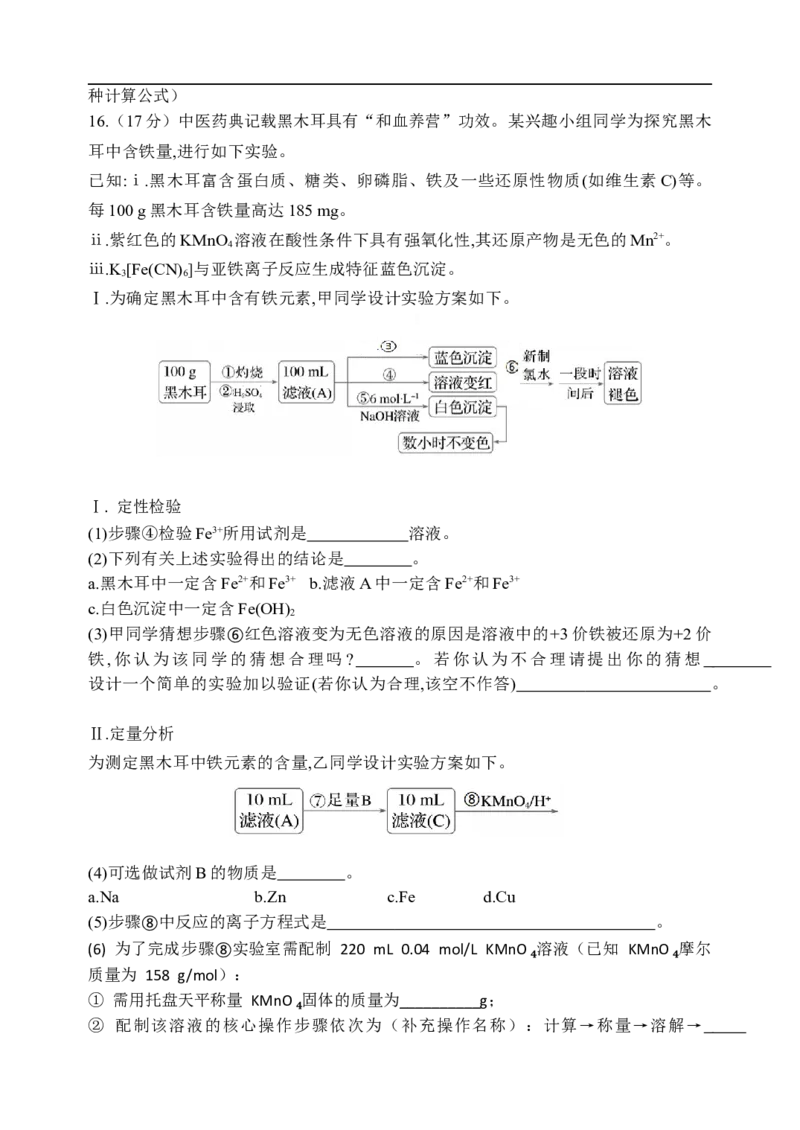
16.(17分)中医药典记载黑木耳具有“和血养营”功效。某兴趣小组同学为探究黑木
耳中含铁量,进行如下实验。
已知:ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素C)等。
每100 g黑木耳含铁量高达185 mg。
ⅱ.紫红色的KMnO 溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。
4
ⅲ.K [Fe(CN) ]与亚铁离子反应生成特征蓝色沉淀。
3 6
Ⅰ.为确定黑木耳中含有铁元素,甲同学设计实验方案如下。
Ⅰ. 定性检验
(1)步骤④检验Fe3+所用试剂是 溶液。
(2)下列有关上述实验得出的结论是 。
a.黑木耳中一定含Fe2+和Fe3+ b.滤液A中一定含Fe2+和Fe3+
c.白色沉淀中一定含Fe(OH)
2
(3)甲同学猜想步骤⑥红色溶液变为无色溶液的原因是溶液中的+3价铁被还原为+2价
铁,你认为该同学的猜想合理吗? 。若你认为不合理请提出你的猜想
设计一个简单的实验加以验证(若你认为合理,该空不作答) 。
Ⅱ.定量分析
为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
(4)可选做试剂B的物质是 。
a.Na b.Zn c.Fe d.Cu
(5)步骤⑧中反应的离子方程式是 。
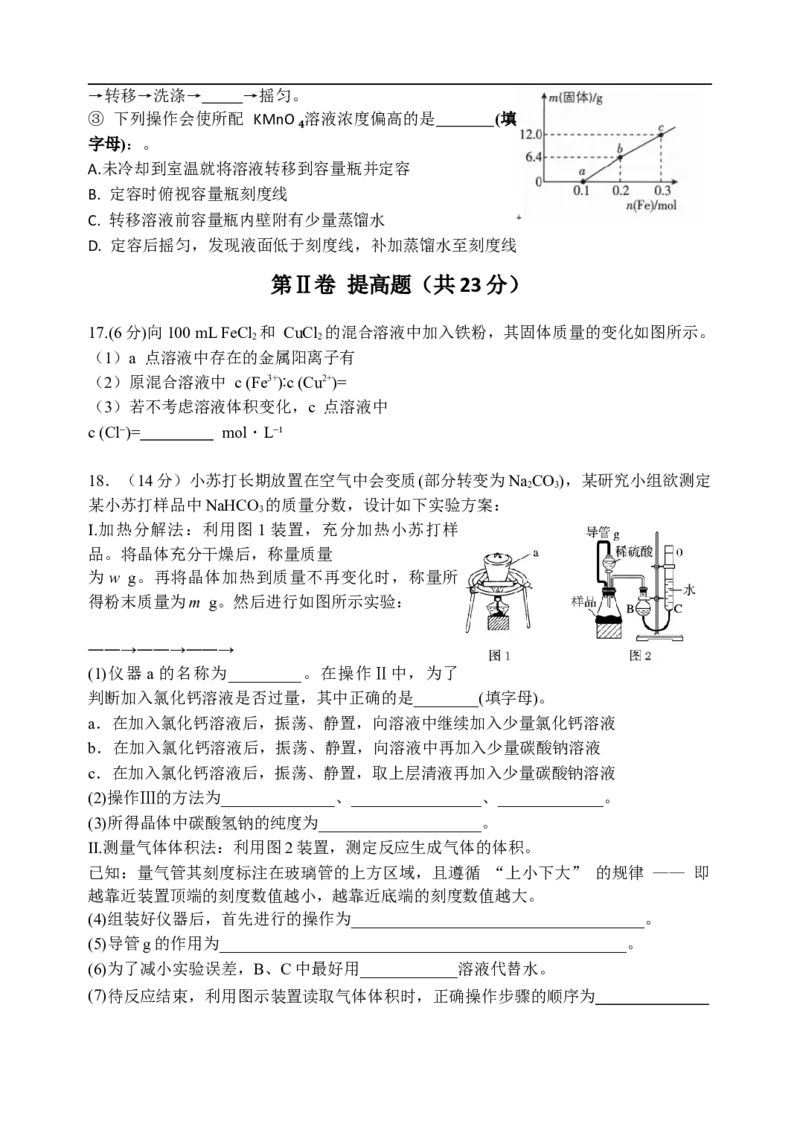
(6) 为了完成步骤⑧实验室需配制 220 mL 0.04 mol/L KMnO₄溶液(已知 KMnO₄摩尔
质量为 158 g/mol):
① 需用托盘天平称量 KMnO₄固体的质量为__________g;
② 配制该溶液的核心操作步骤依次为(补充操作名称):计算→称量→溶解→→转移→洗涤→ →摇匀。
③ 下列操作会使所配 KMnO₄溶液浓度偏高的是 (填
字母):。
A.未冷却到室温就将溶液转移到容量瓶并定容
B. 定容时俯视容量瓶刻度线
C. 转移溶液前容量瓶内壁附有少量蒸馏水
D. 定容后摇匀,发现液面低于刻度线,补加蒸馏水至刻度线
第Ⅱ卷 提高题(共23分)
17.(6分)向100 mL FeCl 和 CuCl 的混合溶液中加入铁粉,其固体质量的变化如图所示。
2 2
(1)a 点溶液中存在的金属阳离子有
(2)原混合溶液中 c (Fe3+)∶c (Cu2+)=
(3)若不考虑溶液体积变化,c 点溶液中
c (Cl⁻)= mol・L⁻¹
18.(14分)小苏打长期放置在空气中会变质(部分转变为NaCO),某研究小组欲测定
2 3
某小苏打样品中NaHCO 的质量分数,设计如下实验方案:
3
Ⅰ.加热分解法:利用图1装置,充分加热小苏打样
品。将晶体充分干燥后,称量质量
为w g。再将晶体加热到质量不再变化时,称量所
得粉末质量为m g。然后进行如图所示实验:
――→――→――→
(1)仪器a的名称为_________。在操作Ⅱ中,为了
判断加入氯化钙溶液是否过量,其中正确的是________(填字母)。
a.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
b.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
c.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
(2)操作Ⅲ的方法为______________、________________、_____________。
(3)所得晶体中碳酸氢钠的纯度为____________________。
Ⅱ.测量气体体积法:利用图2装置,测定反应生成气体的体积。
已知:量气管其刻度标注在玻璃管的上方区域,且遵循 “上小下大” 的规律 —— 即
越靠近装置顶端的刻度数值越小,越靠近底端的刻度数值越大。
(4)组装好仪器后,首先进行的操作为____________________________________。
(5)导管g的作用为__________________________________________________。
(6)为了减小实验误差,B、C中最好用____________溶液代替水。
(7)待反应结束,利用图示装置读取气体体积时,正确操作步骤的顺序为(填字母)。
A.读数 B.冷却至室温 C.调平量气管和烧杯的液面
(8)若所取样品的质量为mg,反应前量气管C的读数为VmL,反应结束后量气管C的读
1
数为VmL,则样品中NaHCO 和NaCO 的物质的量之和为 (气体体积均为
2 3 2 3
标准况)。
19.(3分)卷面分
静海一中2025-2026第一学期高一化学(12月)
学生学业能力调研试卷答题纸
学校:
姓名:
班级:
考场:
座号二、填空题
13. 概念辨析(5 分)
(1)( )理由:___________________________________
(2)( )理由:________________________________
(3)( )理由:_________________________
14. (11 分)
(1)________
(2)___________________________________
(3)___________________________________
(4)___________________________________
(5)
【学法题】
15. (8 分)
(1)
(2)_________
(3)
【学法题】①________________________ ②________________________
16. (17 分)
(1) ________
(2) ________
(3) ________
(4) ________
(5) ___________________________________________
(6) ① ________
②
③ ________
17. (6 分)
(1)________
(2)________
(3)________
18. (14 分)
(1)
(2) ________(3) _________________
(4) ______________________________________
(5)
(6) ________
(7) ________
(8) ________
19. 卷面分(3 分)
静海一中2025-2026第一学期高一化学(12月)
学生学业能力调研试卷答案
一、选择题: 每小题3分,共36分
1 2 3 4 5 6 7 8 9 10 11 12
C C A B D A D A A B B D
二、填空题(共 41 分)13.(5分)
(1)( х ) 最外层电子数不超过 8 个 (2分)
(2)( √ )(1分)
(3)( х ) 7.8 g 物质的 0.1 mol ,转移电子数为 0.1 N (2分)
A
14. 易混易错题组(11分)
(1) ③(1分)
(2分)
(2分)
(4) (2分)
(2分)(1分)
(6) ① 单质、氧化物、难溶物、弱电解质(如弱酸、弱碱、水)写化学式;② 易溶易
电离的物质拆成离子形式;③ 遵循原子守恒、电荷守恒、得失电子守恒(1分)
15.(8分)
(1) 25或25.0(2分)
(2分)
(3) 0.8(2分)
(4)
(2分)
16.(17分)
(1) KSCN(1分)
(2) bc(2分)
(3)不合理(1分) Fe(SCN) 中的SCN-被过量的氯水氧化(2分)
3
设计的实验为在褪色后的溶液中加入FeCl 溶液,不变红色(或在褪色后的溶液中加入
3
KSCN溶液,变红色)(2分)
(4) d (1分)
(5) (2分)
(6) ① 1.6(2分)
② 冷却;定容(2分)
③ AB(2分)
17.(6分)
(1)Fe²+ 和 Cu²+(2分)
(2)2∶1(2分)
(3)8.0(2分)
18. (14分)
(1)坩埚(1分) a(1分)(2)过滤、洗涤、干燥 (3分)
(3)(w-m)84/31w(2分)
(4)检验装置的气密性(1分)
(5)平衡分液漏斗与锥形瓶内的压强,便于液体顺利留下;
消除硫酸体积对产生二氧化碳体积的影响(2分)
(6)饱和碳酸氢钠(1分)
(7)BCA (2分)
(8) (1分)