文档内容
第四章 元素周期律
4.2.1 元素性质的周期性变化规律
1.下列不能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比HS稳定 ②HClO氧化性比HSO 强 ③HClO 酸性比HSO 强
2 2 4 4 2 4
④Cl 能与HS反应生成S ⑤氯原子最外层有7个电子,硫原子最外层有6个电子
2 2
A.②⑤ B.①②
C.①②④ D.①③⑤
2.元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
3.下列各组的排列顺序中,正确的是( )
A.原子半径:NaB>D>C
B.原子的最外层电子数目:A>B>D>C
C.原子序数:d>c>b>a
D.离子半径:C2->D->B+>A2+
8.运用元素周期律分析下面的推断,其中错误的是( )
A.氢氧化铍[Be(OH) ]的碱性比氢氧化镁弱
2
B.砹(At)为有色固体,HAt不稳定
2
C.硫酸锶(SrSO )是难溶于水的白色固体
4
D.硒化氢(H Se)是无色、有毒,比HS稳定的气体
2 2
9.下列粒子半径大小比较正确的是( )
A.原子半径:F>Cl
B.原子半径:钠>硫>氯
C.离子半径:S2-<Cl-<K+<Ca2+
D.第3周期元素的离子半径从左到右逐渐减小
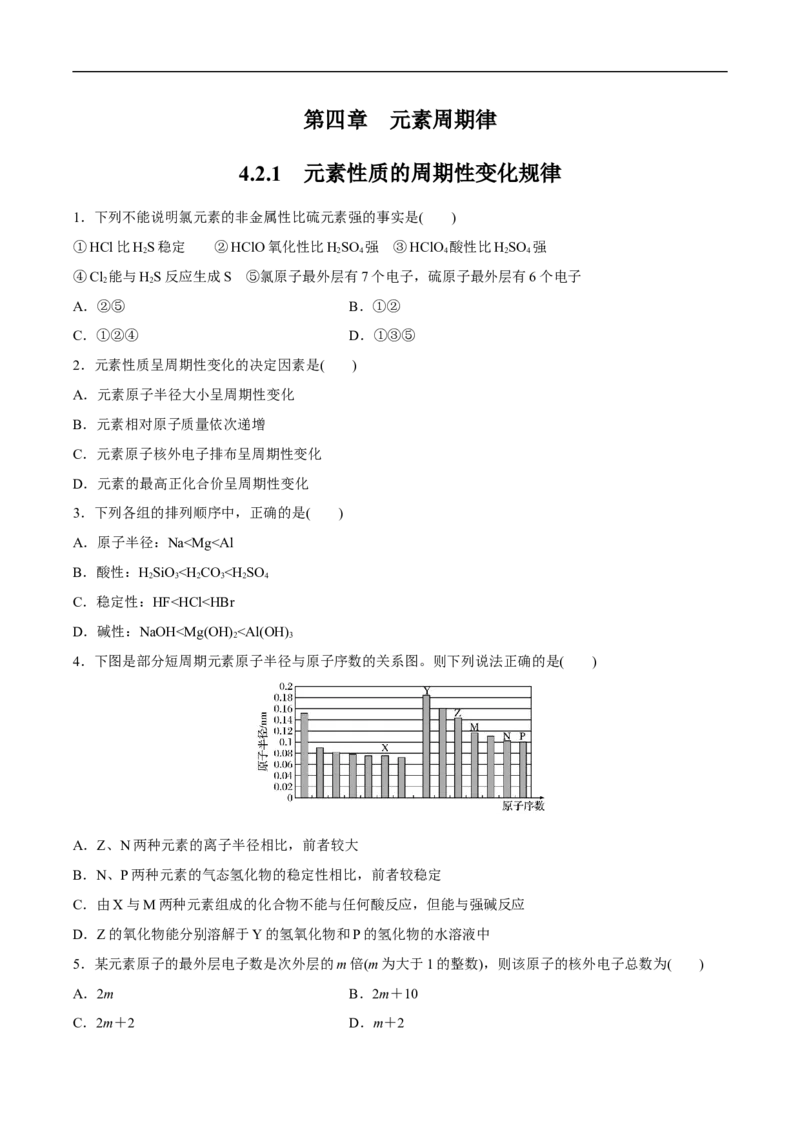
10.右图为周期表中短周期的一部分。已知a原子的最外层电子数是电子总数的三分之一,下列说法中正
确的是( )
A.a的最高价氧化物对应水化物有两性B.b与d组成的化合物不能与水反应
C.c的单质能与强碱反应生成两种盐
D.非金属性:c>d>b>a
11.短周期元素X、Y、Z、W的原子序数依次增大。X的原子半径比Y的小,且X与Y的最外层电子数
之和等于Z的最外层电子数。X与W同主族,Z是地壳中含量最高的元素。下列说法不正确的是( )
A.原子半径的大小顺序:r(W)>r(Y)>r(Z)>r(X)
B.元素Z、W的简单离子的电子层结构相同
C.元素Y的简单气态氢化物的热稳定性比Z的强
D.X、Y两种元素可形成分别含有10e-和18e-的化合物
12.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
把与下面的元素有关性质相符的曲线图的标号填在相应横线上。
(1)第ⅡA族元素的最外层电子数:________。
(2)第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径:________。
(3)第二、三周期主族元素随原子序数递增,原子半径的变化:________。
13.A、B、C、D四种元素的核电荷数依次增多,它们的离子的电子层数相同且最外层电子数均为 8。A
原子的L层电子数与K、M层电子数之和相等;D原子的K、L层电子数之和等于电子总数的一半。回答
以下问题:
(1)四种元素的符号依次是A________;B________;
C________;D________。它们的原子半径由大到小的顺序是________________。
(2)写出四种元素最高价氧化物对应水化物的化学式:________________________________,分别比较酸性
或碱性的强弱:____________________。
(3)写出气态氢化物的分子式:__________________,比较其稳定性:________________。
14.据有关媒体报道,美国华裔科学家叶军领导一个研究小组成功制造出全球最准确的时钟,两亿年误差
不足一秒。它是一个锶原子钟,比铯原子喷泉钟准确得多,估计将可大大促进不同的电讯网络的发展,将
使全球各地的船只导航变得更为准确。请根据锶、铯在元素周期表中的位置,推断下列内容:
(1)锶元素属于________(填“金属”或“非金属”)元素,金属性比钙元素________(填“强”或“弱”),锶原子的核内质子数为________,原子核外有________个电子层,其原子结构示意图为________________,
其原子半径________(填“大于”“小于”或“等于”)镁原子半径;铯的原子核外共有________层电子,
最外层电子数为________。
(2)铯与水发生剧烈反应,放出________色气体,同时使滴有紫色石蕊溶液的溶液显________色,因为
_________________________________(写出化学方程式)。
(3)碳酸锶是________色粉末,与盐酸反应的离子方程式为_________________________________。