文档内容
5.1.2 硫酸 练习(原卷版)
1.下面是硫酸试剂瓶标签上的部分内容。据此下列说法中正确的是( )
硫酸 化学纯CP500 mL
品名:硫酸
化学式:H SO
2 4
相对分子质量:98
密度:1.84 g·cm-3
质量分数:98%
A.该硫酸的物质的量浓度18.0 mol·L-1
B.1molZn与足量的该硫酸反应能产生22.4L H
2
C.配制230mL4.6mol·L-1的稀硫酸需取该硫酸62.5mL
D.若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗
2.将一定量的镁与100 mL 18.5 mol/L浓硫酸充分反应后,镁完全溶解,同时生成气体
A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的c(H+) = 0.1 mol/L,则下
列叙述中错误的是
A.反应中共转移电子3 mol B.反应中共消耗镁 36 g
C.气体A中SO 与H 的体积比为3:1D.气体A为SO 和H 的混合物
2 2 2 2
3.下列物质久置在敞口容器中,溶质质量分数减小,同时溶液质量增加的是
( )
A.澄清石灰水 B.浓硫酸 C.浓盐酸 D.氯化铁溶液
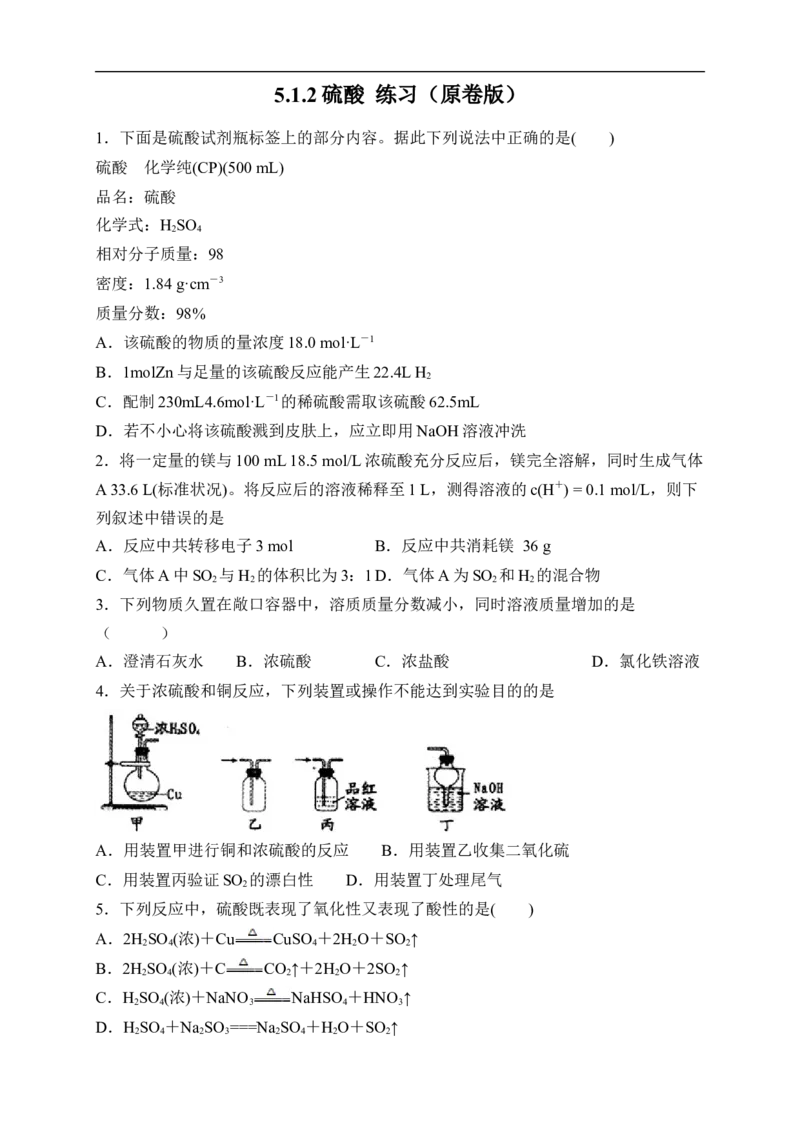
4.关于浓硫酸和铜反应,下列装置或操作不能达到实验目的的是
A.用装置甲进行铜和浓硫酸的反应 B.用装置乙收集二氧化硫
C.用装置丙验证SO 的漂白性 D.用装置丁处理尾气
2
5.下列反应中,硫酸既表现了氧化性又表现了酸性的是( )
A.2H SO (浓)+Cu CuSO +2H O+SO ↑
2 4 4 2 2
B.2H SO (浓)+C CO ↑+2H O+2SO ↑
2 4 2 2 2
C.H SO (浓)+NaNO NaHSO +HNO ↑
2 4 3 4 3
D.H SO +Na SO ===Na SO +H O+SO ↑
2 4 2 3 2 4 2 26.下列关于硫酸的叙述中正确的是( )
A.浓硫酸、稀硫酸都难挥发
B.浓硫酸、稀硫酸都能氧化金属锌,且反应实质相同
C.浓硫酸、稀硫酸在加热时都能与铜反应
D.浓硫酸、稀硫酸在常温下都能用铁制容器贮存
7.在下图的实验装置中,从实验开始过一段时间,对看到的现象叙述不正确的是(
)
A. 苹果块会干瘪 B. 胆矾晶体表面有“白斑”
C. 小试管内有晶体析出 D. pH试纸变红
8.下列物质的用途不正确的是
A.SO 可用于漂白纸张 B.浓硫酸具有吸水性用作干燥剂
2
C.Na CO 受热易分解用作膨松剂 D.Na O 用于呼吸面具供氧
2 3 2 2
9.下列各组气体在通常情况下既能用浓硫酸又能用碱石灰干燥的是( )
A.SO 、O 、N B.HCl、Cl 、CO
2 2 2 2 2
C.CH 、H 、CO D.SO 、O 、Cl
4 2 2 2 2
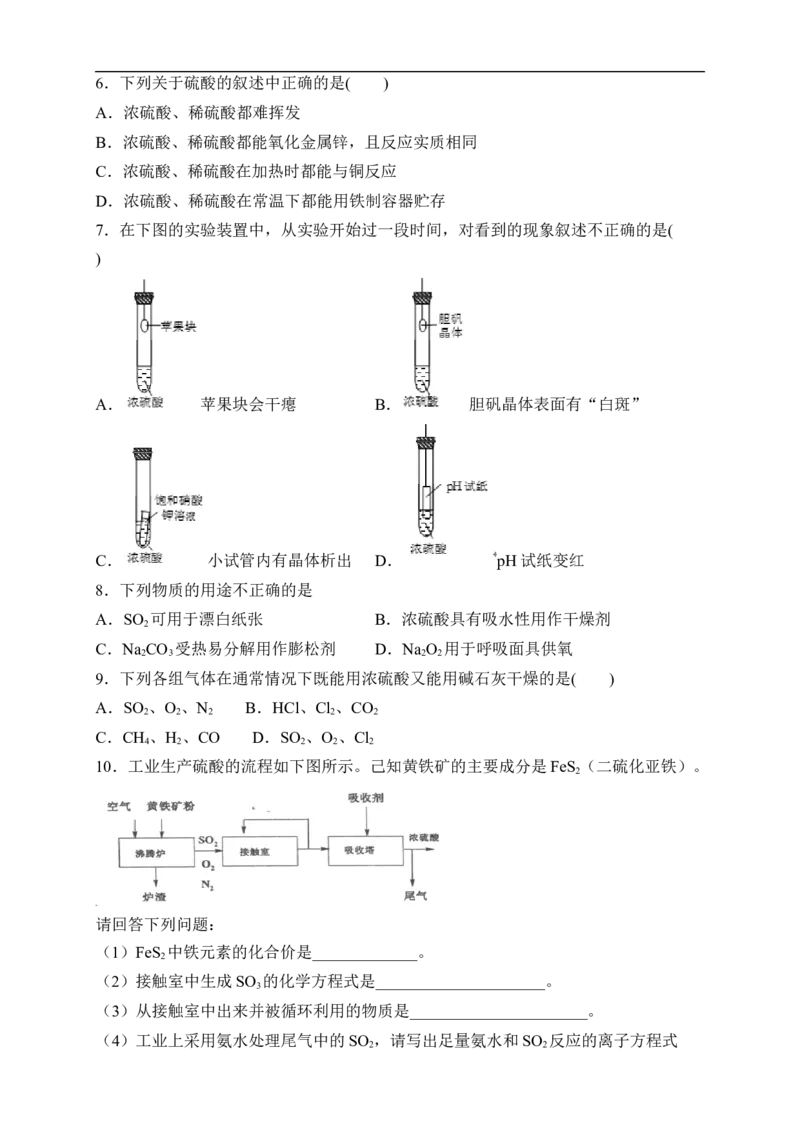
10.工业生产硫酸的流程如下图所示。己知黄铁矿的主要成分是FeS (二硫化亚铁)。
2
请回答下列问题:
(1)FeS 中铁元素的化合价是_____________。
2
(2)接触室中生成SO 的化学方程式是_____________________。
3
(3)从接触室中出来并被循环利用的物质是______________________。
(4)工业上采用氨水处理尾气中的SO ,请写出足量氨水和SO 反应的离子方程式
2 2____________________________________________。
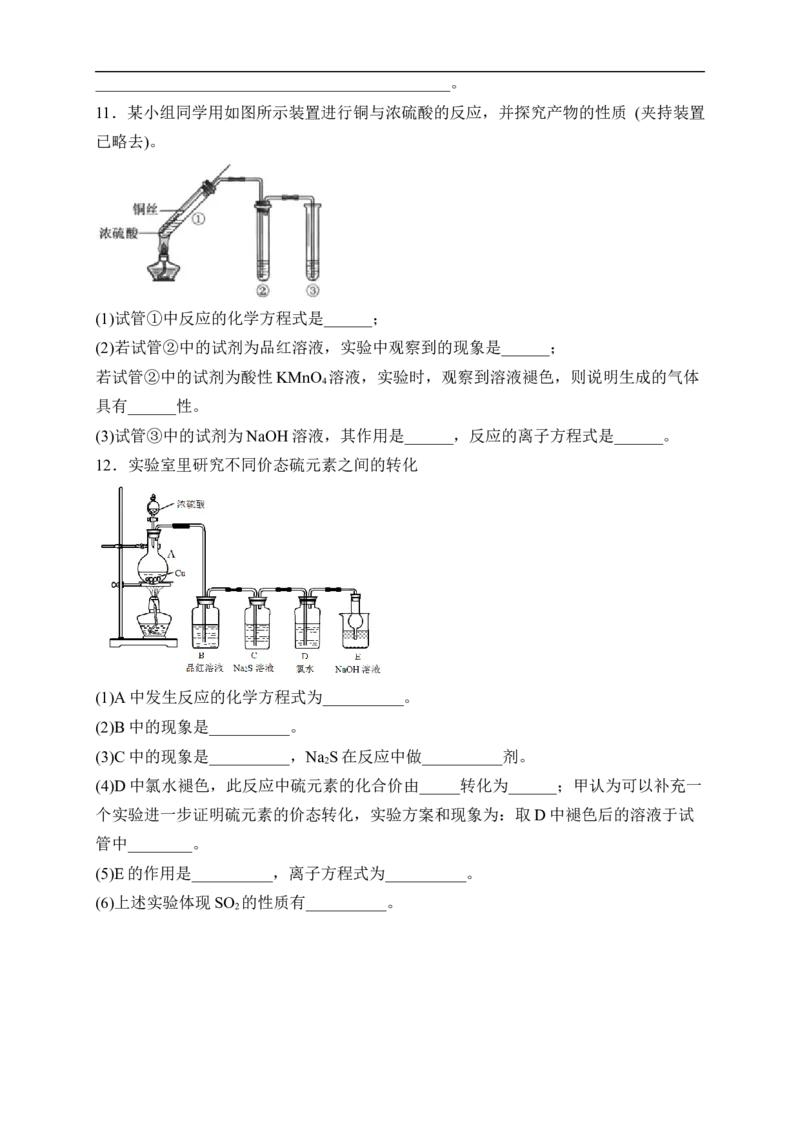
11.某小组同学用如图所示装置进行铜与浓硫酸的反应,并探究产物的性质 (夹持装置
已略去)。
(1)试管①中反应的化学方程式是______;
(2)若试管②中的试剂为品红溶液,实验中观察到的现象是______;
若试管②中的试剂为酸性KMnO 溶液,实验时,观察到溶液褪色,则说明生成的气体
4
具有______性。
(3)试管③中的试剂为NaOH溶液,其作用是______,反应的离子方程式是______。
12.实验室里研究不同价态硫元素之间的转化
(1)A中发生反应的化学方程式为__________。
(2)B中的现象是__________。
(3)C中的现象是__________,Na S在反应中做__________剂。
2
(4)D中氯水褪色,此反应中硫元素的化合价由_____转化为______;甲认为可以补充一
个实验进一步证明硫元素的价态转化,实验方案和现象为:取D中褪色后的溶液于试
管中________。
(5)E的作用是__________,离子方程式为__________。
(6)上述实验体现SO 的性质有__________。
2