文档内容
怀远县 2024-2025 学年第一学期期中教学质量检测
高一年级化学试卷
注意事项:
1.考试时间为75分钟,总分100分。
2.考试范围:鲁科版必修一第一章至第二章第2节。
3.所有答案必须用0.5mm黑色水笔写在答题卷上,写在试卷上一律无效。
4.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 P-31 S-32 Ca-40
Cu-64
一、单项选择题(本题共14小题,每小题3分,共计42分)
1.古诗文经典已融入中华民族的血脉。下列诗文中隐含化学变化的是( )
A.月落乌啼霜满天,江枫渔火对愁眠 B.掬水月在手,弄花香满衣
C.飞流直下三千尺,疑是银河落九天 D.举头望明月,低头思故乡
2.电解质是一类重要的化合物,下列有关叙述中,正确的是( )
A. 固体不导电,所以 不是电解质
B.铜丝、石墨均能导电,所以它们都是电解质
C.熔融的 能导电,所以 是电解质
D. NaCl溶于水,在通电条件下才能发生电离
3.某同学按照纯净物、电解质、盐、酸性氧化物的顺序列举出下列四组物质,其中符合要求的是( )
A.冰水混合物、乙醇、 、 B.洁净的空气、醋酸、 、
C.臭氧、石墨、 、 D.液氮、氢氧化钾、 、
4.油条配方的主要成分为 、 、 ,在溶液中发生的反应为
。下列判断
不正确的是( )
A.该反应中,所有物质均为电解质 B.该反应中元素化合价均未发生改变
C.该油条配方中的成分物质均为盐 D.该反应类型属于离子反应
5.下列表示对应化学反应的离子方程式正确的是( )
A. 与浓盐酸反应制
B.用 溶液腐蚀铜线路板:C. 溶液与少量NaOH溶液反应:
D. 溶于水产生
6.用胆矾 配制 溶液,正确的做法是( )
A.将胆矾加热除去结晶水后,称取16g溶于1L水中
B.将25g胆矾溶于少量水中,然后将此溶液稀释至1L
C.称取胆矾25g溶于1L水中
D.将16g胆矾溶于少量水中,然后将此溶液稀释至1L
7.用 代表阿伏加德罗常数的数值。下列说法中,正确的是( )
A.标准状况下, 的体积是22.4L
B. 个硫酸分子与19.6g磷酸含有相同的氧原子数
C.28g氮气所含的原子数为
D. 个氧气与 个氢气的质量比为1:16
8.当光束通过下列物质时,不会出现丁达尔效应的是( )
① 胶体 ②水 ③蔗糖溶液 ④NaCl溶液 ⑤云、雾
A.②④⑤ B.③④⑤ C.②③④ D.①③④
9.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中: 、 、 、
B.强碱性的溶液中: 、 、 、
C.新制氯水溶液中: 、 、 、
D.能使紫色石蕊变红的溶液中: 、 、 、
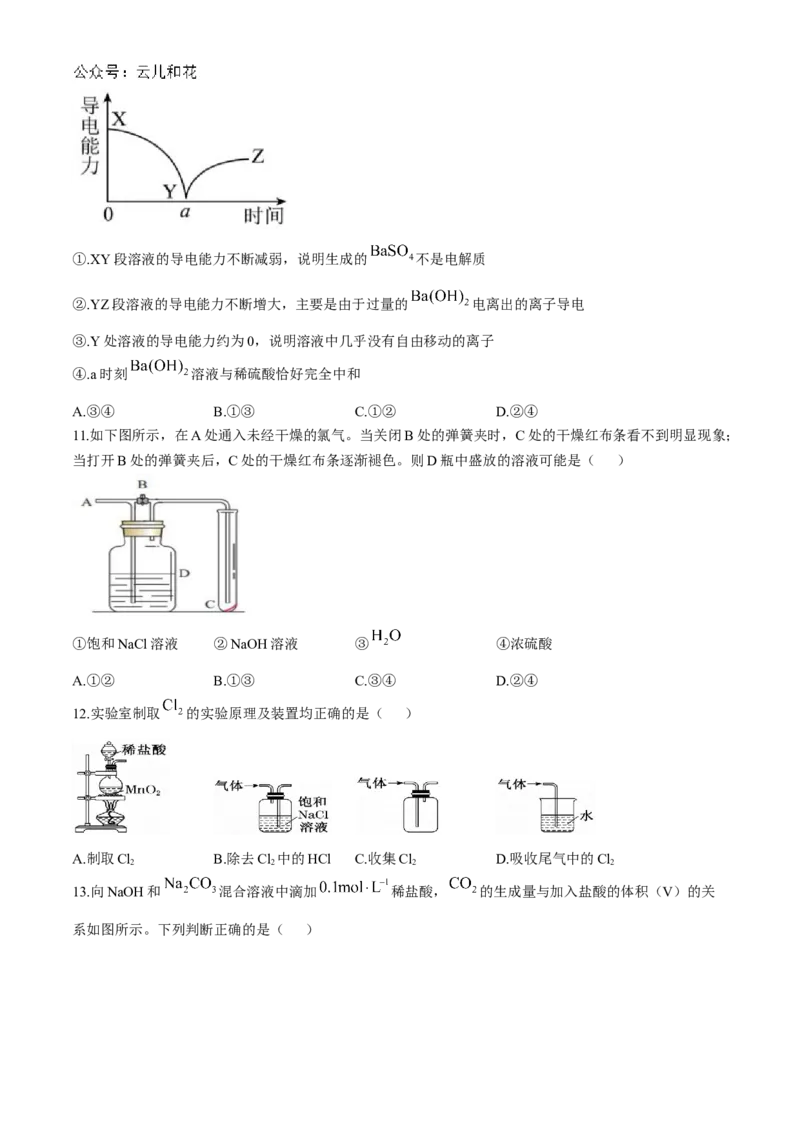
10.向一定体积的 溶液中逐滴加入稀硫酸,测得混合溶液的导电能力随时间变化的曲线如图所示,
下列说法正确的是( )①.XY段溶液的导电能力不断减弱,说明生成的 不是电解质
②.YZ段溶液的导电能力不断增大,主要是由于过量的 电离出的离子导电
③.Y处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
④.a时刻 溶液与稀硫酸恰好完全中和
A.③④ B.①③ C.①② D.②④
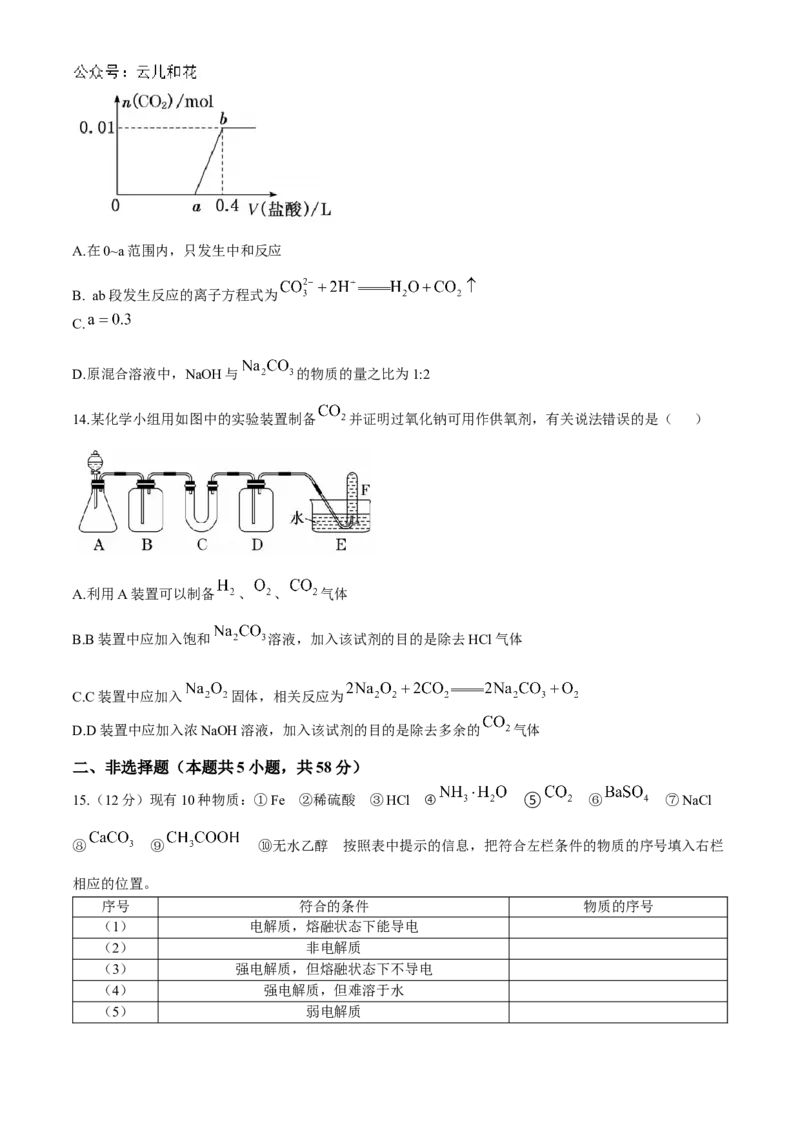
11.如下图所示,在A处通入未经干燥的氯气。当关闭B处的弹簧夹时,C处的干燥红布条看不到明显现象;
当打开B处的弹簧夹后,C处的干燥红布条逐渐褪色。则D瓶中盛放的溶液可能是( )
①饱和NaCl溶液 ②NaOH溶液 ③ ④浓硫酸
A.①② B.①③ C.③④ D.②④
12.实验室制取 的实验原理及装置均正确的是( )
A.制取Cl B.除去Cl 中的HCl C.收集Cl D.吸收尾气中的Cl
2 2 2 2
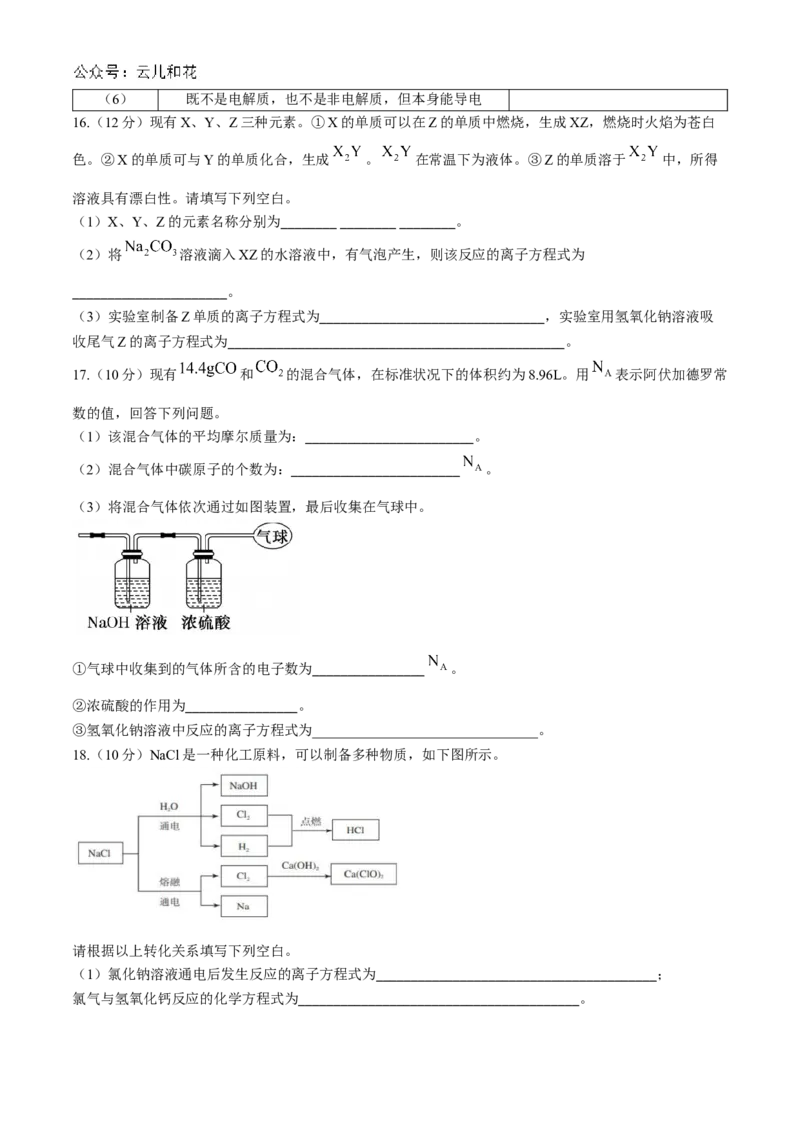
13.向NaOH和 混合溶液中滴加 稀盐酸, 的生成量与加入盐酸的体积(V)的关
系如图所示。下列判断正确的是( )A.在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为
C.
D.原混合溶液中,NaOH与 的物质的量之比为1:2
14.某化学小组用如图中的实验装置制备 并证明过氧化钠可用作供氧剂,有关说法错误的是( )
A.利用A装置可以制备 、 、 气体
B.B装置中应加入饱和 溶液,加入该试剂的目的是除去HCl气体
C.C装置中应加入 固体,相关反应为
D.D装置中应加入浓NaOH溶液,加入该试剂的目的是除去多余的 气体
二、非选择题(本题共5小题,共58分)
15.(12分)现有10种物质:①Fe ②稀硫酸 ③HCl ④ ⑤ ⑥ ⑦NaCl
⑧ ⑨ ⑩无水乙醇 按照表中提示的信息,把符合左栏条件的物质的序号填入右栏
相应的位置。
序号 符合的条件 物质的序号
(1) 电解质,熔融状态下能导电
(2) 非电解质
(3) 强电解质,但熔融状态下不导电
(4) 强电解质,但难溶于水
(5) 弱电解质(6) 既不是电解质,也不是非电解质,但本身能导电
16.(12分)现有X、Y、Z三种元素。①X的单质可以在Z的单质中燃烧,生成XZ,燃烧时火焰为苍白
色。②X的单质可与Y的单质化合,生成 。 在常温下为液体。③Z的单质溶于 中,所得
溶液具有漂白性。请填写下列空白。
(1)X、Y、Z的元素名称分别为________ ________ ________。
(2)将 溶液滴入XZ的水溶液中,有气泡产生,则该反应的离子方程式为
______________________。
(3)实验室制备Z单质的离子方程式为________________________________,实验室用氢氧化钠溶液吸
收尾气Z的离子方程式为________________________________________________。
17.(10分)现有 和 的混合气体,在标准状况下的体积约为8.96L。用 表示阿伏加德罗常
数的值,回答下列问题。
(1)该混合气体的平均摩尔质量为:________________________。
(2)混合气体中碳原子的个数为:________________________ 。
(3)将混合气体依次通过如图装置,最后收集在气球中。
①气球中收集到的气体所含的电子数为________________ 。
②浓硫酸的作用为________________。
③氢氧化钠溶液中反应的离子方程式为________________________________。
18.(10分)NaCl是一种化工原料,可以制备多种物质,如下图所示。
请根据以上转化关系填写下列空白。
(1)氯化钠溶液通电后发生反应的离子方程式为________________________________________;
氯气与氢氧化钙反应的化学方程式为________________________________________。(2)写出 与 反应的化学方程式________________________________________。
(3)若4.6g钠与氧气在一定条件下反应得到7.0g固体产物,将该固体溶于水配成1L溶液,则该溶液的物
质的量浓度为________________。
19.(14分)某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不
与盐酸或氢氧化钠反应):
①配制 稀盐酸和 溶液。
②向一粒研碎后的药片 中加入20.00mL蒸馏水。
③用 溶液中和过量的稀盐酸,记录所消耗NaOH溶液的体积。
④加入 稀盐酸。
请回答下列问题。
(1)正确的操作顺序是________________________(填序号)。
(2)步骤④加入盐酸发生反应的离子方程式为________________________________。
(3)实验时用 的浓盐酸(密度为 )配制980ml该实验所需盐酸,则应选用的容量瓶的规
格为________________,该浓盐酸的浓度为________________,若配制过程中用量筒量取浓盐酸时仰视量
筒读数则导致所配盐酸浓度________(填偏高、偏低或无影响)。
(4)某同学测定所消耗的NaOH溶液的体积为13ml,则药片中碳酸钙的质量分数为______________%。怀远县 2024-2025 学年第一学期期中教学质量检测
高一年级化学试卷及评分标准
一、选择题(每小题3分共42分,答对得3分,答错得0分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14
A C D A C B B C B A D C C B
二、非选择题(共5小题,共58分)
15.(12分)
(1)⑥⑦⑧(2)⑮⑩(3)③(4)⑥⑧(5)④⑨(6)①②
(每空2分,全对给2分,漏选给1分,多选、错选得0分)
16.(12分)
(1)氢、氧、氯(各2分)
(2) (2分不打气体符号不扣分,配平错误0分)
(3) 、
(各2分,方程式不写条件扣1分,不打气体符号不扣分,配平错误0分)
17.(10分)
(1) (2分,不带单位0分) (2)0.4(2分)
(3)①2.8(2分) ②干燥CO气体(2分) ③ (2分,配平错误0
分)
18.(10分)通电
(1) 、
(每个方程式2分,缺少条件或气体符号不扣分,不配平、配平错误或化学式错误得0分)
(2) (2分,不打气体符号不扣分配平错误或化学式错误得0分)
(3) (4分,不带单位得2分)
19.(14分)
(1)①②④③(2分)
(2) (2分不打气体符号不扣分,配平错误0分)
(3)1000ml(2分)、 (2分,不带单位1分)、偏大(2分,填偏高等其它答案得0分)
(4)60(4分,填 得0分)