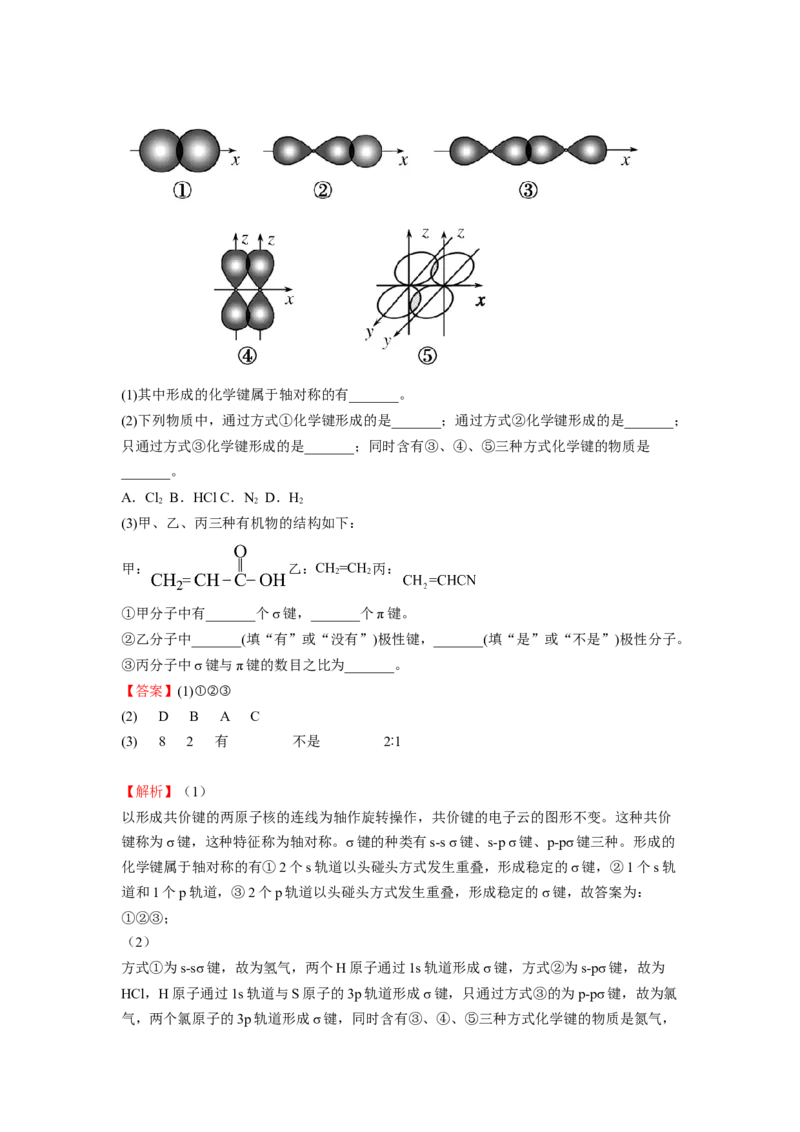
文档内容
期中模拟测试(提高卷)
(时间:75分钟 满分:100分)
可能用到的相对原子质量:H 1 C 12 Si 28 P 31 Cl 35.5
一、选择题(本题包括15个小题,每小题只有一个选项符合题意。每小题2分,共
30分)
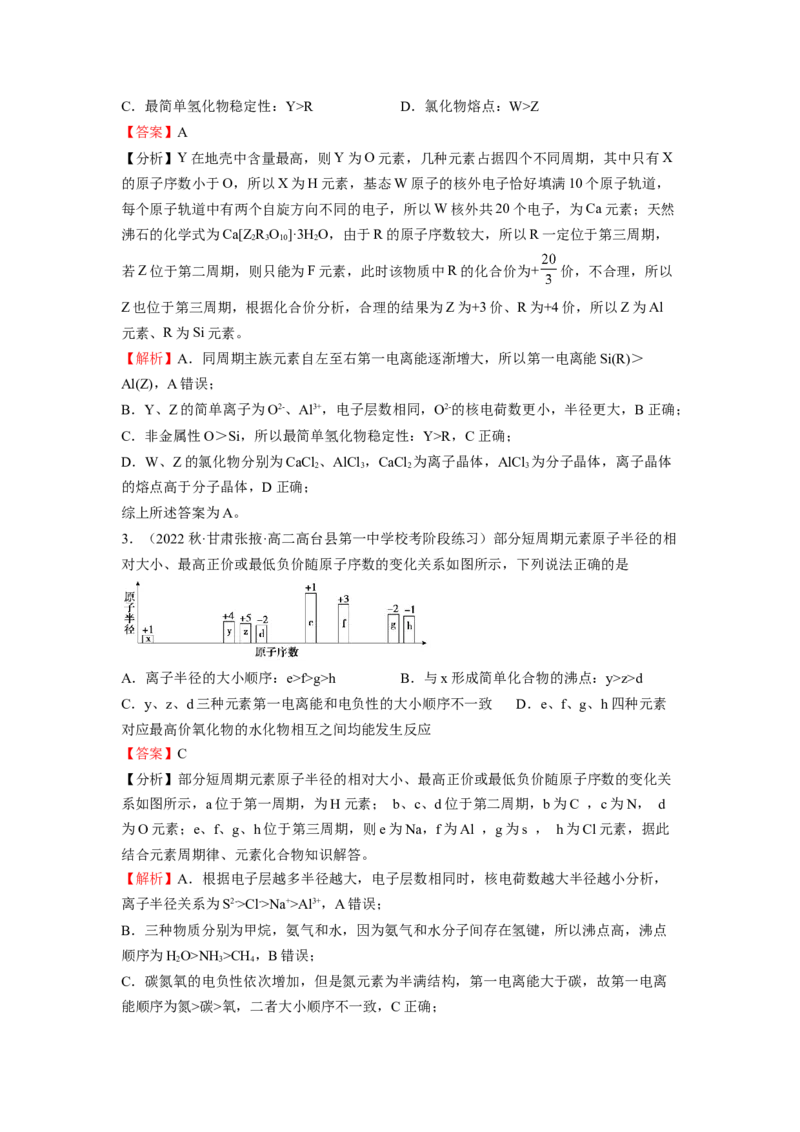
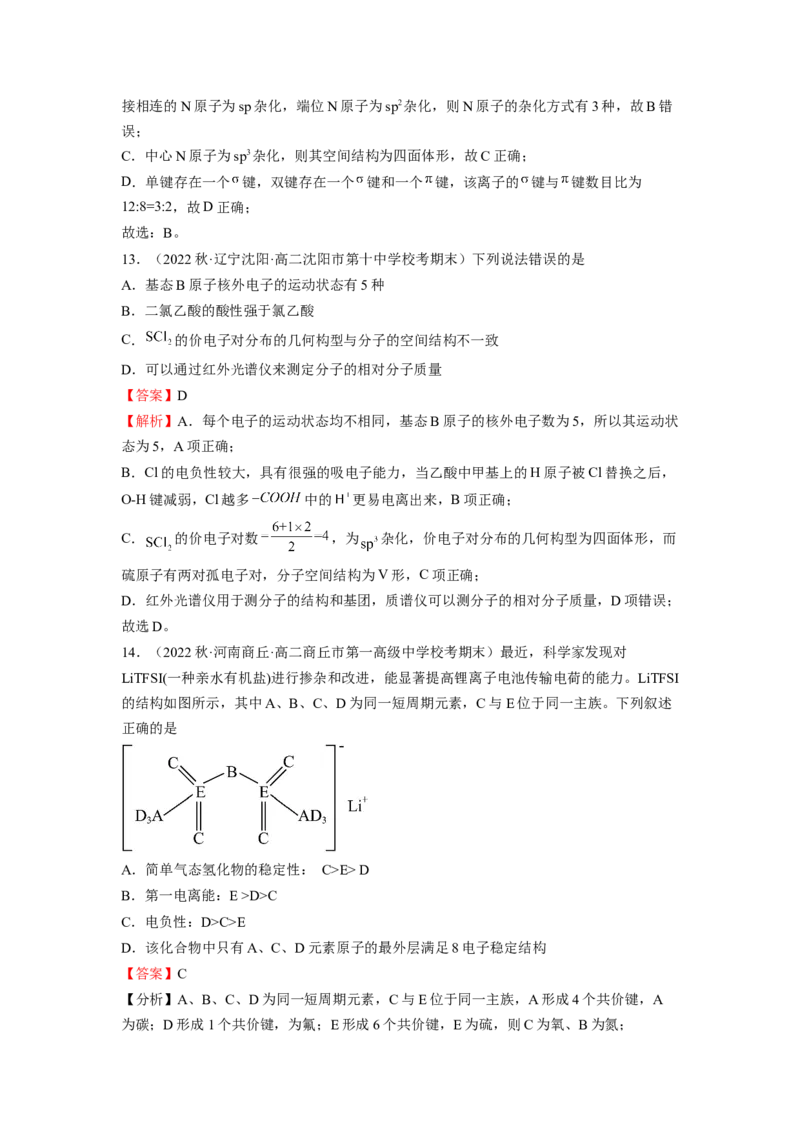
1.(2022春·安徽·高二安徽省怀宁中学校考阶段练习)某锂盐的结构如图所示,其阴离子
是由原子序数依次增大的短周期主族元素X、Y,Z、W形成,X,Y与Z同一周期,Y与
W同族。下列说法正确的是( )
A.元素的电负性: B.第一电离能:
C.简单气态氢化物的热稳定性: D.简单离子的半径:
【答案】B
【分析】某锂盐的结构如图,其阴离子是由原子序数依次增大的短周期主族元素X、Y,
Z、W形成,Y形成两个共价键,W形成六个共价键,Y与W同族,因此它们位于第ⅥA
族,则W为S,Y为O;X、Y、Z位于第二周期,Z形成一个共价键,则Z为F;X形成
两个共价键且使形成的阴离子带一个单位负电荷,则X为N。
【解析】A.主族元素同周期从左向右电负性逐渐增强,同主族从上到下电负性逐渐减弱,
N原子半径小于S原子半径,N原子对键合电子吸引力大于S原子,因此电负性N>S,总
的来说电负性WR B.简单离子半径:Y>ZC.最简单氢化物稳定性:Y>R D.氯化物熔点:W>Z
【答案】A
【分析】Y在地壳中含量最高,则Y为O元素,几种元素占据四个不同周期,其中只有X
的原子序数小于O,所以X为H元素,基态W原子的核外电子恰好填满10个原子轨道,
每个原子轨道中有两个自旋方向不同的电子,所以W核外共20个电子,为Ca元素;天然
沸石的化学式为Ca[Z R O ]·3H O,由于R的原子序数较大,所以R一定位于第三周期,
2 3 10 2
若Z位于第二周期,则只能为F元素,此时该物质中R的化合价为+ 价,不合理,所以
Z也位于第三周期,根据化合价分析,合理的结果为Z为+3价、R为+4价,所以Z为Al
元素、R为Si元素。
【解析】A.同周期主族元素自左至右第一电离能逐渐增大,所以第一电离能Si(R)>
Al(Z),A错误;
B.Y、Z的简单离子为O2-、Al3+,电子层数相同,O2-的核电荷数更小,半径更大,B正确;
C.非金属性O>Si,所以最简单氢化物稳定性:Y>R,C正确;
D.W、Z的氯化物分别为CaCl 、AlCl ,CaCl 为离子晶体,AlCl 为分子晶体,离子晶体
2 3 2 3
的熔点高于分子晶体,D正确;
综上所述答案为A。
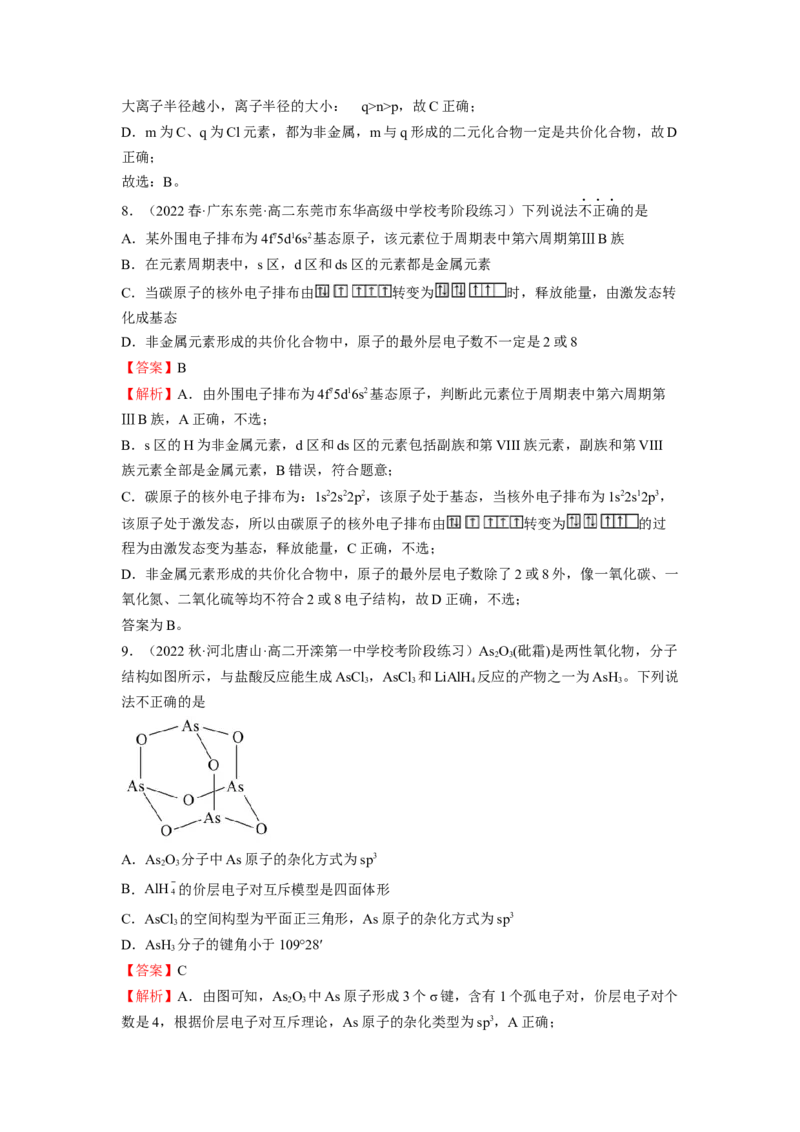
3.(2022秋·甘肃张掖·高二高台县第一中学校考阶段练习)部分短周期元素原子半径的相
对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是
A.离子半径的大小顺序:e>f>g>h B.与x形成简单化合物的沸点:y>z>d
C.y、z、d三种元素第一电离能和电负性的大小顺序不一致 D.e、f、g、h四种元素
对应最高价氧化物的水化物相互之间均能发生反应
【答案】C
【分析】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关
系如图所示,a位于第一周期,为H元素; b、c、d位于第二周期,b为C ,c为N, d
为O元素;e、f、g、h位于第三周期,则e为Na,f为Al ,g为s , h为Cl元素,据此
结合元素周期律、元素化合物知识解答。
【解析】A.根据电子层越多半径越大,电子层数相同时,核电荷数越大半径越小分析,
离子半径关系为S2->Cl->Na+>Al3+,A错误;
B.三种物质分别为甲烷,氨气和水,因为氨气和水分子间存在氢键,所以沸点高,沸点
顺序为HO>NH >CH ,B错误;
2 3 4
C.碳氮氧的电负性依次增加,但是氮元素为半满结构,第一电离能大于碳,故第一电离
能顺序为氮>碳>氧,二者大小顺序不一致,C正确;D.e、f、g、h四种元素对应最高价氧化物的水化物分别为氢氧化钠、氢氧化铝、硫酸、
高氯酸,氢氧化铝和其他三种都能反应,但硫酸和高氯酸不能相互反应,D错误;
故选C。
4.(2022春·广西南宁·高二宾阳中学校考阶段练习)下列各组原子中,彼此化学性质一定
相似的是
A.最外层都只有一个电子的X、Y原子
B.原子核外L层上有8个电子的X原子与M层上有8个电子的Y原子
C.2p轨道上有3个未成对电子的X原子与3p轨道上有3个未成对电子的Y原子
D.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
【答案】C
【解析】A.最外层只有一个电子可能是H原子、碱金属元素原子或者ⅠB族元素原子,
H原子、碱金属元素原子性质有相似的地方,都具有还原性,但与ⅠB族元素原子性质不
同,故A错误;
B.原子核外L层上有8个电子的X原子,没有指明有没有M层,M层上有8个电子的Y
原子,没有指明有没有N层,无法判断它们是什么原子,无法判断它们的化学性质是否相
似,故B错误;
C.2p轨道上有3个未成对电子的X原子为N原子,3p轨道上有3个未成对电子的Y原子
为P原子,N和P位于同一主族,最外层电子数相同,性质相似,故C正确;
D.原子核外电子排布式为1s2的X原子为He原子,原子核外电子排布式为1s22s2的Y原
子为Be,二者性质不同,故D错误;
故答案为C。
5.(2022春·福建宁德·高二柘荣县第一中学校考阶段练习)下列说法正确的是
A.氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少
B.最外层电子数为ns2的元素都在元素周期表第2列
C.处于最低能量的原子叫做基态原子,1s22s22 →1s22s22 过程中形成的是发射光谱
D.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周
期第VIII族位置,属于ds区
【答案】A
【解析】A. 核外电子的运动没有确定的方向和轨迹,只能用电子云描述它在原子核外空间
某处出现机会(几率)的大小,A正确;
B. 最外层电子数为ns2的主族元素都在元素周期表第2列,副族元素也有ns2的情况,比如
Zn,其核外电子排布式为[Ar]3d104s2,B错误;
C. 2p 和2p 的轨道能量一样,电子在这两个轨道之间变迁,不属于电子跃迁,也不会放出
x y
能量,C错误;
D. 该元素为26号元素Fe,位于VIII族,属于d区;ds区仅包含I B族、II B族,D错误;
故合理选项为A。【点睛】为了方便理解,我们可以认为,电子云是通过千百万张在不同瞬间拍摄的电子空
间位置照片叠加而成的图象(实际上还不存在这样的技术),小黑点疏密来表示空间各电子
出现概率大小。
6.(2022·高二单元测试)具有下列电子层结构的原子或离子,其对应元素一定属于同一
周期的是
A.两原子核外全部都是s电子
B.最外层电子排布为3s23p6的原子和最外层电子排布为3s23p6的离子
C.原子核外M层上的s、p能级都充满电子,而3d能级上没有电子的两种原子
D.3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子
【答案】D
【解析】A.氢原子和锂原子都只有s电子但不在同一周期,A错误;
B.最外层电子排布为3s23p6的微粒可能是原子或离子,其核外电子数相等,但质子数可以
不同,例如Ar和K+,两者对应元素不在同一周期,B错误;
C.原子核外M层上的s、p能级都充满电子,而3d能级上没有电子的两种原子,这里M层
可能是最外层,则该原子为Ar,若M为次外层,该原子可能是K,两者不在同一周期,C
错误;
D.3p能级上只有一个空轨道的原子,根据洪特规则可知该轨道电子为3p2,该原子可推知
为Si,3p能级上只有一个未成对电子的原子,根据洪特规则可知该轨道电子为3p5,该原
子可推知为Cl,两者处于同一周期,D正确。
故答案选D。
7.(2022春·湖北宜昌·高二宜昌市夷陵中学校考阶段练习)m、n、p、q 为原子序数依次
增大的短周期主族元素,四种原子最外层电子数之和为18,n3-与p2+ 具有相同的电子层结
构。下列叙述中错误的是
A.m、n、q一定是非金属元素
B.氢化物的沸点: q>n>m
C.离子半径的大小: q>n>p
D.m 与q形成的二元化合物一定是共价化合物
【答案】B
【分析】m、n、p、q为原子序数依次增大的短周期主族元素,n3-与p2+具有相同的电子层
结构,可知n为N元素,p为Mg元素,四种原子最外层电子数之和为18,则可知m、q的
最外层电子数之和为18-5-2=11,m的原子序数小于N,则m为C,q为Cl元素,由以上分
析可知m为C、n为N、p为Mg、q为Cl元素。
【解析】A.由以上分析可知m、n、q一定是非金属元素,故A正确;
B.N的非金属性较强,对应的氢化物NH 分子间存在氢键,比范德华力强,则氢化物沸
3
点比HCl高,且C对应的氢化物不一定为最简单氢化物,如为复杂的烃,沸点可比氨气的
高,故B错误;
C.离子核外电子层数越多,离子半径越大,具有相同核外电子排布的离子,核电荷数越大离子半径越小,离子半径的大小: q>n>p,故C正确;
D.m为C、q为Cl元素,都为非金属,m与q形成的二元化合物一定是共价化合物,故D
正确;
故选:B。
8.(2022春·广东东莞·高二东莞市东华高级中学校考阶段练习)下列说法不正确的是
A.某外围电子排布为4f75d16s2基态原子,该元素位于周期表中第六周期第ⅢB族
B.在元素周期表中,s区,d区和ds区的元素都是金属元素
C.当碳原子的核外电子排布由 转变为 时,释放能量,由激发态转
化成基态
D.非金属元素形成的共价化合物中,原子的最外层电子数不一定是2或8
【答案】B
【解析】A.由外围电子排布为4f75d16s2基态原子,判断此元素位于周期表中第六周期第
ⅢB族,A正确,不选;
B.s区的H为非金属元素,d区和ds区的元素包括副族和第VIII族元素,副族和第VIII
族元素全部是金属元素,B错误,符合题意;
C.碳原子的核外电子排布为:1s22s22p2,该原子处于基态,当核外电子排布为1s22s12p3,
该原子处于激发态,所以由碳原子的核外电子排布由 转变为 的过
程为由激发态变为基态,释放能量,C正确,不选;
D.非金属元素形成的共价化合物中,原子的最外层电子数除了2或8外,像一氧化碳、一
氧化氮、二氧化硫等均不符合2或8电子结构,故D正确,不选;
答案为B。
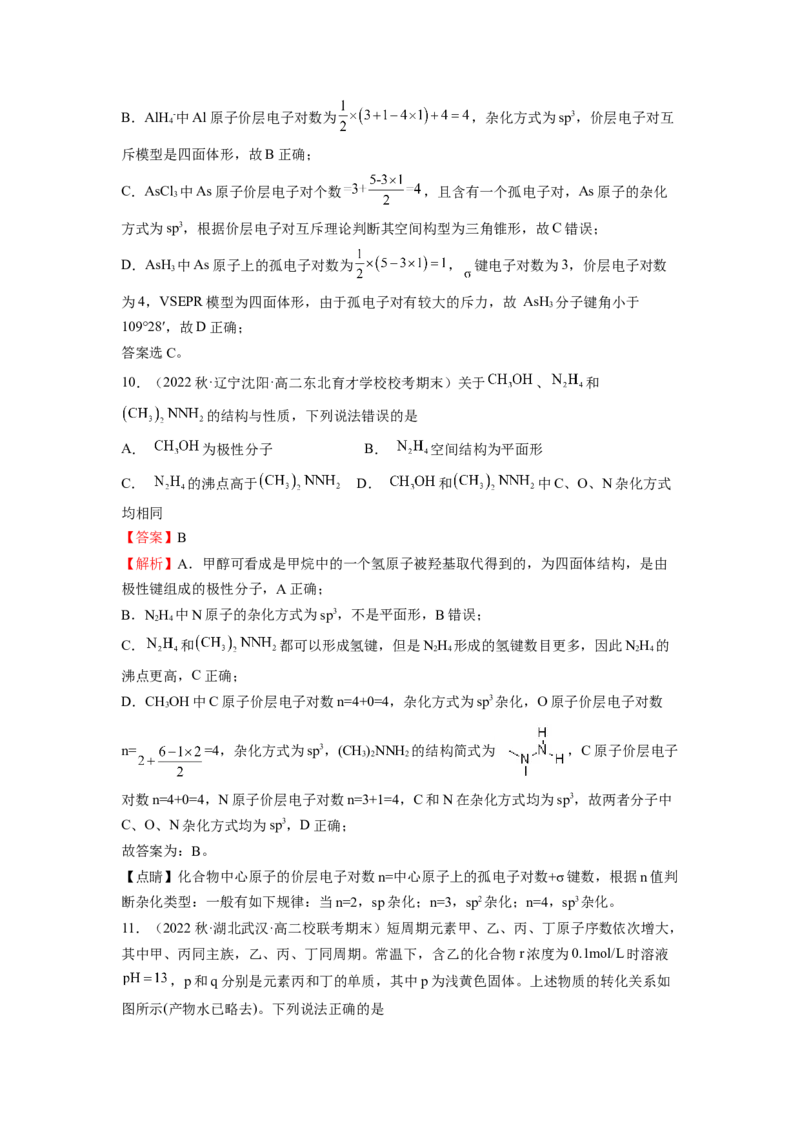
9.(2022秋·河北唐山·高二开滦第一中学校考阶段练习)As O(砒霜)是两性氧化物,分子
2 3
结构如图所示,与盐酸反应能生成AsCl ,AsCl 和LiAlH 反应的产物之一为AsH 。下列说
3 3 4 3
法不正确的是
A.As O 分子中As原子的杂化方式为sp3
2 3
B.AlH 的价层电子对互斥模型是四面体形
C.AsCl 的空间构型为平面正三角形,As原子的杂化方式为sp3
3
D.AsH 分子的键角小于109°28′
3
【答案】C
【解析】A.由图可知,As O 中As原子形成3个σ键,含有1个孤电子对,价层电子对个
2 3
数是4,根据价层电子对互斥理论,As原子的杂化类型为sp3,A正确;B.AlH-中Al原子价层电子对数为 ,杂化方式为sp3,价层电子对互
4
斥模型是四面体形,故B正确;
C.AsCl 中As原子价层电子对个数 ,且含有一个孤电子对,As原子的杂化
3
方式为sp3,根据价层电子对互斥理论判断其空间构型为三角锥形,故C错误;
D.AsH 中As原子上的孤电子对数为 , 键电子对数为3,价层电子对数
3
为4,VSEPR模型为四面体形,由于孤电子对有较大的斥力,故 AsH 分子键角小于
3
109°28′,故D正确;
答案选C。
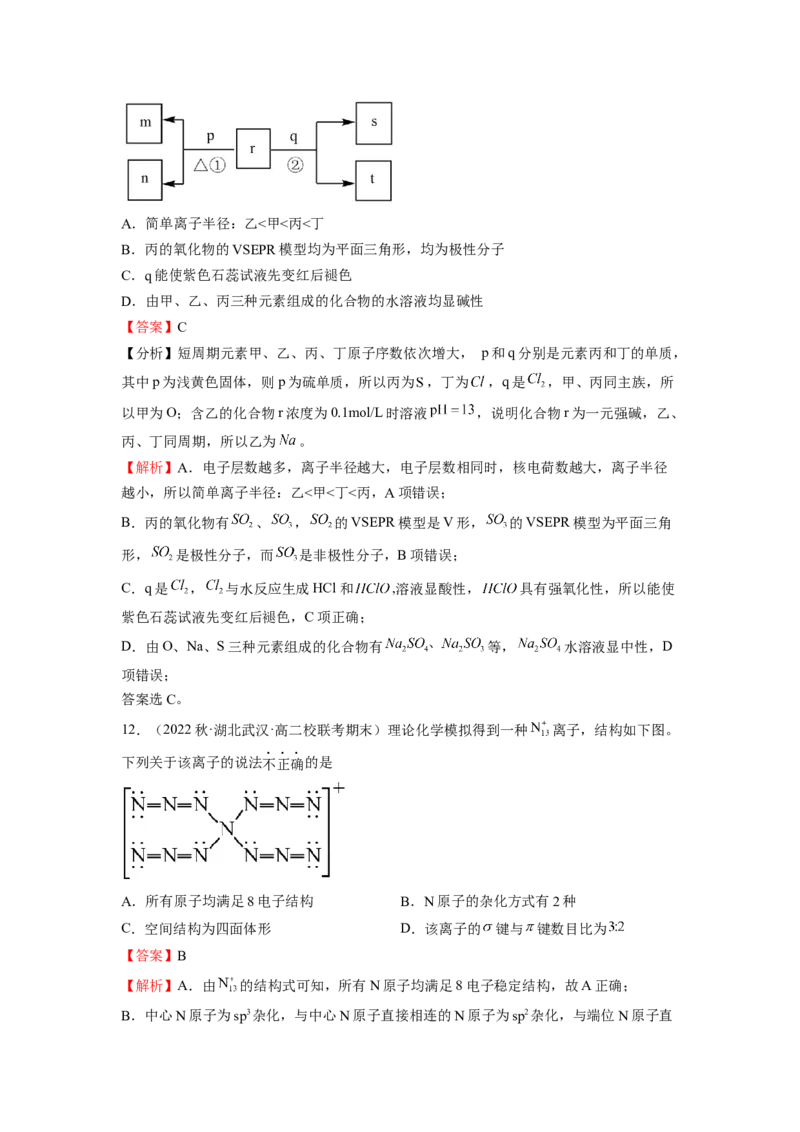
10.(2022秋·辽宁沈阳·高二东北育才学校校考期末)关于 、 和
的结构与性质,下列说法错误的是
A. 为极性分子 B. 空间结构为平面形
C. 的沸点高于 D. 和 中C、O、N杂化方式
均相同
【答案】B
【解析】A.甲醇可看成是甲烷中的一个氢原子被羟基取代得到的,为四面体结构,是由
极性键组成的极性分子,A正确;
B.NH 中N原子的杂化方式为sp3,不是平面形,B错误;
2 4
C. 和 都可以形成氢键,但是NH 形成的氢键数目更多,因此NH 的
2 4 2 4
沸点更高,C正确;
D.CHOH中C原子价层电子对数n=4+0=4,杂化方式为sp3杂化,O原子价层电子对数
3
n= =4,杂化方式为sp3,(CH)NNH 的结构简式为 ,C原子价层电子
3 2 2
对数n=4+0=4,N原子价层电子对数n=3+1=4,C和N在杂化方式均为sp3,故两者分子中
C、O、N杂化方式均为sp3,D正确;
故答案为:B。
【点睛】化合物中心原子的价层电子对数n=中心原子上的孤电子对数+σ键数,根据n值判
断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化。
11.(2022秋·湖北武汉·高二校联考期末)短周期元素甲、乙、丙、丁原子序数依次增大,
其中甲、丙同主族,乙、丙、丁同周期。常温下,含乙的化合物r浓度为0.1mol/L时溶液
,p和q分别是元素丙和丁的单质,其中p为浅黄色固体。上述物质的转化关系如
图所示(产物水已略去)。下列说法正确的是A.简单离子半径:乙<甲<丙<丁
B.丙的氧化物的VSEPR模型均为平面三角形,均为极性分子
C.q能使紫色石蕊试液先变红后褪色
D.由甲、乙、丙三种元素组成的化合物的水溶液均显碱性
【答案】C
【分析】短周期元素甲、乙、丙、丁原子序数依次增大, p和q分别是元素丙和丁的单质,
其中p为浅黄色固体,则p为硫单质,所以丙为 ,丁为 ,q是 ,甲、丙同主族,所
以甲为O;含乙的化合物r浓度为0.1mol/L时溶液 ,说明化合物r为一元强碱,乙、
丙、丁同周期,所以乙为 。
【解析】A.电子层数越多,离子半径越大,电子层数相同时,核电荷数越大,离子半径
越小,所以简单离子半径:乙<甲<丁<丙,A项错误;
B.丙的氧化物有 、 , 的VSEPR模型是V形, 的VSEPR模型为平面三角
形, 是极性分子,而 是非极性分子,B项错误;
C.q是 , 与水反应生成HCl和 ,溶液显酸性, 具有强氧化性,所以能使
紫色石蕊试液先变红后褪色,C项正确;
D.由O、Na、S三种元素组成的化合物有 等, 水溶液显中性,D
项错误;
答案选C。
12.(2022秋·湖北武汉·高二校联考期末)理论化学模拟得到一种 离子,结构如下图。
下列关于该离子的说法不正确的是
A.所有原子均满足8电子结构 B.N原子的杂化方式有2种
C.空间结构为四面体形 D.该离子的 键与 键数目比为
【答案】B
【解析】A.由 的结构式可知,所有N原子均满足8电子稳定结构,故A正确;
B.中心N原子为sp3杂化,与中心N原子直接相连的N原子为sp2杂化,与端位N原子直接相连的N原子为sp杂化,端位N原子为sp2杂化,则N原子的杂化方式有3种,故B错
误;
C.中心N原子为sp3杂化,则其空间结构为四面体形,故C正确;
D.单键存在一个 键,双键存在一个 键和一个 键,该离子的 键与 键数目比为
12:8=3:2,故D正确;
故选:B。
13.(2022秋·辽宁沈阳·高二沈阳市第十中学校考期末)下列说法错误的是
A.基态B原子核外电子的运动状态有5种
B.二氯乙酸的酸性强于氯乙酸
C. 的价电子对分布的几何构型与分子的空间结构不一致
D.可以通过红外光谱仪来测定分子的相对分子质量
【答案】D
【解析】A.每个电子的运动状态均不相同,基态B原子的核外电子数为5,所以其运动状
态为5,A项正确;
B.Cl的电负性较大,具有很强的吸电子能力,当乙酸中甲基上的H原子被Cl替换之后,
O-H键减弱,Cl越多 中的 更易电离出来,B项正确;
C. 的价电子对数 ,为 杂化,价电子对分布的几何构型为四面体形,而
硫原子有两对孤电子对,分子空间结构为V形,C项正确;
D.红外光谱仪用于测分子的结构和基团,质谱仪可以测分子的相对分子质量,D项错误;
故选D。
14.(2022秋·河南商丘·高二商丘市第一高级中学校考期末)最近,科学家发现对
LiTFSI(一种亲水有机盐)进行掺杂和改进,能显著提高锂离子电池传输电荷的能力。LiTFSI
的结构如图所示,其中A、B、C、D为同一短周期元素,C与E位于同一主族。下列叙述
正确的是
A.简单气态氢化物的稳定性: C>E> D
B.第一电离能:E >D>C
C.电负性:D>C>E
D.该化合物中只有A、C、D元素原子的最外层满足8电子稳定结构
【答案】C
【分析】A、B、C、D为同一短周期元素,C与E位于同一主族,A形成4个共价键,A
为碳;D形成1个共价键,为氟;E形成6个共价键,E为硫,则C为氧、B为氮;【解析】A.D、C、E的简单气态氢化物分别为 、 、 ,F和O同周期,非金属
性F>O,则相应的气态氢化物稳定性为 ;O和S同主族,非金属性O>S,则相应
的气态氢化物稳定性为 ,故D、C、E的简单气态氢化物的稳定性为
,A错误;
B.同一主族随原子序数变大,原子半径变大,第一电离能变小;同一周期随着原子序数
变大,第一电离能呈变大趋势;第一电离能:D > C >E,B错误;
C.同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,
金属性增强,非金属性逐渐减弱,元素电负性减弱;电负性:D>C>E,C正确;
D.8电子稳定结构即每个原子最外层都有8个电子,A为C,成键数为4,最外层电子数
为4,和为8,满足8电子稳定结构;C为O,成键数为2,最外层电子数为6,和为8,满
足8电子稳定结构;D为F,成键数为1,最外层电子数为7,和为8,满足8电子稳定结
构;B为N,成键数为2,带一个单位负电荷,最外层电子数为5,和为8,满足8电子稳
定结构;E为S,成键数为6,最外层电子数为6,和不为8,不满足8电子稳定结构;故
该化合物中A、B、C、D元素原子的最外层满足8电子稳定结构,D错误;
故选C。
15.(2022秋·山东临沂·高二山东省临沂第一中学校考期末)现有四种元素的基态原子的
核外电子排布式如下:① ;② ;③ ;④ 。
下列说法错误的是
A.电负性:②>①>④>③
B.原子半径:③>④>①>②
C.简单气态氢化物的稳定性:①>②>③>④
D.第一电离能:①>②>④>③
【答案】C
【分析】根据电子排布式,推出元素①-④分别为N、O、Si、P;
【解析】A.同主族从上到下,电负性逐渐减小,同周期从左向右电负性逐渐增大(稀有气
体除外),因此电负性大小顺序是②>①>④>③,故A正确;
B.同周期从左向右原子半径依次减小,同主族从上到下原子半径增大,原子半径大小顺
序是③>④>①>②,故B正确;
C.非金属性越强,其简单氢化物的稳定性越强,非金属性强弱顺序是O>N>P>Si,简
单气态氢化物的稳定性:②>①>④>③,故C错误;
D.同一主族随原子序数变大,原子半径变大,第一电离能变小;同一周期随着原子序数
变大,第一电离能变大,N、P的p轨道为半充满稳定状态,第一电离能大于同周期相邻元
素,第一电离能:①>②>④>③,故D正确;
故选C。
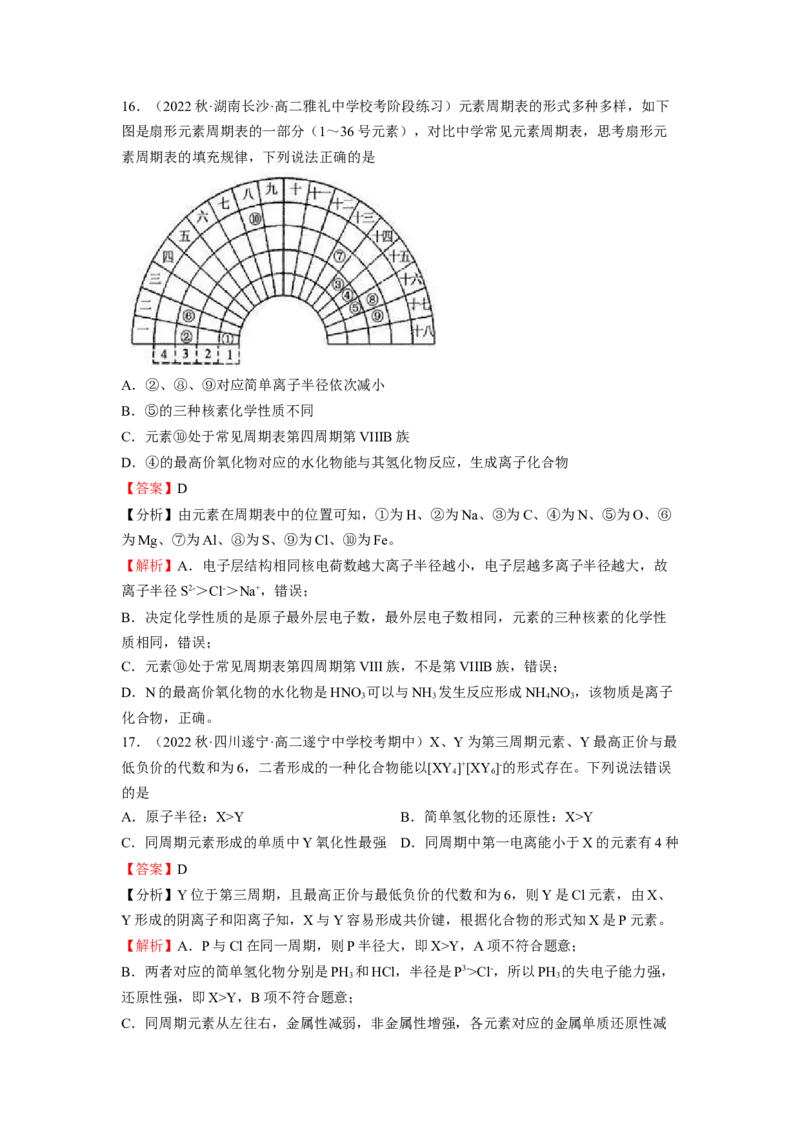
二、选择题(本题包括5个小题,每小题有1~2个选项符合题意。每小题3分,共15分)16.(2022秋·湖南长沙·高二雅礼中学校考阶段练习)元素周期表的形式多种多样,如下
图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元
素周期表的填充规律,下列说法正确的是
A.②、⑧、⑨对应简单离子半径依次减小
B.⑤的三种核素化学性质不同
C.元素⑩处于常见周期表第四周期第VIIIB族
D.④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物
【答案】D
【分析】由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥
为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe。
【解析】A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故
离子半径S2->Cl->Na+,错误;
B.决定化学性质的是原子最外层电子数,最外层电子数相同,元素的三种核素的化学性
质相同,错误;
C.元素⑩处于常见周期表第四周期第VⅢ族,不是第VIIIB族,错误;
D.N的最高价氧化物的水化物是HNO 可以与NH 发生反应形成NH NO ,该物质是离子
3 3 4 3
化合物,正确。
17.(2022秋·四川遂宁·高二遂宁中学校考期中)X、Y为第三周期元素、Y最高正价与最
低负价的代数和为6,二者形成的一种化合物能以[XY ]+[XY ]-的形式存在。下列说法错误
4 6
的是
A.原子半径:X>Y B.简单氢化物的还原性:X>Y
C.同周期元素形成的单质中Y氧化性最强 D.同周期中第一电离能小于X的元素有4种
【答案】D
【分析】Y位于第三周期,且最高正价与最低负价的代数和为6,则Y是Cl元素,由X、
Y形成的阴离子和阳离子知,X与Y容易形成共价键,根据化合物的形式知X是P元素。
【解析】A.P与Cl在同一周期,则P半径大,即X>Y,A项不符合题意;
B.两者对应的简单氢化物分别是PH 和HCl,半径是P3->Cl-,所以PH 的失电子能力强,
3 3
还原性强,即X>Y,B项不符合题意;
C.同周期元素从左往右,金属性减弱,非金属性增强,各元素对应的金属单质还原性减弱,非金属单质的氧化性增强,所以Cl 的氧化性最强,C项不符合题意;
2
D.同一周期,从左到右,第一电离能呈现增大的趋势,第VA族元素的第一电离能大于相
邻元素的第一电离能;所以第三周期第一电离能从小到大依次为Na、Al、Mg、Si、S、
P、Cl,所以有5种,D项符合题意;
故选D。
18.(2022春·吉林通化·高二统考期中)在短周期元素中,元素的基态原子核外未成对电
子数等于能层序数的元素有a种,元素的基态原子最外层电子数是未成对电子数2倍的元
素有b种,则 的值为
A.1 B.2 C.3 D.4
【答案】B
【解析】在短周期元素中,寻找基态原子核外未成对电子数等于能层序数的元素可按周期
序数进行,第一周期中有H,第二周期中原子核外未成对电子数为2的元素有C和O,第
三周期中原子核外未成对电子数为3的元素有P,符合条件的元素共有4种,即 。符
合基态原子最外层电子数是未成对电子数2倍的元素,其基态原子的最外层电子数是2、
4、6或8,若最外层电子数为2,则是He、Be或Mg,但这三种元素无未成对电子,不符
合题意;若最外层电子数为4,则是C、Si,符合题意;若最外层电子数为6,则是O、
S,最外层有2个未成对电子,最外层电子数是未成对电子数的3倍,不符合题意;若最外
层电子数为8,则是Ne、Ar,但这两种元素均无未成对电子,不符合题意,则符合题意的
元素共有2种,即 。综上可知, 的值为2。
故选B。
19.(2022春·河北衡水·高二校考期中)下列说法正确的是
A.某主族金属元素气态基态原子的逐级电离能的数值分别为 738、1451、7733、10540、
13630、17995、21703……当它与氯气反应时生成的阳离子是 X2+
B.在氨水中,大部分 NH 与 HO 以氢键结合形成 NH ·H O 分子,则 NH ·H O 的结构
3 2 3 2 3 2
式为:
C.18 g 冰中所含的氢键数均为 2 mol
D.由于氢键的作用,NH 、HO、HF 中的沸点反常,且沸点高低顺序为 HF>H O>NH
3 2 2 3
【答案】AC
【解析】A.该元素第三电离能剧增,最外层应有2个电子,表现+2价,当它与氯气反应
时最可能生成的阳离子是X2+,故A正确;
B.NH 与HO以氢键(用“•••”表示)结合形成NH •H O分子,氨气中N和水中H形
3 2 3 2成氢键,则NH •H O的结构式为 ,故B错误;
3 2
C.冰中水分子每2个O原子间都有一个H原子,更靠近H原子的O原子与它形成共价键,
另一个与它形成氢键,即每个H原子都形成一个氢键,所以1mol冰中存在2mol氢键,故
C正确;
D.由于氢键的作用,使NH 、HO、HF在同主族氰化氢中的沸点反常,但常温下水为液
3 2
体,则沸点高低顺序为HO>HF>NH ,故D错误;
2 3
故选:AC。
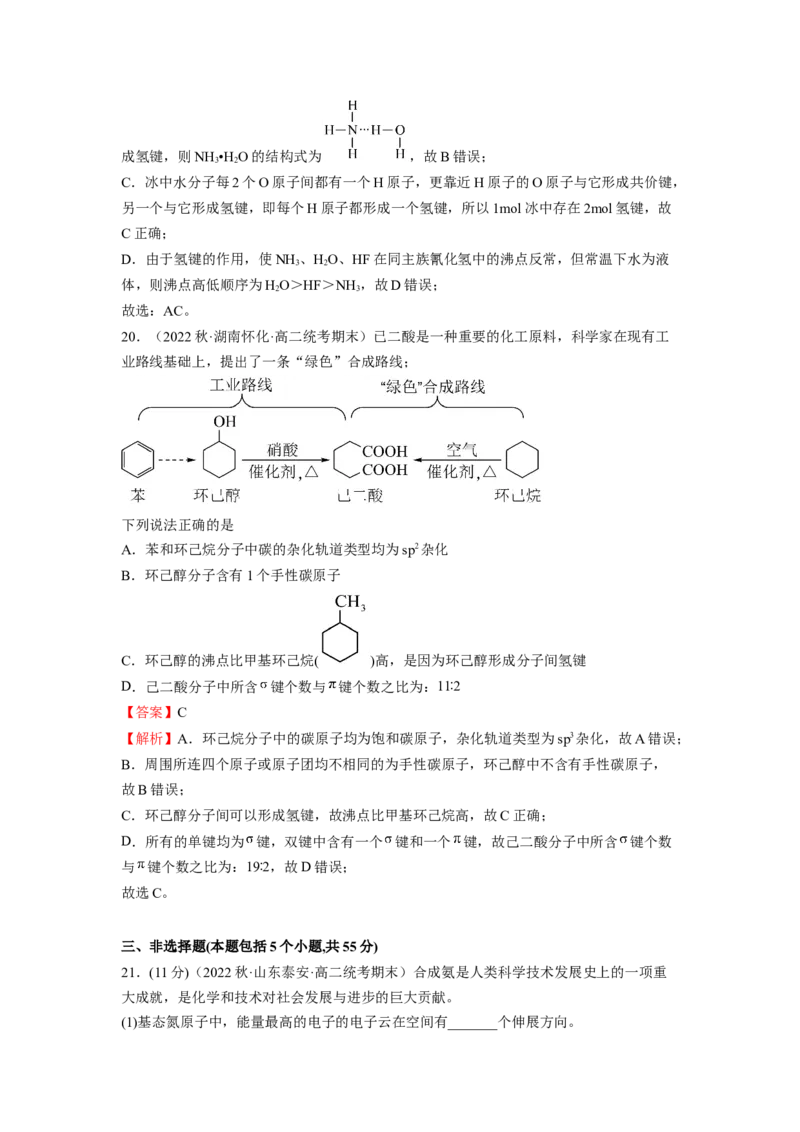
20.(2022秋·湖南怀化·高二统考期末)已二酸是一种重要的化工原料,科学家在现有工
业路线基础上,提出了一条“绿色”合成路线;
下列说法正确的是
A.苯和环己烷分子中碳的杂化轨道类型均为sp2杂化
B.环己醇分子含有1个手性碳原子
C.环己醇的沸点比甲基环己烷( )高,是因为环己醇形成分子间氢键
D.己二酸分子中所含 键个数与 键个数之比为:11∶2
【答案】C
【解析】A.环己烷分子中的碳原子均为饱和碳原子,杂化轨道类型为sp3杂化,故A错误;
B.周围所连四个原子或原子团均不相同的为手性碳原子,环己醇中不含有手性碳原子,
故B错误;
C.环己醇分子间可以形成氢键,故沸点比甲基环己烷高,故C正确;
D.所有的单键均为 键,双键中含有一个 键和一个 键,故己二酸分子中所含 键个数
与 键个数之比为:19∶2,故D错误;
故选C。
三、非选择题(本题包括5个小题,共55分)
21.(11分)(2022秋·山东泰安·高二统考期末)合成氨是人类科学技术发展史上的一项重
大成就,是化学和技术对社会发展与进步的巨大贡献。
(1)基态氮原子中,能量最高的电子的电子云在空间有_______个伸展方向。(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反
的用“ ”表示,称为电子的自旋磁量子数。对于基态的氮原子,其价电子自旋磁量子
数的代数和为_______。
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、 、CaO、
MgO、 等氧化物中的几种。
①Cr原子的价电子排布图为_______;第四周期ds区元素中,与基态Cr原子最外层电子数
目相同的元素的元素符号为_______。
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有_______(填元素符号)
(4)我国科研人员研制出了M-LiH(M为Fe、Mn等金属)等催化剂,使得合成氨工业的温度,
压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①Mn在元素周期表中的位置_______,基态Mn原子未成对的电子数为_______。
②第三电离能 _______ (填“>”或“<”),原因是_______。
【答案】(1)3
(2) 或
(3) Cu Al、O
(4) 第四周期ⅦB族 5 < 价电子排布为 ,易失去一个电子形成比
较稳定的 半满状态,而 的价电子排布式为 ,处于较稳定的半充满状态,所以
难失去
【解析】(1)基态氮原子中,能量最高的电子为2p电子,电子云在空间有3个伸展方向。
(2)基态氮原子电子排布为1s22s22p3,则其价电子自旋磁量子数的代数和为 或 ;
(3)①Cr为24号元素,Cr原子的价电子排布图为 ;第四周
期ds区元素中,铜的价电子为3d104s1,与基态Cr原子最外层电子数目相同的元素的元素
符号为Cu。
②上述氧化物所涉及的元素中,处于元素周期表中p区的元素有Al、O;
(4)①Mn为25号元素,在元素周期表中的位置第四周期ⅦB族,基态Mn原子核外电子
排布为1s22s22p63s23p63d54s2,故基态Mn原子未成对的电子数为5;
② 价电子排布为 ,易失去一个电子形成比较稳定的 半满状态,而 的价电
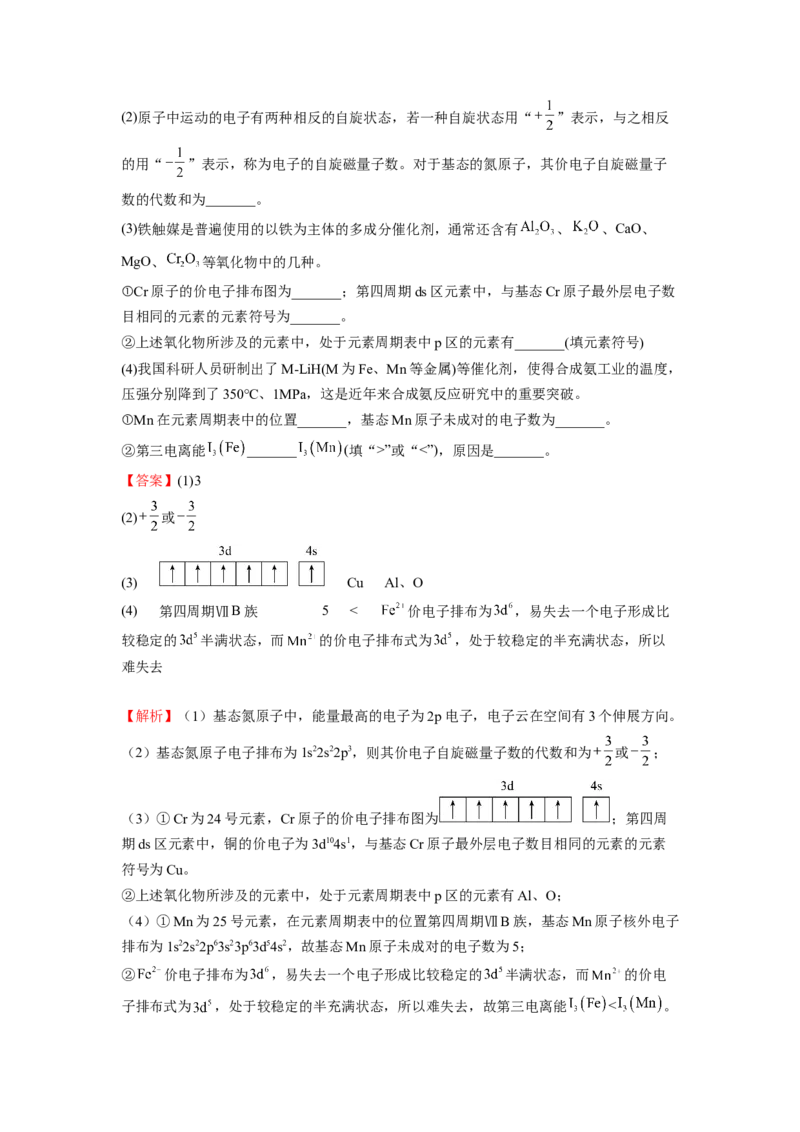
子排布式为 ,处于较稳定的半充满状态,所以难失去,故第三电离能 < 。22.(11分)(2022秋·天津和平·高二统考期末)回答下列问题:
(1)氟原子激发态的电子排布式有______,其中能量较高的是______。(填标号)
a.1s22s22p43s1 b.1s22s22p43d2 c.1s22s12p5 d.1s22s22p33p2
(2)某元素原子的位于周期表的第四周期,元素原子的最外层只有一个电子,其次外层内的
所以轨道电子均成对。该元素位于周期表的______区,写出该基态原子电子排布式为
______。
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一
电离能的变化图是______(填标号),判断的根据是______;第三电离能的变化图是
______(填标号)。
(4)短周期元素X、Y、Z、W的原子序数依次增大。根据表中信息完成下列空白。
元素 X Y Z W
最高价氧化物的水化物 HZO
3 4
0.1 mol∙L−1溶液对应的pH(25℃) 1.00 13.00 1.57 0.70
①元素的电负性:Z______W(填“大于”“小于”或“等于”)。
②简单离子半径:W______Y(填“大于”“小于”或“等于”)。
③氢化物的稳定性:X______Z(填“大于”“小于”或“等于”)。
【答案】(1) ad d
(2) ds [Ar]3d104s1
(3) 图a 同一周期第一电离能的总体趋势是依次升高的,但由于N元紧的2p能级为半
充满状态,因此N元索的第一电离能较C、O两种元素高 图b
(4) 小于 大于 大于
【解析】(1)氟是9号元素,核外有9个电子,因此bc不符合题意,而原子激发态的电
子排布式有ad,3p能级上电子的能量高于3s能级上电子的能量,因此能量较高的是
1s22s22p33p2即d;故答案为:ad;d。
(2)某元素原子的位于周期表的第四周期,元素原子的最外层只有一个电子,其次外层内
的所以轨道电子均成对,则该原子价电子排布式为3d104s1;该元素位于周期表的ds区,写
出该基态原子电子排布式为[Ar]3d104s1;故答案为:ds;[Ar]3d104s1。
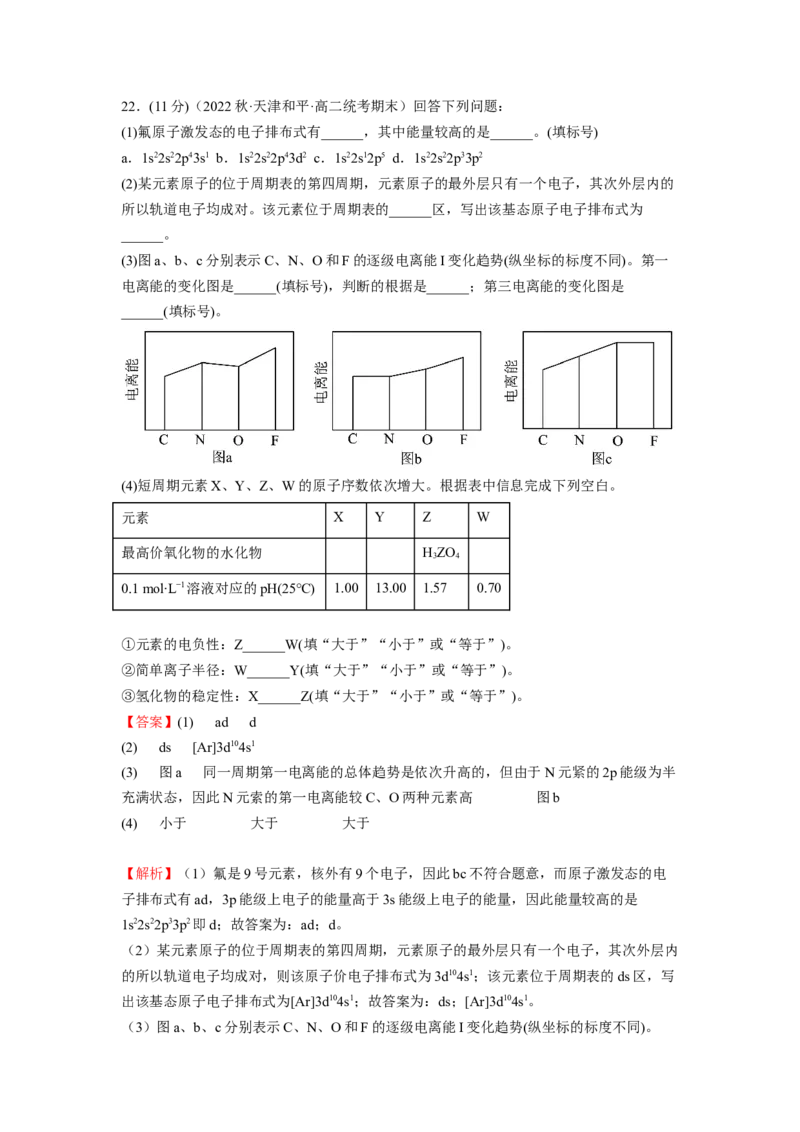
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。根据题意,同周期从左到右第一电离能呈增大趋势,但第IIA族大于第IIIA族,第VA族
大于第VIA族,因此第一电离能第一电离能的变化图是图a,判断的根据是同一周期第一
电离能的总体趋势是依次升高的,但由于N元紧的2p能级为半充满状态,因此N元索的
第一电离能较C、O两种元素高;失去两个电子后的价电子排布式分别为2s2,2s22p1,
2s22p2,2s22p3,碳价电子2p处于全空,稳定,难失去电子,第三电离能比氮大,因此第三
电离能的变化图是图b;故答案为:图a;同一周期第一电离能的总体趋势是依次升高的,
但由于N元紧的2p能级为半充满状态,因此N元索的第一电离能较C、O两种元素高;图
b。
(4)根据短周期元素X、Y、Z、W的原子序数依次增大,0.1 mol∙L−1溶液对应的
pH(25℃)分析,得到X为N,Y为Na,Z为P,W为S。
①根据同周期从左到右电负性逐渐增强,同主族从上到下电负性逐渐减小,则元素的电负
性:Z小于W;故答案为:小于。
②根据层多径大,同电子层结构核多径小,则简单离子半径:W大于Y;故答案为:大于。
③根据非金属性越强,其气态氢化物越稳定,则氢化物的稳定性:X大于Z;故答案为:
大于。
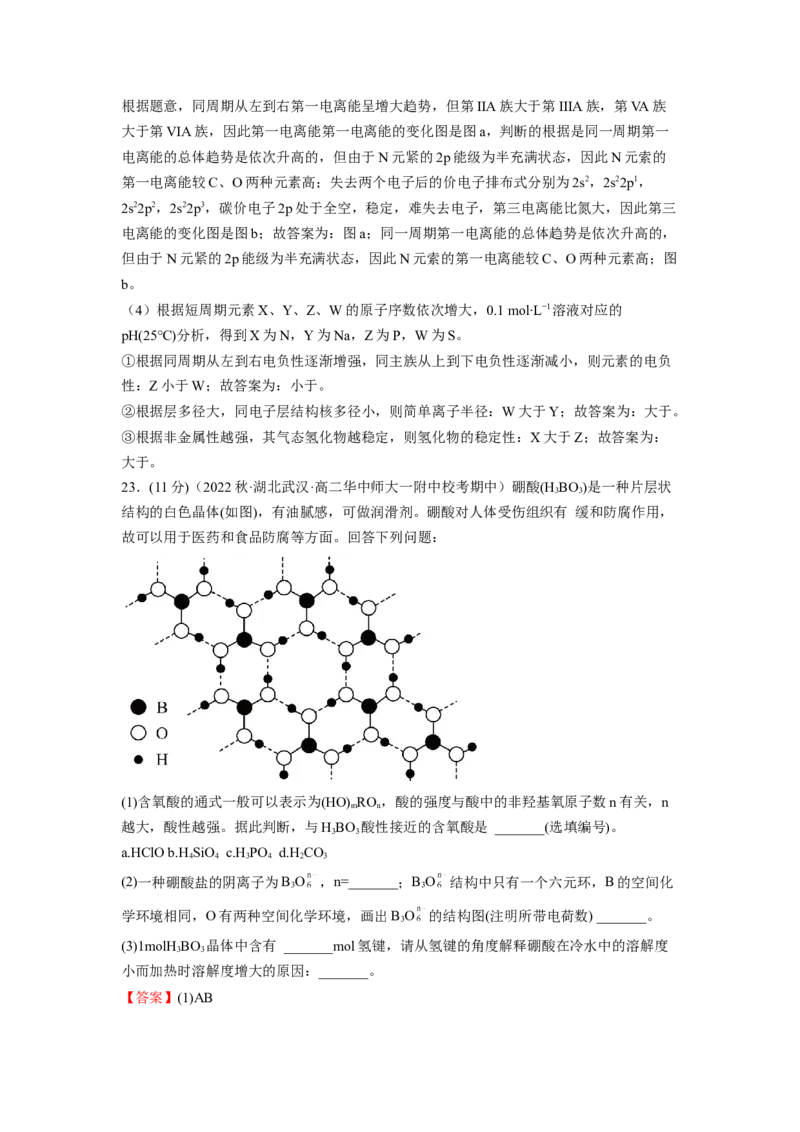
23.(11分)(2022秋·湖北武汉·高二华中师大一附中校考期中)硼酸(H BO)是一种片层状
3 3
结构的白色晶体(如图),有油腻感,可做润滑剂。硼酸对人体受伤组织有 缓和防腐作用,
故可以用于医药和食品防腐等方面。回答下列问题:
(1)含氧酸的通式一般可以表示为(HO) RO,酸的强度与酸中的非羟基氧原子数n有关,n
m n
越大,酸性越强。据此判断,与HBO 酸性接近的含氧酸是 _______(选填编号)。
3 3
a.HClO b.H SiO c.H PO d.H CO
4 4 3 4 2 3
(2)一种硼酸盐的阴离子为B O ,n=_______;B O 结构中只有一个六元环,B的空间化
3 3
学环境相同,O有两种空间化学环境,画出B O 的结构图(注明所带电荷数) _______。
3
(3)1molH BO 晶体中含有 _______mol氢键,请从氢键的角度解释硼酸在冷水中的溶解度
3 3
小而加热时溶解度增大的原因:_______。
【答案】(1)AB(2) 3
(3) 3 硼酸分子之间形成氢键,使硼酸谛合成层状大分子,在冷水中溶解度小,而加
热硼酸分子之间形成的氢键被破坏,硼酸分子与水分子之间形成大量的氢键而使加热时硼
酸的溶解度增大
【解析】(1) 可以改写成 ,非羟基氧为0,A. 可以改写为:
,非羟基氧为0;B. 可以改写为 ,非羟基氧为0;C.
可以改写为, ,非羟基氧为1;D. 可以改写成 ,非羟基氧为
1。非羟基数目相同,酸性相近,故AB符合;
(2) 中B为+3价,O为-2价,n=3;每个B原子形成3个共价键,每个O原子形成
2个共价键,所以 的结构图为:
;
(3)根据图示,1个硼酸分子参与形成6个氢键,一个氢键由两个分子形成,所以1个硼
酸分子形成3个氢键,故1mol 晶体中含有3mol氢键;硼酸分子之间形成氢键,使
硼酸谛合成层状大分子,在冷水中溶解度小,而加热硼酸分子之间形成的氢键被破坏,硼
酸分子与水分子之间形成大量的氢键而使加热时硼酸的溶解度增大。
24.(11分)(2022秋·四川凉山·高二宁南中学校考阶段练习)雄黄(As S)、雌黄(As S)均可
4 4 2 3
入药,具有解毒、杀菌、去燥湿的功效,也是中国画主要的黄色矿物质颜料。回答下列问
题:
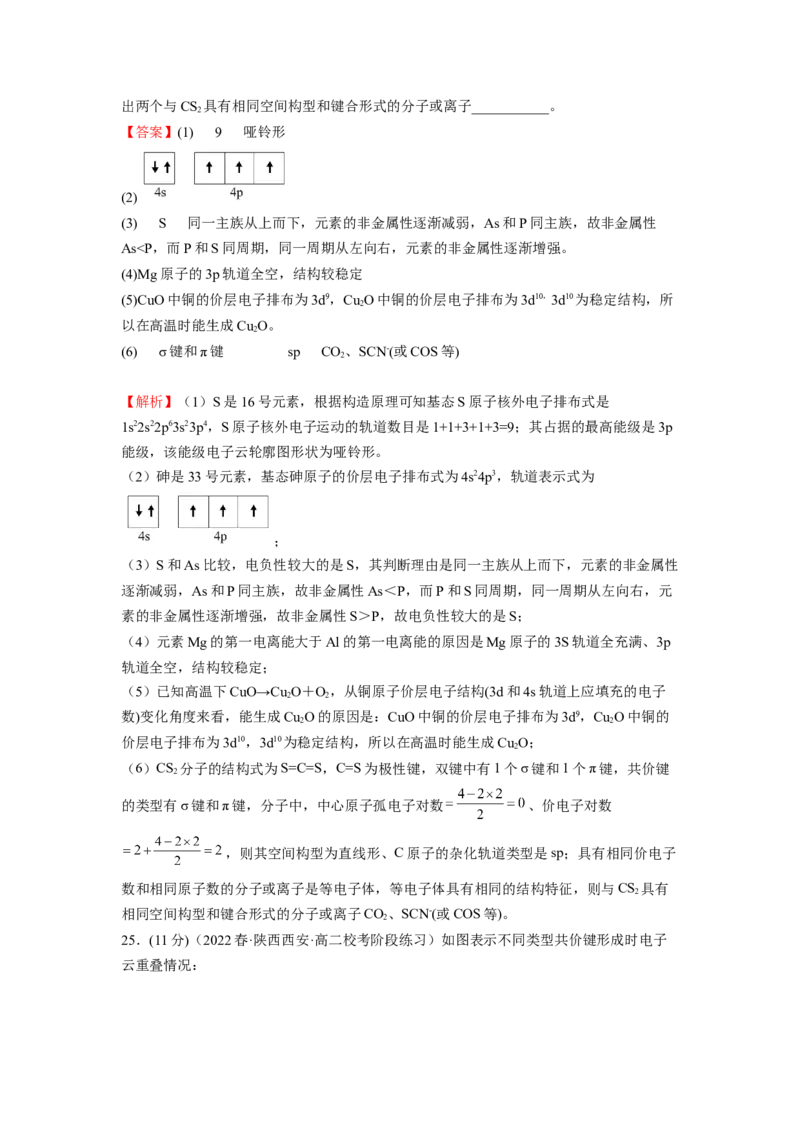
(1)基态硫原子核外电子的运动轨道数有___________种;其核外电子运动最高能级的电子
云轮廓图的形状为___________。
(2)基态砷原子的价层电子的轨道表示式为___________。
(3)S和As比较,电负性较大的是___________,其判断理由是___________。
(4)元素Mg的第一电离能大于Al的第一电离能的原因是___________。
(5)已知高温下CuO→Cu O+O,从铜原子价层电子结构(3d和4s轨道上应填充的电子数)
2 2
变化角度来看,能生成Cu O的原因是___________。
2
(6)CS 分子中,共价键的类型有___________,C原子的杂化轨道类型是___________,写
2出两个与CS 具有相同空间构型和键合形式的分子或离子___________。
2
【答案】(1) 9 哑铃形
(2)
(3) S 同一主族从上而下,元素的非金属性逐渐减弱,As和P同主族,故非金属性
As