文档内容
高一化学必修第一册同步单元AB卷(新教材人教版)
高一化学上学期期末模拟卷(二)
说明:本试卷分选择题非选择题,满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5 K 39 Fe 56 Zn 65
As 75
一、选择题:本题共20个小题,每小题2分。共40分,在每小题给出的四个选项中,只有一项是符合题
目要求的。
1. (2019江西四校协作体高一期中)下列有关物质分类的说法正确的是
A.纯碱、液态氧、碘酒、稀盐酸依次是盐、单质、混合物、电解质
B.干冰、生石灰、硫酸、碳酸氢铵依次是单质、氧化物、酸、盐
C.氯化氢、氨、水银、草木灰依次是电解质、非电解质、单质、混合物
D.冰水、空气、泥水依次是溶液、胶体、浊液
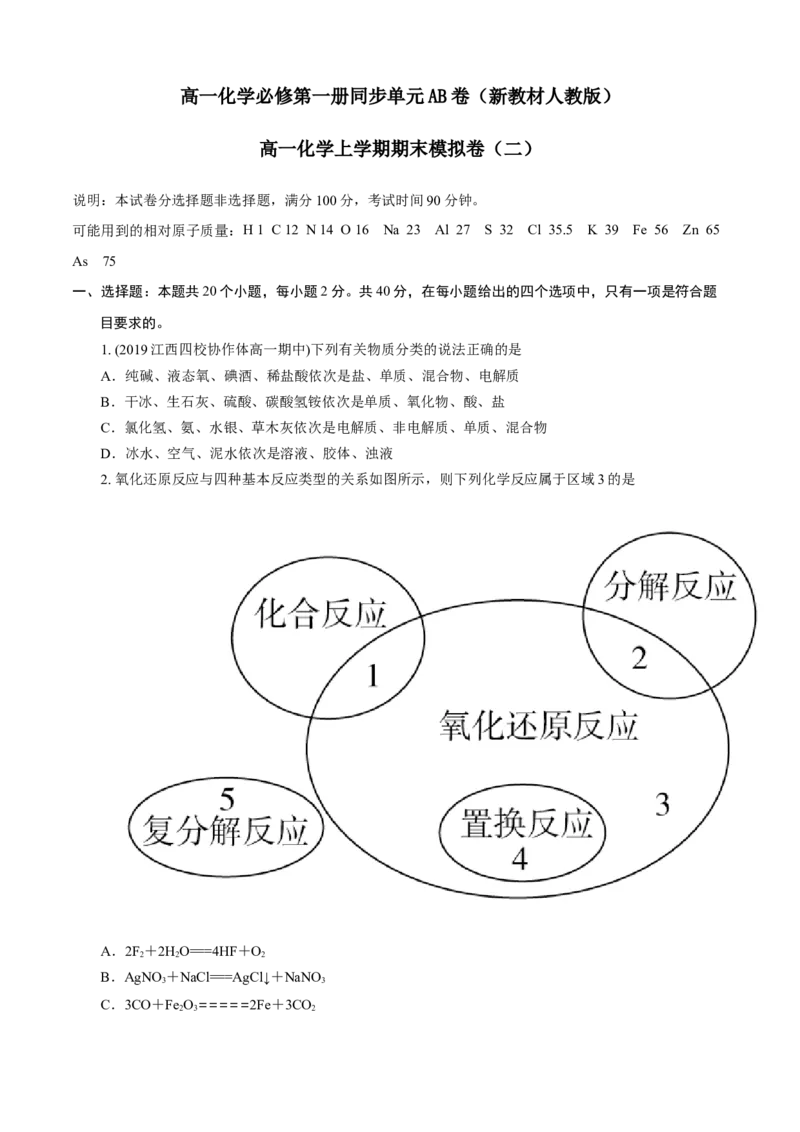
2. 氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是
A.2F+2HO===4HF+O
2 2 2
B.AgNO+NaCl===AgCl↓+NaNO
3 3
C.3CO+Fe O=====2Fe+3CO
2 3 2D.MgCl (熔融)=====Mg+Cl↑
2 2
3. 下列反应的离子方程式书写正确的是
A. NaHSO 溶液中加入Ba(OH) 溶液后溶液恰好显中性:Ba2++OH-+H++SO===BaSO +HO
4 2 4 2
B. 向澄清石灰水中通入过量CO:OH-+CO===HCO
2 2
C. 氢氧化钡溶液与稀硫酸反应:Ba2++SO===BaSO ↓
4
D. 碳酸钙与盐酸反应:CO+2H+===H O+CO↑
2 2
4. 反应①②分别是从海藻灰和某种矿石中提取碘的主要反应:①2NaI+MnO +3HSO ===2NaHSO +
2 2 4 4
MnSO +2HO+I;②2NaIO +5NaHSO===2Na SO +3NaHSO+HO+I。下列说法正确的是
4 2 2 3 3 2 4 4 2 2
A.两个反应中硫元素均被氧化
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:MnO >SO>IO>I
2 2
D.反应①②中生成等量的I 时,转移电子数之比为1∶5
2
5. 下列有关于焰色反应说法错误的是
A. 焰色反应是物理变化,利用的是元素的性质
B. 焰色反应一般用铂丝,细铁丝蘸取药品做相关实验
C. 更换样品时,需用盐酸洗涤铂丝,然后在酒精灯上灼烧至几乎无色才能蘸取新样品
D. 某物质焰色反应是黄色,则一定含有钠元素,不可能含有钾元素
6. 将紫色石蕊试液滴入NaOH溶液中,溶液变蓝色,再通入氯气,溶液由蓝色变成红色,最后颜色慢
慢褪去,其原因是
①氯气有漂白性 ②氯气与NaOH溶液反应 ③氯气的水溶液呈酸性 ④次氯酸有漂白性 ⑤氯化钠
有漂白性
A.①④ B.②③④
C.①②③ D.④⑤
7. 已知氯气和NaOH溶液在一定温度下能发生反应:
Cl+2NaOH===NaCl+NaClO+HO
2 2
3Cl+6NaOH===5NaCl+NaClO+3HO。
2 3 2
某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO和NaClO 的混合溶液,经测定ClO-与
3
ClO的物质的量之比为1∶3,则氯气与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比
为
A. 21∶5 B.11∶3
C.3∶1 D.4∶1
8. 含有砒霜(As O)的试样和锌、盐酸混合反应,生成的砷化氢(AsH)在热玻璃管中完全分解成单质砷
2 3 3
和氢气。若砷的质量为1.50 mg,则
A.被氧化的砒霜为1.98 mg
B.分解产生的氢气为0.672 mL
C.和砒霜反应的锌为3.90 mgD.转移的电子总数为6×10-5N
A
9. V L Fe (SO ) 溶液中含有a g SO,取此溶液0.5V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质
2 4 3
的量浓度为
A. mol·L-1 B. mol·L-1
B. mol·L-1 D. mol·L-1
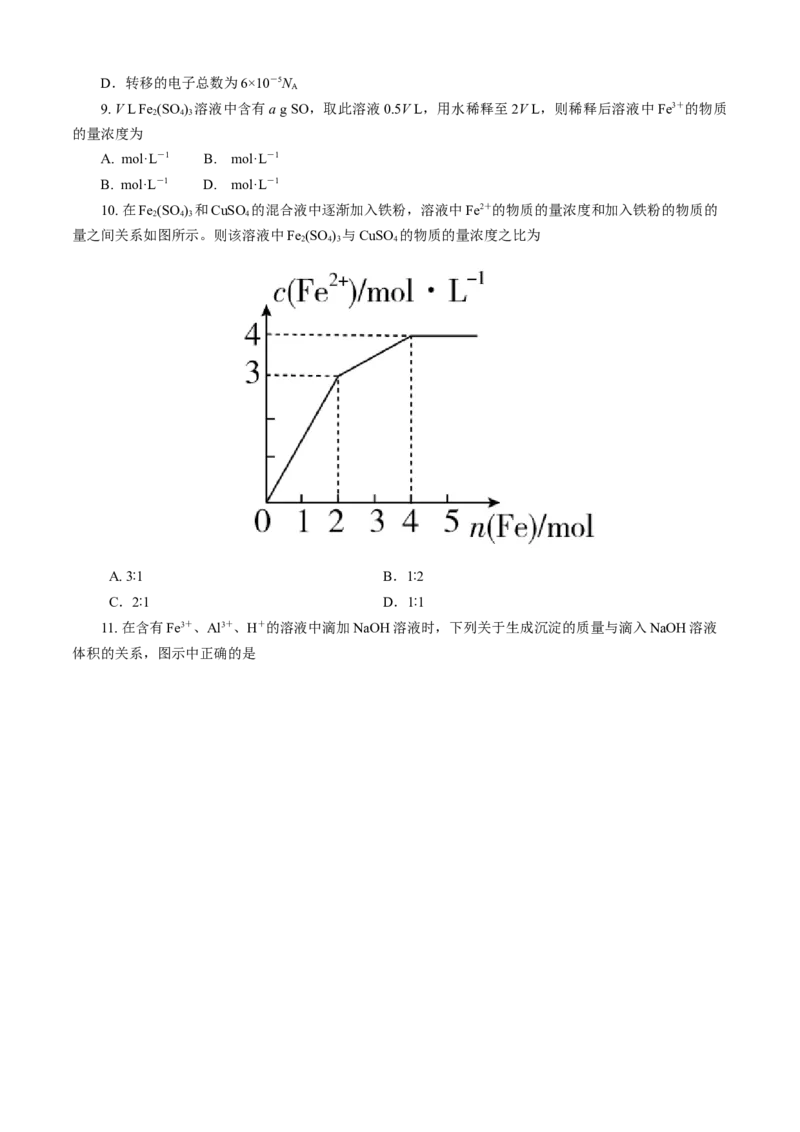
10. 在Fe (SO ) 和CuSO 的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的
2 4 3 4
量之间关系如图所示。则该溶液中Fe (SO ) 与CuSO 的物质的量浓度之比为
2 4 3 4
A. 3∶1 B.1∶2
C.2∶1 D.1∶1
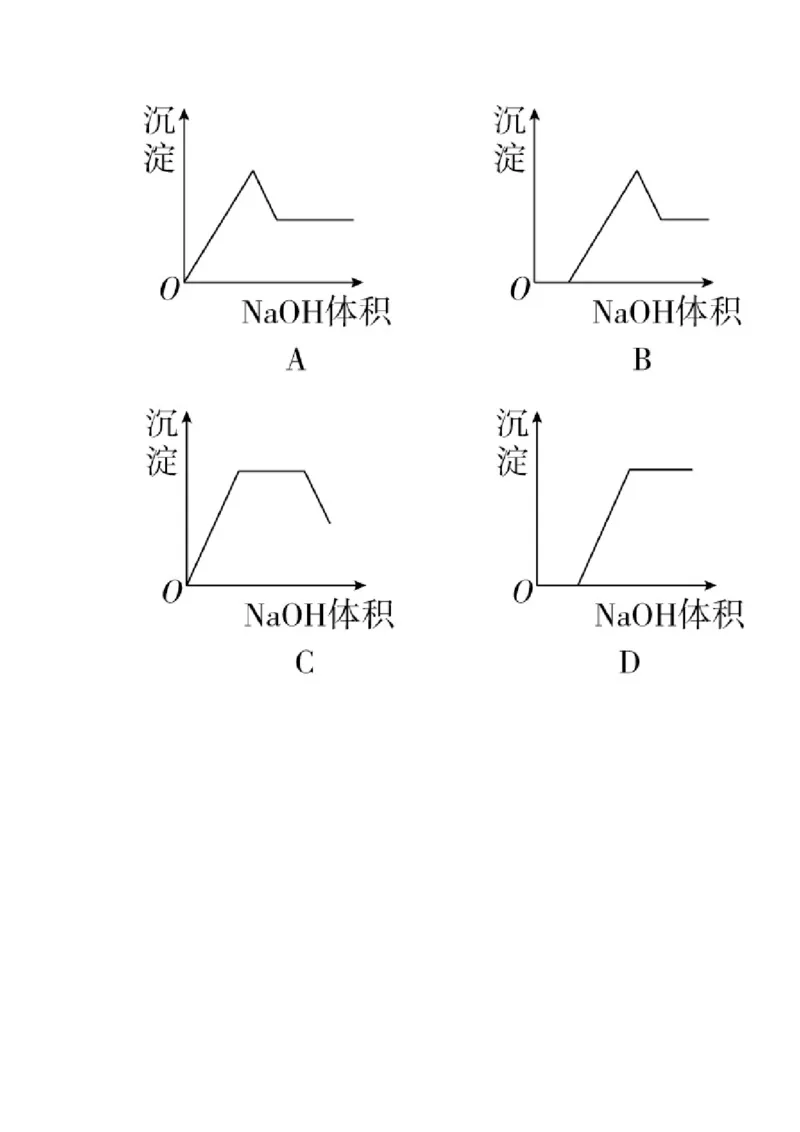
11. 在含有Fe3+、Al3+、H+的溶液中滴加NaOH溶液时,下列关于生成沉淀的质量与滴入NaOH溶液
体积的关系,图示中正确的是12. 下列混合物分离(或除杂)的方法正确的是
A.除去Mg粉中的Al粉:加入足量NaOH溶液后,过滤、洗涤
B.除去BaCO 固体中混有的BaSO:加入过量盐酸后,过滤、洗涤
3 4
C.除去NaHCO 溶液中的NaCO:加入适量稀盐酸
3 2 3
D.除去Al O 中的少量Fe O:加入过量氢氧化钠溶液,过滤、洗涤
2 3 2 3
13. 甲、乙两个烧杯中分别盛有100 mL 4.0 mol·L-1盐酸和100 mL 4.0 mol·L-1 NaOH溶液,向两个烧
杯中均加入5.4 g铝粉,在相同状况下甲、乙两个烧杯中产生气体的体积之比为
A.1∶1 B.2∶3
C.3∶2 D.3∶1
14. “嫦娥四号”月球探测器于2019年1月3日实现人类首次月背登陆。“嫦娥四号”中使用了大量
合金。下列有关金属或合金的说法中不正确的是
A.生铁属于合金B.合金的化学性质与其成分金属的化学性质不同
C.一般合金的熔点比各成分金属的低
D.改变原料的配比、生成合金的条件,可以得到具有不同性能的合金
15. 13C-NMR(核磁共振)可用于含碳化合物的结构分析,15N-NMR可用于测定蛋白质、核酸等生物
大分子的空间结构,下列有关13C、15N的叙述正确的是
A.13C与15N具有相同的中子数
B.13C与C 是同一种物质
60
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
16. 砹(At)原子序数为85,与F、Cl、Br、I同族,推测砹或砹的化合物不可能具有的性质是
A.砹是有色固体
B.非金属性:At<I
C.HAt非常稳定
D.I 能从砹的可溶性盐溶液中置换出At
2 2
17. 固体A的化学式为NH ,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子层结构,
5
则下列有关说法中错误的是
A.1 mol NH 中含有5N 个N—H键(N 表示阿伏加德罗常数)
5 A A
B.NH 中既含有共价键又含有离子键,属于离子化合物
5
C.NH 的电子式为
5
D.NH 能与HO发生氧化还原反应
5 2
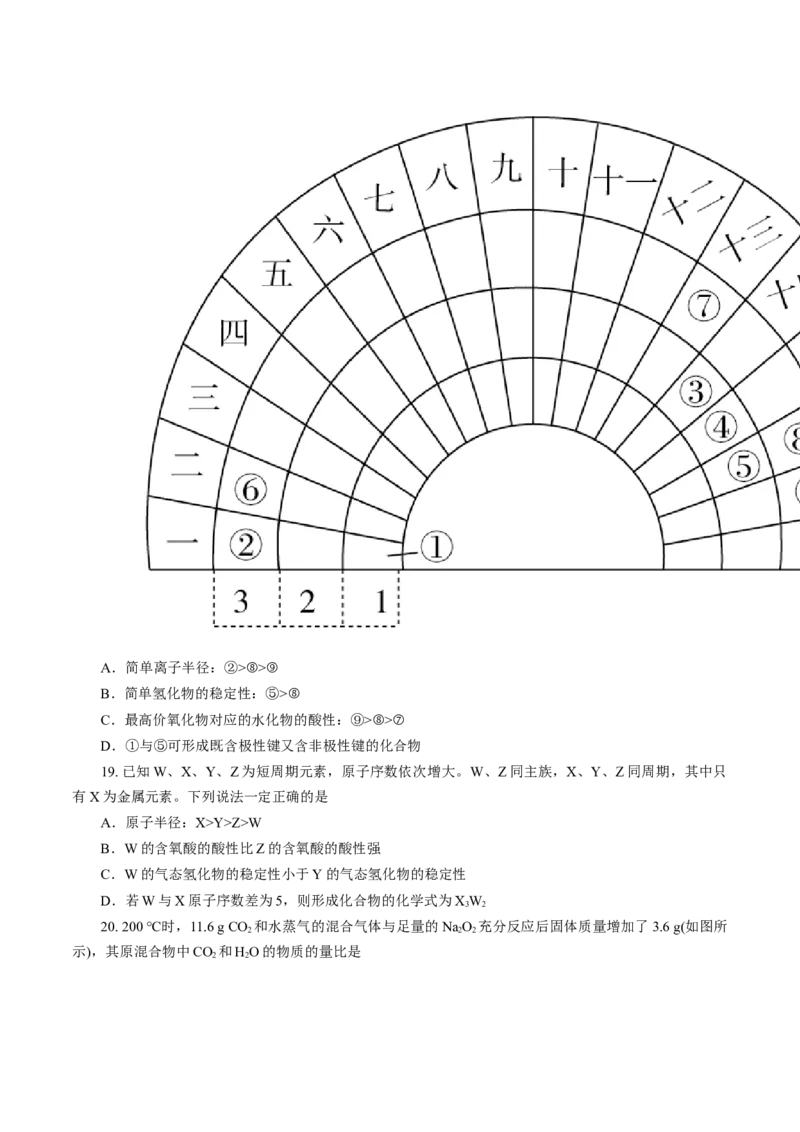
18. 元素周期表的形式多种多样,如下图所示是扇形元素周期表的一部分,对比中学常见元素周期表,
思考扇形元素周期表的填充规律,下列说法不正确的是A.简单离子半径:②>⑧>⑨
B.简单氢化物的稳定性:⑤>⑧
C.最高价氧化物对应的水化物的酸性:⑨>⑧>⑦
D.①与⑤可形成既含极性键又含非极性键的化合物
19. 已知W、X、Y、Z为短周期元素,原子序数依次增大。W、Z同主族,X、Y、Z同周期,其中只
有X为金属元素。下列说法一定正确的是
A.原子半径:X>Y>Z>W
B.W的含氧酸的酸性比Z的含氧酸的酸性强
C.W的气态氢化物的稳定性小于Y的气态氢化物的稳定性
D.若W与X原子序数差为5,则形成化合物的化学式为XW
3 2
20. 200 ℃时,11.6 g CO 和水蒸气的混合气体与足量的NaO 充分反应后固体质量增加了3.6 g(如图所
2 2 2
示),其原混合物中CO 和HO的物质的量比是
2 2A.1∶4 B.3∶1
C.1∶11 D.21∶22
二、非选择题:本题共5个题,共60分。
21. (12分)
某学生欲配制6.0 mol·L-1的HSO 溶液1000 mL,实验室有三种不同体积、不同浓度的 HSO 溶液:
2 4 2 4
①480 mL 0.5 mol·L-1的HSO 溶液;②150 mL 25%的HSO 溶液(ρ=1.18 g·mL-1);③足量的18 mol·L-1
2 4 2 4
的HSO 溶液。有三种规格的容量瓶:250 mL、500 mL、1000 mL。老师要求把①②两种HSO 溶液全部
2 4 2 4
用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的HSO 溶液的物质的量浓度为________ mol·L-1(保留一位小数)。
2 4
(2)配制该HSO 溶液应选用容量瓶的规格为________ mL。
2 4
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部倒入烧杯中混合均匀;
B.用量筒准确量取所需的18 mol·L-1的HSO 溶液________ mL,沿烧杯内壁倒入上述混合液中,并
2 4
用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的HSO 溶液沿玻璃棒注入所选的容量瓶中;
2 4
D.______________________________________________________________________;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm处;
F.改用胶头滴管加水,使溶液的凹液面最低处恰好与刻度线相切;
G.将容量瓶盖紧,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?________(填“偏大”“偏小”或“无影响”)。
(5)进行操作C前还需注意___________________。
22. (12分)
阅读表中短周期主族元素的相关信息,回答下列问题:
元素代号 相关信息
A A的单质能与冷水剧烈反应,得到强碱性溶液
B B的原子最外层电子数是其内层电子数的3倍
C 在第三周期元素中,C的简单离子半径最小
D A、B、D组成的36电子的化合物X是家用消毒剂的主要成分E 所有有机物中都含有E元素
(1)写出E在元素周期表中的位置:________________________________;
画出C的简单离子的结构示意图:________。
(2)X的化学式为________。
(3)A、B、C三种元素的简单离子的半径由大到小的顺序为________(用离子符号表示)。
(4)A、B两元素组成的化合物AB 属于________(填“离子化合物”或“共价化合物”),其中存在的
2 2
化学键是________。
(5)C 的 单 质 能 与 A 的 最 高 价 氧 化 物 对 应 水 化 物 发 生 反 应 , 反 应 离 子 方 程 式 为
_______________________。
23. (12分)
硫酸亚铁晶体(FeSO ·7H O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该
4 2
补血剂是否变质。实验步骤如下:
请回答下列问题:
(1)向步骤①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有________(填离子符号),检验滤
液中还存在Fe2+的方法为_____________________________________________________(说明试剂、现象)。
(2)步骤②加入过量HO 的目的是__________________________。
2 2
(3)步骤③中反应的离子方程式为_________________________________________。
(4)步骤④中一系列处理的操作步骤包括:过滤、________、灼烧、________、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为________g。
24. (10分)
现有由等质量的NaHCO 和KHCO 组成的混合物a g,与100 mL盐酸反应。(题中涉及的气体体积均
3 3
换算成标准状况下的气体体积)
(1)该混合物中NaHCO 与KHCO 的物质的量之比为________。
3 3
(2)若混合物与盐酸恰好完全反应,则盐酸中HCl的物质的量为________mol。
(3)若盐酸过量,则生成CO 的体积为________L。
2
(4)如果反应后溶液中仍有HCO,要计算生成CO 的体积,还需要知道____________________。
2(5)若NaHCO 和KHCO 不是以等质量混合,则a g混合物与足量的盐酸完全反应时生成CO 的体积
3 3 2
[V(CO)]范围是______________。
2
25. (14分)
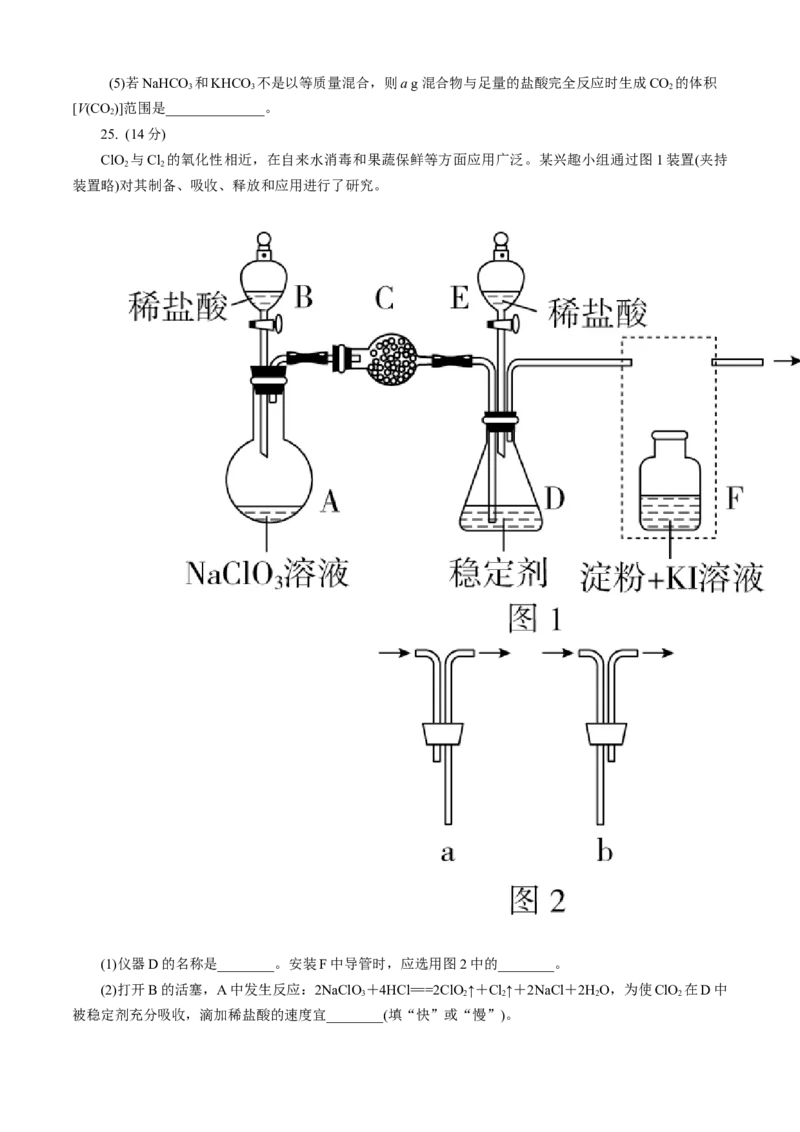
ClO 与Cl 的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持
2 2
装置略)对其制备、吸收、释放和应用进行了研究。
(1)仪器D的名称是________。安装F中导管时,应选用图2中的________。
(2)打开B的活塞,A中发生反应:2NaClO+4HCl===2ClO ↑+Cl↑+2NaCl+2HO,为使ClO 在D中
3 2 2 2 2
被稳定剂充分吸收,滴加稀盐酸的速度宜________(填“快”或“慢”)。(3)关闭B的活塞,ClO 在D中被稳定剂完全吸收生成NaClO ,此时F中溶液的颜色不变,则装置C
2 2
的作用是_____________________________。
(4)已知在酸性条件下 NaClO 可发生反应生成 NaCl 并释放出 ClO ,该反应的离子方程式为
2 2
________________________________________。在ClO 释放实验中,打开E的活塞,D中发生反应,则装
2
置F的作用是________________________。
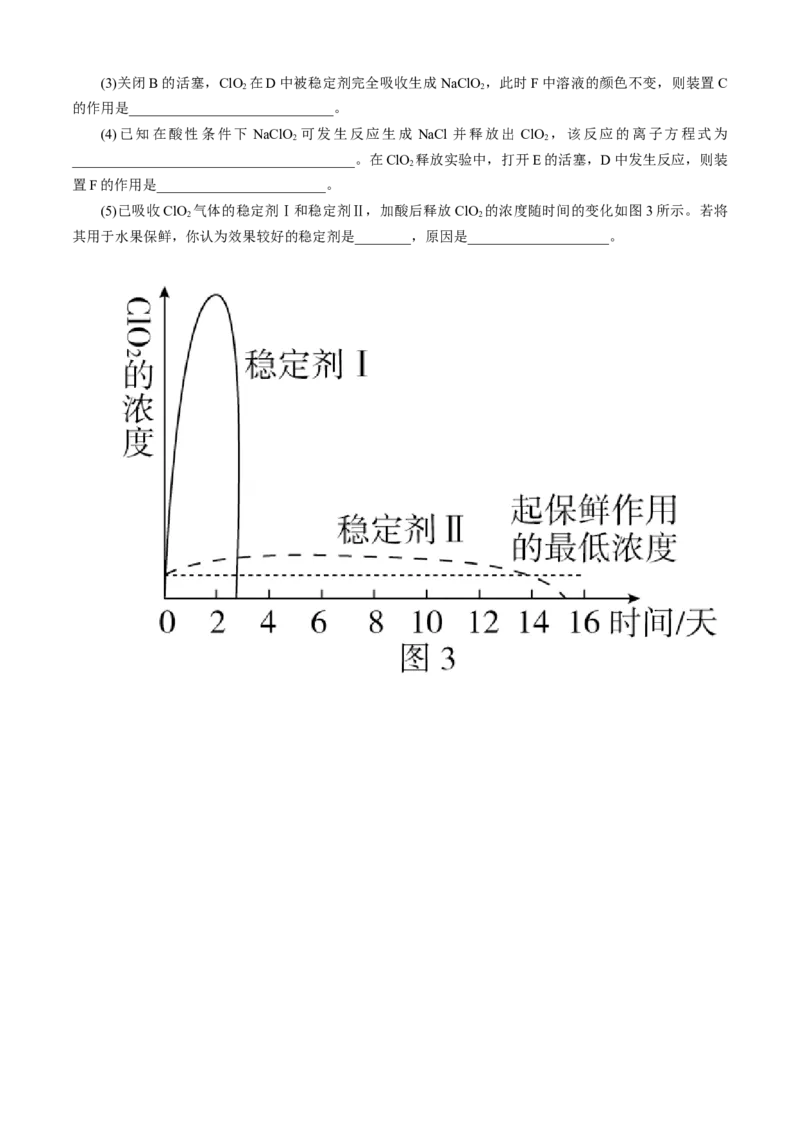
(5)已吸收ClO 气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO 的浓度随时间的变化如图3所示。若将
2 2
其用于水果保鲜,你认为效果较好的稳定剂是________,原因是____________________。