文档内容
2024—2025 学年度高一年级 11 月联考
化学试题
本试卷共8页,20题。全卷满分100分。考试用时75分钟。
注意事项:
1.答题前,先将自己的姓名、准考证号填写在答题卡上.并将准考证号条形码粘贴在答题卡
上的指定位置。
2.选择题的作答:每小题选出答案后,用 2B铅笔把答题卡上对应题目的答案标号涂黑。写
在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接写在答题卡上对应的答题区域内。写在试题卷、草稿纸和
答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H 1 Li 17 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl
35.5 K 39 Cu 64 Zn 65 Ag 108 Ba 137
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题
4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.劳动创造美好生活。下列劳动场景中涉及氧化还原反应的是( )
A.用“84”消毒液消毒 B.海水晒盐
C.雕刻雕像 D.用熟石灰为墙体刮白
2.欲确定某溶液中是否含有 ,下列试剂或仪器通常不会被使用的是( )
A. 溶液 B.稀硝酸 C.胶头滴管 D.球形冷凝管
3.氢氧化钠广泛用于制肥皂、造纸、纺织和印染等工业。下列关于氢氧化钠的说法不正确的是( )
A.是化合物,属于一元碱 B.俗称苛性钠、烧碱、纯碱
C.在空气中易变质 D.可由碳酸钠和石灰乳反应制得
4.设 为阿伏加德罗常数的值。下列关于73g氯化氢的说法正确的是( )
A.常温常压下的体积为44.8L B.含有原子的数目为2
C.含有电子的数目为36 D.溶于1L水中可配成2 的盐酸5. 有多种途径,使用下列试剂能达到该目的的是( )
A. 溶液,NaOH溶液 B.KOH溶液
C.HCl溶液, 溶液 D. ,澄清石灰水
6.下列关于0.5L 1 溶液的说法正确的是( )
A.含有氧原子的数目约为 个
B.溶质 的摩尔质量为213g
C.
D.取上述溶液0.1L,可得到0.2 的 溶液
7.“类推”是化学学习中常用的一种方法。下列根据实际事实能得出相应类推结论的是( )
选项 实际事实 类推结论
A
与漂白粉溶液反应可得到 沉淀 与漂白液反应可得
B 氯化钠属于盐类,能食用
也属于盐类.也能食用
C
具有漂白性 也具有漂白性
D CaO是碱性氧化物,可作食品的干燥剂
也是碱性氧化物,可作食品的干燥剂
8.下列转化中必须加入氧化剂才能实现的是( )
A. B.
C. D.
9.臭氧是淡蓝色具有鱼腥味的气体,可用作漂白剂、皮毛脱臭剂、消毒杀菌剂等。下列有关 、 的
说法不正确的是( )
A.是同素异形体
B.均有较强的氧化性
C.常温常压下,等质量的 、 的体积之比为3:2
D.等质量的 、 中氧原子的个数之比为2:3
10.纳米级 具有特殊的光学、电学和光电化学性质,广泛用于太阳能、电池和传感器等方面,其一
种制备原理为[该反应中仅 作氧化剂]。下列说法正确的是( )
A.激光笔照射纳米级 粉末可产生丁达尔效应
B.纳米级 的直径可能是120nm
C.制备原理中的“X”为“ ”
D.每生成0.1mol ,理论上转移电子的数目为0.1
11.氢化锂(LiH)是一种优良的贮氢试剂,可用作有机合成的还原剂、核防护材料以及在军事上可用作
氢气发剂。LiH与水反应的化学方程式为 。下列说法不正确的是( )
A.LiH中两种离子的核外电子数相同 B.上述反应中LiH作还原剂
C.被氧化、被还原的元素均是氢元素 D.氧化产物与还原产物的质量之比为12:1
12.下列实验操作可达到预期目的或能得到相应结论的是( )
选项 实验操作 预期目的或结论
A 向某无色溶液中滴加盐酸,有无味气泡产生
该溶液中一定有
B 将含 和少量HCl的混合气体缓慢通过饱和 溶液
除去 中的HCl
中
C 用洁净的铂丝蘸取溶液Z后在酒精灯火焰f灼烧并观察 确定Z是否为钠盐
D 向包裹有过氧化钠的脱脂棉上滴几滴水,脱脂棉燃烧
与水反应放热
13.下列试剂不能将等物质的量浓度的 溶液、 溶液区分开的是( )
A. 溶液 B. 溶液 C.盐酸 D.酚酞试液
14.苏打广泛用于玻璃、造纸、纺织、洗涤剂等,工业上以食盐水、 、 为原料,制备苏打的流
程如图所示。下列说法不正确的是( )
A.“溶液1”是NaCl的饱和溶液
B.相同温度下“晶体1”的溶解度比NaCl的大C.成盐反应的离子方程式为
D.“操作a”是加热,其产物之一是物质Y
15.如图所示为常见含氯元素物质的“价类”二维图。下列说法正确的是( )
A.在溶液中a与f或a与g混合后均可得到b
B.d与NaOH溶液反应的离子方程式为
C.c是新型水消毒剂,有较强的还原性
D.c的化学式为 ,名称为氯酸
16.将一定量的Fe加入到100mL浓度均为1 的含 、 、 三种溶质
的混合溶液中 ,充分反应后过滤,得到固体X(不合Fe元素)和滤液Y(忽略反应过程中溶液体积的变
化),下列说法正确的是( )
A.若滤液Y呈蓝色,则固体X中只含银
B.若滤液Y中溶质有两种,则滤液Y中
C.溶液中一定会发生的置换反应是
D.若滤液Y中溶质有三种,则固体X的质量可能小于10.8g
二、非选择题:本题包括4小题,共56分。
17.(14分)
有以下六种物质:① 固体;② 溶液;③饱和 溶液;④蔗糖;⑤ ;⑥
。
回答下列问题:
(1)能导电的是______(填序号,下同).属于电解质的是______是非电解质但水溶液能导电的是
______。
(2)②中 的电离方程式为______。(3)将③滴加到沸腾的水中并继续加热至生成 胶体,产生的现象是______;将铜与③混合后,
产物之一是 ,相应反应的离子方程式为______ ,该反应属于______(填选项字母)。
A.置换反应 B.氧化还原反应 C.化合反应
(4)向①的溶液中加入少量②,反应的离子方程式为______。
18.(17分)
钠元素能形成众多用途广泛的化合物,单质钠的化学性质很活泼。
回答下列问题:
(1)将钠粒置于 溶液中,发生两步化学反应,反应的离子方程式分别为______、______,该实验中
能说明钠的密度小于 的现象是______。
(2)过氧化钠在空气中变质,过程中固体由______色最终变为______色,写出一个相应氧化还原反应的
化学方程式并用双线桥法标出电子转移的方向与数目:______。
(3)若某次实验需要使用450mL 0.2 的NaOH溶液,现用NaOH固体和蒸馏水配制。
ⅰ.实验中用托盘天平需要称量______g NaOH固体,称量时NaOH应盛放在______(填仪器名称)中。
ⅱ.图2的操作步骤应在图1中的______(填选项字母,下同)之间。
A.②与③ B.①与② C.④与⑤
ⅲ.下列操作会导致所配溶液的浓度偏高的是______。
A.定容时,仰视刻度线
B.NaOH溶解后未冷却至室温即转移到容量瓶中
C.称量NaOH固体时,天平指针向右偏转
19.(13分)
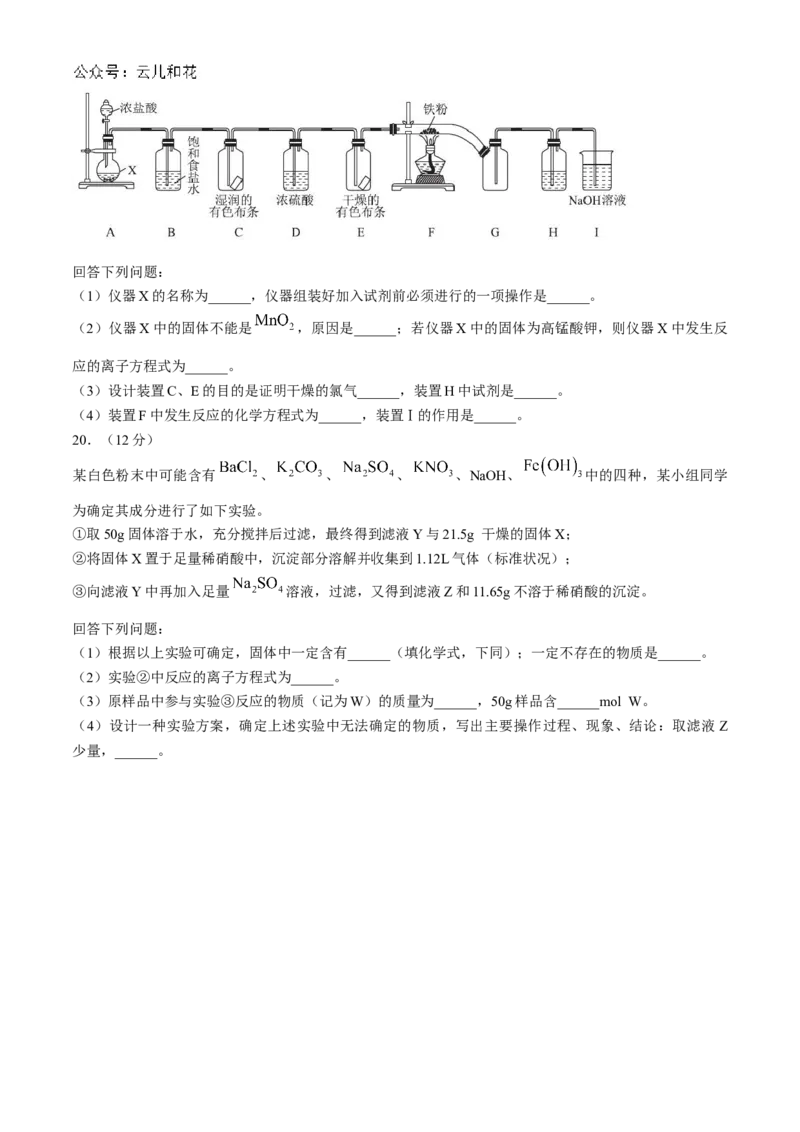
某化学兴趣小组设计了如图所示的装置制备氯气并探究其部分性质,其中铁与氯气反应的产物遇水易转化
为 。回答下列问题:
(1)仪器X的名称为______,仪器组装好加入试剂前必须进行的一项操作是______。
(2)仪器X中的固体不能是 ,原因是______;若仪器X中的固体为高锰酸钾,则仪器X中发生反
应的离子方程式为______。
(3)设计装置C、E的目的是证明干燥的氯气______,装置H中试剂是______。
(4)装置F中发生反应的化学方程式为______,装置Ⅰ的作用是______。
20.(12分)
某白色粉末中可能含有 、 、 、 、NaOH、 中的四种,某小组同学
为确定其成分进行了如下实验。
①取50g固体溶于水,充分搅拌后过滤,最终得到滤液Y与21.5g 干燥的固体X;
②将固体X置于足量稀硝酸中,沉淀部分溶解并收集到1.12L气体(标准状况);
③向滤液Y中再加入足量 溶液,过滤,又得到滤液Z和11.65g不溶于稀硝酸的沉淀。
回答下列问题:
(1)根据以上实验可确定,固体中一定含有______(填化学式,下同);一定不存在的物质是______。
(2)实验②中反应的离子方程式为______。
(3)原样品中参与实验③反应的物质(记为W)的质量为______,50g样品含______mol W。
(4)设计一种实验方案,确定上述实验中无法确定的物质,写出主要操作过程、现象、结论:取滤液Z
少量,______。2024—2025 学年度高一年级 11 月联考
化学参考答案及解析
一、选择题
1.A 【解析】“84”消毒液有强氧化性,能将病毒、细菌氧化杀死,A项符合题意;海水晒盐是溶剂蒸
发使溶质析出的过程,属于物理变化,B项不符合题意;雕刻雕像是利用锋利的刀具对石材进行打磨、塑
形的过程,属于物理变化,C项不符合题意;用熟石灰为墙体刮白的过程不涉及氧化还原反应,D项不符
合题意。
2.D 【解析】检验 必须使用 溶液,为排除 等离子的干扰还需要用到稀硝酸,检验时所
用试剂量较少,通常是使用胶头滴管取用,反应容器通常用试管,没有用到球形冷凝管。故选D项。
3.B 【解析】NaOH 是由 、 构成的,是化合物,属于一元碱,A 项正确;纯碱的成分是
,B项错误;NaOH易与空气中的 发生反应,C项正确;NaOH可由碳酸钠和石灰乳制得,D
项正确。
4.C 【解析】73g氯化氢的物质的量为2 mol,在标准状况下的体积为44.8L,标准状况不是常温常压,A
项错误;1个HCl分子中含有2个原子,故73g氯化氢含有原子的数目为4 ,B项错误;1个HCl分子
中含有18个电子,故73g氯化氢含有电子的数目为36 ,C项正确;2mol HCl溶于1L水后,所配成的
溶液体积不是1L,无法得到2 的盐酸,D项错误。
5.D 【解析】铜与 溶液和NaOH溶液均不反应,A项不符合题意;Cu与KOH溶液不反应,B项
不符合题意;铜与盐酸和 溶液均不反应,C项不符合题意;Cu与 反应得到 ,再与
溶液反应生成 ,D项符合题意。
6.C 【解析】 溶液中的水也含有氧原子,A项错误;摩尔质量的单位是“ ”,B项错
误;由 可知 ,C项正确; 溶液的浓度不变,D
项错误。
7.C 【解析】 与漂白液反应生成 ,A项不符合题意; 有毒,不能食用,B项不符
合题意; 、 中氧元素均显-1价,具有强氧化性,因此均具有漂白性,C项符合题意;CaO可作干燥剂,是因其能与水反应生成 ,但 不能与水反应,故不能作干燥剂,D项不符合
题意。
8.B 【解析】 与碱发生自身的氧化还原反应可得到 ,A项不符合题意; 的过程
中铁失电子作还原剂,故必须加入氧化剂才能实现,B项符合题意; 需要加入还原剂,C项不
符合题意; 的过程中没有元素价态的变化,D项不符合题意。
9.D 【解析】 、 是由同种元素形成的不同单质,A项正确;氧原子最外层有6个电子,易得到电
子,故 和 均有较强的氧化性,B项正确;质量相等的 、 的物质的量之比为 ,同
温同压下物质的量之比等于体积之比,C项正确;两种分子均是由氧原子构成的,故氧原子的个数之比为
1:1,D项错误。
10.C 【解析】纳米级 没有分散到分散剂中,故不能产生丁达尔效应,A项错误;纳米材料的直径
介于1~100nm,B项错误;由元素质量守恒原理可确定“X”为“ ”,C项正确;该制备原理中
作氧化剂,由铜元素化合价从+2价变为+1价可知,每生成0.1mol ,理论上转移电子
的数目为0.2 ,D项错误。
11.D 【解析】 、 核外均有2个电子,A项正确;LiH中氢显-1价,反应后转化为0价的 ,
故LiH作还原剂,B项正确;反应过程中价态发生变化的元素只有氢元素,C项正确;氧化产物与还原产
物均是 ,质量比为1:1,D项错误。
12.D 【解析】 遇到盐酸也能产生气泡,A项错误; 、HCl均可与 反应,B项错误
钠盐与NaOH的焰色相同,不能确定Z是否为钠盐,C项错误; 与水反应放热,致使脱脂棉燃烧,
D项正确。
13.B 【解析】 能与 反应生成 沉淀而 不能,A 项不符合题意;
与 、 溶液反应均能生成白色 沉淀,B 项符合题意;盐酸滴加到溶液中立即有大量气泡产生,滴加到 溶液中开始无气泡冒出,C项不符合题意;等物质
的量浓度的 、 溶液碱性强弱不同,前者遇酚酞显浅红色、后者使酚酞试液显红色,D
项不符合题意。
14.B 【解析】由题可知,X是 ,Y是 ,成盐反应的离子方程式为
, 属于可溶性盐,制备原理是利用了NaCl、 溶解度的差异,使
析出,因此制备过程中NaCl溶液浓度越大越有利于 的析出,A、C项正确,B项错误;
“晶体1”是 ,加热时分解生成 、 、 ,D项正确。
15.A 【解析】次氯酸盐、氯酸盐均具有强氧化性,二者遇盐酸时均可发生氧化还原反应生成 ,A项
正确;d是HClO,属于弱酸,在离子方程式中不能改写成 ,B项错误; 具有强氧化性,C项错误;
的名称为高氯酸,D项错误。
16.B 【解析】因置换反应的先后顺序为 、 ,不能置换出Zn,因此X中一定有银,
但当部分 发生反应时,固体X中也会含有Cu,A、C项错误;若滤液Y中溶质有两种时,其溶
质是 和 ,Fe恰好完全反应,因此滤液中 ,B项正确;
固体X中不含Fe元素,若滤液Y中溶质有三种,则固体X为银单质或银和铜的混合物,故X的质量应大
于10.8g,小于17.2g,D项错误。
二、非选择题
17.(14分)
(1)②③(2分) ①⑤(2分) ⑥(1分)
(2) (2分)
(3)溶液变为红褐色(1分,答案合理即可) (2分) B(2分)
(4) (2分)
【解析】(1)酸、碱、盐、金属氧化物是电解质,熔融的电解质和电解质的溶液均能导电,故能导电的是
②、③;①、⑤是电解质; 是非电解质,但其溶于水后可生成电解质 ,因此其水溶液能导电。(2) 完全电离出 、 ,故 的电离方程式为 。
(3)将饱和 溶液滴入沸水中最终可得到红褐色 胶体; 时 被还原,
Cu被氧化为 ,离子方程式为 ,该反应是氧化还原反应但不属于置换反应,
更不属于化合反应,故选B项。
(4)少量 与 反应时, 有剩余,反应的离子方程式为
。
18.(17分)
(1) (2分) (2分) 钠粒浮在液
面上(1分,答案合理即可)
(2)淡黄(1分) 白(1分)
或 (3分)
(3)ⅰ.4.0(2分) 烧杯(1分,答案合理即可) ⅱ.C(2分) ⅲ.B(2分)
【解析】(1)钠投入到 溶液中首先是与水反应,生成的NaOH再与 反应,故反应的离子方程
式分别为 、 ;能说明钠的密度比水小的
现象是钠粒浮在液面上。
(2) 在变质过程中会缓慢地与空气中 、 反应,导致固体颜色由浅黄色变为白色,反应
中 中的氧元素化合价一部分升高变成 0 价,一部分降低变为-2 价,反应的化学方程式为
或 。
(3)ⅰ.因无450mL规格的容量瓶,故实际配制的是500mL溶液,需要NaOH的质量为4.0g;NaOH有
强腐蚀性与吸水性,因此应盛放在烧杯中进行称量。
ⅱ.配制溶液的步骤:计算、称量、溶解、冷却、移液、洗涤、震荡、定容,颠倒摇匀,定容时先直接加蒸馏水,当液面离刻度线1~2cm时改用胶头滴管逐滴加水,图2的操作为加蒸馏水定容,步骤应在图1中
的④与⑤之间。故选C项。
ⅲ.定容时,仰视刻度线会导致加水量增多,溶液浓度偏低,A项不符合题意;由于热胀冷缩效应的存在,
未冷却至室温即转移到容量瓶中会导致溶解液体积大于室温时的体积,从而导致加水量偏小,溶液浓度偏
高,B项符合题意;指针有偏,说明取用NaOH的物质的量偏少,溶液浓度偏低,C项不符合题意。
19.(13分)
(1)圆底烧瓶(1分) 检验装置气密性(1分)
(2) 与浓盐酸反应需要加热(2分,答案合理即可)
(2分)
(3)无漂白性(2分) 浓硫酸(1分)
(4) (2分) 吸收未反应的氯气,防止其污染空气(2分)
【解析】(1)仪器X的名称为圆底烧瓶;加入试剂前必须检查装置的气密性,以防止实验中出现漏气现象。
(2) 与浓盐酸的反应需要加热,而装置中无加热仪器;利用得失电子守恒及元素质量守恒可得反
应的离子方程式: 。
(3)由图可知,进入装置C中的氯气是潮湿的,进入装置E中的氯气是干燥的,故其目的是证明干燥的
氯气没有漂白性;由题可知,装置H中的试剂是浓硫酸,以防止装置Ⅰ中的水蒸气进入装置G中。
(4)氯气与铁反应生成 ,反应的化学方程式为 ; 有毒,故装置Ⅰ的作
用是吸收未反应的氯气,防止其污染空气。
20.(12分)
(1) 、 、 (3分) (1分)
(2) (2分)
(3)10.4g(2分) 0.15(2分)
(4)放入试管中,向试管中加入几滴酚酞,若溶液变为红色,则说明有NaOH无 ;若溶液不变红
色,则说明含有 而无NaOH(2分,答案合理即可)
【解析】(1)由固体颜色可知固体中一定不含 ,由实验①、②可确定固体X是 、 ,
故固体样品中一定含有 、 、 。(2) 可溶于硝酸而 不溶于 ,故实验②中反应的离子方程式为
。
(3)实验③中发生的反应为 ,W为 ,沉淀 ,故参
与本实验反应的 ,质量为10.4g;实验①中生成的 ,
,故实验①中生成 ,参与实验①反应的
,由此可知50g样品中共含0.15mol 。
(4)前述实验没有确定的物质是 、NaOH,可利用NaOH溶液显碱性,用酚酞做检验试剂进行实验。