文档内容
江苏省连云港市东海县 2024-2025 学年高一上学期期中考试
化学试题
注意事项:
1.本试卷共6页,包含选择题(第1题13题,共13题),非选择题(第14题 题,共4
题)两部分。满分100分,考试时间75分钟,考试结束后,请将答题纸交回。
2.请将自己的学校、姓名、考试证号填、涂在答题纸上。
3.作答非选择题时必须用0.5mm黑色签字笔写在答题纸上的指定位置,在其他位置作答一
律无效,作答选择题请用2B铅笔涂黑。
可能用到的相对原子质量:
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.我国的神舟号载人飞船上常携带一定量的活性炭,其主要作用是
A.处理宇航员的生活垃圾 B.去除呼吸废气中的异味
C.提供生活中需要的能量 D.改善失重条件下的平衡
2.利用反应 可捕集 ,下列有关化学用语正确的是
A. 的俗名:苏打 B.Na原子的结构示意图:
C.中子数为8的氧原子: D. 的电离方程式:
3.下列钠及其化合物的性质与用途具有对应关系的是
A.Na有强还原性,可用于制作高压钠灯 B. 能与 反应放出 ,可作供氧剂
C. 能与HCl反应,可治疗胃酸过多症 D. 易溶于水,可去除物品表面油污
4.我国科研人员实现了对同位素 的灵敏检测。 的半衰期长达10万年,是 的17倍,可应用于
地球科学与考古学。下列说法正确的是
A. 的原子核内有21个中子B. 的半衰期长,说明 难以失去电子
C. 衰变一半所需的时间小于 衰变一半所需的时间
D.从Ca原子束流中直接俘获 原子的过程属于化学变化
5.下列说法正确的是
A.钠元素在自然界无游离态,因为Na有3个电子层
B.电解熔融氯化钠制取钠时,钠蒸气可以在空气中冷却
C.“海水晒盐”的原理是蒸发,制得的粗盐中含有
D.除去NaCl溶液中 可加石灰乳,过滤后用酸中和
6.在给定条件下,下列物质转化均可实现的是
A. B.
C. D.
阅读材料,回答 题:氯及其化合物应用广泛。 与浓盐酸反应得到 , 可从海水中提取
;氯的氧化物 是一种黄绿色气体,易溶于水,与碱反应会生成 与 ,可用于自来
水消毒。
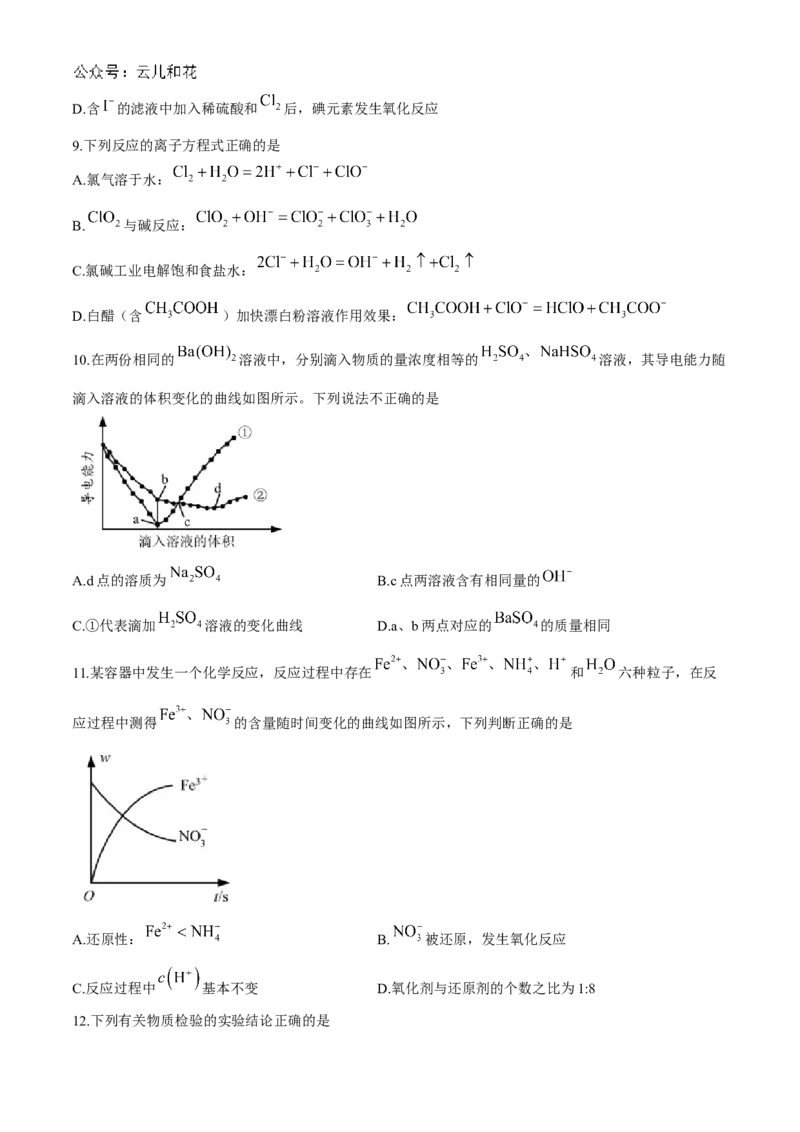
7.下列有关氯气制取、净化、收集及验证其氧化性的原理、装置及操作不正确的是
A.制备 B.净化 C.收集 D.验证 的氧化性
8.从海带中提取碘单质的工艺流程如下。下列关于海水制碘的说法,不正确的是
A.在碘水中加入几滴淀粉溶液,溶液变蓝色
B.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
C.碘水加入 得到 的 溶液,该操作为“萃取”D.含 的滤液中加入稀硫酸和 后,碘元素发生氧化反应
9.下列反应的离子方程式正确的是
A.氯气溶于水:
B. 与碱反应:
C.氯碱工业电解饱和食盐水:
D.白醋(含 )加快漂白粉溶液作用效果:
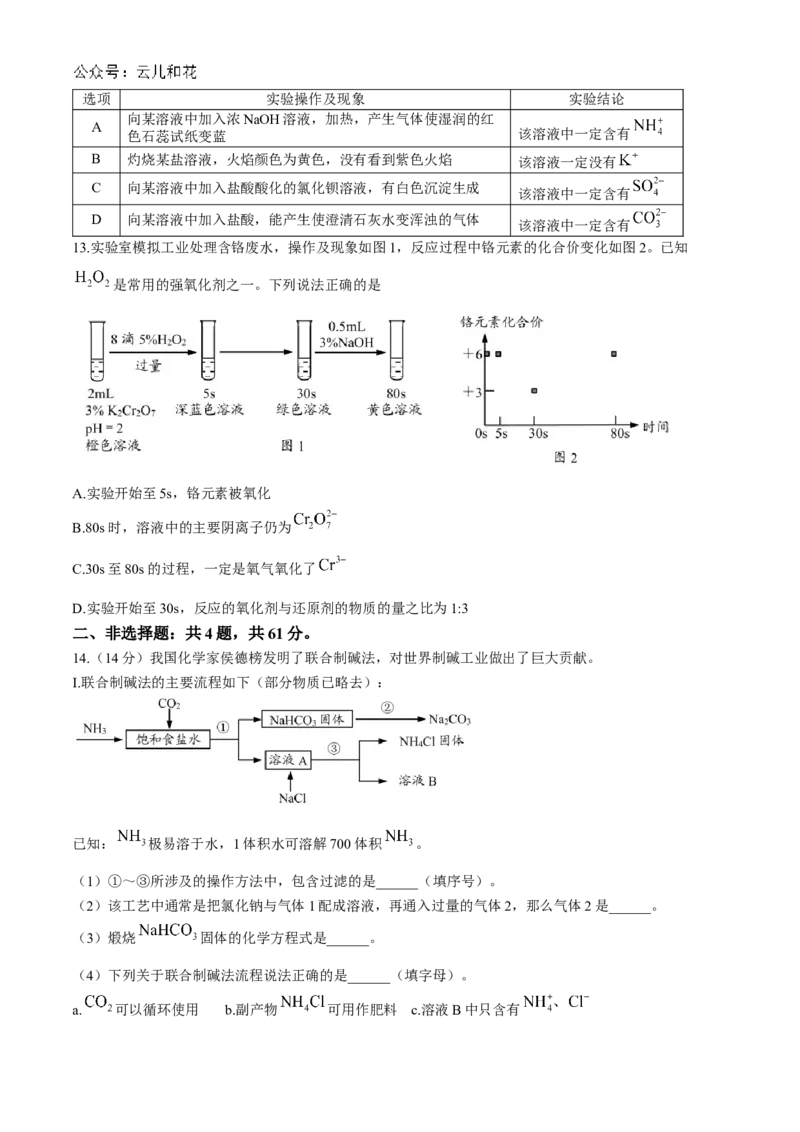
10.在两份相同的 溶液中,分别滴入物质的量浓度相等的 溶液,其导电能力随
滴入溶液的体积变化的曲线如图所示。下列说法不正确的是
A.d点的溶质为 B.c点两溶液含有相同量的
C.①代表滴加 溶液的变化曲线 D.a、b两点对应的 的质量相同
11.某容器中发生一个化学反应,反应过程中存在 和 六种粒子,在反
应过程中测得 的含量随时间变化的曲线如图所示,下列判断正确的是
A.还原性: B. 被还原,发生氧化反应
C.反应过程中 基本不变 D.氧化剂与还原剂的个数之比为1:8
12.下列有关物质检验的实验结论正确的是选项 实验操作及现象 实验结论
向某溶液中加入浓NaOH溶液,加热,产生气体使湿润的红
A
色石蕊试纸变蓝 该溶液中一定含有
B 灼烧某盐溶液,火焰颜色为黄色,没有看到紫色火焰 该溶液一定没有
C 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
该溶液中一定含有
D 向某溶液中加入盐酸,能产生使澄清石灰水变浑浊的气体
该溶液中一定含有
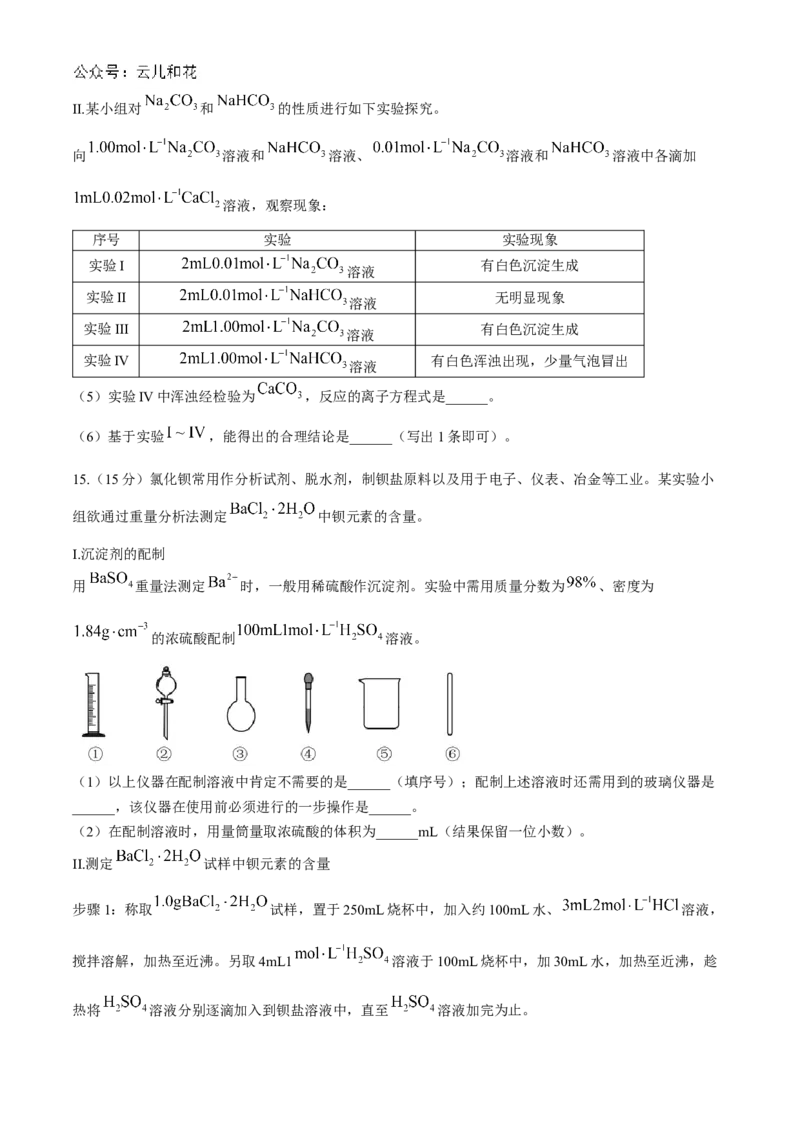
13.实验室模拟工业处理含铬废水,操作及现象如图1,反应过程中铬元素的化合价变化如图2。已知
是常用的强氧化剂之一。下列说法正确的是
A.实验开始至5s,铬元素被氧化
B.80s时,溶液中的主要阴离子仍为
C.30s至80s的过程,一定是氧气氧化了
D.实验开始至30s,反应的氧化剂与还原剂的物质的量之比为1:3
二、非选择题:共4题,共61分。
14.(14分)我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。
Ⅰ.联合制碱法的主要流程如下(部分物质已略去):
已知: 极易溶于水,1体积水可溶解700体积 。
(1)①~③所涉及的操作方法中,包含过滤的是______(填序号)。
(2)该工艺中通常是把氯化钠与气体1配成溶液,再通入过量的气体2,那么气体2是______。
(3)煅烧 固体的化学方程式是______。
(4)下列关于联合制碱法流程说法正确的是______(填字母)。
a. 可以循环使用 b.副产物 可用作肥料 c.溶液B中只含有Ⅱ.某小组对 和 的性质进行如下实验探究。
向 溶液和 溶液、 溶液和 溶液中各滴加
溶液,观察现象:
序号 实验 实验现象
实验I 有白色沉淀生成
溶液
实验II 无明显现象
溶液
实验III 有白色沉淀生成
溶液
实验IV 有白色浑浊出现,少量气泡冒出
溶液
(5)实验IV中浑浊经检验为 ,反应的离子方程式是______。
(6)基于实验 ,能得出的合理结论是______(写出1条即可)。
15.(15分)氯化钡常用作分析试剂、脱水剂,制钡盐原料以及用于电子、仪表、冶金等工业。某实验小
组欲通过重量分析法测定 中钡元素的含量。
I.沉淀剂的配制
用 重量法测定 时,一般用稀硫酸作沉淀剂。实验中需用质量分数为 、密度为
的浓硫酸配制 溶液。
(1)以上仪器在配制溶液中肯定不需要的是______(填序号);配制上述溶液时还需用到的玻璃仪器是
______,该仪器在使用前必须进行的一步操作是______。
(2)在配制溶液时,用量筒量取浓硫酸的体积为______mL(结果保留一位小数)。
II.测定 试样中钡元素的含量
步骤1:称取 试样,置于250mL烧杯中,加入约100mL水、 溶液,
搅拌溶解,加热至近沸。另取4mL1 溶液于100mL烧杯中,加30mL水,加热至近沸,趁
热将 溶液分别逐滴加入到钡盐溶液中,直至 溶液加完为止。步骤2:待 沉淀下沉后,向上层清液中加入 滴 溶液,仔细观察沉淀是否完全。沉淀完
全后,盖上表面皿,放置过夜陈化。
步骤3:沉淀用倾泻法过滤;用稀硫酸洗涤沉淀 次。
步骤4:沉淀的灼烧和恒重。将沉淀置于已恒重的瓷坩埚中烘干、炭化、灰化后,在( 的马弗
炉中灼烧至恒重,重复实验 次。
(3)溶解 试样时加入稀盐酸的目的是______。
(4)若最终产生沉淀的平均质量为0.932g,则 中钡元素的含量为______(写出计算过程)。
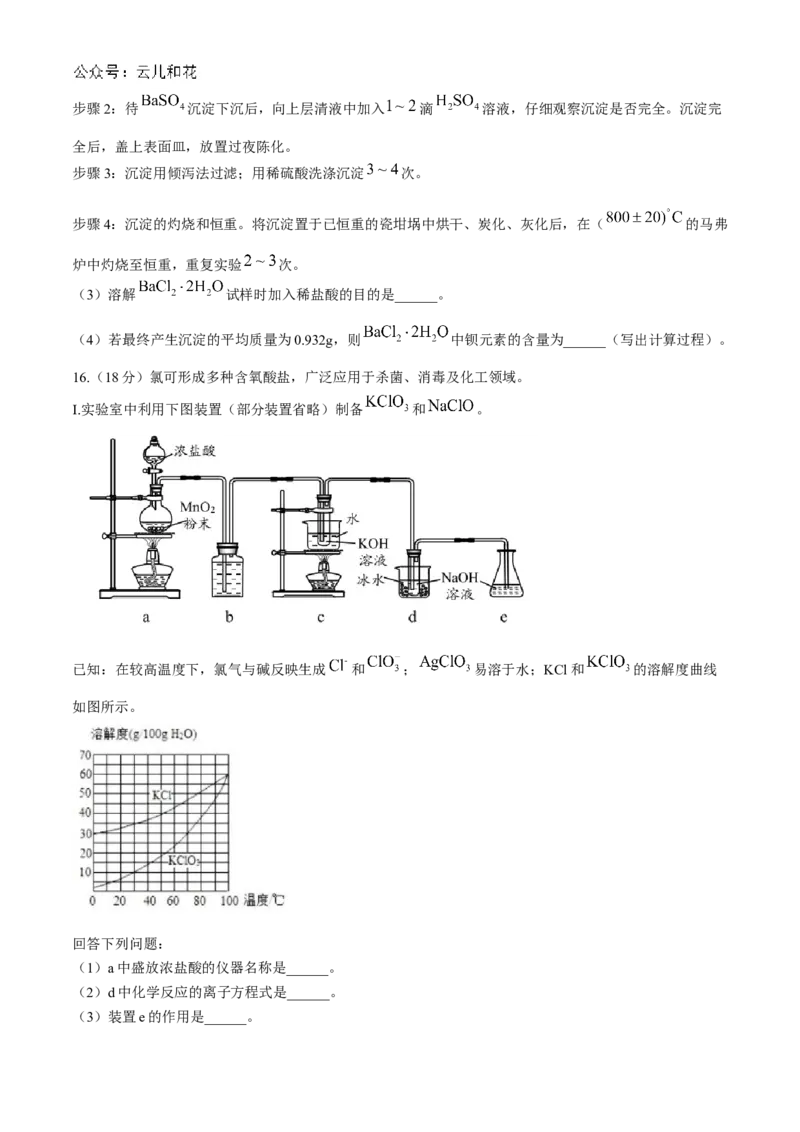
16.(18分)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。
I.实验室中利用下图装置(部分装置省略)制备 和 。
已知:在较高温度下,氯气与碱反映生成 和 ; 易溶于水;KCl和 的溶解度曲线
如图所示。
回答下列问题:
(1)a中盛放浓盐酸的仪器名称是______。
(2)d中化学反应的离子方程式是______。
(3)装置e的作用是______。(4)结合KCl和 的溶解度曲线,补充完整获取 晶体的实验方案:反应结束后,将装置c试
管内溶液转移至______,干燥,得到 晶体。[实验中必须使用的试剂:稀 溶液,
冰水]
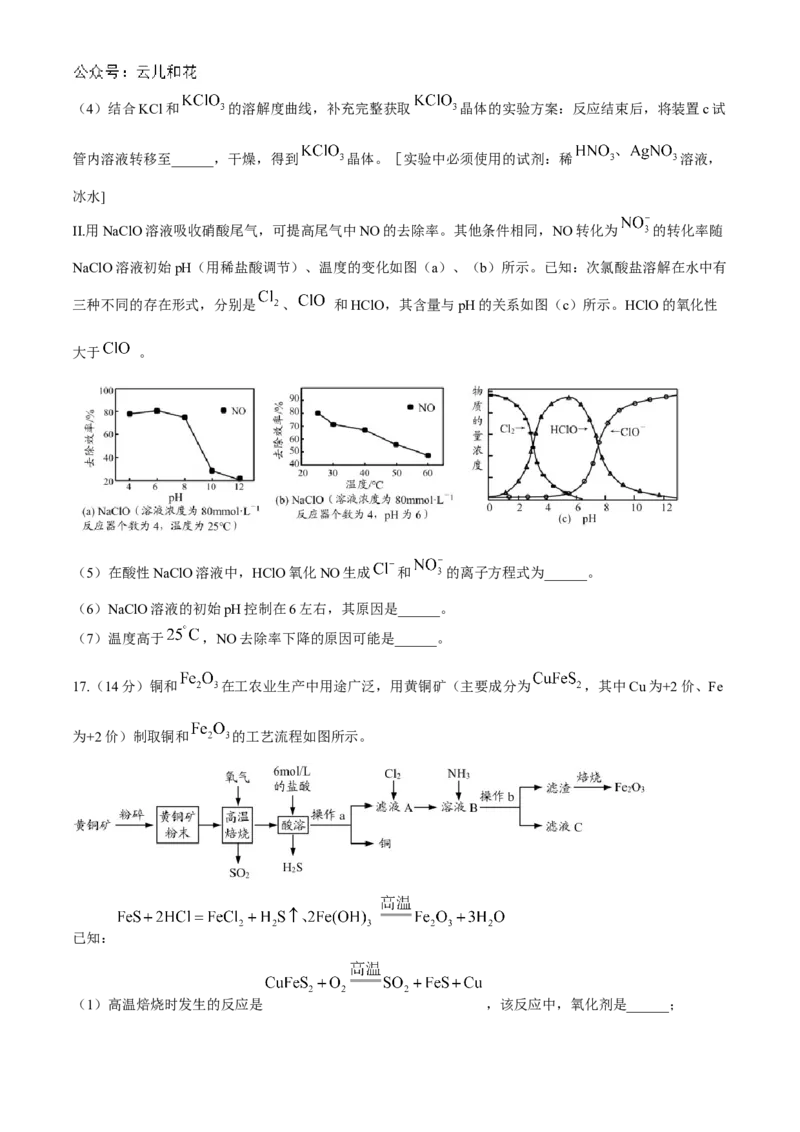
II.用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随
NaClO溶液初始pH(用稀盐酸调节)、温度的变化如图(a)、(b)所示。已知:次氯酸盐溶解在水中有
三种不同的存在形式,分别是 、 和HClO,其含量与pH的关系如图(c)所示。HClO的氧化性
大于 。
(5)在酸性NaClO溶液中,HClO氧化NO生成 和 的离子方程式为______。
(6)NaClO溶液的初始pH控制在6左右,其原因是______。
(7)温度高于 ,NO去除率下降的原因可能是______。
17.(14分)铜和 在工农业生产中用途广泛,用黄铜矿(主要成分为 ,其中Cu为+2价、Fe
为+2价)制取铜和 的工艺流程如图所示。
已知:
(1)高温焙烧时发生的反应是 ,该反应中,氧化剂是______;参加反应时,反应中转移电子______mol。
(2) 具有较强的氧化性, 具有较强的还原性,写出向滤液A中通入氯气的离子方程式______。
(3)向溶液B中通入 后发生反应的离子方程式为______。
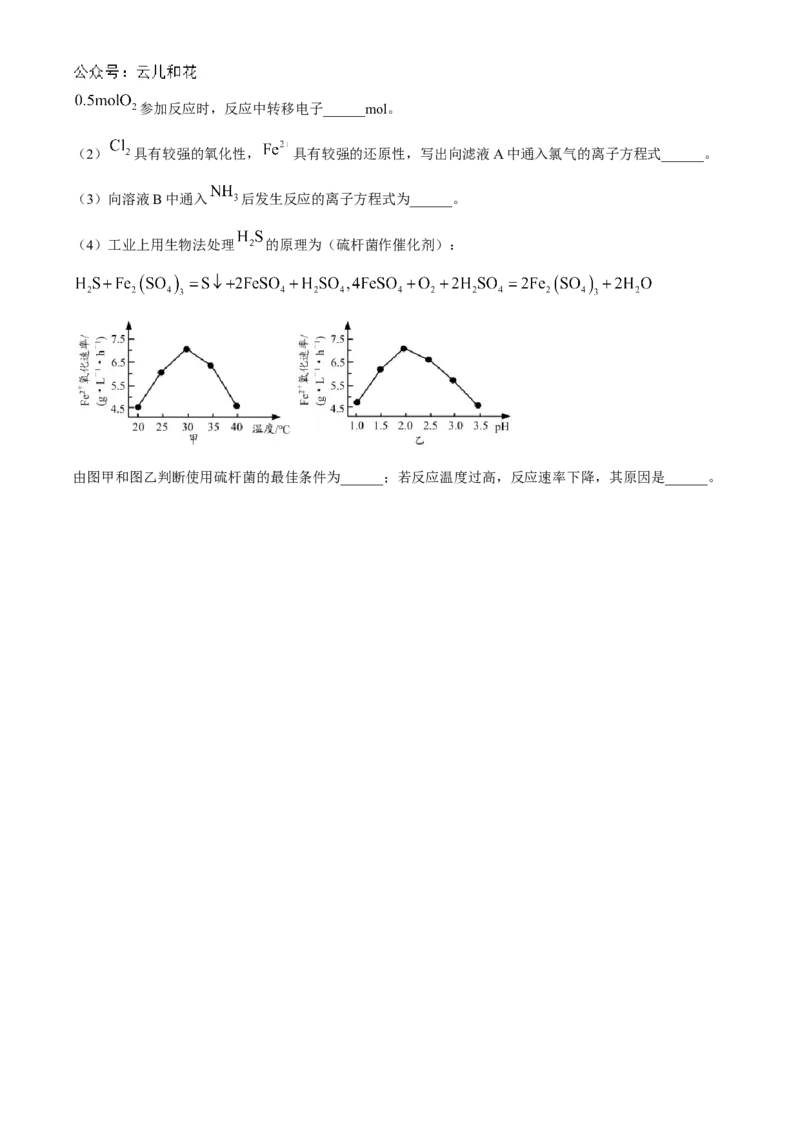
(4)工业上用生物法处理 的原理为(硫杆菌作催化剂):
由图甲和图乙判断使用硫杆菌的最佳条件为______;若反应温度过高,反应速率下降,其原因是______。2024-2025 学年第一学期期中考试高一化学试题参考答案
一、单项选择(39分)
1.B 2.C 3.D 4.A 5.C 6.A 7.C 8.B 9.D 10.B
11.D 12.A 13.D
二、非选择题(61分)
14.(14分)
(1)①②(2分) (2) (2分)
(3) (3分) (4)ab(2分)
(5) (3分)
(6)碳酸氢钠能否与氯化钙反应与其浓度有关(2分)
15.(15分)
(1)②③(2分) 100mL容量瓶(2分) 检查是否漏水(2分)
(2)5.4(3分)
(3)排除杂质离子的干扰,保证产生的沉淀完全是硫酸钡沉淀(2分)
(4) (4分)
(2分)
钡元素的含量为 (2分)
16.(18分)
(1)分液漏斗(2分)
(2) (3分)
(3)吸收多余氯气,防其污染环境(1分)
(4)蒸发皿中,蒸发浓缩至液面出现晶膜时,降温结晶,过滤,用冰水洗涤,取最后一次洗涤滤液滴加
溶液和稀硝酸,无明显现象(5分)
(5) (3分)
(6)pH过低,酸性较强,对设备腐蚀严重,pH过高,NO的转化率下降(2分)
(7)温度过高,NO的溶解度下降;次氯酸或次氯酸跟分解(2分)
17.(14分)(1) (2分) 3(2分)
(2) (3分)
(3)
或 (3分)
(4)温度为 (2分)
反应温度过高,使硫杆菌失去活性,催化活性降低(2分)