文档内容
2024~2025 学年度第一学期高一年级第三次月考
化学
考生注意:
1.本试卷分选择题和非选择题两部分。满分 100分,考试时间 75分钟。
2.答题前,考生务必用直径 0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用 2B铅笔把答题卡上对
应题目的答案标号涂黑;非选择题请用直径 0.5毫米黑色墨水签字笔在答题卡上各题的答题
区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
...........................
4.本卷命题范围:苏教版必修第一册专题 1专题3第一单元。
5.可能用到的相对原子质量:H1 C12 N14 O16 Na23 Cl35.5 K39 Mn55
一、选择题(本题共 14小题,每小题 3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的)
1.近日,有科学家发现了一种以前未知的铀原子——
学科网(北京)股份有限公司
29 42 1 U ,这是自1979年以来科学家首次发现富含中子
的铀原子。下列关于 29 42 1 U 的叙述错误的是( )
A.241U是一种新核素 B.相对原子质量为241
C.与233U互为同位素 D.中子数为149
2.下列化学用语表示正确的是( )
A.Cl的结构示意图: B. N
2
的摩尔质量:28g
C.LiAlH 中H元素的化合价:
4
1 D.小苏打的化学式: N a
2
C O
3
3.实验室检验氨气可用( )
A.干燥的蓝色石蕊试纸 B.干燥的红色石蕊试纸
C.湿润的蓝色石蕊试纸 D.湿润的红色石蕊试纸
4.氧化还原反应是一类重要的化学反应,下列转化必须加入氧化剂才能实现的是( )
A.CCO B.Cl Cl C.SO2 SO D.H OO
2 2 3 2 2 2
5.胶体区别于其他分散系的本质特征是( )
A.胶体的分散质能通过滤纸空隙 B.胶体能产生丁达尔效应
C.分散质粒子直径为1~100nm D.胶体在一定条件下能稳定存在
催化剂
6.在汽车尾气处理装置中发生反应:4CO2NO 4CO N 。下列有关该反应的说法中正确
2 2 2
的是( )A.CO是氧化剂 B.NO 被还原 C.CO发生还原反应 D.N 是氧化产物
2 2
7.根据下列反应判断物质的氧化性强弱,其中排序正确的是( )
①2FeCl 2KI2FeCl I 2KCl
3 2 2
②2FeCl H O 2HCl2FeCl 2H O
2 2 2 3 2
③2KMnO 5H O 3H SO K SO 2MnSO 5O 8H O
4 2 2 2 4 2 4 4 2 2
A.FeCl H O KMnO B.FeCl H O I
3 2 2 4 3 2 2 2
C.I H O FeCl D.KMnO H O I
2 2 2 3 4 2 2 2
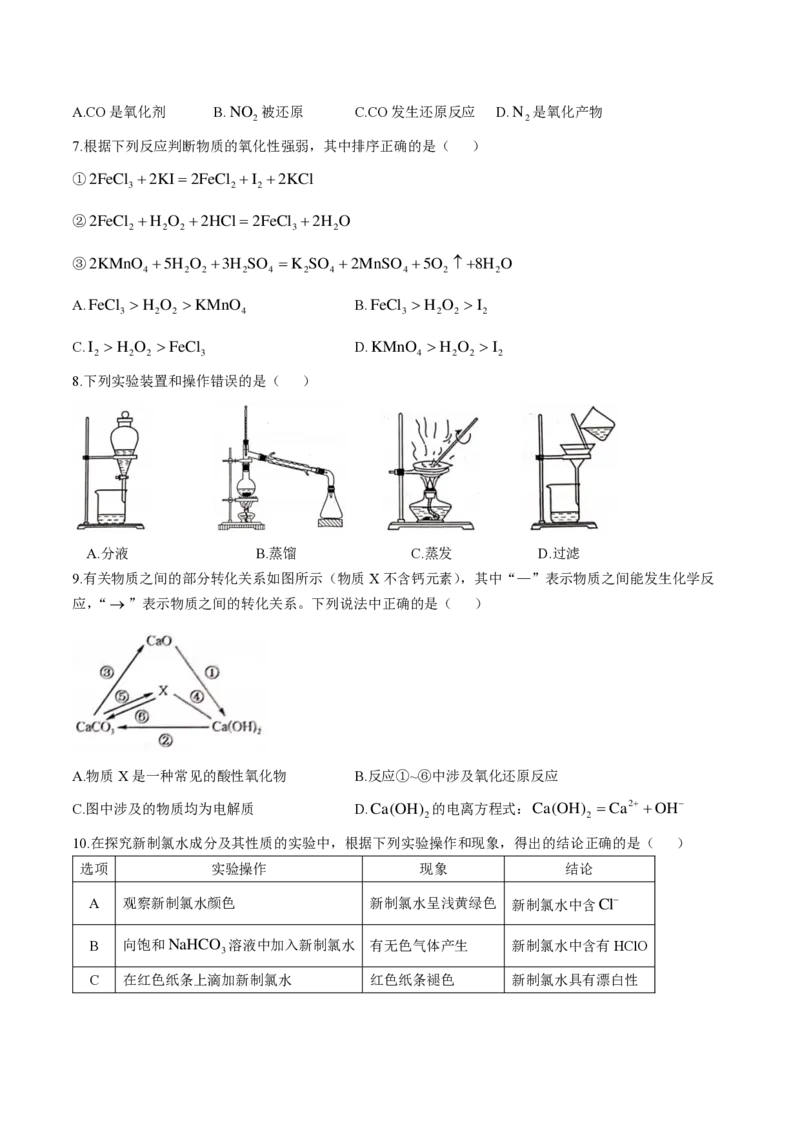
8.下列实验装置和操作错误的是( )
A.分液 B.蒸馏 C.蒸发 D.过滤
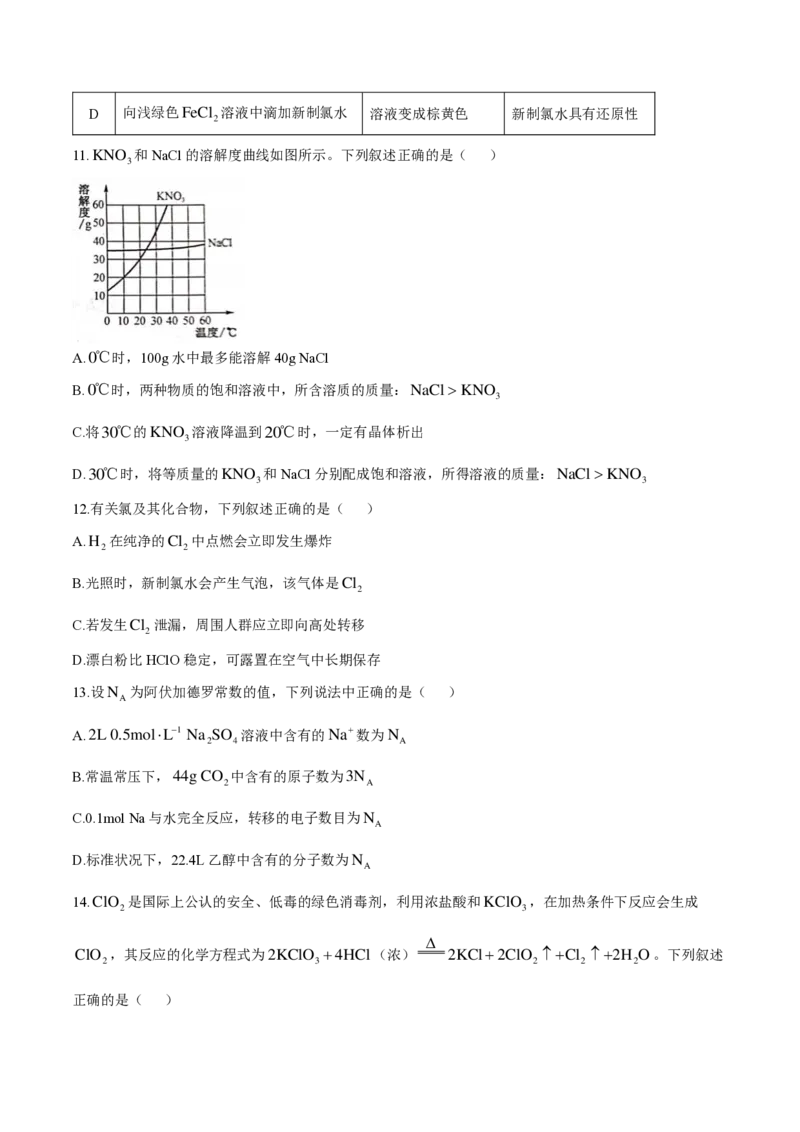
9.有关物质之间的部分转化关系如图所示(物质X不含钙元素),其中“—”表示物质之间能发生化学反
应,“
学科网(北京)股份有限公司
”表示物质之间的转化关系。下列说法中正确的是( )
A.物质X是一种常见的酸性氧化物 B.反应①~⑥中涉及氧化还原反应
C.图中涉及的物质均为电解质 D. C a ( O H )
2
的电离方程式:Ca(OH) Ca2 OH
2
10.在探究新制氯水成分及其性质的实验中,根据下列实验操作和现象,得出的结论正确的是( )
选项 实验操作 现象 结论
A 观察新制氯水颜色 新制氯水呈浅黄绿色 新制氯水中含Cl
B 向饱和NaHCO 溶液中加入新制氯水 有无色气体产生 新制氯水中含有HClO
3
C 在红色纸条上滴加新制氯水 红色纸条褪色 新制氯水具有漂白性D 向浅绿色FeCl 溶液中滴加新制氯水 溶液变成棕黄色 新制氯水具有还原性
2
11.KNO 和NaCl的溶解度曲线如图所示。下列叙述正确的是( )
3
A.0℃时,100g水中最多能溶解40g NaCl
B.0℃时,两种物质的饱和溶液中,所含溶质的质量:
学科网(北京)股份有限公司
N a C l K N O
3
C.将30℃的KNO 溶液降温到
3
2 0 ℃ 时,一定有晶体析出
D.30℃时,将等质量的 K N O
3
和NaCl分别配成饱和溶液,所得溶液的质量: N a C l K N O
3
12.有关氯及其化合物,下列叙述正确的是( )
A.H 在纯净的
2
C l
2
中点燃会立即发生爆炸
B.光照时,新制氯水会产生气泡,该气体是 C l
2
C.若发生Cl 泄漏,周围人群应立即向高处转移
2
D.漂白粉比HClO稳定,可露置在空气中长期保存
13.设N 为阿伏加德罗常数的值,下列说法中正确的是( )
A
A.2L0.5molL1 Na SO 溶液中含有的
2 4
N a 数为 N
A
B.常温常压下, 4 4 g C O
2
中含有的原子数为 3 N
A
C.0.1mol Na与水完全反应,转移的电子数目为N
A
D.标准状况下,22.4L乙醇中含有的分子数为N
A
14.ClO 是国际上公认的安全、低毒的绿色消毒剂,利用浓盐酸和KClO ,在加热条件下反应会生成
2 3
ClO ,其反应的化学方程式为2KClO 4HCl(浓) 2KCl2ClO Cl 2H O。下列叙述
2 3 2 2 2
正确的是( )A.浓盐酸在反应中只体现还原性 B.还原产物为Cl
2
C.氧化剂与还原剂的质量之比为245:146 D.每生成1molClO ,反应中转移1mole
2
二、非选择题(本题共 4小题,共 58分)
15.(14分)①硫酸钠是一种无机化合物,难溶于②乙醇,能溶于③水,用途非常广泛。硫酸钠的制备方
法很多,例如可由④NaOH或⑤
学科网(北京)股份有限公司
N a H C O
3
与⑥H SO 在溶液中反应制得,也可由⑦Na CO 溶液与⑧
2 4 2 3
CuSO 溶液反应制得,除了生成Na SO 外,还生成⑨Cu (OH) CO 、⑩
4 2 4 2 2 3
C O
2
。回答下列问题:
(1)上述标有序号的物质中属于电解质的是________(填序号,下同),属于盐的是________。
(2)①在水中的电离方程式为________。
(3)将少量⑩通入④的溶液中反应的化学方程式为________;向⑨中加入过量⑥的稀溶液,发生反应的
化学方程式为________。
(4)将少量④加入⑧中,产生的实验现象为________。
(5)电解水实验中,通常会在水中加入少量①,目的是________,写出电解水的化学方程式并用双线桥
标出电子转移的方向和数目:________。
16.(14分)某固体混合物可能含有 M g C O
3
、Al SO 、
2 4 3
N a
2
S O
4
、BaNO 、
3 2
A g N O
3
和 C u S O
4
中的几种。将该混合物依次进行如下实验,回答下列问题:
(1)取少许混合物于烧杯中溶解得到无色溶液和白色沉淀,原混合物中一定不存在的物质为________
(填化学式,下同),原因是________。
(2)取(1)中溶液进行焰色反应,火焰呈黄色。原混合物中一定存在的物质为________。
(3)取(1)中白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。原混合物中一定存在的物质为______,
一定不存在的物质为________。沉淀完全溶解时的化学方程式为________。
(4)通过上述实验仍无法确定的物质是________。
17.(14分)实验小组需要0.5molL1 Na CO 溶液950mL,现用碳酸钠晶体(Na CO 10H O)来配
2 3 2 3 2
制该Na CO 溶液,配制涉及计算、称量、溶解、洗涤、转移、定容等环节。回答下列问题:
2 3
(1)需用天平称量碳酸钠晶体的质量为________g,所选用容量瓶的规格为________mL。
(2)“洗涤”操作中,将洗涤烧杯后的溶液也注入容量瓶,其目的是________。
(3)“定容”的正确操作是继续加蒸馏水至液面离刻度线下________时,改用________加水至液面与刻度
线相切。
(4)“定容”时,不小心液面超过了刻度,处理的方法是________(填字母,下同)。
a.重新配制
b.吸出多余液体,使凹液面与刻度线相切
c.经计算加入一定量的碳酸钠晶体
d.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切(5)配制时下列操作会导致所配溶液浓度偏高的是________。
a.转移时有少量溶液溅出 b.定容时俯视读取刻度
c.容量瓶用蒸馏水洗净后未干燥 d.定容时液面超过了刻度线
(6)从上述配制的溶液(整个过程均正确)中取出10mL,其中Na CO 的物质的量浓度是________,含
2 3
Na CO 的质量是________g。
2 3
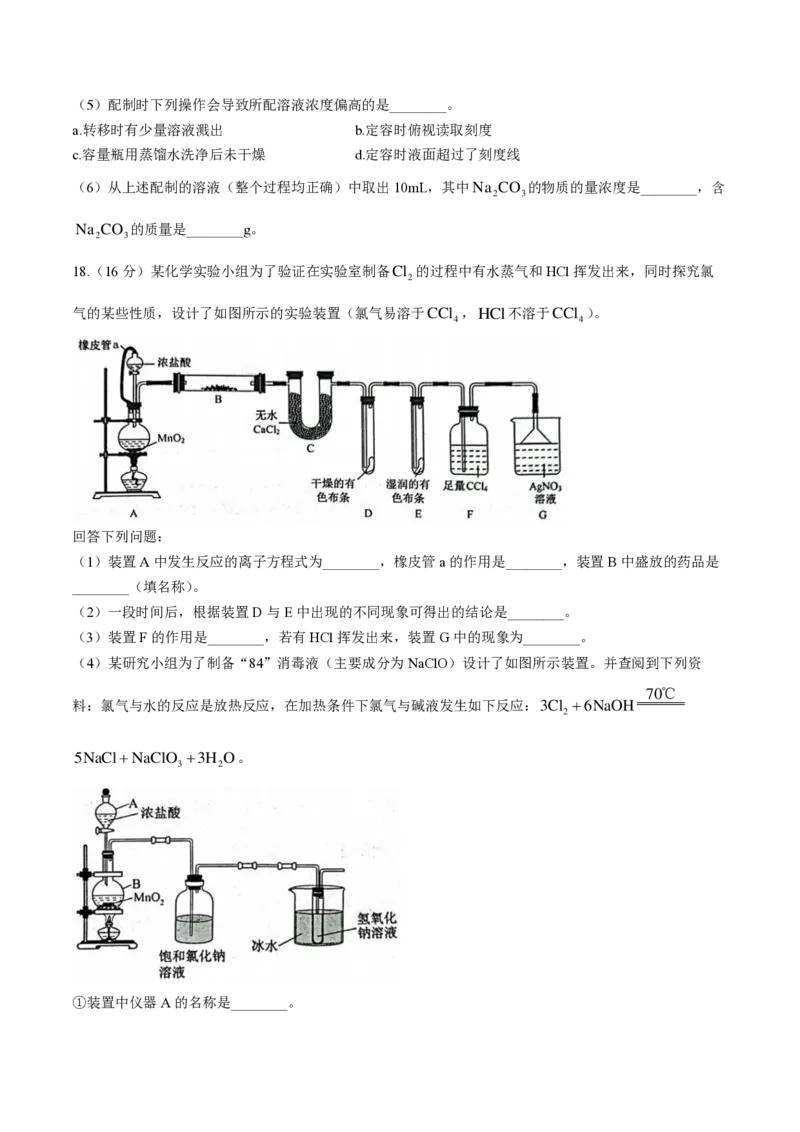
18.(16分)某化学实验小组为了验证在实验室制备Cl 的过程中有水蒸气和HCl挥发出来,同时探究氯
2
气的某些性质,设计了如图所示的实验装置(氯气易溶于CCl ,HCl不溶于CCl )。
4 4
回答下列问题:
(1)装置A中发生反应的离子方程式为________,橡皮管a的作用是________,装置B中盛放的药品是
________(填名称)。
(2)一段时间后,根据装置D与E中出现的不同现象可得出的结论是________。
(3)装置F的作用是________,若有HCl挥发出来,装置G中的现象为________。
(4)某研究小组为了制备“84”消毒液(主要成分为NaClO)设计了如图所示装置。并查阅到下列资
70℃
料:氯气与水的反应是放热反应,在加热条件下氯气与碱液发生如下反应:3Cl 6NaOH
2
5NaClNaClO 3H O。
3 2
①装置中仪器A的名称是________。
学科网(北京)股份有限公司②装置中能否省去盛冰水的烧杯?________(填“能”或“否”),理由是________。
③若仪器B中用8.7gMnO 与足量浓盐酸混合加热,则被氧化的HCl的物质的量是________mol.
2
学科网(北京)股份有限公司2024~2025 学年度第一学期高一年级第三次月考·化学
参考答案、提示及评分细则
1.B 241U是一种新核素,A项正确;241代表该原子的质量数,不能代表元素的相对原子质量,B项错
误;二者互为同位素,C项正确;中子数质量数质子数24192149,D项正确。
2.C Cl的电子数为18,A项错误;N 的摩尔质量是28gmol1,B项错误;化合物中Li为1价,Al
2
为3价,则H为1价,C项正确;小苏打的化学式为
学科网(北京)股份有限公司
N a H C O
3
,D项错误。
3.D 检验氨气可用湿润的红色石蕊试纸,D项正确。
4.A C元素化合价升高,必须加入氧化剂才能实现,A项符合题意;Cl元素化合价降低,需要加入还原
剂或者自身与碱、水等反应,B项不符合题意; S 、 O 元素化合价都无变化,C项不符合题意;O元素化
合价升高,但可以通过电解生成,反应中 H
2
O 自身既作为氧化剂又作为还原剂,不一定需要加入氧化
剂,D项不符合题意。
5.C 胶体的分散质粒子直径小于滤纸空隙,故能通过滤纸空隙,A项不符合题意;产生丁达尔效应,这是
胶体的性质,B项不符合题意;胶体区别于其他分散系的本质特征是胶体粒子直径为 1 ~ 1 0 0 n m ,溶液的
粒子直径小于1nm,浊液的粒子直径大于 1 0 0 n m ,C项符合题意;胶体在一定条件下能稳定存在,说明胶
体具有介稳性,是胶体的性质,D项不符合题意。
催化剂
6.B 反应4CO2NO 4CO N 中,C元素失去电子化合价升高发生氧化反应,CO为还
2 2 2
原剂,CO 为氧化产物,N元素得到电子化合价降低发生还原反应,
2
N O
2
为氧化剂, N
2
为还原产物,B
项正确。
7.D 根据反应①判断氧化性: F e C l
3
I
2
,根据反应②判断氧化性:H O FeCl ,根据反应③判断氧
2 2 3
化性:KMnO H O ,综上氧化性:KMnO H O FeCl I ,D项正确。
4 2 2 4 2 2 3 2
8.B 分液利用分液漏斗,A项正确;球形冷凝管容易在球部积留蒸馏液,不适宜作为倾斜式蒸馏装置,应
该使用直形冷凝管,B项错误;蒸发利用蒸发皿,C项正确;过滤装置正确,D项正确。
9.A 物质X为CO ,CO 是酸性氧化物,A项正确;反应①~⑥中均未涉及氧化还原反应,B项错误;
2 2
CO 不属于电解质,C项错误;Ca(OH) 的电离方程式:Ca(OH) Ca2 2OH,D项错误。
2 2 2
10.C 新制氯水呈浅黄绿色,说明新制氯水中含Cl ,A项错误;向饱和NaHCO 溶液中加入新制氯水,
2 3
有无色气体产生,说明溶液中含有H,B项错误;在红色纸条上滴加新制氯水,纸条褪色,说明新制氯
水有漂白性,C项正确;向浅绿色溶液(FeCl 溶液)中滴加新制氯水,溶液变为棕黄色(FeCl 溶液),
2 3
说明新制氯水具有氧化性,D项错误。11.D 0℃时,NaCl的溶解度小于40g,所以100g水中溶解不了40g NaCl,A项错误;没有标注质量,
不能判断含有溶质质量大小,B项错误;硝酸钾溶液没注明是否饱和,降温后无法确定析出晶体,C项错
误;30℃时,KNO 的溶解度大于NaCl的溶解度,即30℃时等质量的KNO 和NaCl分别配成饱和溶
3 3
液,KNO 需要的水少,所得溶液质量就小,D项正确。
3
12.C 氯气和氢气在光照条件下混合才会发生爆炸,纯净的氯气与氢气点燃时可以安静地燃烧,A项错
误;新制氯水中有HClO,次氯酸光照条件下分解生成盐酸和氧气,B项错误;氯气有毒且密度比空气
大,因此若氯气发生泄漏,应立即用湿毛巾捂住口鼻,并向高处转移,C项正确;漂白粉不可露置在空气
光照
中,Ca(ClO) H OCO CaCO 2HClO,2HClO 2HClO ,D项错误。
2 2 2 3 2
13.B 2L0.5molL1 Na SO 溶液中含有的
2 4
学科网(北京)股份有限公司
N a 数为 2 0 . 5 2 N
A
2 N
A
,A项错误; 4 4 g C O
2
的物
质的量为1mol, 1 m o l C O
2
含有1mol C和2mol O原子,总个数为 3 N
A
,B项正确;0.1mol Na与水完全
反应,生成NaOH,转移的电子数目为 0 .1 N
A
,C项错误;标准状况下,乙醇为液态,不适用于气体的气
体摩尔体积,D项错误。
14.D 在整个反应中一部分HCl中氯元素化合价升高转化为 C l
2
,一部分未发生变化生成对应的盐,体现
还原性和酸性,A项错误;反应2KClO 4HCl(浓)2KCl2ClO Cl 2H O中,
3 2 2 2
K C l O
3
作氧化剂,HCl作还原剂,氧化产物为 C l
2
,还原产物为 C l O
2
,B项错误;氧化剂与还原剂的质量之比为
245:73,C项错误; K C l O
3
中Cl元素由 5 价 4 价,HCl中Cl元素由 1 0 ,故每生成 1 m o l
ClO ,转移1mole,D项正确。
2
15.(1)①③④⑤⑥⑨;①⑤⑨(各2分)
(2)Na SO 2Na SO2(1分)
2 4 4
(3)CO 2NaOH Na CO H O;
2 2 3 2
Cu (OH) CO 2H SO 2CuSO 3H OCO (各2分)
2 2 3 2 4 4 2 2
(4)产生蓝色絮状沉淀(2分)
(5)增强水的导电性(1分); (2分)16.(1)CuSO ;溶液无色,而CuSO 溶液显蓝色
4 4
(2)Na SO
2 4
(3)MgCO ;BaNO 、AgNO ;MgCO 2HClMgCl H OCO
3 3 2 3 3 2 2 2
(4)Al SO (每空2分)
2 4 3
17.(1)143.0(2分);1000(1分)
(2)使溶质完全转移到容量瓶中(1分)
(3)1~2cm;胶头滴管(各1分)
(4)a(2分) (5)b(2分)
(6)0.5molL1;0.53(各2分)
18.(1)4H 2Cl MnO Mn2 2H OCl (2分);
2 2 2
平衡分液漏斗和烧瓶中的气压,使液体能够顺利流下(1分);无水硫酸铜(2分)
(2)干燥的氯气无漂白性,氯水(次氯酸)有漂白性(合理即可,2分)
(3)吸收氯气(2分);产生白色沉淀(1分)
(4)①分液漏斗(1分)
②否(1分);氯气与水的反应是放热反应,若省去冷却装置,可能引起温度升高,发生副反应生成
NaClO (合理即可,2分) ③0.2(2分)
3
学科网(北京)股份有限公司