文档内容
台州市第高一年级期末质量评估试题
化 学
2025.01
1.答题前,请务必将自己的姓名、准考证号用黑色字迹的签字笔或钢笔分别填写在试题
卷和答题纸规定的位置上。
2.答题时,请按照答题纸上“注意事项”的要求,在答题纸相应的位置上规范作答,在本
试题卷上的作答一律无效。
3.非选择题的答案必须使用黑色字迹的签字笔或钢笔写在答题纸上相应区域内,作图时
可先使用2B铅笔,确定后必须使用黑色字迹的签字笔或钢笔描黑。
4.可能用到的相对原子质量:H-1 Na-23 Mg-24 0-16 S-32 Cl-35.5
K-39 Fe-56 Cu-64 Ca-40 N-14 Br-80 I-127
选择题部分
一、选择题(本大题共25小题,每小题2分,共50分。每个小题列出的四个备选项中只有
一个符合题目要求,不选、多选、错选均不得分)
1.下列不属于电解质的是
A.H?O B. HCl C. BaSO? D.石墨
2.下列物质属于共价化合物的是
A.K?S B. CO? C. NaOH D. Cl?
3.下列气体中,既可用浓硫酸干燥,又可用NaOH固体干燥的是
A. Cl? B. O? C. SO? D. NH?
4.下列仪器名称不正确的是
A.圆底烧瓶 B.锥形瓶 C.蒸发皿 D.分液漏斗
5.下列标识不正确的是
A.用电 B.排风 C.易燃类物质 D.锐器
6. 下列化学用语或图示表达不正确的是
:?:c:?:
A.Mg的原子结构示意图:+3383 B.CO?的电子式:
C.氮化镁的化学式:Mg?N? D.氧化还原反应的电子转移:
还原剂 氧化剂
7.铈(Ce)是稀土元素,广泛应用于医药、玻璃等工业。下列说法正确的是
A.S?Ce和Ce互为同位素 B.s3Ce和Ce都含有58个中子
C. s?Ce和Ce含有不同的质子数 D. 8Ce和!Ce含有不同的电子数
8.物质的性质决定用途,下列两者对应关系不正确的是
A.碳酸氢钠是白色晶体,可用于焙制糕点
B.钠、钾等金属元素的焰色分别是黄色、紫色,可用于节日燃放的烟花
C. Fe?O?是一种红棕色粉末,常用作油漆、涂料和橡胶的红色颜料
D.铝表面覆盖着致密的氧化铝薄膜,保护内部金属,可用于制作门窗框架
台州市高一化学期末试题 第1页 共6页9.下列说法不正确的是
A.Li和O?在加热条件下生成Li?O
B.往紫色石蕊试液中通入 SO?气体,溶液变红色
C.将未用完的钠、钾、白磷丢入垃圾桶
D.如果不慎将碱沾到皮肤上,应立即用大量水冲洗,然后涂上1??硼酸
10.下列反应中,调节反应条件(温度、反应物用量比)后反应产物不会改变的是
A.钠与氧气 B.铁与氯气
C.碳酸钠溶液中滴盐酸
D.二氧化碳与氢氧化钠溶液
11.图a~c分别为NaCl在不同条件下(固态、熔融、水溶液)的导电性实验的微观示意图
(X、Y均表示石墨电极,分别与电源的正负极相连)。下列说法不正确的是
A. NaCl固体存在Na*、Cl x
發
Y X
B.图a说明干燥的NaCl固体不导电 X
C.由图b可知熔融的NaCl在通电条
件下才能发生电离 a b c
D.由图b和c可知熔融NaCI和NaCI溶液导电的微粒不相同
12.下列各组离子因发生氧化还原反应而不能在水溶液中大量共存的是
A. K*、OH、Cl、Fe3+ B.I、H*、Cl、S2-
C. Na+、H+、S2、MnO; D.Na、Ca2+、SO}、Cl
13.P?Os常用作气体干燥剂, ?。下列说法不正确的是
A. P?Os中P元素化合价为+5价 B. P?Os属于碱性氧化物
C. P?Os能与CaO反应 D. P?O?能与NaOH反应
14.硫代硫酸钠(Na?S?O?)被称为“养鱼宝”,可降低水中的氯对鱼的危害。脱氯反应为:
S?O}+4Cl?+5H?O=2SO?+10H++8Cl,下列说法正确的是
A. S?O;是还原剂 B.消耗1 mol Cl?转移1 mol e
C. SO?是还原产物 D.H?O被还原
15.下列关于物质性质的比较,不正确的是
A.酸性强弱:HIO?>HBrO?>HCIO? B.还原性:Na>Mg>Al
C.氢化物的稳定性:H?O>H?S>H?Se D.氧化性:F?>Cl?>Br?
16.下列说法正确的是
A.元素原子的最外层电子数等于元素的最高正化合价
B.同周期IIA族与IIA族元素原子序数可能相差11
C.碳酸钠固体溶于水放热,则碳酸氢钠固体溶于水也放热
D.在元素周期表金属与非金属的分界处寻找耐高温、耐腐蚀的合金元素
17.下列离子方程式正确的是
A.氧化亚铁与稀盐酸反应:FeO+2H+=Fe3++H?O
B.用醋酸除水垢:2H++CaCO?==Ca2++CO?↑+H?O
C. Na与H?O反应:Na+H?O==Na++OH+H?↑
D.用NaHCO?治疗胃酸过多:HCO;+H+==CO?↑+H?O
台州市高一化学期末试题 第2页 共6页18.下列实验装置使用不正确的是
NalICO,
a
湿棉花 还原铁粉 铜丝 Na,co,
浸NaOH溶 NH,
浓硫酸 液的棉团
肥皂液
cO?和NaCl
品红溶液 的饱和溶液 沿清石失水
④
① ② ③
A.装置①可用于铁粉和水蒸气反应并检验气态产物
B.装置②可用于铜与浓硫酸反应并检验气态产物
C.装置③可用于模拟侯氏制碱法制备NaHCO?
D.装置④可用于比较Na?CO?和NaHCO?的热稳定性
19.设NA为阿伏伽德罗常数值,下列有关叙述不正确的是
A.等体积、等浓度的NaCl和KI溶液中所含有的离子数均为2NA
B.标准状况下,2.24LSO?含有的分子数为0.1 NA
C. I mol由Na?O?和Na?O组成的混合物中阴离子数为NA
D.32g Cu与足量S完全反应转移的电子数为0.5NA
20.A、B、C、D是中学化学常见的纯净物,均含同一种元素,A是单A
②
质,它们之间有如下转化关系,下列说法不正确的是
④
①
C D
A.若A是S且C、D是氧化物,则B可以是H?S
B ③
B.若A是Al且B、D具有两性,则反应④可以通CO?
C.若A是Na且C是淡黄色固体,则①②③④可以是化合反应
D.若A是Fe且B、C、D为三种不同类别的物质,则D可以是FeSO?
21.有效脱除烟气中的 SO?是环境保护的重要课题,工业上常用钠钙双碱法高效脱除烟气中
的SO?,流程如图所示:
NaOH溶液
Na?SO? 滤渣一…一CaSO
含SO?的烟气 吸收
尾气 物质X
下列说法不正确的是
A.“吸收”时气液逆流可提高SO?吸收率
B.该方法可实现NaOH的循环利用
C.物质X可以是澄清石灰水
D.滤渣转变成CaSO?需要O?参与
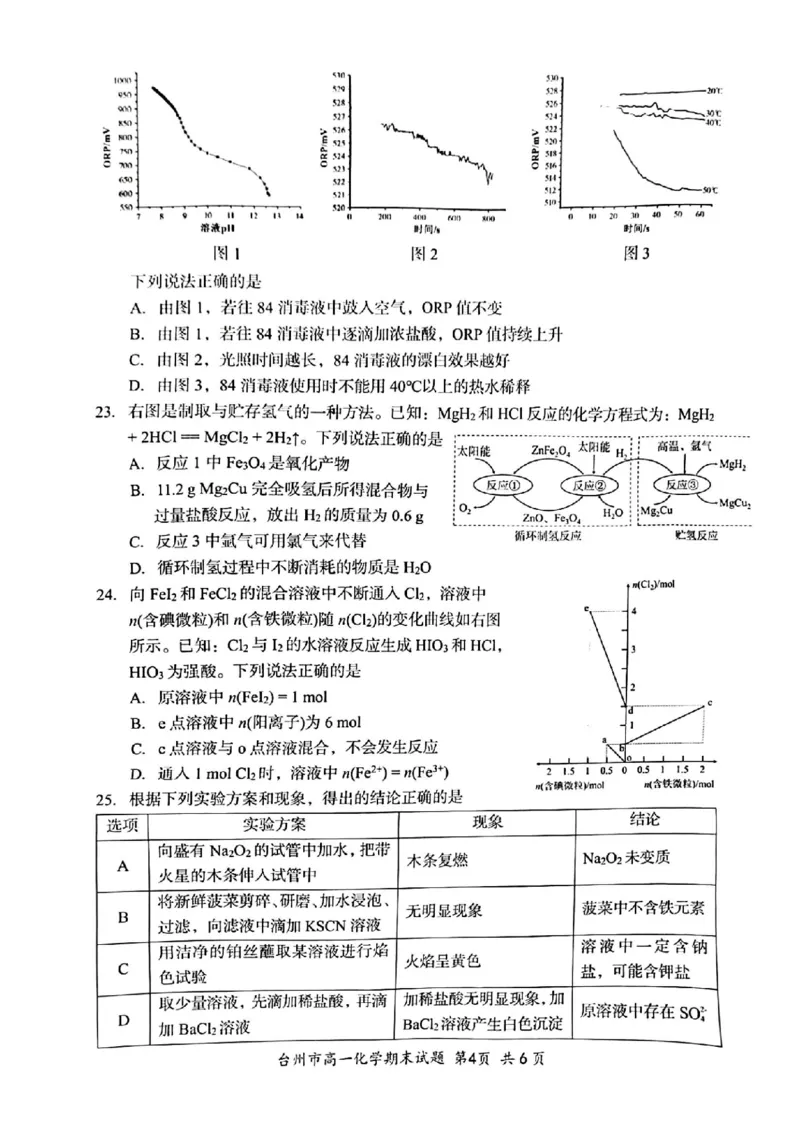
22.某化学兴趣小组设计实验探究84消毒液的漂白性。已知:ORP可以表示水溶液中物质
的氧化性或还原性强弱。本实验中,ORP值越大,氧化性越强。
I往84消毒液中逐滴加稀硫酸,测得84消毒液ORP值随pH的变化如图1所示;
Ⅱ光照下,测得84消毒液ORP值随时间的变化如图2所示;
Ⅲ 不同温度时,测得84消毒液ORP值随时间的变化如图3所示。
台州市高一化学期末试题 第3页 共6页9
i0 500
528 -2mr
os0
on0 s28 526 oc
*so 27 24
ORP/mV ORP/mVss6s W ORP/mV522 40℃
s00
520
70 84 s18
s6
su
650 s2
600 s21 s12 -50℃
ss0 "2 s20+ s0
a200 400n s00 00 20 30 40 500
溶液pH 时间/s 时间/s
图1 图2 图3
下列说法正确的是
A.由图1,若往84消毒液中鼓入空气,ORP值不变
B.由图1,若往84消毒液中逐滴加浓盐酸,ORP值持续上升
C.由图2,光照时间越长,84消毒液的漂白效果越好
D.由图3,84消毒液使用时不能用40℃以上的热水稀释
23.右图是制取与贮存氢气的一种方法。已知:MgH?和HCI反应的化学方程式为:MgH?
+2HCl=MgCl?+2H?↑。下列说法正确的是
太阳能 ZnFe?O?太阳能H? 高温、氩气
A.反应1中Fe?O?是氧化产物 MgH?
B. 11.2gMg?Cu完全吸氢后所得混合物与 反应① 反应② 反应③
MgCu?
O? H?O Mg?Cu
过量盐酸反应,放出H?的质量为0.6g ZnO、Fe,O?
C.反应3中氩气可用氯气来代替 循环制氢反应 贮氢反应
D.循环制氢过程中不断消耗的物质是H?O
n(Cl?Vmol
24.向FeI?和FeCl?的混合溶液中不断通入 Cl?,溶液中
e
4
n(含碘微粒)和n(含铁微粒)随n(Cl?)的变化曲线如右图
所示。已知:Cl?与I?的水溶液反应生成HIO?和HCl, 3
HIO?为强酸。下列说法正确的是
2
A.原溶液中n(Fel?)=1 mol c
d
B.e点溶液中n(阳离子)为6 mol 1
a
C.c点溶液与o点溶液混合,不会发生反应
成
lo
D.通入1 mol Cl?时,溶液中n(Fe2+)=n(Fe3+) 2 1.5 10.5 0 0.5 1 1.5 2
m含碘微粒Vmol m(含铁微粒Vmol
25.根据下列实验方案和现象,得出的结论正确的是
选项 实验方案 现象 结论
向盛有Na?O?的试管中加水,把带
Na?O?未变质
A 木条复燃
火星的木条伸入试管中
将新鲜菠菜剪碎、研磨、加水浸泡、
B 无明显现象 菠菜中不含铁元素
过滤,向滤液中滴加 KSCN溶液
用洁净的铂丝蘸取某溶液进行焰 溶液中一定含钠
C 火焰呈黄色
盐,可能含钾盐
色试验
加稀盐酸无明显现象,加
取少量溶液,先滴加稀盐酸,再滴
原溶液中存在SO?
D
加BaCl?溶液 BaCl?溶液产生白色沉淀
台州市高一化学期末试题 第4页 共6页非选择题部分
二、填空题(本大题共5小题,共50分)
26.(8分)按要求回答:
(1)HCIO的结构式是▲,化学键的类型是▲。
(2)用电子式表示MgCl?的形成过程▲。
(3)MgCl?溶液、AlCl?溶液中分别滴加 NaOH溶液,观察到的现象是_▲,说明碱性:
Mg(OH)?▲Al(OH)?(填“>”“<”或“=”)
27.(10分)某化学兴趣小组利用工厂的废铁屑(主要成分为Fe,还含有少量Cu、Al、Al?O?
和Fe?O?)制备水处理剂Fe(OH)?胶体和Na?FeO?的流程如图:
溶液A
过量试剂x[
废铁屑 固体B
过量盐酸
固体 足量H?O?溶液溶液D足量试剂x[ 溶液E Gh园
溶液C-
NaCIO溶液
固体F
Fe(OH,胶体 试剂X
请回答:
(1)试剂X是▲(填化学式),溶液A中所含溶质为X和▲(填化学式)。
(2)溶液C中未检出Fe3+,原因是▲(用离子方程式表示)。
(3)由D的饱和溶液制备 Fe(OH)?胶体的操作是▲。
C
Ch
(4)双电层模型认为胶体粒子通常由胶核和吸附层构成。新制
Ct Fe0
FeO
Fe(OH)?胶体的胶团结构如图所示。下列说法正确的是▲。 FeO
FeO
cr
([Fe(OH)l cr
A. Fe(OH)?胶体带正电荷 cr )FeO
胶核
B. Fe(OH)?胶体粒子的直径介于1~100nm之间 FeO FeO
cr FeO 扩散层
C. Fe(OH)?胶体的丁达尔效应是胶体粒子对光的反射
CH
D.外加电场作用下 Fe(OH)?胶体粒子会发生定向移动 吸附层
(5)由固体F生成Na?FeO?的离子方程式是▲。 Fe(OH)?胶团结构示意图
28.(12分)下表为元素周期表的一部分,已知J的核电荷数是Z的2倍。
请回答:
X Y Z
(1)元素Y在周期表中的位置▲。
(2)非金属性:J▲Q(填“>”“<”或“=”), J Q
判断依据是(用一个离子方程式表示)▲。 N
(3)下列说法不正确的▲。
A.Y的原子半径比Z的大
B.考古时利用14X测定一些文物的年代
C.X的单质与J的最高价氧化物对应水化物之间不发生化学反应
D.周期表中某元素的周期序数大于其族序数,该元素可能是非金属
(4)元素Q与N组成的化合物NQ性质与Cl?相似,则
浓H?SO?
NQ与JZ?水溶液反应的化学方程式为▲。 Se
含硒 物质A 水
(5)硒(Se)与元素J同主族,可从精炼铜的废渣 焙烧
废渣 SeO?
物质B
中提取,废渣中硒主要以 Se和Cu?Se的形式存
CuSO?
在,工业提取硒的流程如右图:Cu?Se与浓H?SO?
反应的化学方程式是▲,上述流程中可循环使用的物质是▲(填化学式)。
台州市高一化学期末试题 第5页 共6页29.(8分)生理盐水是指临床上常用的渗透压与人体血浆的渗透压相等的氯化钠溶液,其
质量分数为0.9密度为1.005 g/cm3。某实验小组需要配制480 mL生理盐水。
(1)用托盘天平称量▲gNaCl固体。
(2)下图为溶液配制的过程,请将下列操作排序:a→b→_
8
4
Na
a b c d e f g
用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液注人容量瓶,其目的是_▲。
(3)下列说法不正确的是▲。
A.容量瓶在使用前需检查是否完好,瓶口处是否漏水
B.容量瓶使用前需烘干
C.定容时仰视容量瓶上的刻度线,所配溶液浓度偏小
D.将容量瓶上下颠倒摇匀,静置后液面低于刻度线,补加少量水至刻度线
30.(12分)二氧化氯是一种比较安全的消毒剂。某实验小组以氯气和亚氯酸钠为原料制
备二氧化氯。
已知:iCIO?为黄绿色气体,易溶于水,在空气中质量分数超过10??有爆炸性;
i NaCIO?溶液呈碱性,在酸性条件下会产生两种黄绿色气体;
iii 饱和食盐水中的Cl浓度增大,会有NaCl晶体析出。
浓盐酸
N?
收集和
尾气处理
弹簧夹
饱和
NaCI NaCIO? CCL
MnO? 溶液 c 溶液
A B D
(1)A为Cl?发生装置(夹持和加热装置已略)。A中反应体现了MnO?的▲性。
(2)实验过程中,持续通入N?的作用是稀释CIO?和▲。
(3)反应一段时间后,装置B中观察到有NaCl晶体析出,可能由以下两个原因导致:
i浓盐酸挥发产生的HCl溶解在饱和食盐水中,提高了Cl-浓度;
ii▲。
(4)装置C中制备CIO?的化学方程式为▲__,反应一段时间后,装置C中溶液
pH▲(填“增大”或“下降”),NaCIO?可能会发生副反应,其离子方程式▲。
台州市高一化学期末试题 第6页 共6页2024学年_
台州市 高一年级期末质量评估试题
第一学期l
化学评分标准
一、选择题(本大题共25小题,每小题2分,共50分。每小题列出的四个备选项中只有一个
是符合题目要求的,不选、多选、错选均不得分)
题号 1 2 3 4 5 6 7 8 9
答案 D B B C D B A A C
题号 10 11 12 13 14 15 16 17 18
答案 B C C B A A B D C
题号 19 20 21 22 23 24 25
题号 A D C D D D D
二、非选择题(本大题共5小题,共50分)
26.(8分)
(1)H—0-CI(1分)共价键(1分)
(2):c·+×Mg×+ C:一[:C×1-Mg2×C:}(2分)
(3)MgCl?溶液中滴加NaOH溶液,出现白色沉淀;AlCl?溶液中滴加 NaOH溶液,先出
现白色沉淀,后沉淀逐渐溶解。(2分)>(2分)
27.(10分)
(1)NaOH(1分)Na[Al(OH)4](1分)(2)Fe+2Fe3+=3Fe2+(2分)
(3)向沸水中逐滴加入5~6滴FeCl?饱和溶液,继续煮沸至液体呈红褐色,停止加热。(2分)
(4)BD(2分)(5)3CIO+4OH+2Fe(OH)?=2FeO}+3Cl+5H?O(2分)
28.(12分)
(1)第二周期VA族(1分)(2)<(1分) Cl?+S2=2Cl+S↓(2分)
(3)CD(2分)(4)BrCl+SO?+2H?O=H?SO?+HCl+HBr(2分)
(5)6H?SO?(m)+Cu?Se焙烧2cuSO?+SeO?+4SO?↑ +6H?O(2分)H?SO?(2分)
29.(8分)
(1)4.5(2分)(2)dc fg(2分)避免溶质损失(2分)(3)BD(2分)
30.(12分)
(1)氧化性(2分)(2)使C中生成的CIO?逸出,便于收集(2分)
(3)氯气与水反应产生Cl,提高了Cl浓度(2分)
(4)Cl?+2NaCIO?=2NaCl+2CIO?(2分)下降(2分)
8CIO?+8H+=6CIO?↑+Cl?↑+4H?O(2分)
台州市高一化学答案 第1页 共1页