文档内容
第一章单元检测试卷(原卷版)
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 S 32
第Ⅰ卷
一、选择题:本题共20个小题,每小题2分,共40分。在每小题给出的四个选项中,只有一项是
符合题目要求的。
1.下列物质的鉴别方法不正确的是( )
A.用焰色反应鉴别NaCl、KCl和NaSO
2 4
B.用氢氧化钠溶液鉴别MgCl 溶液、NaCl溶液
2
C.利用丁达尔效应鉴别Fe(OH) 胶体与FeCl 溶液
3 3
D.用氯化钙溶液鉴别NaCO 和NaHCO 两种溶液
2 3 3
2.将一小块钠投入到FeCl 溶液中,观察到的现象是( )
3
A.钠溶解,有铁析出并有气体产生
B.只有气体产生
C.既有气体产生,又有红褐色沉淀产生
D.只有沉淀产生
3.向饱和NaCO 溶液中通入足量CO,结果有晶体析出,对析出晶体的原因分析不正确的是(
2 3 2
)
A.相同温度下,NaHCO 的溶解度小于NaCO
3 2 3
B.溶液中溶剂减少了
C.溶质质量增加了
D.反应过程放热
4.下列做法或操作正确的是( )
A.对浓硫酸进行稀释时,将水倒入浓硫酸中B.实验室制取氯气时,应该设计尾气吸收装置
C.配制100mL 0.1mol/L的NaCl溶液时,应将称量好的NaCl固体转移至100mL容量瓶中,加
水定容
D.切取6.0 g Na进行Na与水的反应
5.设N 表示阿伏加德罗常数的值,下列叙述不正确的是( )
A
A.标准状况下,22.4 L由NH 和CH 组成的混合气体,所含分子数为N
3 4 A
B.常温常压下,28 g CO中所含碳原子数为N
A
C.1 L 0.5 mol·L-1 MgCl 溶液中,含有Cl-的个数为N
2 A
D.N 个氯气分子的体积为22.4 L
A
6.如图所示,甲、乙、丙常温下都为气体,2 mol甲反应生成1 mol丙和3 mol乙,下列判断不
正确的是( )
A.1个乙分子中含有2个H原子
B.甲的摩尔质量为17 g·mol-1
C.同温同压下,生成丙和乙的体积比为1∶3
D.标准状况下,将11.2 L甲溶于500 mL水中,所得溶液中甲的物质的量浓度为1 mol·L-1
7.海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
―→―→
――→
粗盐中含Ca2+、Mg2+、Fe3+、SO等杂质,提纯的步骤有:
①加入过量的NaCO 溶液 ②加入过量的BaCl 溶液 ③加入过量的NaOH溶液 ④加入适量
2 3 2
盐酸 ⑤溶解 ⑥过滤 ⑦蒸发,其正确的操作顺序是( )A.⑤②③①⑥④⑦
B.⑤①②③⑥④⑦
C.⑤②①③④⑥⑦
D.⑤③①②⑥④⑦
8.过氧化钠与CO 作用时,反应的化学方程式为2NaO +2CO===2Na CO +O 。当0.2 mol
2 2 2 2 2 3 2
NaO 与足量CO 完全反应后,下表对生成物NaCO 和O 的描述中正确的是( )
2 2 2 2 3 2
选项 NaCO 的质量 关于O 的描述
2 3 2
A 21.2 g O 的摩尔质量是36 g·mol-1
2
B 21.2 g 生成标准状况下O 的体积为2.24 L
2
C 10.6 g O 的摩尔质量是34 g·mol-1
2
D 22.4 g 生成标准状况下O 的体积为1.12 L
2
9.在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和
结论一定正确的是( )
A.加入有色布条,有色布条褪色,说明氯水中有Cl 分子存在
2
B.溶液呈黄绿色,且有刺激性气味,说明氯水中有Cl 存在
2
C.加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明氯水中有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明氯水中有HClO分子存在
10.如图所示,从A处通入新制备的Cl ,关闭B阀时,C处的红色布条看不到明显现象;当
2
打开B阀后,C处红色布条逐渐褪色。D瓶中装的是( )
A.稀硫酸 B.NaOH溶液C.HO D.饱和NaCl溶液
2
11.下列变化过程不能直接实现的是( )
①HCl ②Cl ③Ca(ClO) ④HClO ⑤CO
2 2 2
A.①→② B.②→③ C.③→④ D.④→⑤
12.下列离子方程式书写正确的是( )
A.次氯酸钙溶液中通入过量的CO:Ca2++2ClO-+HO+CO===CaCO ↓+2HClO
2 2 2 3
B.氢氧化钠溶液吸收氯气:2OH-+Cl===Cl-+ClO-+HO
2 2
C.盐酸与硝酸银溶液反应:HCl+Ag+===AgCl↓+H+
D.氯气通入水中:Cl+HO===2H++Cl-+ClO-
2 2
13.为了证明氯酸钾晶体中含氯元素,选用给出的试剂和操作,其操作顺序正确的是( )
①滴加AgNO 溶液 ②加水溶解 ③过滤、取滤液 ④与二氧化锰混合加热
3
⑤加稀HNO ⑥与浓盐酸反应 ⑦加NaOH溶液加热 ⑧用淀粉碘化钾
3
A.⑥⑦①⑤ B.⑥⑧
C.④②③①⑤ D.②①⑤
14.NaCl是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是( )
A.25℃,NaHCO 在水中的溶解度比NaCO 的大
3 2 3
B.石灰乳与Cl 的反应中,Cl 既是氧化剂,又是还原剂
2 2
C.常温下干燥的Cl 能用钢瓶贮运,所以Cl 不与铁反应
2 2D.上图所示转化反应都是氧化还原反应
15.下列关于物质的量浓度表述正确的是( )
A.0.3 mol·L-1的NaSO 溶液中含有Na+和SO的总物质的量为0.9 mol
2 4
B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L-1,只有当22.4 L氨气溶于水制得
1 L氨水时,其浓度才是1 mol·L-1
C.在KSO 和NaCl的中性混合水溶液中,如果Na+和SO的物质的量相等,则K+和Cl-的物
2 4
质的量浓度一定相等
D.10 ℃时,0.35 mol·L-1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10 ℃时,其体积小于
100 mL,它的物质的量浓度仍为0.35 mol·L-1
16.现加热5 g碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31 g,
则原混合物中碳酸钠的质量为( )
A.3.38 g B.4.58 g C.4.16 g D.4.41 g
17.将9.58 g Na CO·10 H O与NaHCO 的混合物溶于水配成100 mL溶液,测得c(Na+)=1
2 3 2 3
mol·L-1。再取同质量的混合物,充分加热至质量不变时,所得固体的质量为( )
A.5.30 g B.7.78 g C.6.72 g D.6 g
18.a g纯净的碳酸钠和a g碳酸钠与碳酸氢钠的混合物相比,下列描述正确的是( )
A.分别和盐酸反应时,混合物的耗酸量大
B.分别和足量盐酸反应时,混合物放出的CO 多
2
C.分别配制成等体积溶液,混合物碱性大
D.分别配制成等体积溶液,混合物的Na+的物质的量大
19.用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏高的是( )
A.定容时加水加多了,用滴管吸出溶液至刻度线
B.定容时仰视视刻度线C.没有洗涤溶解NaCl固体的烧杯和玻璃棒
D.称量NaCl固体时砝码上有杂质
20.0.5mol/L的NaCl溶液中混有一定量的NaCO ,向该溶液中滴加适量的BaCl 溶液后再过
2 3 2
滤,以除去其中的NaCO 杂质,则滤液中的NaCl的物质的量浓度为( )
2 3
A.小于0.5mol/L
B.大于0.5mol/L
C.等于0.5mol/L
D.无法确定
第Ⅱ卷
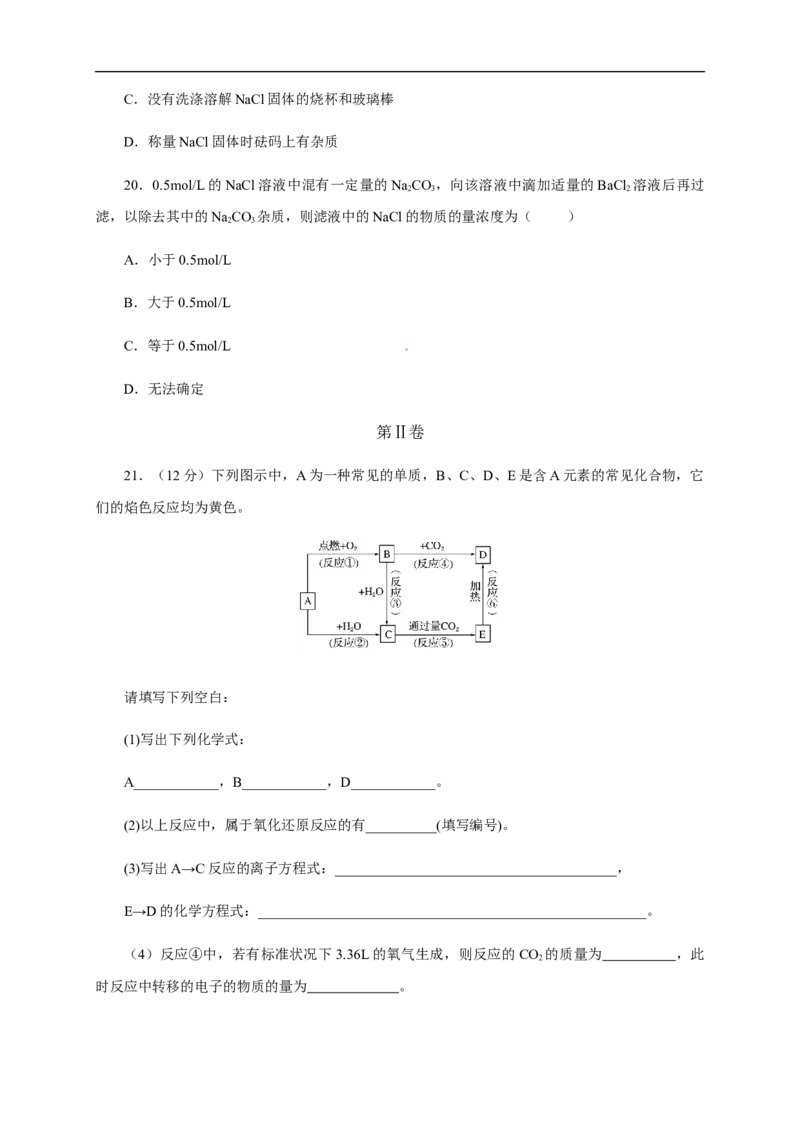
21.(12分)下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它
们的焰色反应均为黄色。
请填写下列空白:
(1)写出下列化学式:
A____________,B____________,D____________。
(2)以上反应中,属于氧化还原反应的有__________(填写编号)。
(3)写出A→C反应的离子方程式:________________________________________,
E→D的化学方程式:_______________________________________________________。
(4)反应④中,若有标准状况下3.36L的氧气生成,则反应的CO 的质量为 ,此
2
时反应中转移的电子的物质的量为 。22.(10分)KClO 和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表
3
述为:
_____KClO+_____HCl(浓)===______KCl+______ClO ↑+______Cl↑+______HO
3 2 2 2
(1)配平以上化学方程式(化学计量数填入横线上)。
(2)反应中的氧化剂是________,ClO 是反应的________(填“氧化”或“还原”)产物。
2
(3)反应产生0.1 mol Cl ,则转移的电子的物质的量为________mol。
2
(4)ClO 具有很强的氧化性,因此可被用来作消毒剂,若 ClO 作消毒剂后转化为Cl-,则其消
2 2
毒的效率(以单位物质的量得到电子数表示)是Cl 的________倍。
2
23.(16分)为了探究新制饱和氯水的组成和性质而进行了下列科学实验,请根据要求回答
问题:
(1)请写出新制饱和氯水中含有氯元素的物质的化学式:______________________________。
(2)若不进行实验,请说明判断氯水中含有Cl 的主要依据:__________________________。
2
(3)取适量新制氯水滴入品红溶液后褪色,可得出氯气与水反应的产物具有漂白性,请你评价该
结论是否合理?________。若不合理,请说明理由(若合理,则无需填写):___________________。
(4)先观察了氯水的外观性质以后,又用胶头滴管将该氯水逐滴滴入含有酚酞的NaOH溶液中,
边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。根据预测,实验中溶液红
色褪去的原因可能有两种,请用简要的文字说明:
①________________________________________________________________________。
②________________________________________________________________________。
他们又要通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
[实验步骤]
①取试管内的无色溶液3 mL盛于另一支洁净的试管中;
②______________________________,振荡试管。
[实验现象及结论]①若________,则证明溶液红色褪去的原因是①而不是②;
②若________,则证明溶液红色褪去的原因是②而不是①。
24.(18分)(1)如图所示的仪器中配制溶液肯定不需要的是____________。(填序号)仪
器C的名称是________,本实验所需玻璃仪器E规格和名称是___________。
(2)下列操作中,容量瓶所不具备的功能有__________(填序号)
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D.量取220毫升体积的溶液
(3)在配制NaOH溶液实验中,共它操作均正确,若定容时仰视刻度线,则所配制溶溶液浓
度_____________0.1mol/L(填“大于”“等于”或“小于”,下同)。若 NaOH溶液未冷却即转
移至容量瓶定容,则所配制溶液浓度__________0.1mol/L。
(4)根据计算得知:所需质量分数为 98%、密度为 1.84g.cm-3 的浓硫酸的体积为
__________mL(计算结果保留一位小数)。如果实验室有l0mL、25mL、50mL量筒,,应选用
__________mL规格的量筒最好。
(5)如果定容时不小心超过刻度线,应如何操作___________。
25.(4分)用11.92gNaClO配成100mL溶液,向其中加入0.01mol Na S 恰好完全反应,生成
2 x
NaSO 和NaCl。
2 4
(1)NaClO溶液的物质的量浓度_________mol·L-1。
(2)化学式NaS 中的X=____________。
2 x