文档内容
第二章 海水中的重要元素——钠和氯
单元测试卷
时间:90分钟 满分:100分
一、 选择题(本题共12小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.同温同压下,质量相同的CO、H、O、CH、SO 五种气体,下列说法错误的是
2 2 2 4 2
A.所占的体积由大到小的顺序是:H>CH >O >CO >SO
2 4 2 2 2
B.所含分子数由多到少的顺序是:H>CH >O >CO >SO
2 4 2 2 2
C.密度由大到小的顺序是:SO >CO >O >CH >H
2 2 2 4 2
D.所含的电子数由多到少的顺序是:CO>SO>CH >O >H
2 2 4 2 2
2.若一个氖原子质量是a g,一个12C原子质量是b g,设阿伏加德罗常数的数值为N ,下列说法不正确的
A
是 ( )
A.该氖原子的相对原子质量是12a/b B.该氖原子的摩尔质量是aN g
A
C.Wg该氖原子的物质的量是 mol D.Wg该氖原子所含质子数是10W/a
3.下列解释实验现象的反应方程式正确的是( )
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O=Na O
2 2 2
B.将Na块放入水中,产生气体:2Na+2HO=2NaOH+H↑
2 2
C.NaO 在潮湿的空气中放置一段时间,变成白色粘稠物:2NaO+2CO=2Na CO+O
2 2 2 2 2 2 3 2
D.向NaHCO 溶液中加入过量的澄清石灰水,出现白色沉淀:2NaHCO +Ca(OH) =CaCO ↓+NaCO+
3 3 2 3 2 3
2HO
2
4.在紫色石蕊试液中分别加入(或通入)足量的下列物质,最后不能使溶液变成无色的是( )
A.Cl B.新制氯水 C.NaO D.NaOH
2 2 2
5.某同学将金属钠露置于空气中足够长时间,观察到下列现象:银白色→变灰暗→变白色→出现液滴→
白色固体→白色粉末。下列有关叙述不正确的是( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了NaO
2
B.出现液滴原因是生成的NaCO 吸收空气中的水蒸气在表面形成了溶液
2 3
C.最后白色粉末为碳酸钠粉末
D.最后白色粉末的质量比金属钠质量大
6.下列说法不正确的是( )A.NaO 可以作为呼吸面具或潜水艇里的氧气来源
2 2
B.将NaO加到酚酞溶液中,溶液先变红色后褪色
2
C.可用水来检验某NaO样品中是否含有NaO
2 2 2
D.过氧化钠为淡黄色固体粉末
7.用N 代表阿伏加德罗常数,下列说法中正确的是( )
A
A.1 mol水含有的氢原子数目为N B.1 mol氩气分子所含的原子数目为2N
A A
C.0.5 mol碳酸钠中含有的钠离子为0.5N D.0.5 mol硝酸中含有的氧原子为1.5N
A A
8.同温同压下,等质量的氧气和二氧化碳相比较,下列叙述正确的是
A.质子数之比为1∶1 B.氧原子数比为8∶11
C.物质的量之比为8∶11 D.原子个数比1∶1
9.气体的体积主要由以下什么因素决定:( )
①气体的分子多少 ②气体分子的大小
③气体分子间的平均距离 ④气体分子的相对分子质量.
A.①② B.①③ C.②③ D.②④
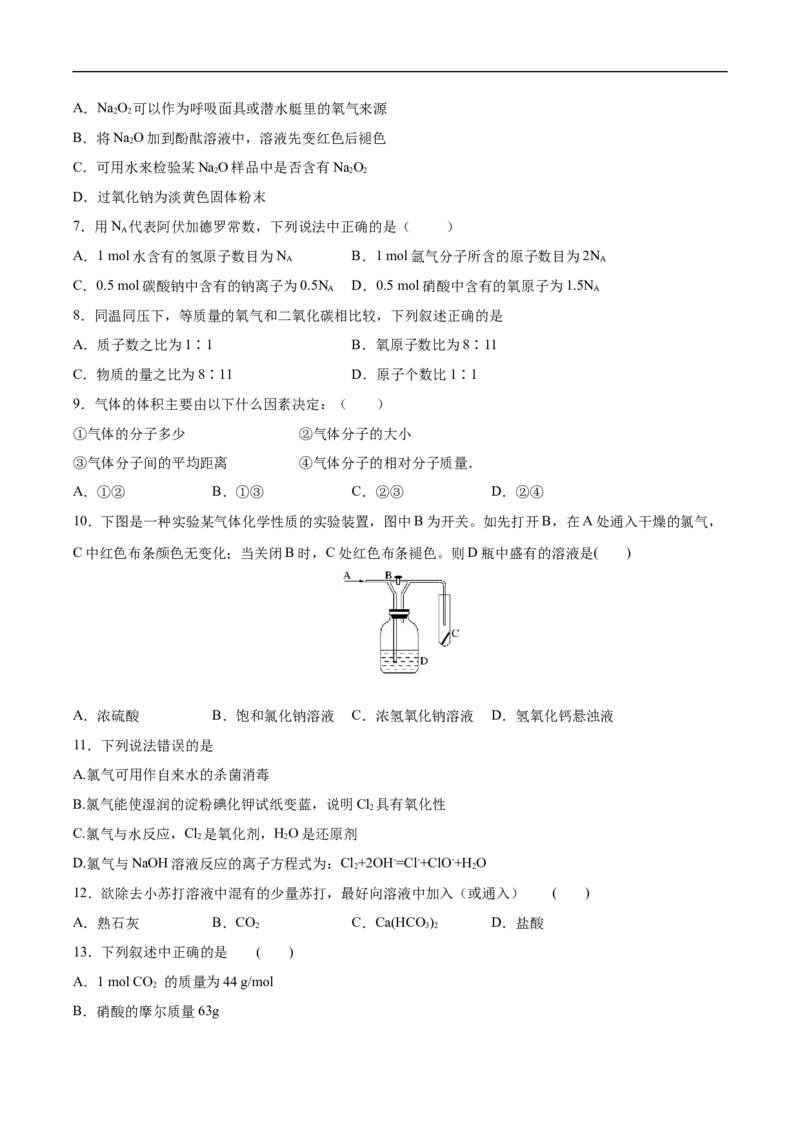
10.下图是一种实验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥的氯气,
C中红色布条颜色无变化;当关闭B时,C处红色布条褪色。则D瓶中盛有的溶液是( )
A.浓硫酸 B.饱和氯化钠溶液 C.浓氢氧化钠溶液 D.氢氧化钙悬浊液
11.下列说法错误的是
A.氯气可用作自来水的杀菌消毒
B.氯气能使湿润的淀粉碘化钾试纸变蓝,说明Cl 具有氧化性
2
C.氯气与水反应,Cl 是氧化剂,HO是还原剂
2 2
D.氯气与NaOH溶液反应的离子方程式为:Cl+2OH-=Cl-+ClO-+H O
2 2
12.欲除去小苏打溶液中混有的少量苏打,最好向溶液中加入(或通入) ( )
A.熟石灰 B.CO C.Ca(HCO ) D.盐酸
2 3 2
13.下列叙述中正确的是 ( )
A.1 mol CO 的质量为44 g/mol
2
B.硝酸的摩尔质量63gC.2gH 所含原子数目为2mol
2
D.0.5molNa SO 溶于水中,所得溶液中Na+个数为6.02×1023
2 4
14.对于反应:2NaO+2HO===4NaOH+O↑,下列说法中正确的是 ( )。
2 2 2 2
A.NaO 是氧化剂,HO是还原剂
2 2 2
B.NaO 既是氧化剂,又是还原剂
2 2
C.该反应中电子转移的数目为4e-
D.氧气是还原产物
二、综合题
15.(14分)(1)在标准状况下,CO和CO 的混合气体共28L,质量为51g。其中CO 的质量为
2 2
_____g,混合气体中CO的物质的量分数为____。混合气体的平均摩尔质量为_______。
(2)同温同压下,同质量的NH 和HS气体体积比为______,原子个数之比为______,密度之比为
3 2
________。
(3)在120℃时分别进行如下四个反应(除S外其它物质均为气体):
A.2HS+O=2HO+2S↓ B.2HS+3O=2HO+2SO
2 2 2 2 2 2 2
C.C H+3O =2HO+2CO D.C H+6O =4HO+4CO
2 4 2 2 2 4 8 2 2 2
若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d
>d 和V <V 的是___________;符合d >d 和V >V 的是___________(填写反应的代号)。
前 后 前 后 前 后 前 后
16.(15分)用MnO 氧化密度为1.19 g·cm-3,溶质质量分数为36.5%的HCl溶液。反应的化学方程式为:
2
MnO +4HCl(浓) MnCl +Cl↑+2H O
2 2 2 2
(1)该反应的离子方程式为:________________,该盐酸的物质的量浓度为___________mol/L。
(2)用双线桥法表示出该反应的电子转移方向和数目:___________________________。
(3)8.7gMnO 与足量浓盐酸反应能使________molHCl被氧化;其中,还原过程为:________→_______。
2
(4)浓盐酸在反应中显示出来的性质是__________(填字母)
a.还原性 b.酸性 c.氧化性 d. 挥发性
17.(14分)现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl 固体 ⑥稀
3
NaOH溶液 ⑦硝酸亚铁溶液。
(1)上述物质中属于电解质的物质序号为______ 。
(2)有两种物质发生反应的离子方程式为:H++OH-=H O,这两种物质的序号是______。
2
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(4)能导电的物质序号为_______________。(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表
示)___________________________。
(6)实验室用⑤制备胶体的化学方程式为__________________________________。如果将1molFeCl 全部制
3
成胶体,制得的胶体________(选填“带负电”“电中性”“带正电”),胶粒数目________N (选填“大
A
于”“等于”“小于”)。
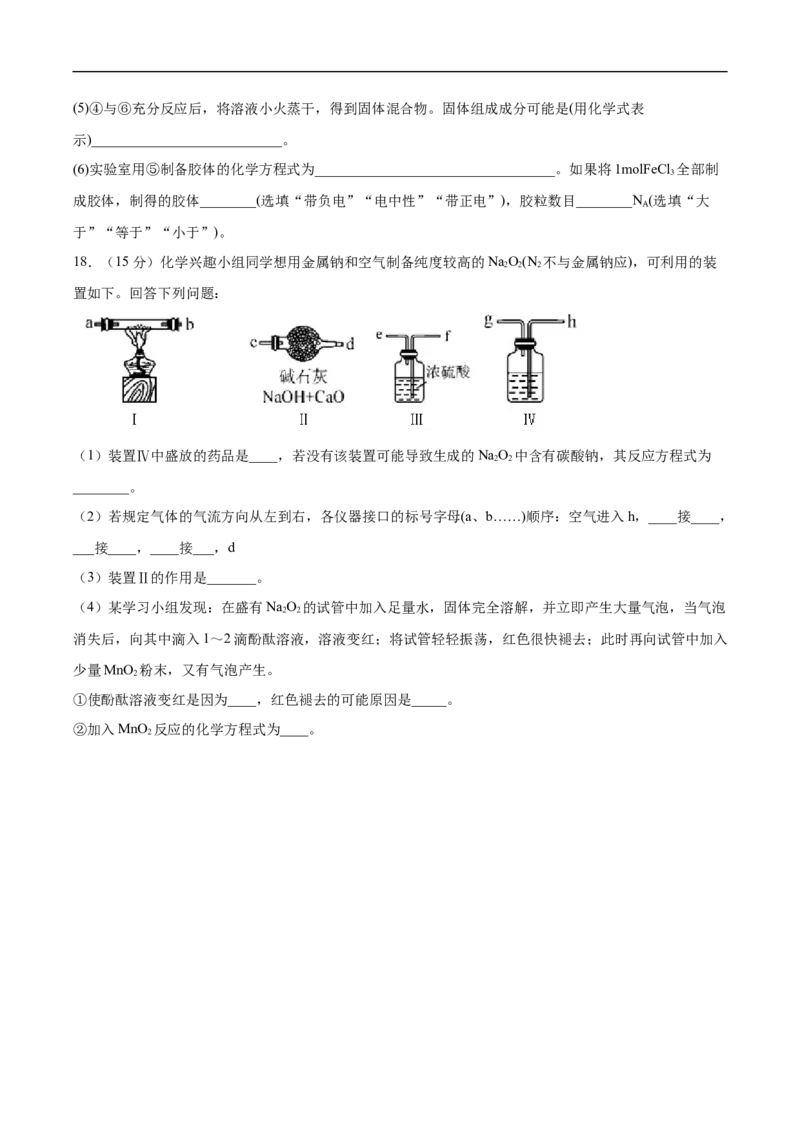
18.(15分)化学兴趣小组同学想用金属钠和空气制备纯度较高的NaO(N 不与金属钠应),可利用的装
2 2 2
置如下。回答下列问题:
(1)装置Ⅳ中盛放的药品是____,若没有该装置可能导致生成的NaO 中含有碳酸钠,其反应方程式为
2 2
________。
(2)若规定气体的气流方向从左到右,各仪器接口的标号字母(a、b……)顺序:空气进入h,____接____,
___接____,____接___,d
(3)装置Ⅱ的作用是_______。
(4)某学习小组发现:在盛有NaO 的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡
2 2
消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入
少量MnO 粉末,又有气泡产生。
2
①使酚酞溶液变红是因为____,红色褪去的可能原因是_____。
②加入MnO 反应的化学方程式为____。
2