文档内容
人教版(2019)必修第二册第六章第二节化学反应的速率与限度
课时训练一
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.二氧化硫的催化氧化反应: 是工业制硫酸中
的重要反应。某温度下,在一密闭容器中探究二氧化硫的催化氧化反应,下列叙述正
确的是
A.加入合适催化剂可以提高 的平衡产率
B.缩小容器容积可以增大活化分子百分含量
C.扩大容器容积可以提高 的平衡产率
D.缩小容器容积可以增大反应速率
2.1L密闭容器中进行反应: ,2min内 的物质的量由2
减小到0.8 ,则用 的浓度变化表示的化学反应速率 为
A.2.4 B.1.8 C.1.2 D.0.6
3.对于反应2A(g)+B(g) 3C(g)+4D(g),下列表示的反应速率最快的是
A.v(A)=0.5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·min-1 D.v(D)=1 mol·L-1·s-1
4.已知反应N(g)+3H(g) 2NH (g)在四种不同情况下的反应速率分别如下:
2 2 3
①v(N)=6.0mol•L-1•min-1
2
②v(H )=0.45mol•L-1•s-1
2
③v(H)=0.3mol•L-1•s-1
2
④v(NH)=0.15mol•L-1•s-1
3
则该反应进行速率快慢顺序正确的是
A.①>②>③>④ B.②>①=③>④ C.③>①>②>④ D.④>③>①>
②
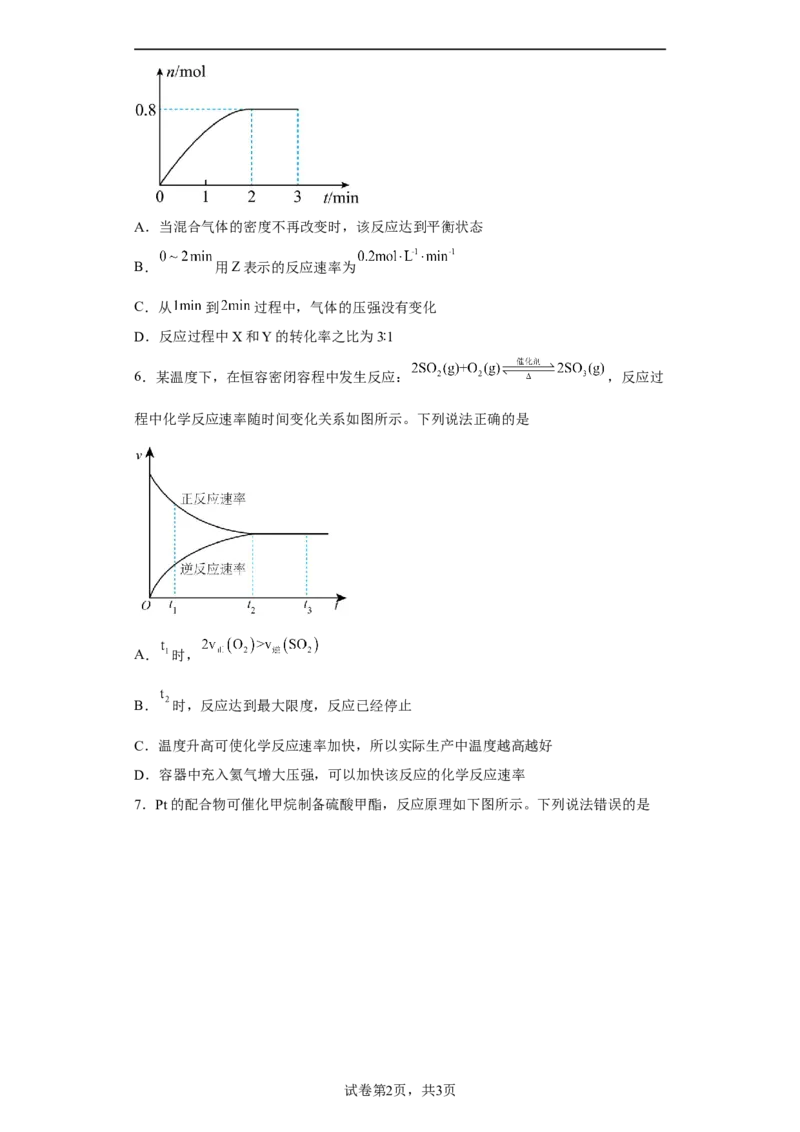
5.一定条件下,将 和 混合于 恒容的密闭容器中,发生反应:
。 末该反应达到平衡,生成W的物质的量随时间的
变化情况如图所示。下列判断正确的是A.当混合气体的密度不再改变时,该反应达到平衡状态
B. 用Z表示的反应速率为
C.从 到 过程中,气体的压强没有变化
D.反应过程中X和Y的转化率之比为3∶1
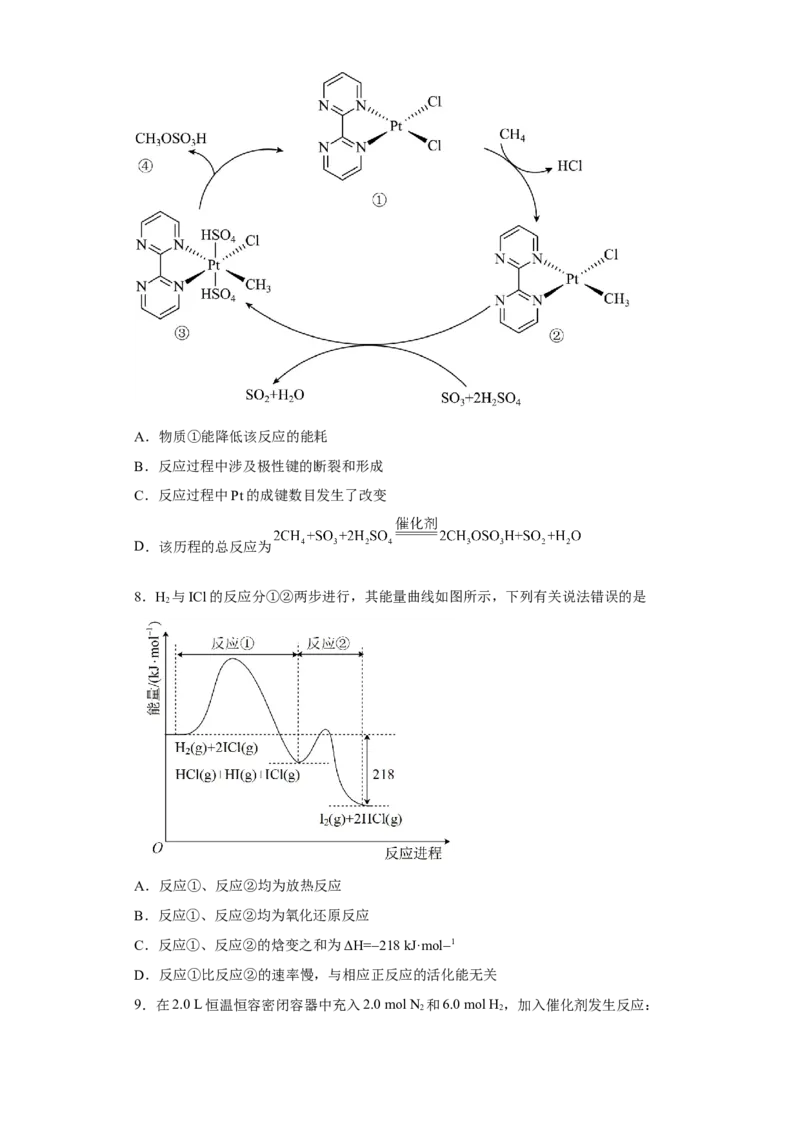
6.某温度下,在恒容密闭容程中发生反应: ,反应过
程中化学反应速率随时间变化关系如图所示。下列说法正确的是
A. 时,
B. 时,反应达到最大限度,反应已经停止
C.温度升高可使化学反应速率加快,所以实际生产中温度越高越好
D.容器中充入氦气增大压强,可以加快该反应的化学反应速率
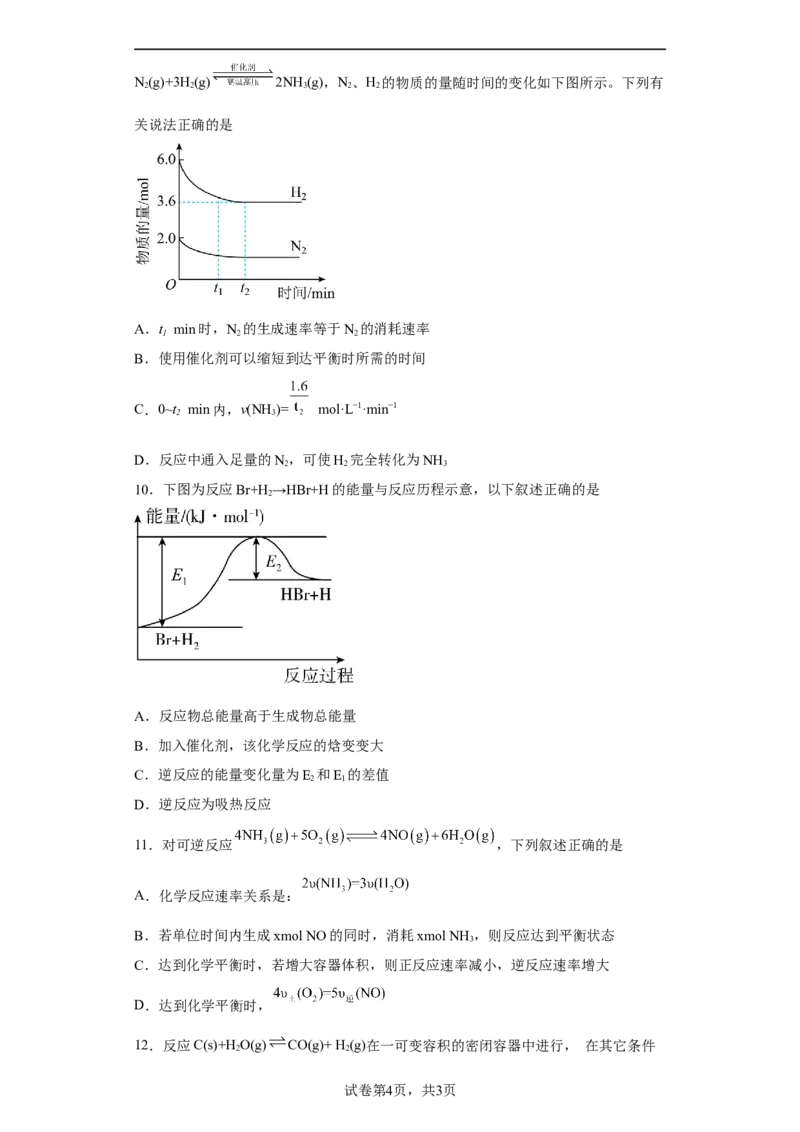
7.Pt的配合物可催化甲烷制备硫酸甲酯,反应原理如下图所示。下列说法错误的是
试卷第2页,共3页A.物质①能降低该反应的能耗
B.反应过程中涉及极性键的断裂和形成
C.反应过程中Pt的成键数目发生了改变
D.该历程的总反应为
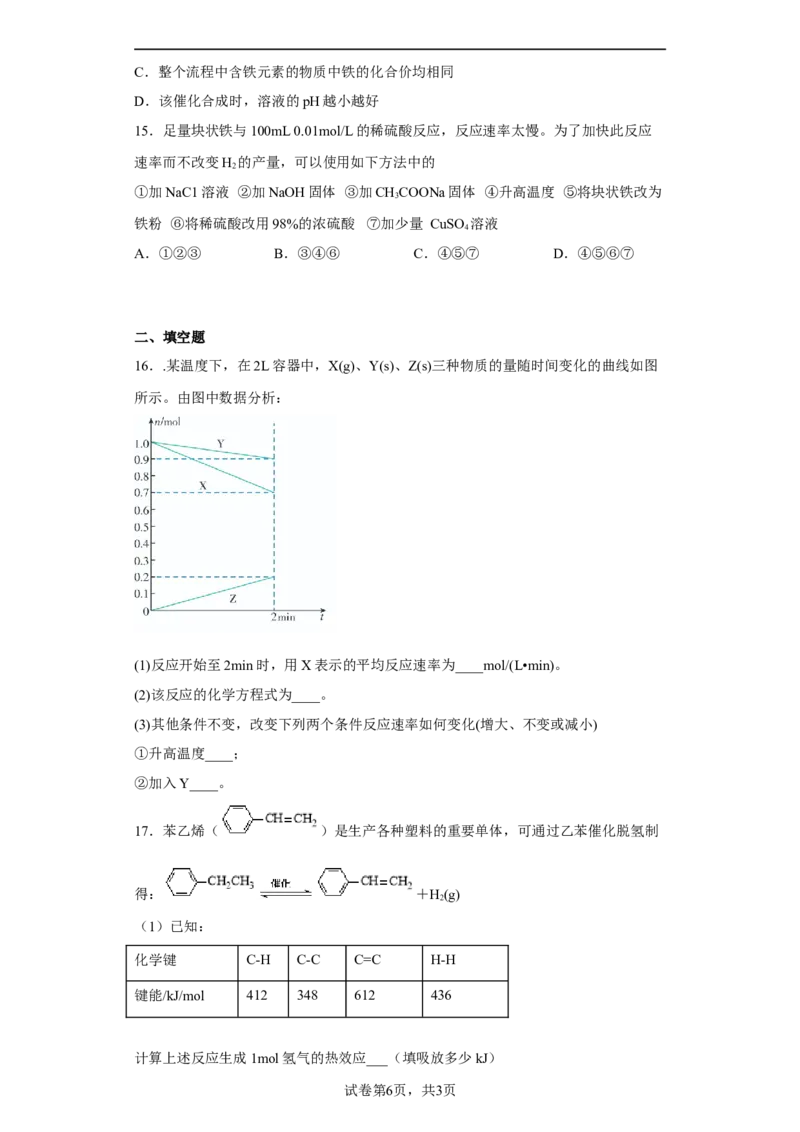
8.H 与ICl的反应分①②两步进行,其能量曲线如图所示,下列有关说法错误的是
2
A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.反应①、反应②的焓变之和为ΔH=218 kJ·mol1
D.反应①比反应②的速率慢,与相应正反应的活化能无关
9.在2.0 L恒温恒容密闭容器中充入2.0 mol N 和6.0 mol H,加入催化剂发生反应:
2 2N(g)+3H(g) 2NH (g),N、H 的物质的量随时间的变化如下图所示。下列有
2 2 3 2 2
关说法正确的是
A.t min时,N 的生成速率等于N 的消耗速率
1 2 2
B.使用催化剂可以缩短到达平衡时所需的时间
C.0~t min内,v(NH )= mol·L−1·min−1
2 3
D.反应中通入足量的N,可使H 完全转化为NH
2 2 3
10.下图为反应Br+H →HBr+H的能量与反应历程示意,以下叙述正确的是
2
A.反应物总能量高于生成物总能量
B.加入催化剂,该化学反应的焓变变大
C.逆反应的能量变化量为E 和E 的差值
2 1
D.逆反应为吸热反应
11.对可逆反应 ,下列叙述正确的是
A.化学反应速率关系是:
B.若单位时间内生成xmol NO的同时,消耗xmol NH ,则反应达到平衡状态
3
C.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时,
12.反应C(s)+HO(g) CO(g)+ H (g)在一可变容积的密闭容器中进行, 在其它条件
2 2
试卷第4页,共3页不变的情况下,下列条件的改变对其反应速率几乎无影响的是
A.加CO的物质的量 B.保持压强不变,充入N 使容器体积
2
变大
C.保持体积不变,充入N 使体系压强增大 D.将容器的体积缩小一半
2
13.NH 可通过催化氧化反应 制取NO,再由NO进一步
3
制取NO 和HNO。调控反应条件会对NH 的催化氧化反应产生影响。下列说法正确
2 3 3
的是
A.减小O 的浓度会加快反应的速率
2
B.适当升高温度会加快反应的速率
C.使用合适的催化剂不改变反应的速率
D.反应足够长的时间,可以将反应物完全转化
14.某科研团队利用缺陷工程(贫氧环境焙烧)制备了含有大量氧缺陷和表面羟基的
,该 参与如图所示的 还原。下列说法正确的是
A. 为该过程的氧化剂
B.图中总反应可能为C.整个流程中含铁元素的物质中铁的化合价均相同
D.该催化合成时,溶液的pH越小越好
15.足量块状铁与100mL 0.01mol/L的稀硫酸反应,反应速率太慢。为了加快此反应
速率而不改变H 的产量,可以使用如下方法中的
2
①加NaC1溶液 ②加NaOH固体 ③加CHCOONa固体 ④升高温度 ⑤将块状铁改为
3
铁粉 ⑥将稀硫酸改用98%的浓硫酸 ⑦加少量 CuSO 溶液
4
A.①②③ B.③④⑥ C.④⑤⑦ D.④⑤⑥⑦
二、填空题
16..某温度下,在2L容器中,X(g)、Y(s)、Z(s)三种物质的量随时间变化的曲线如图
所示。由图中数据分析:
(1)反应开始至2min时,用X表示的平均反应速率为____mol/(L•min)。
(2)该反应的化学方程式为____。
(3)其他条件不变,改变下列两个条件反应速率如何变化(增大、不变或减小)
①升高温度____;
②加入Y____。
17.苯乙烯( )是生产各种塑料的重要单体,可通过乙苯催化脱氢制
得: +H(g)
2
(1)已知:
化学键 C-H C-C C=C H-H
键能/kJ/mol 412 348 612 436
计算上述反应生成1mol氢气的热效应___(填吸放多少kJ)
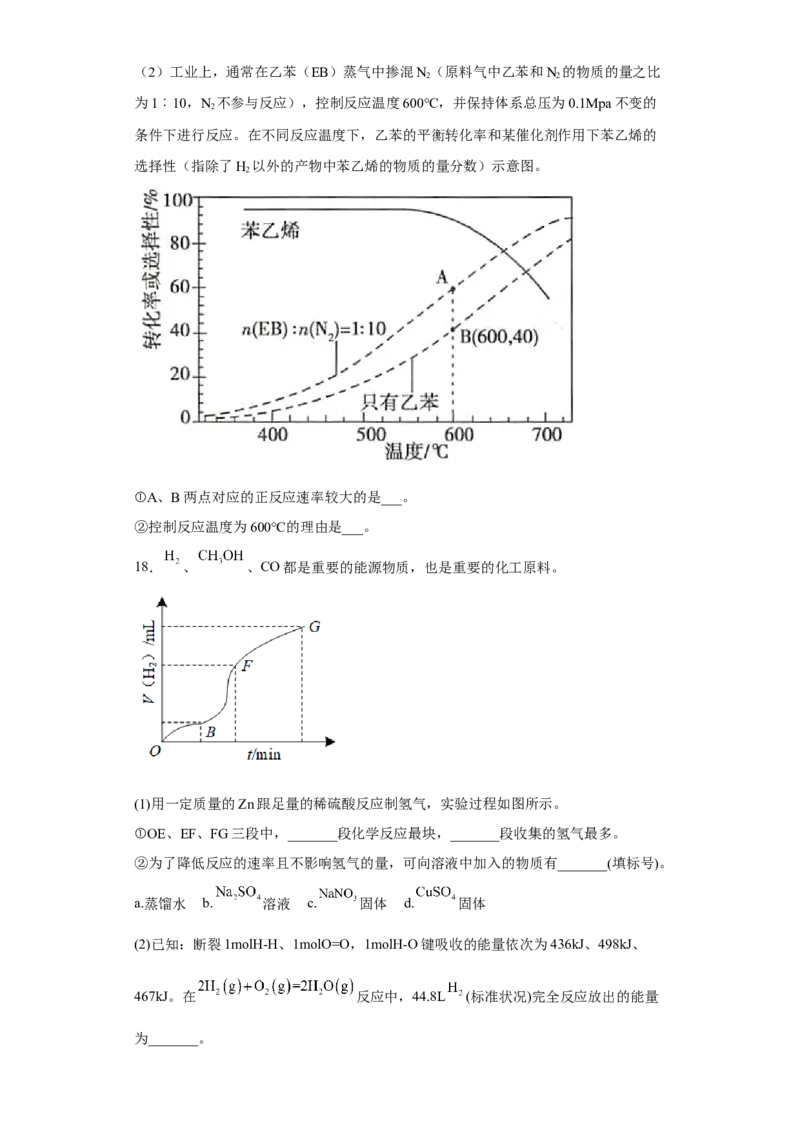
试卷第6页,共3页(2)工业上,通常在乙苯(EB)蒸气中掺混N(原料气中乙苯和N 的物质的量之比
2 2
为1︰10,N 不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的
2
条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的
选择性(指除了H 以外的产物中苯乙烯的物质的量分数)示意图。
2
①A、B两点对应的正反应速率较大的是___。
②控制反应温度为600℃的理由是___。
18. 、 、CO都是重要的能源物质,也是重要的化工原料。
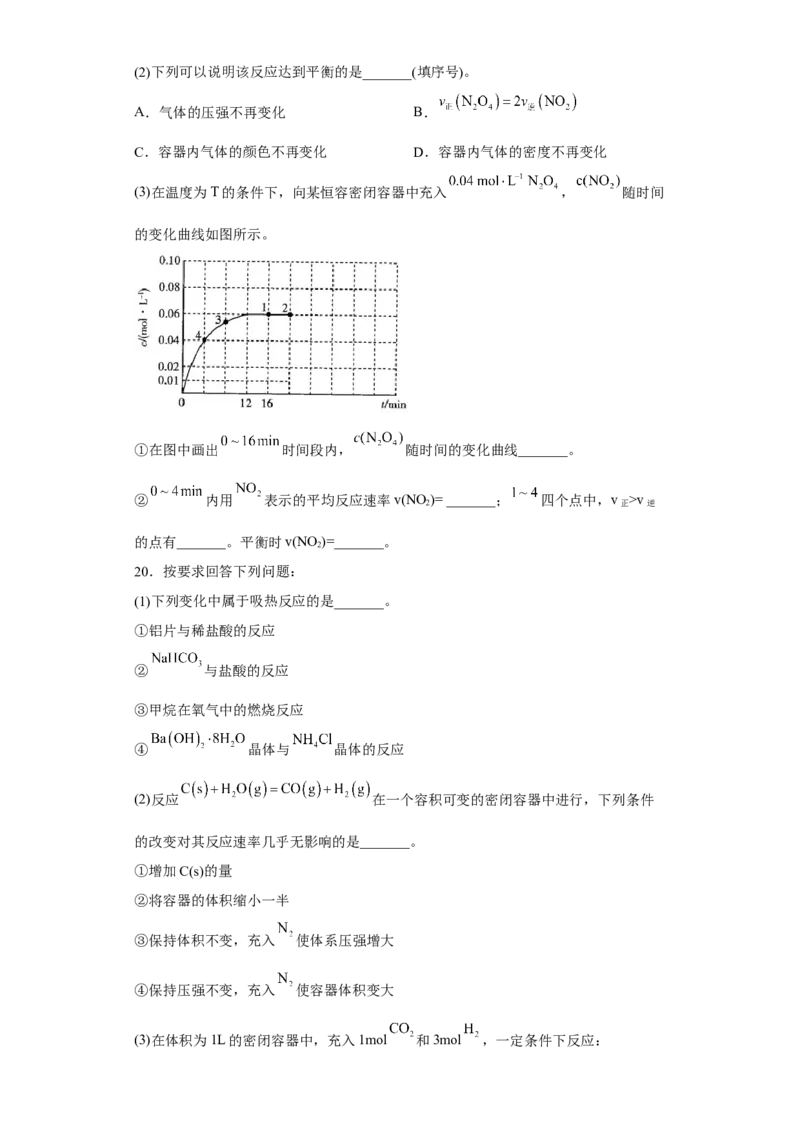
(1)用一定质量的Zn跟足量的稀硫酸反应制氢气,实验过程如图所示。
①OE、EF、FG三段中,_______段化学反应最块,_______段收集的氢气最多。
②为了降低反应的速率且不影响氢气的量,可向溶液中加入的物质有_______(填标号)。
a.蒸馏水 b. 溶液 c. 固体 d. 固体
(2)已知:断裂1molH-H、1molO=O,1molH-O键吸收的能量依次为436kJ、498kJ、
467kJ。在 反应中,44.8L (标准状况)完全反应放出的能量
为_______。(3)工业上可用CO和 为原料制备 ,反应方程式为:
。在体积固定的密闭容器中充入一定量的CO和 ,下
列叙述能说明反应达到平衡状态的是_______(填标号)。
A.CO与 的物质的量之比为1:1
B.混合气体的总压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1mol
D. 在混合气体中的质量分数保持不变
(4)为减少温室效应,有效利用 ,工业上可用 生产甲醇。在体积为2L的密闭
容器中充入1mol 和3mol ,一定条件下发生反应:
,测得CHOH和 的物质的量随时间变化
如下图所示。
①从反应开始到平衡, 的平均反应速率 _______。
②达到平衡时, 的浓度为_______ 。
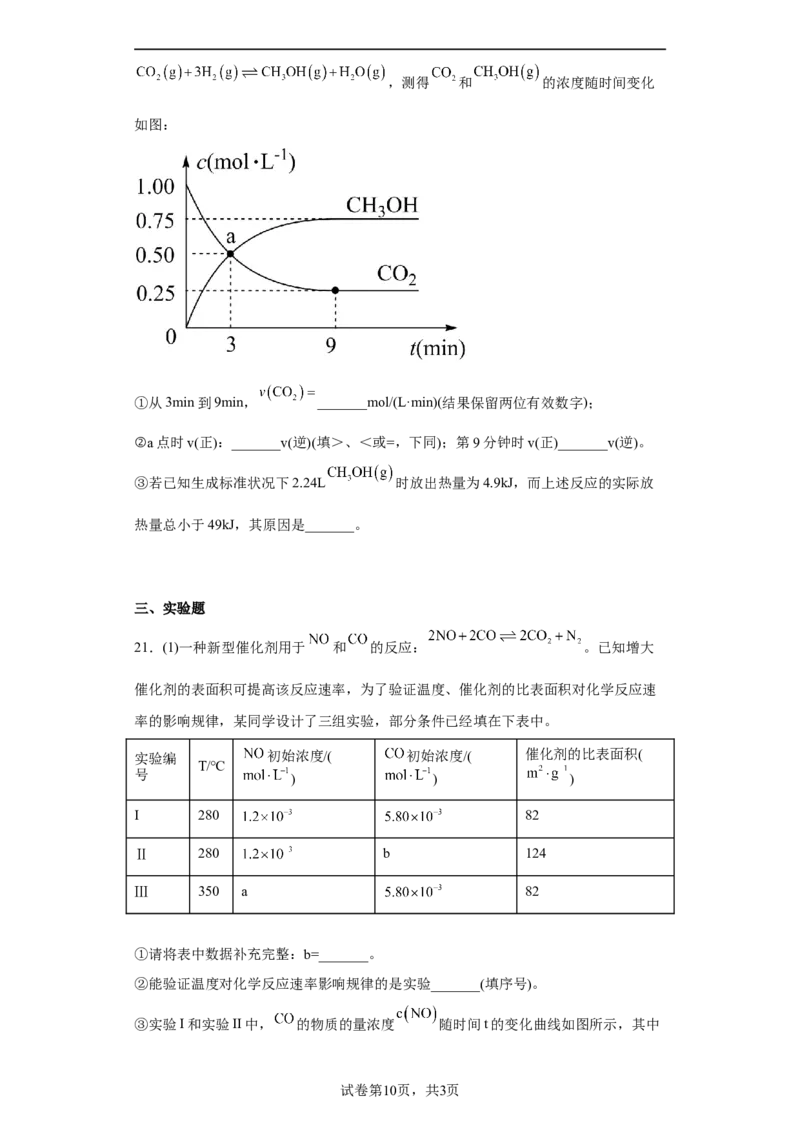
19.已知反应: 。将一定量 气体充入某恒容密闭容器中,控
制反应温度为T。
(1)该反应为吸热反应,则断开化学键所需要的总能量_______(填“大于”“小于”或
“等于”)形成化学键放出的总能量。
试卷第8页,共3页(2)下列可以说明该反应达到平衡的是_______(填序号)。
A.气体的压强不再变化 B.
C.容器内气体的颜色不再变化 D.容器内气体的密度不再变化
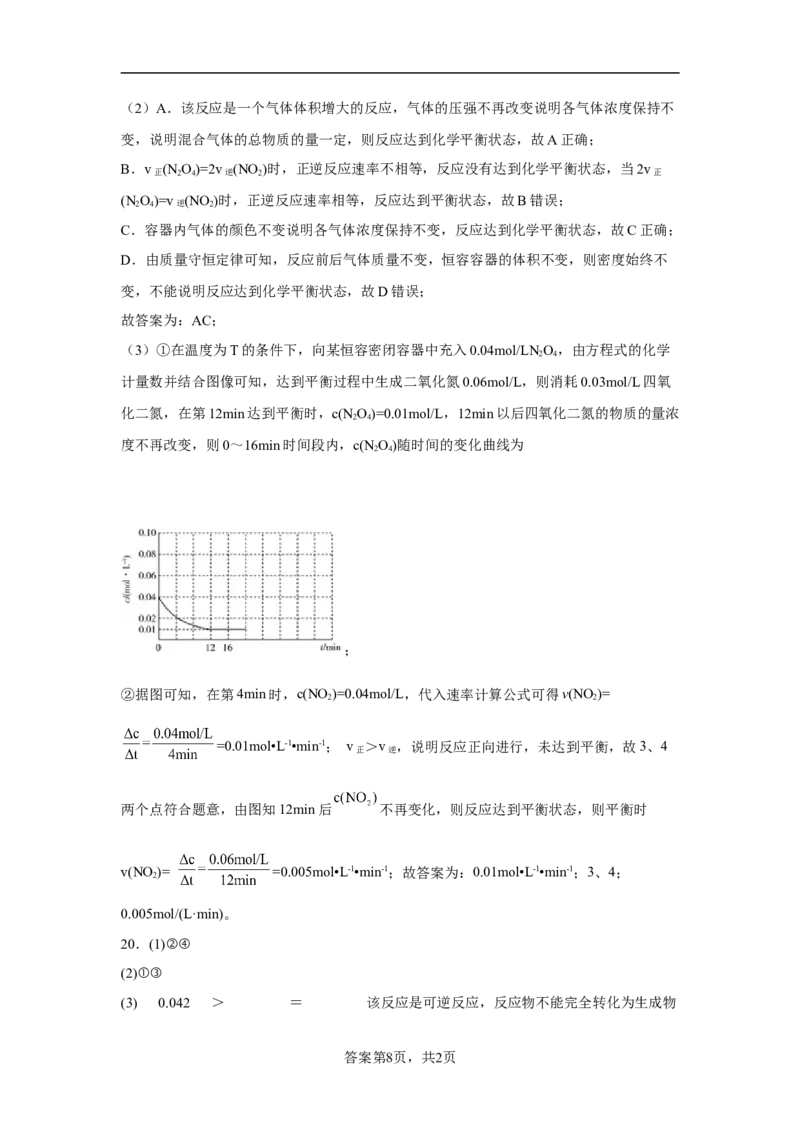
(3)在温度为T的条件下,向某恒容密闭容器中充入 , 随时间
的变化曲线如图所示。
①在图中画出 时间段内, 随时间的变化曲线_______。
② 内用 表示的平均反应速率v(NO )= _______; 四个点中,v >v
2 正 逆
的点有_______。平衡时v(NO )=_______。
2
20.按要求回答下列问题:
(1)下列变化中属于吸热反应的是_______。
①铝片与稀盐酸的反应
② 与盐酸的反应
③甲烷在氧气中的燃烧反应
④ 晶体与 晶体的反应
(2)反应 在一个容积可变的密闭容器中进行,下列条件
的改变对其反应速率几乎无影响的是_______。
①增加C(s)的量
②将容器的体积缩小一半
③保持体积不变,充入 使体系压强增大
④保持压强不变,充入 使容器体积变大
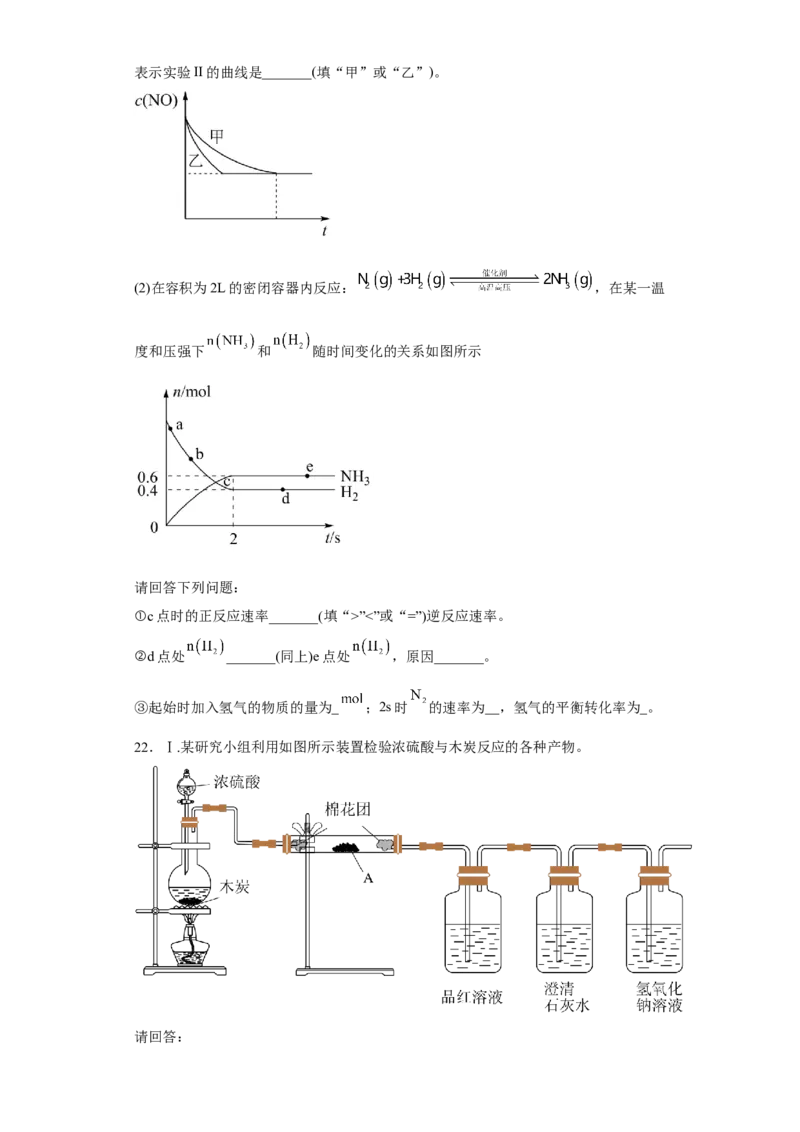
(3)在体积为1L的密闭容器中,充入1mol 和3mol ,一定条件下反应:,测得 和 的浓度随时间变化
如图:
①从3min到9min, _______mol/(L·min)(结果保留两位有效数字);
②a点时v(正):_______v(逆)(填>、<或=,下同);第9分钟时v(正)_______v(逆)。
③若已知生成标准状况下2.24L 时放出热量为4.9kJ,而上述反应的实际放
热量总小于49kJ,其原因是_______。
三、实验题
21.(1)一种新型催化剂用于 和 的反应: 。已知增大
催化剂的表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速
率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编 初始浓度/( 初始浓度/( 催化剂的比表面积(
T/℃
号
) ) )
I 280 82
Ⅱ 280 b 124
Ⅲ 350 a 82
①请将表中数据补充完整:b=_______。
②能验证温度对化学反应速率影响规律的是实验_______(填序号)。
③实验I和实验II中, 的物质的量浓度 随时间t的变化曲线如图所示,其中
试卷第10页,共3页表示实验II的曲线是_______(填“甲”或“乙”)。
(2)在容积为2L的密闭容器内反应: ,在某一温
度和压强下 和 随时间变化的关系如图所示
请回答下列问题:
①c点时的正反应速率_______(填“>”<”或“=”)逆反应速率。
②d点处 _______(同上)e点处 ,原因_______。
③起始时加入氢气的物质的量为_ ;2s时 的速率为__,氢气的平衡转化率为_。
22.Ⅰ.某研究小组利用如图所示装置检验浓硫酸与木炭反应的各种产物。
请回答:(1)浓硫酸与木炭反应的化学方程式是___________。
(2)试剂A是___________。
(3)品红溶液的作用是___________。
(4)澄清石灰水变浑浊,能否说明一定生成二氧化碳并说明理由:___________。
(5)氢氧化钠溶液的作用是___________。
Ⅱ.硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。
(6)下列对于反应2SO +O 2SO 的说法中,正确的是___________(填字母)。
2 2 3
A.只要选择适宜的条件,SO 和O 就能全部转化为SO
2 2 3
B.在工业合成SO 时,使用催化剂、加热均能加快化学反应速率
3
C.该反应达到平衡后,反应就完全停止了,即正、逆反应速率均为零
试卷第12页,共3页参考答案:
1.D
【详解】A.催化剂只加快反应速率,不影响平衡产率,A错误;
B.缩小容器容积增大单位体积内活化分子的数目,不能改变活化分子百分含量,B错误;
C.扩大容器容积会使平衡逆向移动,降低 的平衡产率,C错误;
D.缩小容器容积可增大反应物的浓度,可以加快反应速率,D正确;
故选D。
2.B
【详解】在1L的密闭容器中进行反应 , 2min内 的物质的
量由2mol减小到0.8mol,则用 的浓度变化表示的反应速率v(N )= =
2
=0.6mol/(L•min),v(N ):v(H )=1:3,所以v(H )=3×0.6mol/(L•min)=1.8mol/(L•min)。
2 2 2
答案选B。
3.B
【详解】不同物质表示的速率之比等于其化学计量数之比,故不同物质的速率与其化学计
量数比值越大,表示的反应速率越快。
A. ;
B. ;
C. , ;
D. ;
可知B反应速率最快,故答案选B。
4.B
【分析】比较反应速率时,应使用同一种物质,且注意单位的统一。
【详解】①v(N )=6.0mol•L-1•min-1,则v(H )= mol•L-1•s-1=0.3mol•L-1•s-1;
2 2
②v(H )=0.45mol•L-1•s-1;
2
③v(H)=0.3mol•L-1•s-1;
2④v(NH)=0.15mol•L-1•s-1,则v(H )= mol•L-1•s-1=0.225mol•L-1•s-1;
3 2
比较以上数据,可得出②>①=③>④,故选B。
5.A
【详解】A.反应中的生成物Z为固体,根据质量守恒定律可知,随反应的进行,气体的
总质量将减小,气体密度 随反应的进行而减小,因此当混合气体的密度不再改变时,
该反应达到平衡状态,故A项正确;
B.Z为固体,因此无法用Z表示化学反应速率,故B项错误;
C.由图可知,从 到 过程中,反应正向进行,根据方程式可知,随反应的进行,
容器内气体的总物质的量将减小,根据同温同容时,气体的压强之比等于气体的物质的量
之比可知,从 到 过程中,气体的压强将减小,故C项错误;
D.反应过程中 ,因此反应过程中X和Y的转化率之比为 =
=1:1,故D项错误;
综上所述,正确的是A项。
6.A
【详解】A. 时,反应未达平衡状态, ,根据速率之比等于计量数之比,
则 ,即有 ,故A正确;
B. 时,反应达平衡状态,处于动态平衡,反应并未停止,故B错误;
C.实际生产中考虑到设备、催化剂等因素,并不是温度越高越好,故C错误;
D.容器中充入氦气,虽然压强增大,但是各物质浓度不变,分压不变,反应速率不变,
故D错误;
故选A。
7.D
【详解】A.由图可知,物质①为催化剂,能降低改反应的能耗,A正确;
B.反应①→②过程涉及到C-H键极性键的断裂,③→④过程中涉及到C-O键极性键的形
成,B正确;
答案第2页,共2页C.物质①、②、③中Pt的成键数目分别为4、4、6,故反应过程中Pt的成键数目发生了
改变,C正确;
D.据图分析可知,③→④过程有HCl的消耗,且有HSO 生成,故该历程的总反应式为
2 4
CH+SO+H SO CHOSO H+SO +H O,D错误;
4 3 2 4 3 3 2 2
答案选D。
8.D
【分析】影响化学反应速率的内因是反应的活化能,活化能越大,化学反应越慢。
【详解】A.从能量曲线图看,反应①、反应②的反应物总能量都高于生成物总能量,即
均为放热反应,A项正确;
B.反应①有H 参与、反应②有I 生成,必然都有化合价变化,均为氧化还原反应,B项
2 2
正确;
C.能量曲线图表明,起始反应物“H(g)+2ICl(g)”比最终生成物“I(g)+2HCl(g)”能量高
2 2
218 kJ·mol-1,即 ΔH=-218 kJ·mol-1,C项正确;
D.图中,反应①的活化能比反应②的大,使反应①比反应②速率慢。活化能与断裂反应
物中化学键吸收能量有关,D项错误;
故选:D。
9.B
【详解】A. t min时反应未达到平衡状态,反应继续正向进行,N 的生成速率小于N 的
1 2 2
消耗速率,故A错误;
B. 催化剂可以加快反应速率,故使用催化剂可以缩短达到平衡所需的时间,故B正确;
C. 0~ t min内,Δc(H )=(6-3.6)mol=2.4mol,则Δc(NH )==1.6mol,则0~t min内,
2 2 3 2
v(NH )= ,故C错误;
3
D. 可逆反应不能进行到底,加入足量N,也不可以使H 完全转化为NH ,故D错误;
2 2 3
故选B。
10.C
【详解】A.由图象可知反应后能量升高,则反应物的总能量低于生成物的总能量,A错
误;B.催化剂只能降低反应的活化能,不能改变反应的反应热,B错误;
C.正反应的能量变化量为:正反应的活化能-逆反应的活化能,则+(E- E ) ,那
1 2
么逆反应的能量变化量与正反应符号相反,大小一致,故逆反应的能量变化量为:-(E - E )
1 2
= (E - E ) ,C正确;
2 1
D.由图象可知正反应过程是能量升高的过程,故正反应是吸热反应,那么逆反应为放热
反应,D错误;
故本题选C。
11.D
【详解】A.根据速率之比等于计量系数之比得到化学反应速率关系是:
,故A错误;
B.若单位时间内生成xmol NO,正向反应,同时消耗xmol NH ,正向反应,同一个方向,
3
不能说明反应达到平衡状态,故B错误;
C.达到化学平衡时,若增大容器体积,浓度减小,则正反应速率减小,逆反应速率减小,
故C错误;
D.达到化学平衡时,速率之比等于计量之比, ,故D正确。
综上所述,答案为D。
12.C
【详解】A.浓度越大,化学反应速率越快,增加CO物质的量,加快了反应速率,故A
不选;
B.保持压强不变,充入氮气,容器体积变大,氮气不参与反应,反应体系中的各物质的
浓度减小,则反应速率减小,故B不选;
C.保持体积不变,充入氮气,氮气不参与反应,反应体系中的各物质的浓度不变,则反
应速率不变,故C选;
D.将容器的体积缩小一半,反应体系中物质的浓度增大,则化学反应速率增大,故D不
选;
故选C。
13.B
答案第4页,共2页【详解】A.减小O 的浓度,反应物浓度减小,则反应的速率减慢,故A错误;
2
B.适当升高温度会加快反应的速率,一般来说每升高10℃,反应速率加快2~4倍,故B
正确;
C.使用合适的催化剂,降低反应所需活化能,能加快反应的速率,故C错误;
D.该反应是可逆反应,反应足够长的时间,反应物不可能完全转化,故D错误。
综上所述,答案为B。
14.B
【详解】A.由图可知,先加入了 后又生成了 , 为该过程的催
化剂,A项错误;
B.由图可知,该反应过程是NH 和NO、O 反应生成N 和HO,方程式为:
3 2 2 2
,故B正确;
C.整个流程中发生了氧化还原反应,铁的化合价发生了变化,C项错误;
D. 会与 发生反应,溶液的pH越小, D项错误;
故选B。
15.C
【详解】影响反应速率的因素有:温度、浓度、催化剂、原电池、接触面积等。足量块状
铁稀硫酸反应,向溶液中加入NaC1溶液,会将稀硫酸稀释,降低反应速率,①错误;加
固体,与硫酸反应消耗硫酸,使反应速率减小,②错误;加CHCOONa固体,消
3
耗硫酸,使反应速率减慢,③错误;升高温度,可以加快反应速率,④正确;将块状铁转
化为铁粉,增大接触面,⑤正确;适当增大硫酸的浓度但又不能使用浓硫酸,会产生钝化
现象,⑥错误;加少量 CuSO 溶液铁能置换出Cu,形成原电池,⑦正确;故正确的有:
4
④⑤⑦,选C。
16.(1)0.075
(2)3X+Y=2Z
(3) 增大 不变
【详解】(1)由图可知,反应开始至2min时,用X表示的平均反应速率为
=0.075mol/(L•min)。(2)参加反应的X、Y、Z 的物质的量分别为1.0mol-0.7mol=0.3mol、
1.0mol-0.9mol=0.1mol、0.2mol,则反应方程式为:3X(g)+Y(s)=2Z(s);
(3)①升高温度,活化分子比率增加,反应速率加快;
②加入Y,Y为固体,浓度可以看做常数,不影响反应速率。
17. 吸124kJ B 600℃时,乙苯的转化率和苯乙烯的选择性均较高。温度过
低,反应速率慢,转化率低;温度过高,选择性下降。高温还可能使催化剂失活,且能耗
更高
【分析】利用反应物的键能总和减去生成物的键能总和的值计算反应的反应热;利用A、
B两点压强和温度相同体积不同的特征判断A、B两点的速率大小;根据600℃时反应的转
化率和选择性均较高这一特性分析。
【详解】(1)反应的热效应可以利用键能大小计算,利用反应物的键能总和减去生成物的键
能总和即可得到反应的热效应,当计算结果为正值时为吸热反应,反之则为放热反应;在
本反应中由于苯基在反应前后不变,因此苯基的能量在反应前后相同,只需要计算乙基变
成乙烯基的能量变化差值即可,即反应的热效应=(348+412×5)kJ/mol-(612+412×3+436)kJ/
mol=124kJ/mol,故反应生成1mol氢气的热效应为吸收124kJ的能量;
(2)①根据图象可知,A、B两点的温度和压强都相等,但B点乙苯的浓度大于A点,反应
浓度越大,反应速率越快,正反应速率B点大于A点;
②有图可知,600℃时,乙苯的转化率和苯乙烯的选择性均较高,该反应为吸热反应,温度
过低,反应速率较慢,乙苯的平衡转化率低,若温度过高,苯乙烯的转化率下降,高温可
能使催化剂的活性降低,且耗能大,所以控制温度在600℃。
18.(1) EF EF ab
(2)498kJ
(3)BD
(4) 0.0375 0.375
【解析】(1)①OE、EF、FG三段中,从图中曲线的斜率可看出,EF段化学反应最块,
三段中EF段的纵坐标升高最大,EF段收集的氢气最多;②a.蒸馏水,稀释氢离子浓度,
反应速率下降,且总量不变,符合题意; b. 溶液,稀释氢离子浓度,反应速率下
降,且总量不变,符合题意;c. 固体,溶液生成HNO,反应得到NO,H 的量减少,
3 2
答案第6页,共2页不符合题意;d. 固体,得到Cu2+先与Zn反应,Zn的量减少,氢气总量下降,不符
合题意;故选ab。
(2)依题意,44.8L (标准状况)物质的量为2mol,完全反应放出的能量为形成生成物放
出总能量减去断裂反应物吸收总能量,即467kJ×2×2-436kJ×2-498kJ=498kJ。
(3)A. CO与 的物质的量之比为1:1,不能说明其量保持不变,故不能说明反应
达到平衡状态,A不符合题意;B. 该反应气体分子说发生改变,容器体积固定,故混合气
体的总压强不随时间的变化而变化,说明反应达到平衡状态,B符合题意;C. 单位时间内
每消耗1molCO,同时生成1mol ,二者均是指正反应速率,不能说明正逆反应速率
相等,故不能说明反应达到平衡状态,C不符合题意;D. 是生成物,其在混合气
体中的质量分数保持不变,说明反应达到平衡状态,D符合题意;故选BD。
(4)①从反应开始到平衡, 的改变量是1.00-0.25=0.75(mol),用时10min,容器体积
为2L,故平均反应速率 =0.0375mol·L-1·min-1;②达到平衡时,CO 减
2
少了0.75mol,则 减少了0.75×3=2.25(mol),则平衡时H 的物质的量为3-
2
2.25=0.75(mol),其浓度为 =0.375mol/L。
19.(1)大于
(2)AC
(3) 3、4 0.005mol/(L·min)
【详解】(1)断开化学键吸收能量,形成化学键放出能量,该反应为吸热反应,说明断开
化学键吸收的能量大于形成化学键放出的能量,故答案为:大于;(2)A.该反应是一个气体体积增大的反应,气体的压强不再改变说明各气体浓度保持不
变,说明混合气体的总物质的量一定,则反应达到化学平衡状态,故A正确;
B.v (N O)=2v (NO )时,正逆反应速率不相等,反应没有达到化学平衡状态,当2v
正 2 4 逆 2 正
(N O)=v (NO )时,正逆反应速率相等,反应达到平衡状态,故B错误;
2 4 逆 2
C.容器内气体的颜色不变说明各气体浓度保持不变,反应达到化学平衡状态,故C正确;
D.由质量守恒定律可知,反应前后气体质量不变,恒容容器的体积不变,则密度始终不
变,不能说明反应达到化学平衡状态,故D错误;
故答案为:AC;
(3)①在温度为T的条件下,向某恒容密闭容器中充入0.04mol/LN O,由方程式的化学
2 4
计量数并结合图像可知,达到平衡过程中生成二氧化氮0.06mol/L,则消耗0.03mol/L四氧
化二氮,在第12min达到平衡时,c(NO)=0.01mol/L,12min以后四氧化二氮的物质的量浓
2 4
度不再改变,则0~16min时间段内,c(NO)随时间的变化曲线为
2 4
;
②据图可知,在第4min时,c(NO )=0.04mol/L,代入速率计算公式可得v(NO )=
2 2
=0.01mol•L-1•min-1; v >v ,说明反应正向进行,未达到平衡,故3、4
正 逆
两个点符合题意,由图知12min后 不再变化,则反应达到平衡状态,则平衡时
v(NO )= =0.005mol•L-1•min-1;故答案为:0.01mol•L-1•min-1;3、4;
2
0.005mol/(L·min)。
20.(1)②④
(2)①③
(3) 0.042 > = 该反应是可逆反应,反应物不能完全转化为生成物
答案第8页,共2页【解析】(1)
①铝片与稀盐酸的反应、③甲烷在氧气中的燃烧反应均是放热反应,②NaHCO 与盐酸的
3
反应、④ 晶体与 晶体的反应属于吸热反应,答案选②④;
(2)
①碳是固体,增加C(s)的量不影响反应速率;
②将容器的体积缩小一半,压强增大,反应速率加快;
③保持体积不变,充入 使体系压强增大,但浓度不变,反应速率不变;
④保持压强不变,充入 使容器体积变大,浓度减小,反应速率减小;
答案选①③;
(3)
①从3min到9min内二氧化碳浓度减少0.5mol/L-0.25mol/L=0.25mol/L,
0.25mol/L÷6min≈0.042mol/(L·min);
②a点时反应没有达到平衡状态,反应正向进行,则v(正)>v(逆);第9分钟时反应达到平
衡状态,则v(正)=v(逆)。
③由于该反应是可逆反应,反应物不能完全转化为生成物,因此上述反应的实际放热量总
小于49kJ。
21. I、Ⅲ 乙 > = d、e点时,
反应达到平衡状态,H 的物质的量不变 1.3
2
【分析】该实验是为了验证温度、催化剂的比表面积对化学反应速率的影响规律,通过对
比实验I、Ⅱ可知,实验I、II是为了验证催化剂的比表面积对化学反应速率的影响规律,
则 ;通过对比实验I、Ⅲ可知,实验I、Ⅲ是为了验证温度对化学反应速率的影
响规律,则 。
【详解】(1)①由分析可知, ;②由分析可知,实验I、Ⅲ是为了验证温度对化学反应速率的影响规律;
③由题中信息可知,增大催化剂的表面积可提高该反应速率,由图可知,曲线乙的反应速
率大于曲线甲,故曲线乙所对应的催化剂的比表面积较大,则其中表示实验II的曲线是乙;
(2)①由图可知,c点后,NH 的物质的量增加,H 的物质的量减小,平衡向正反应方向进
3 2
行,则c点时的正反应速率>逆反应速率;
②d点时,H 的物质的量不变,e点时,NH 的物质的量不变,说明d、e点时,反应达到平
2 3
衡状态,则d点处 =e点处 ;
③由图可知,达平衡时,生成0.6mol NH ,则反应消耗的H 的物质的量为0.9mol,平衡时,
3 2
H 的物质的量为0.4mol,则起始时加入氢气的物质的量为0.9mol+0.4mol=1.3mol;2s时,
2
生成0.6mol NH ,消耗 的物质的量为0.3mol,则2s时 的速率为
3
;反应消耗的H 的物质的量为0.9mol,起始时加入氢气的物质的
2
量为1.3mol,则氢气的平衡转化率为 。
22. C+2H SO (浓) CO↑+2SO↑+2H O 无水CuSO 检验SO 不能;
2 4 2 2 2 4 2
SO 也能使澄清石灰水变浑浊 吸收尾气中的二氧化硫,防止污染空气 B
2
【详解】(1)浓硫酸具有强氧化性,木炭具有还原性,二者在加热的条件下反应生成CO、
2
SO 、HO,反应方程式为C+2H SO (浓) CO↑+2SO↑+2H O。
2 2 2 4 2 2 2
(2)由于检验二氧化碳或二氧化硫时要通入溶液中,会带出水蒸气,所以首先检验水,即试
剂A是无水CuSO 。
4
(3)二氧化硫具有漂白性,能够使品红溶液褪色,因此品红溶液的作用是检验SO 。
2
(4)品红溶液能检验二氧化硫,但不能除去二氧化硫,即气体中含二氧化碳和二氧化硫时,
二氧化硫也能使澄清石灰水变浑浊,所以澄清石灰水变浑浊,不能说明生成二氧化碳。
(5) 二氧化硫有毒,会污染空气,所以要进行尾气处理,二氧化硫是酸性气体,可以用碱
溶液吸收。
答案第10页,共2页(6)A.2SO +O 2SO 为可逆反应,因此SO 和O 不可能全部转化为SO ,故A错误;
2 2 3 2 2 3
B.在工业合成SO 时,使用催化剂能够降低反应活化能而使反应速率加快、加热能够加快
3
活化分子的碰撞频率使反应速率加快,故B正确;
C.该反应达到平衡后,反应并未停止,此时正逆反应速率相等,达到“动态平衡”,故C
错误;
综上所述,说法正确的是B项,故答案为B。答案第12页,共2页