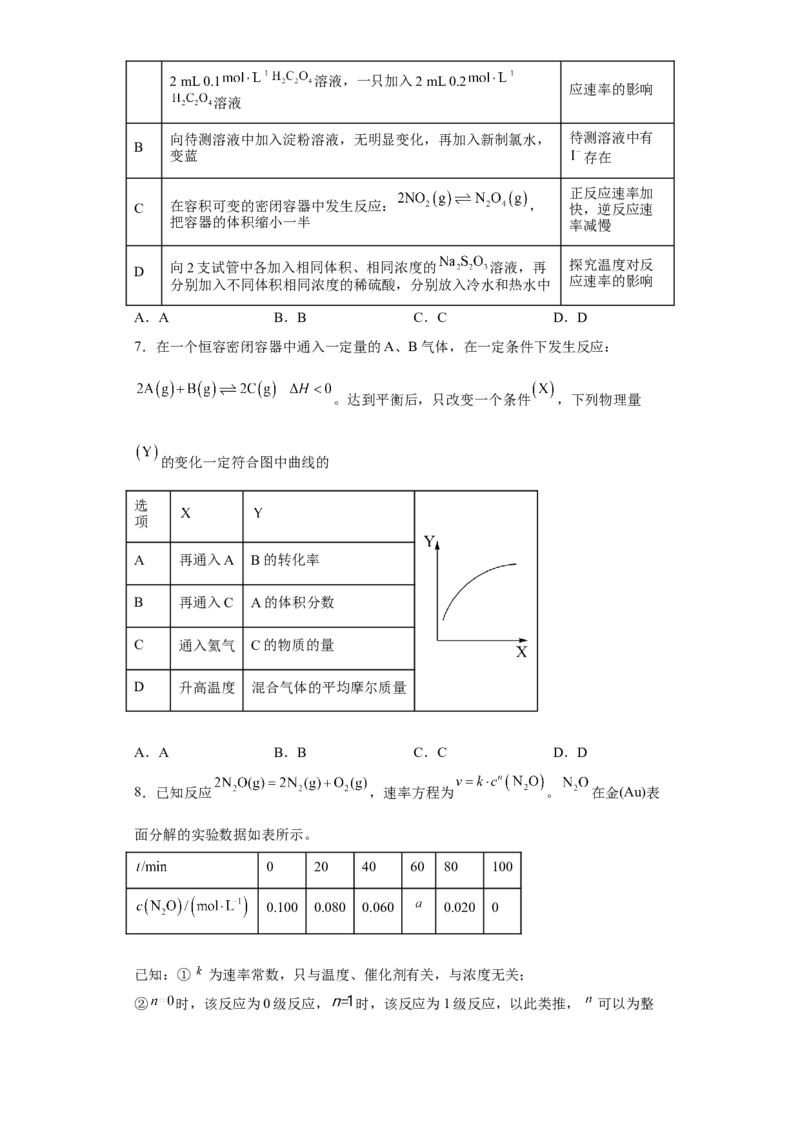文档内容
第六章第二节化学反应的速率与限度小题训练--人教版
(2019)必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.催化剂催化水煤气变换反应:CO(g)+HO(g) CO(g)+H(g) H<0,过程示意
2 2 2
△
图如图所示,下列说法错误的是
A.过程I、过程II中都有水参与反应
B.该反应反应物总能量高于生成物总能量
C.使用催化剂不能改变水煤气变换反应的 H
D.催化过程中既有极性键的断裂和形成,△也有非极性键的断裂和形成
2.一定温度下,在某密闭容器中发生反应: ,若15s
内 由0.1 降到0.07 ,则下列说法正确的是
A.减小反应体系的体积,化学反应速率增大
B.升高温度正反应速率增大,逆反应速率减小
C.0~15s内用 表示的平均反应速率为
D. 由0.07 降到0.05 所需的反应时间小于10s
3.化学反应速率和限度与生产、生活密切相关,这是化学学科关注的方面之一、某学
生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用
排水法收集反应放出的氢气,为控制反应速率防止反应过快难以测量氢气体积。他事
先在盐酸中加入等体积的下列物质以减慢反应速率但不影响生成氢气的量。你认为可
行的是
①KCl溶液②浓盐酸③蒸馏水④CuSO 溶液⑤KNO 固体⑥CHCOONa固体
4 3 3
A.①③⑥ B.①⑤⑥ C.①③⑤⑥ D.②④
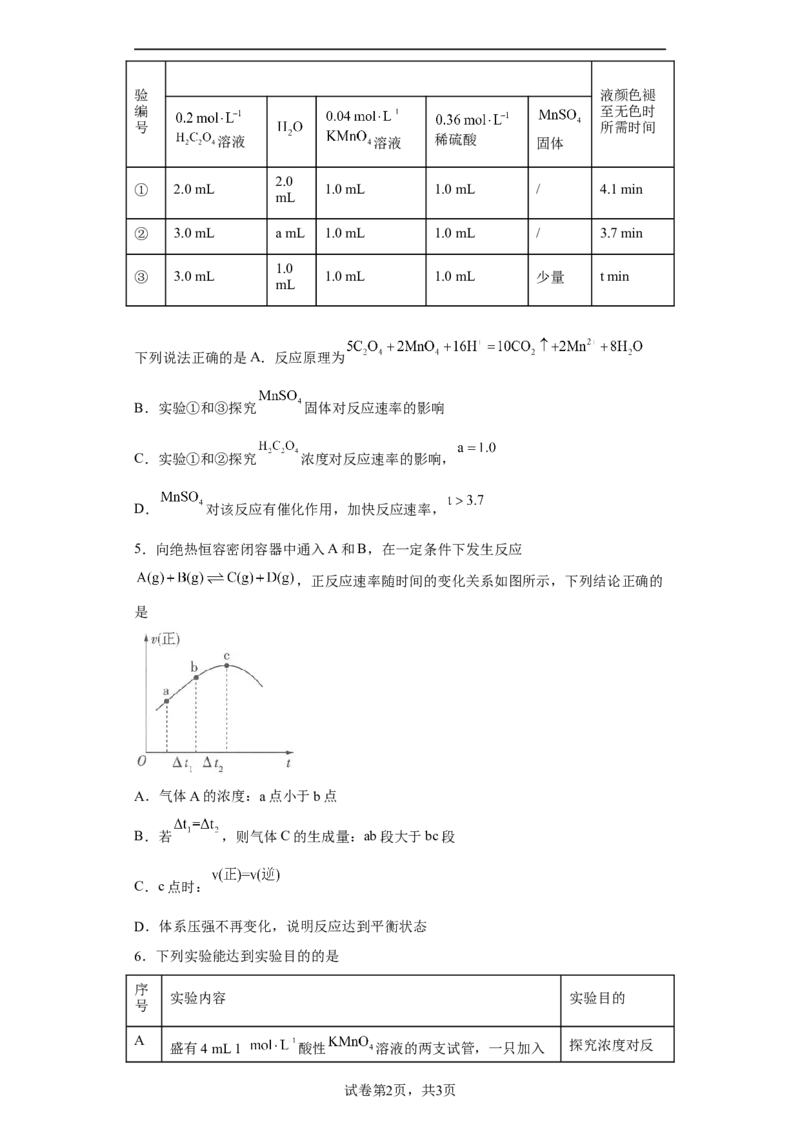
4.某小组为了研究外界条件对化学反应速率的影响,设计实验方案如下。
实 室温下,试管中所加试剂及其用量 室温下溶验 液颜色褪
编 至无色时
号 所需时间
溶液 溶液 稀硫酸 固体
2.0
① 2.0 mL 1.0 mL 1.0 mL / 4.1 min
mL
② 3.0 mL a mL 1.0 mL 1.0 mL / 3.7 min
1.0
③ 3.0 mL 1.0 mL 1.0 mL 少量 t min
mL
下列说法正确的是A.反应原理为
B.实验①和③探究 固体对反应速率的影响
C.实验①和②探究 浓度对反应速率的影响,
D. 对该反应有催化作用,加快反应速率,
5.向绝热恒容密闭容器中通入A和B,在一定条件下发生反应
,正反应速率随时间的变化关系如图所示,下列结论正确的
是
A.气体A的浓度:a点小于b点
B.若 ,则气体C的生成量:ab段大于bc段
C.c点时:
D.体系压强不再变化,说明反应达到平衡状态
6.下列实验能达到实验目的的是
序
实验内容 实验目的
号
A
盛有4 mL 1 酸性 溶液的两支试管,一只加入 探究浓度对反
试卷第2页,共3页2 mL 0.1 溶液,一只加入2 mL 0.2
应速率的影响
溶液
向待测溶液中加入淀粉溶液,无明显变化,再加入新制氯水, 待测溶液中有
B
变蓝 存在
正反应速率加
C 在容积可变的密闭容器中发生反应: , 快,逆反应速
把容器的体积缩小一半 率减慢
D
向2支试管中各加入相同体积、相同浓度的 溶液,再 探究温度对反
应速率的影响
分别加入不同体积相同浓度的稀硫酸,分别放入冷水和热水中
A.A B.B C.C D.D
7.在一个恒容密闭容器中通入一定量的A、B气体,在一定条件下发生反应:
。达到平衡后,只改变一个条件 ,下列物理量
的变化一定符合图中曲线的
选
项
A 再通入A B的转化率
B 再通入C A的体积分数
C 通入氦气 C的物质的量
D 升高温度 混合气体的平均摩尔质量
A.A B.B C.C D.D
8.已知反应 ,速率方程为 。 在金(Au)表
面分解的实验数据如表所示。
0 20 40 60 80 100
0.100 0.080 0.060 0.020 0
已知:① 为速率常数,只与温度、催化剂有关,与浓度无关;
② 时,该反应为0级反应, 时,该反应为1级反应,以此类推, 可以为整数,也可以为分数;③浓度消耗一半所用的时间叫半衰期( )。
下列说法正确的是A.表格中
B.该反应为2级反应
C.保持其他条件不变,若起始浓度为 ,则半衰期为100min
D.该反应的速率常数
9.N 为阿伏加德罗常数的值。下列说法正确的是
A
A.1mol铁单质与足量的硫单质充分反应,转移电子的数目为3N
A
B.标准状况下,22.4LSO 与足量的O 反应,生成的SO 分子数为N
2 2 3 A
C.常温下,将5.4g铝片投入足量的浓硫酸中,铝失去的电子数为0.3N
A
D.0.1molFeI 与0.1molCl 反应时,转移电子的数目为0.2N
2 2 A
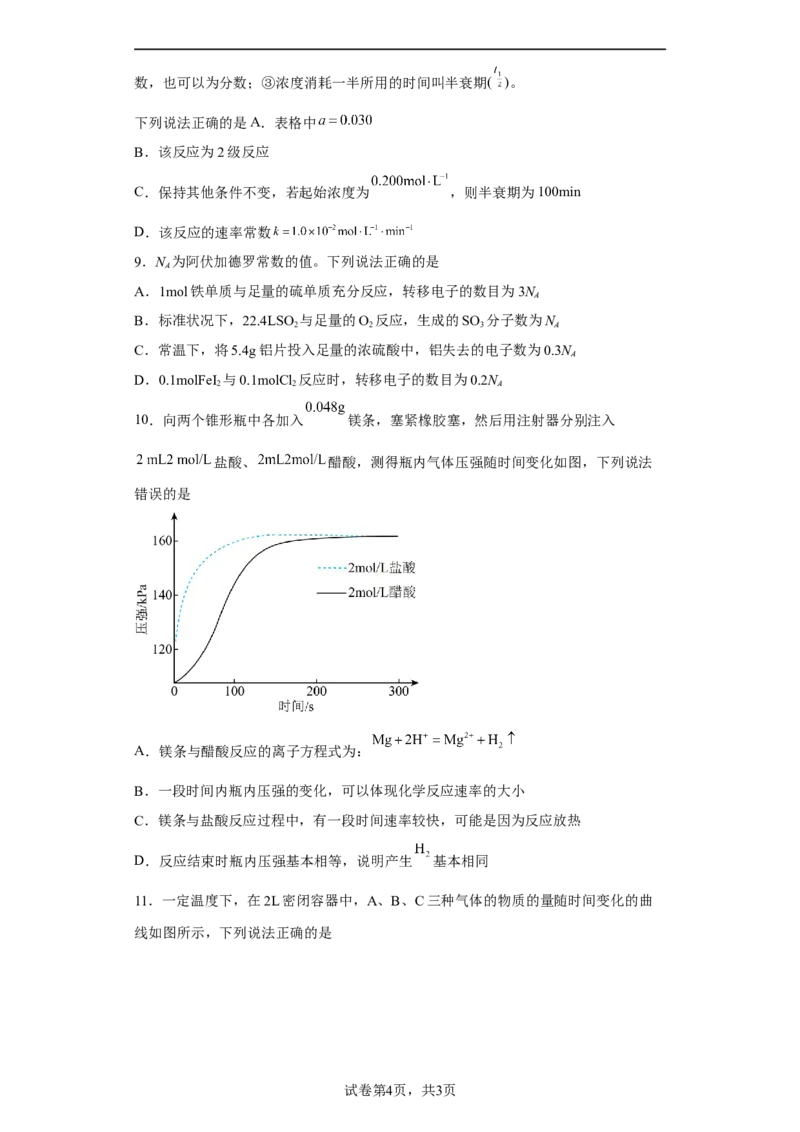
10.向两个锥形瓶中各加入 镁条,塞紧橡胶塞,然后用注射器分别注入
盐酸、 醋酸,测得瓶内气体压强随时间变化如图,下列说法
错误的是
A.镁条与醋酸反应的离子方程式为:
B.一段时间内瓶内压强的变化,可以体现化学反应速率的大小
C.镁条与盐酸反应过程中,有一段时间速率较快,可能是因为反应放热
D.反应结束时瓶内压强基本相等,说明产生 基本相同
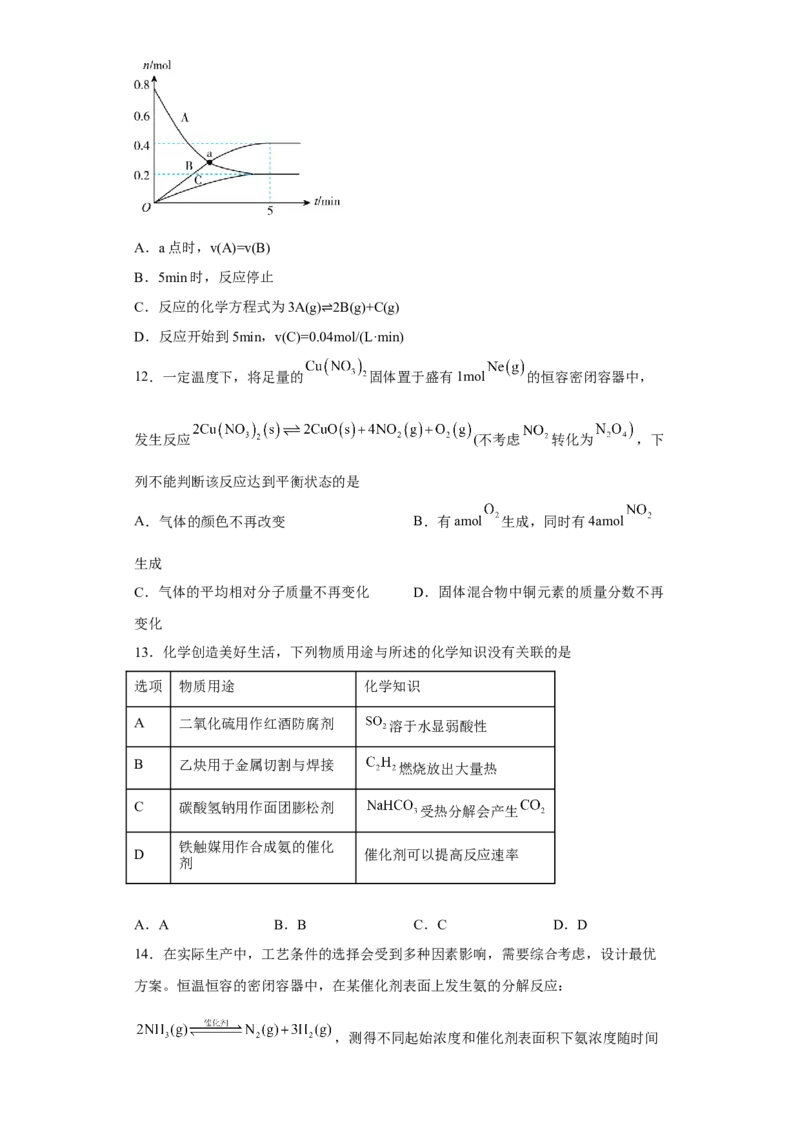
11.一定温度下,在2L密闭容器中,A、B、C三种气体的物质的量随时间变化的曲
线如图所示,下列说法正确的是
试卷第4页,共3页A.a点时,v(A)=v(B)
B.5min时,反应停止
C.反应的化学方程式为3A(g) 2B(g)+C(g)
D.反应开始到5min,v(C)=0.0⇌4mol/(L·min)
12.一定温度下,将足量的 固体置于盛有1mol 的恒容密闭容器中,
发生反应 (不考虑 转化为 ,下
列不能判断该反应达到平衡状态的是
A.气体的颜色不再改变 B.有amol 生成,同时有4amol
生成
C.气体的平均相对分子质量不再变化 D.固体混合物中铜元素的质量分数不再
变化
13.化学创造美好生活,下列物质用途与所述的化学知识没有关联的是
选项 物质用途 化学知识
A 二氧化硫用作红酒防腐剂 溶于水显弱酸性
B 乙炔用于金属切割与焊接 燃烧放出大量热
C 碳酸氢钠用作面团膨松剂 受热分解会产生
铁触媒用作合成氨的催化
D 催化剂可以提高反应速率
剂
A.A B.B C.C D.D
14.在实际生产中,工艺条件的选择会受到多种因素影响,需要综合考虑,设计最优
方案。恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:
,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化如下表所示,下列有关说法错误的是
时间/min
编号 0 20 40 60 80
表面积
① a 2.40 2.00 1.60 1.20 0.80
② a 1.20 0.80 0.40 x
③ 2a 2.40 1.60 0.80 0.40 0.40
A.实验①,0~20min,
B.实验③,60min时处于平衡状态,此时容器中,压强与初始压强的比为11:6
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
15.在金催化剂表面上进行某反应历程如图所示,其中吸附在金催化剂表面上的物种
用•标注。下列说法正确的是
A.该历程中最大能垒(活化能)步骤的反应式为HO•=H•+OH•
2
B.该反应的热效应ΔH>0
C.反应过程中发生非极性键的断裂与生成
D.其他条件不变,使用另一高效催化剂可使CO的平衡转化率增大
二、填空题
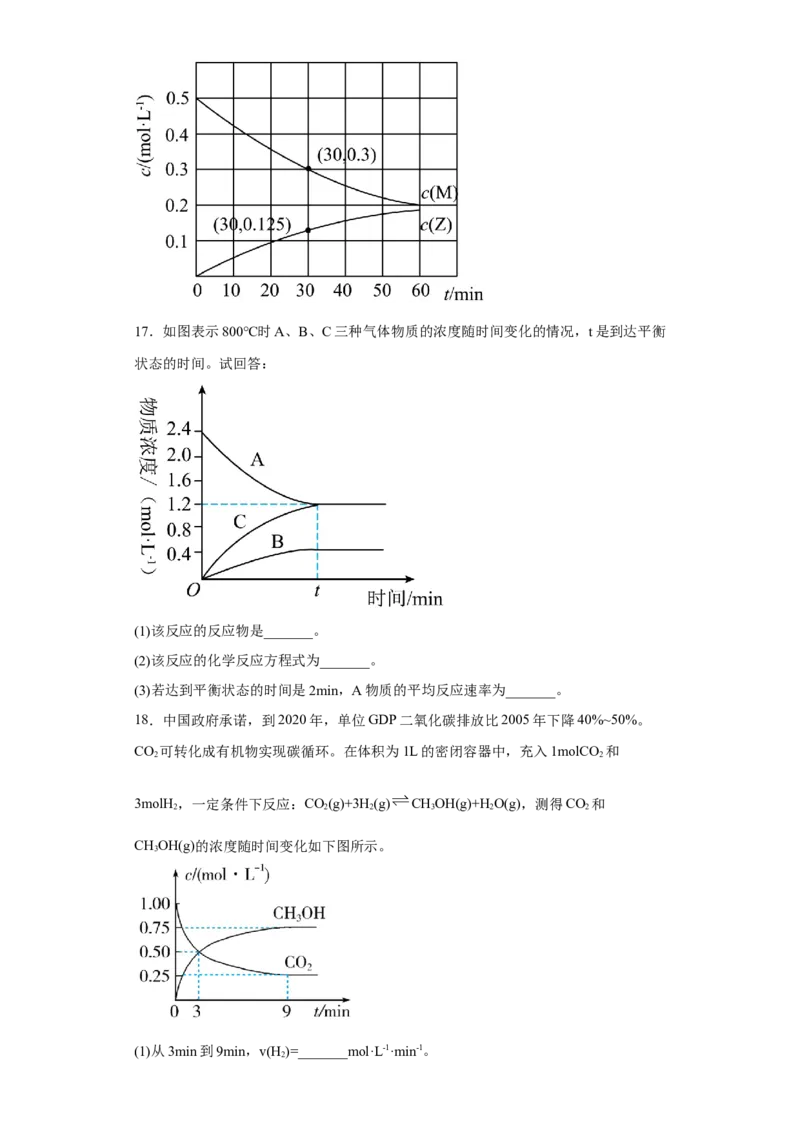
16.室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:
①M+N=X+Y;②M+N=X+Z。反应体系中组分M、Z的浓度随时间变化情况如图所示。
则0~30min时间段内,Y的平均反应速率为6.67×10-3mol•L-1•min-1。(_____)
试卷第6页,共3页17.如图表示800℃时A、B、C三种气体物质的浓度随时间变化的情况,t是到达平衡
状态的时间。试回答:
(1)该反应的反应物是_______。
(2)该反应的化学反应方程式为_______。
(3)若达到平衡状态的时间是2min,A物质的平均反应速率为_______。
18.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
CO 可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1molCO 和
2 2
3molH ,一定条件下反应:CO(g)+3H(g) CHOH(g)+H O(g),测得CO 和
2 2 2 3 2 2
CHOH(g)的浓度随时间变化如下图所示。
3
(1)从3min到9min,v(H )=_______mol·L-1·min-1。
2(2)能说明上述反应达到平衡状态的是_______(填编号)。
A.反应中CO 与CHOH的物质的量浓度之比为1∶1(即图中交叉点)
2 3
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3molH ,同时生成1molH O
2 2
D.CO 的体积分数在混合气体中保持不变
2
(3)平衡时CO 的转化率为_______。
2
(4)平衡时混合气体中CHOH(g)的体积分数是_______。
3
(5)一定温度下,第9分钟时v逆(CHOH)_______(填“大于”、“小于”或“等于”)
3
第3分钟时v正(CHOH)。
3
(6)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:银电极
上发生_______反应(“氧化”或“还原”),电极反应式为_______,该原电池的总反应
离子方程式为_______。
19.t℃时,将2molSO 和1molO 通入体积为2L的恒温恒容密闭容器中,发生反应:
1 2 2
2SO (g)+O(g) 2SO (g),2min时反应达到化学平衡,此时测得反应物O 还剩余
2 2 3 2
0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO 的平均反应速率为______;平衡时SO 转化率
3 2
为______。
(2)下列叙述能证明该反应已达到化学平衡状态的是_____(填标号)。
A.容器内压强不再发生变化
B.SO 的体积分数不再发生变化
2
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO 的同时消耗nmolO
2 2
E.相同时间内消耗2nmolSO 的同时生成nmolO
2 2
(3)t ℃时,若将物质的量之比n(SO )∶n(O )=1∶1的混合气体通入一个恒温恒压的密闭容
2 2 2
器中,反应达到平衡时,混合气体体积减少了20%。SO 的转化率为_____。
2
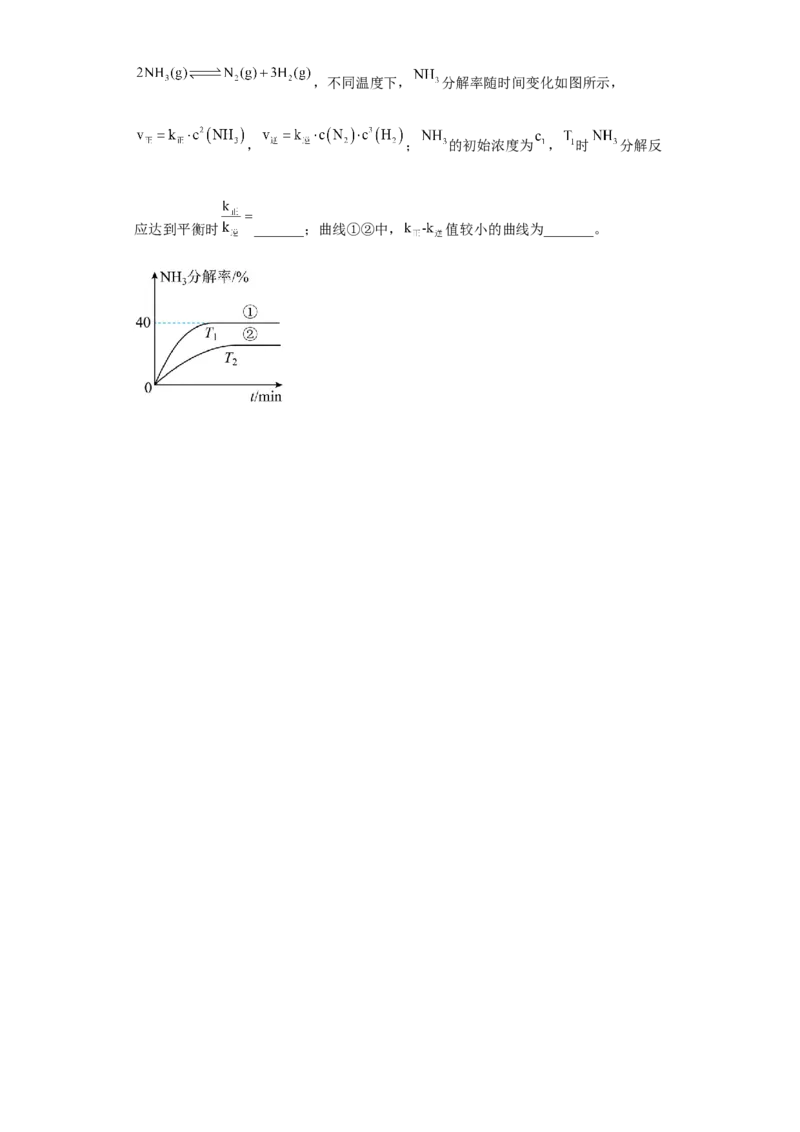
20.恒容密闭容器中,在 作催化剂条件下, 分解反应如下:
试卷第8页,共3页,不同温度下, 分解率随时间变化如图所示,
, ; 的初始浓度为 , 时 分解反
应达到平衡时 _______;曲线①②中, 值较小的曲线为_______。参考答案:
1.D
【详解】A.根据反应过程示意图,过程Ⅰ、过程Ⅱ中都有水分子中 键的断裂,故A
正确;
B.据题给热化学方程式可知该反应为放热反应,故该反应反应物总能量高于生成物总能
量,故B正确;
C.催化剂能改变反应的活化能,但不能改变反应的 ,故C正确;
D.该催化过程中有极性键 键的断裂,极性键 键、非极性键 键的形成,
没有非极性键的断裂,故D错误;
故答案选D。
2.A
【详解】A.该反应是气体物质的量不变的反应,减小反应体系的体积,压强增大,化学
反应速率加快,故A正确;
B.升高温度,正逆反应速率都增大,故B错误;
C.0~15s内c(HI)由0.1mol/L降到0.07mol/L,HI变化的物质的量浓度为0.03mol·L-1,根
据化学反应速率的数学表达式,v(HI)= =0.002mol/(L·s),根据速率之比=方程式
系数之比,所以v(I)= 0.001mol/(L·s),故C错误;
2
D.浓度降低,化学反应速率减缓,c(HI)由0.07mol·L-1降到0.05mol·L-1,HI表示的化学
反应速率小于0.002mol/(L·s),因此所用时间大于10s,故D错误;
答案为A。
3.A
【详解】要降低反应速率,可以采用降低温度、降低氢离子浓度等方法实现;①加入KCl
溶液,使溶液中c(H+)降低,反应速率降低,且氢离子总物质的量不变,生成氢气总量不
变;②加入浓盐酸溶液,使溶液中c(H+)增大,化学反应速率增大,且氢离子总物质的量
增加,使生成氢气总量增大;③加入蒸馏水,使溶液中c(H+)减小,反应速率降低,且氢
离子总物质的量不变,生成氢气总量不变;④加入CuSO 溶液,Zn和铜离子发生置换反应
4
生成Cu,Zn与置换产生的Cu和稀盐酸构成了原电池而加快反应速率;⑤KNO 固体对溶
3
液中c(H+)没有影响,反应速率不变;⑥加入CHCOONa固体,引入CHCOO-,CHCOO-
3 3 3
水解使溶液中c(H+)减小,反应速率降低,且氢离子总物质的量不变,生成氢气总量不变;
所以反应①③⑥可行;故答案选A。
4.C
【详解】A.反应原理为 ,A错误;
B.探究 固体对反应速率的影响需要控制其他变量,选用实验②和③,B错误;
C.实验①和②探究 浓度对反应速率的影响, ,C正确;
D. 对该反应有催化作用,加快反应速率, ,D错误;
故选C。
5.D
【详解】A.随着反应的进行,反应物气体 的浓度不断减小,故气体 的浓度: 点大
于 点, 错误;
B.在 段,正反应速率不断增大,则单位时间内气体 的生成量不断增多,故若
,则气体 的生成量: 段小于 段,B错误;
C.化学反应达到平衡状态时,正反应速率不再变化,而c点时,正反应速率开始减少,说
明反应没有达到平衡状态,则 ,C错误;
D.该反应前后气体分子数不变,绝热恒容密闭容器中气体压强一直在变,体系压强不再
变化,表明体系的温度不变,从而说明反应达到平衡状态,D正确;
答案选D。
6.B
【详解】A.盛有4 mL 1 酸性 溶液的两支试管,一只加入2 mL 0.1
溶液,一只加入2 mL 0.2 溶液, 溶液过量,溶液不能
完全褪色,不能根据高锰酸钾溶液褪色的快慢探究浓度对反应速率的影响,故不选A;
B.向待测溶液中加入淀粉溶液,无明显变化,再加入新制氯水,变蓝,说明有I-被氯水氧
化为I,待测溶液中有 存在,故选B;
2
C.在容积可变的密闭容器中发生反应: ,把容器的体积缩小一半,
答案第2页,共2页反应正向移动,正逆反应速率均加快,故不选C;
D.向2支试管中各加入相同体积、相同浓度的 溶液,再分别加入不同体积相同浓
度的稀硫酸,分别放入冷水和热水中,温度、浓度都不同,两个变量,不能探究温度对反
应速率的影响,故不选D;
选B。
7.A
【详解】A.达到平衡后,再通入A,平衡正向移动,B的转化率增大,与题图中曲线符合,
A正确;
B.达到平衡后,再通入C,平衡逆向移动,由于混合气体的总物质的量的增加程度大于A
的物质的量的增加程度,A的体积分数减小,与题图中曲线不符合,B错误;
C.该反应在恒容密闭容器中进行,达到平衡后,通入氦气,各组分的浓度不变,平衡不
移动,C的物质的量不变,与题图中曲线不符合,C错误;
D.该反应的正反应是放热反应,达到平衡后,升高温度,平衡逆向移动,混合气体的总
物质的量增大,而混合气体的总质量不变,故混合气体的平均摩尔质量减小,与题图中曲
线不符合,D错误;
故选A。
8.C
【详解】A.分析表格数据知,NO的浓度变化与时间成正比,该反应是匀速反应,
2
a=0.040,故A错误;
B.该反应是匀速反应,则 为直线方程,则n=0,该反应是0级反应,故B
错误;
C.设起始浓度为c,v=k, ,半衰期与起始浓度成正比,根据表格数据知,起
始浓度为0.1mol/L时半衰期为50min,温度不变,速率常数不变,则起始浓度为
时,半衰期为100min ,故C正确;
D.该反应是0级反应,则速率常数等于反应速率,可根据任何一段时间求速率和速率常
数, =k= ,故D错误;故选C。
9.D
【详解】A.铁单质与足量的硫单质共热充分反应生成氯化亚铁,则1mol铁单质与足量的
硫单质充分反应生转移电子的数目为1mol×2×N mol—1=2N ,故A错误;
A A
B.二氧化硫与氧气生成三氧化硫的反应为可逆反应,可逆反应不可能完全反应,则标准
状况下,22.4L二氧化硫与足量氧气反应,生成的三氧化硫分子数小于 ×N mol—
A
1=N ,故B错误;
A
C.常温下,铝片在浓硫酸中钝化,阻碍反应的继续进行,所以无法计算常温下,将5.4g
铝片投入足量的浓硫酸中,铝失去的电子数目,故C错误;
D.0.1mol碘化亚铁与0.1mol氯气反应时,氯气不足量,完全反应转化为氯离子,则转移
电子的数目为0.1mol×2×N mol—1=0.2N ,故D正确;
A A
故选D。
10.A
【详解】A.镁与醋酸溶液反应生成醋酸镁和氢气,反应的离子方程式为
Mg+2CHCOOH=Mg2++2CH COO—+H ↑,故A错误;
3 3 2
B.一段时间内瓶内压强的变化可以代表反应生成氢气的多少,从而体现化学反应速率的
大小,故B正确;
C.镁条与盐酸的反应为放热反应,反应放出的热量使反应温度升高,使反应速率加快,
所以镁条与盐酸反应过程中,有一段时间速率较快可能是因为反应放热,故C正确;
D.由图可知,反应结束时瓶内压强基本相等说明镁条与等体积等浓度的盐酸和醋酸溶液
反应生成的氢气的量基本相同,故D正确;
故选A。
11.C
【详解】A. 由图可知,a点时,A、B两物质反应的时间相同,但物质的量的变化量不同,
反应速率不相等,选项A错误;
B. 5min时,反应达平衡,是动态平衡,不是反应停止,选项B错误;
C. 反应达到平衡时,A的物质的量由0.8 mol减少为0.2 mol,变化量为0.6 mol,A为反应
物,B的物质的量由0增加到0.4 mol,变化量为0.4 mol,C的物质的量由0增加到0.2
mol,变化量为0.2 mol,B、C为生成物,化学反应计量系数之比等于反应体系中物质变化
量之比,∆n(A):∆n(B) :∆n(C) =0.6 mol:0.4 mol:0.2 mol=3:2:1,则反应的化学方程
答案第4页,共2页式为:3A(g) 2B(g)+C(g),选项C正确;
⇌
D. 反应开始到5min,∆n(C)= 0.2 mol,υ(C) = =0.02 mol/(L·min),
选项D错误;
答案选C。
12.B
【详解】A.该反应是气体颜色变深的反应,气体的颜色不再改变说明正逆反应速率相等,
反应已达到平衡,故A不符合题意;
B.有amol 生成,同时有4amol 生成都代表正反应速率,不能说明正逆反应速率相
等,无法判断反应是否达到平衡,故B符合题意;
C.该反应是气体体积增大的反应,一定温度下,将足量的硝酸铜固体置于盛有1mol氖气
的恒容密闭容器中发生反应时,气体的平均相对分子质量减小,则气体的平均相对分子质
量不再变化说明正逆反应速率相等,反应已达到平衡,故C不符合题意;
D.硝酸铜与氧化铜中铜元素的质量分数不同,则固体混合物中铜元素的质量分数不再变
化说明正逆反应速率相等,反应已达到平衡,故D不符合题意;
故选B。
13.A
【详解】A.二氧化硫用作红酒防腐剂,主要是由于二氧化硫的抗氧化性和杀菌作用,而
且还能保持葡萄酒的天然香味,故A符合题意;
B.乙炔与氧气燃烧放出大量热,可用于金属切割与焊接,故B不符合题意;
C. 受热分解会产生 ,可用作面团膨松剂,故C不符合题意;
D.铁触媒可用作合成氨的催化剂,提高反应速率,故D不符合题意;
故答案选A。
14.C
【详解】A.实验①中 ,
则 ,故A正确;
B.实验③,60min时处于平衡状态,设容器体积为1L,则起始时NH 物质的量为
3;60min时NH 物质的量为 ,N 物质的量为 ,
3 2
H 物质的量为 ,所以60min时压强与初始压强的比为
2
,故B正确;
C.实验①、实验②中0~20min、20min~40min 氨气浓度变化量都是4.00×10−4mol/L,实
验②中60min时反应达到平衡状态,实验①和实验②催化剂表面积相同,实验①中氨气初
始浓度是实验②中氨气初始浓度的两倍,实验①60min时反应未达到平衡状态,相同条件
下,增加氨气浓度,反应速率并没有增大,故C错误;
D.结合①②③的数据,催化剂表面积越大,反应速率越快,则相同条件下,增加催化剂
的表面积,反应速率增大,故D正确;
故答案选C。
【点睛】本题考查化学反应速率的影响因素,难度不大,结合实验数据分析影响因素以及
实验数据的差异为解答的关键,注意化学反应速率计算的应用。
15.A
【详解】A.由图可知,该历程中最大能垒(活化能)步骤的化学方程式为HO•=H•+
2
OH•,故A正确;
B.由图可知,反应物总能量大于生成物总能量,该反应为放热反应,ΔH<0,故B错误;
C.由图可知,反应过程中发生非极性键H−H键形成,无非极性键的断裂,故C错误;
D.催化剂不改变化学平衡状态,则催化剂不改变CO的平衡转化率,故D错误;
故答案选选A。
【点睛】本题考查反应热与焓变,为高频考点,把握反应中能量变化、活化能为解答的关
键,侧重分析与应用能力的考查,题目难度不大。
16.错误
【详解】从图中可以看出,起始时,c(M)=0.5mol/L,30min时,c(M)=0.3mol/L,则M的浓
度变化量为0.2mol/L;30min时,c(Z)=0.125mol/L,则反应M+N=X+Z中,M的浓度变化
量为0.125mol/L,反应M+N=X+Y中,M的浓度变化量为0.2mol/L-0.125mol/
L=0.075mol/L,从而得出生成Y的浓度为0.075mol/L,0~30min时间段内,Y的平均反应
速率为 =2.5×10-3mol•L-1•min-1,(错误)。答案为:错误。
答案第6页,共2页17.(1)A
(2)3A(g) B(g)+3C(g)
(3)0.6mol/(L·min)
【详解】(1)从图中可以看出,反应前,A的物质的量浓度为2.4mol/L,B、C的物质的
量浓度都为0,则该反应的反应物是A。答案为:A;
(2)该反应进行到tmin时反应达平衡,A、B、C的浓度变化量分别为1.2ml/L、
0.4mol/L、1.2mol/L,则反应中A、B、C的化学计量数之比为1.2:0.4:1.2=3:1:3,所以化学
反应方程式为3A(g) B(g)+3C(g)。答案为:3A(g) B(g)+3C(g);
(3)若达到平衡状态的时间是2min,A物质的平均反应速率为
=0.6mol/(L·min)。答案为:0.6mol/(L·min)。
18.(1)0.125
(2)D
(3)75%
(4)30%
(5)小于
(6) 还原 Cu2++2e-=Cu Zn+Cu2+=Zn2++Cu
【详解】(1)3 min到9 min, CO 浓度变化为:0.50 -0.25 =0.25
2
,CO 的反应速率: ;则v(H )=3 v(CO)= 0.125
2 2 2
mol·L-1·min-1;答案为:0.125;
(2)A.反应中CO 与CHOH的物质的量浓度之比为1 : 1(即图中交叉点), 浓度相等而
2 3
不是不变,故A错误;
B.反应前后,气体质量不变,容器体积不变,则气体密度始终不变,不能判断是否平衡,
故B错误;
C.单位时间内每消耗3molH ,同时生成1molH O,从反应开始到平衡始终相等,不一定
2 2
平衡,故C错误;D. CO 的体积分数在混合气体中保持不变,说明正逆反应速率相等,达平衡状态,故D
2
正确,故本题选D。
(3)由图像可知平衡时CO 的为0.25mol/L,可知消耗0.75mol/L,则转化率为:
2
75%;答案为:75%;
(4)根据题意得三段式:
,平衡时混合气体中
CHOH(g)的体积分数是: ;答案为:30%
3
(5)第9分钟时达到平衡,v (CHOH)= v (CHOH),随着反应的进行,正反应速率逐渐
逆 3 正 3
减小,则第9分钟时v (CHOH)小于第3分钟时v (CHOH);故答案为:小于;
逆 3 正 3
(6)锌比银活泼,故锌为负极,银为正极,银为正极,发生还原反应,得到电子,电极反
应式为Cu2++2e-=Cu;该原电池的总反应离子方程式为:Zn+Cu2+=Zn2++Cu;
答案为:还原;Cu2++2e-=Cu;Zn+Cu2+=Zn2++Cu。
19.(1) 0.1mol•L-1•min-1 20%
(2)ABE
(3)80%
【详解】(1)列三段式有
,
答案第8页,共2页则v(SO )= =0.1mol•L-1•min-1;平衡时SO 转化率= ×100%=20%;
3 2
(2)A.反应前后体积不同,即压强不再发生变化达到平衡,A正确;
B.SO 的体积分数不再改变,达到平衡状态,B正确;
2
C.反应中遵循原子守恒,不能由此判断是否平衡,C错误;
D.反应同向进行,不能由此判断是否平衡,D错误;
E.消耗2nmolSO 的同时生成nmolO ,即符合正逆反应速率相等,达到平衡状态,E正确;
2 2
故选ABE。
(3)设SO 、O 的物质的量均为1mol,反应过程中总物质的量减小了
2 2
2mol×20%=0.4mol,由2SO (g)+O(g) 2SO (g),可知当总的物质的量减小0.4mol时,
2 2 3
SO 反应了0.8mol,其转化率为80%。
2
20. ②
【详解】图像是 分解率和时间的关系,先达到平衡,说明温度高,即 ,当反应
达到平衡, ,即 ,可知 ,达
平衡时, 分解率为40%,此时消耗 ,达到平衡时,
, , ,
,即 ; 值较小,说明反应向逆
反应方向进行程度较大,根据图像,温度升高 分解率增大,即温度越低,反应向逆反
应方向进行的程度越大,则 值较小的曲线为②,故答案为 ;②。答案第10页,共2页