文档内容
必修第二册 第六章 第二节 化学反应的速率与限度 测试题
榆次一中 李金虎
一、选择题(每小题只有一个正确选项,每小题4分,共40分)
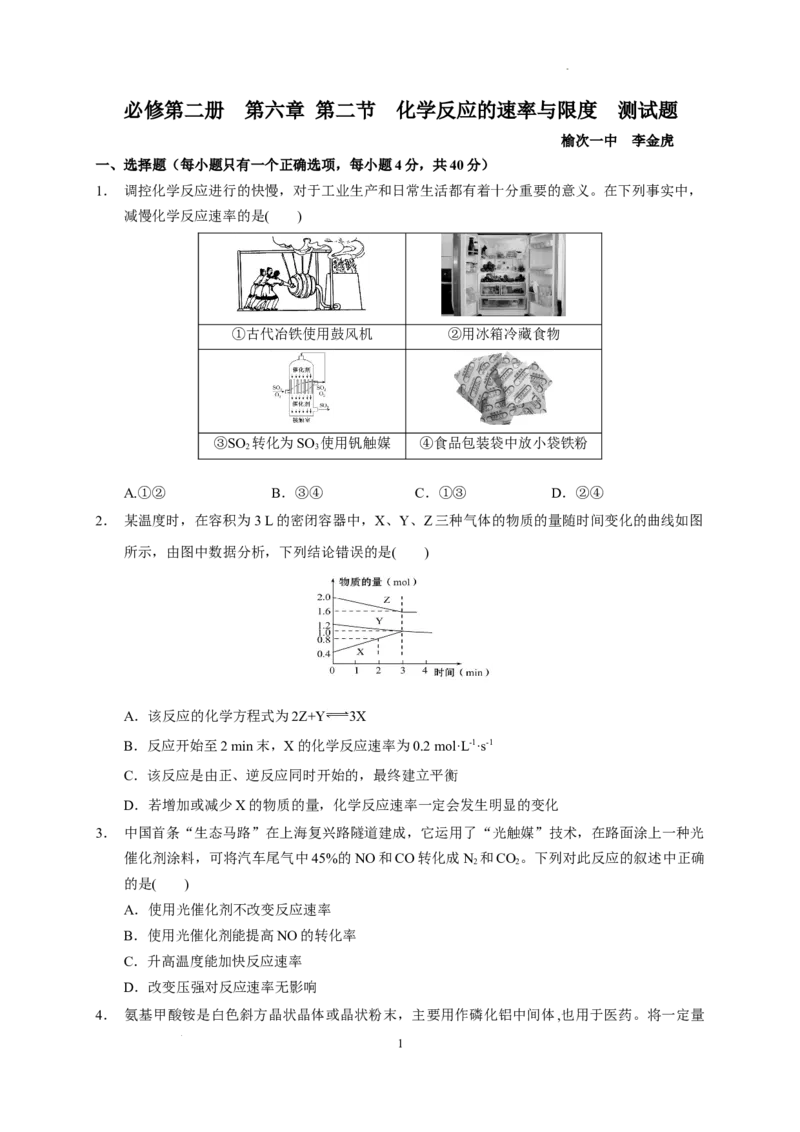
1. 调控化学反应进行的快慢,对于工业生产和日常生活都有着十分重要的意义。在下列事实中,
减慢化学反应速率的是( )
①古代冶铁使用鼓风机 ②用冰箱冷藏食物
③SO 转化为SO 使用钒触媒 ④食品包装袋中放小袋铁粉
2 3
A.①② B.③④ C.①③ D.②④
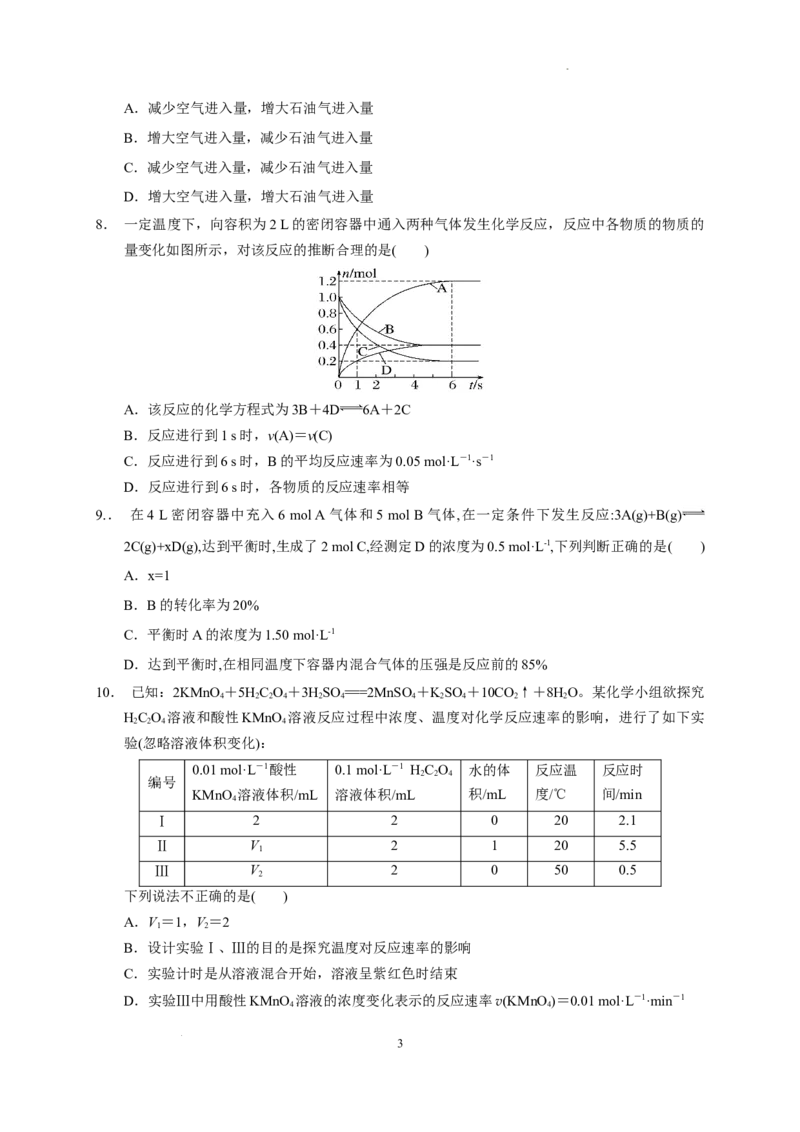
2. 某温度时,在容积为3 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图
所示,由图中数据分析,下列结论错误的是( )
A.该反应的化学方程式为2Z+Y 3X
B.反应开始至2 min末,X的化学反应速率为0.2 mol·L-1·s-1
C.该反应是由正、逆反应同时开始的,最终建立平衡
D.若增加或减少X的物质的量,化学反应速率一定会发生明显的变化
3. 中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光
催化剂涂料,可将汽车尾气中45%的NO和CO转化成N 和CO 。下列对此反应的叙述中正确
2 2
的是( )
A.使用光催化剂不改变反应速率
B.使用光催化剂能提高NO的转化率
C.升高温度能加快反应速率
D.改变压强对反应速率无影响
4. 氨基甲酸铵是白色斜方晶状晶体或晶状粉末,主要用作磷化铝中间体,也用于医药。将一定量
1
学科网(北京)股份有限公司纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计) ,在恒定温度下使其达到
分解平衡:NH COONH(s) 2NH (g)+CO (g)。判断该分解反应已经达到化学平衡的是( )
2 4 3 2
A.2v(NH )=v(CO )
3 2
B.密闭容器中c(NH )∶c(CO)=2∶1
3 2
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
5. 2019年是京沪高铁迎来开通运营8周年。作为世界铁路历史上一次建成里程最长、标准最高的
高速铁路,京沪高铁于2011年6月30日开通运营。8年来京沪高铁成为中国高铁的标杆和典
范。京沪高铁用创新领跑中国速度。
科研人员通过改良技术提高高铁速度,同样改变条件也能改变化学反应速率,下列措施对增大
反应速率明显有效的是( )
A.Na与水反应时增大水的用量
B.Fe与稀硫酸反应制取氢气时,改用浓硫酸
C.在KSO 与BaCl 两溶液反应时,增大压强
2 4 2
D.将铝片改为铝粉,做铝与氧气反应的实验
6. 可逆反应2NO (g) 2NO(g)+O(g)在体积固定的密闭容器中,达到平衡状态的标志是( )
2 2
①单位时间内生成n mol O 的同时生成2n mol NO
2 2
②单位时间内生成n mol O 的同时生成2n mol NO
2
③用NO 、NO、O 表示的反应速率的比为2∶2∶1的状态
2 2
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
7. 生活中家庭常用的燃料气体有三种:天然气、水煤气和液化石油气。
天然气和液化石油气燃烧的主要化学方程式依次为CH+2O CO+2H O,C H+5O
4 2 2 2 3 8 2
3CO+4H O,现有一套以天然气为燃料的灶具,今改为烧液化石油气,应采用的正确措施是( )
2 2
2
学科网(北京)股份有限公司A.减少空气进入量,增大石油气进入量
B.增大空气进入量,减少石油气进入量
C.减少空气进入量,减少石油气进入量
D.增大空气进入量,增大石油气进入量
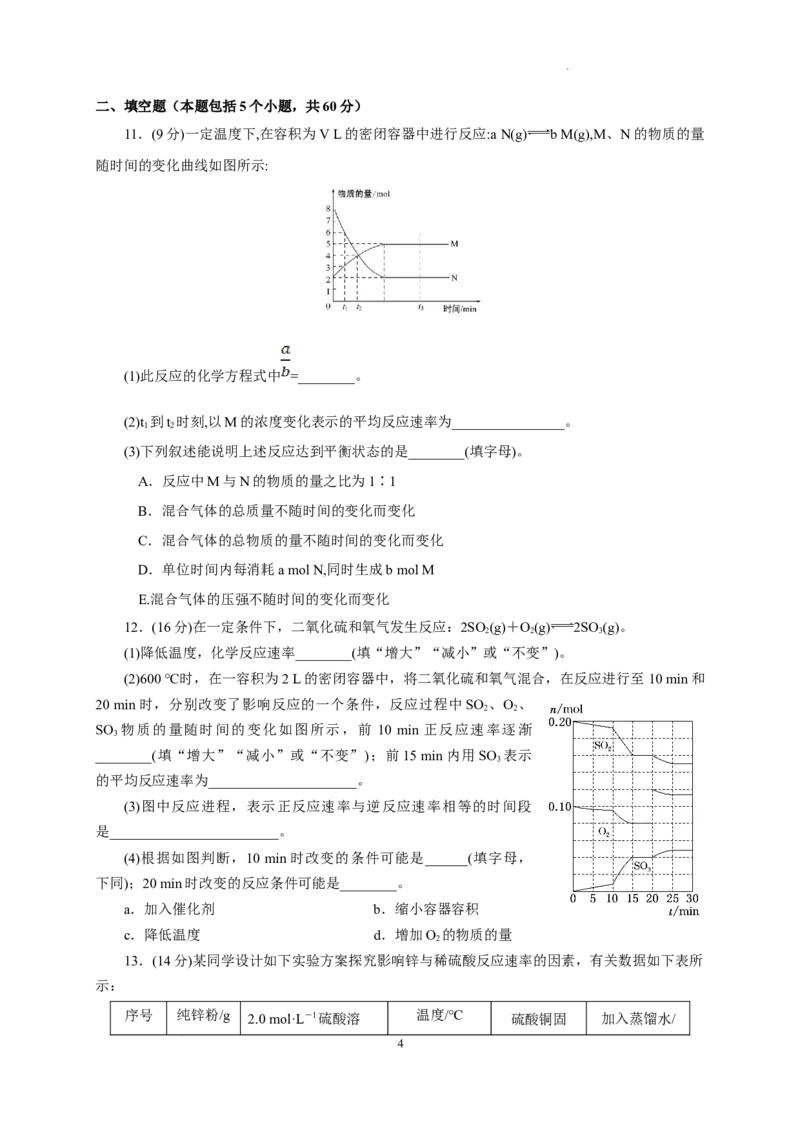
8. 一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的
量变化如图所示,对该反应的推断合理的是( )
A.该反应的化学方程式为3B+4D 6A+2C
B.反应进行到1 s时,v(A)=v(C)
C.反应进行到6 s时,B的平均反应速率为0.05 mol·L-1·s-1
D.反应进行到6 s时,各物质的反应速率相等
9.. 在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A.x=1
B.B的转化率为20%
C.平衡时A的浓度为1.50 mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
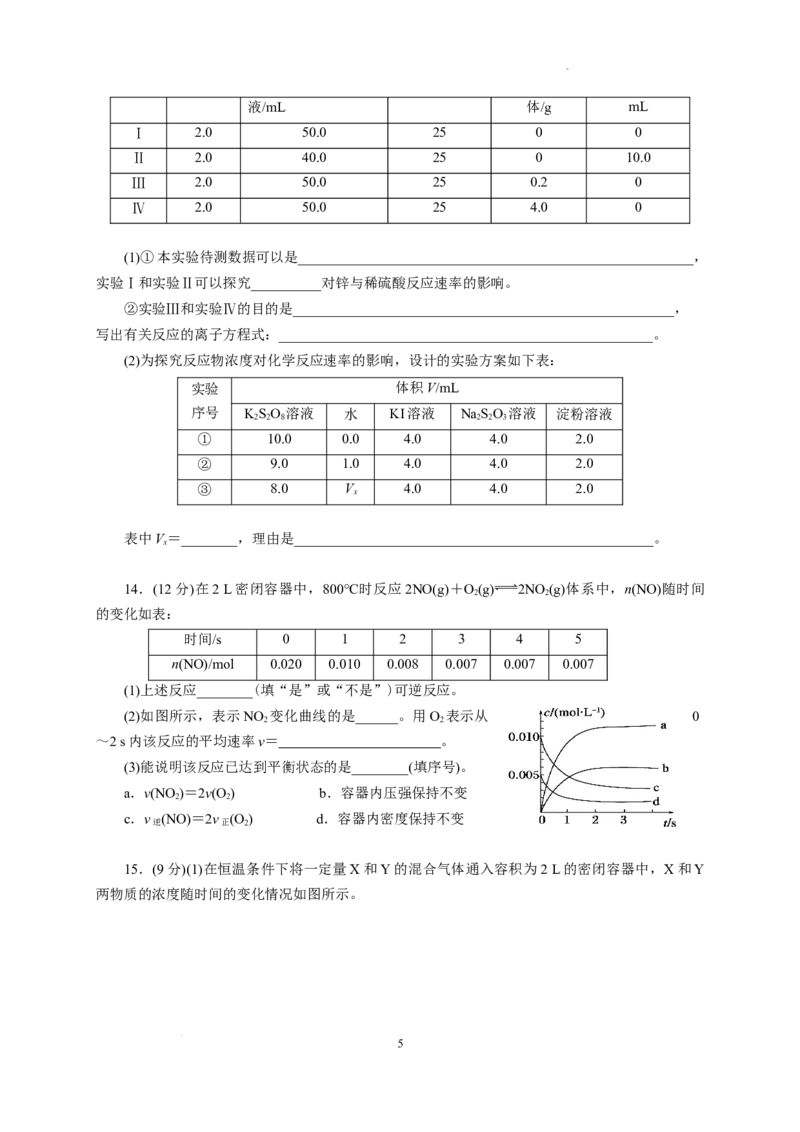
10. 已知:2KMnO +5HC O+3HSO ===2MnSO +KSO +10CO↑+8HO。某化学小组欲探究
4 2 2 4 2 4 4 2 4 2 2
HC O 溶液和酸性KMnO 溶液反应过程中浓度、温度对化学反应速率的影响,进行了如下实
2 2 4 4
验(忽略溶液体积变化):
0.01 mol·L-1酸性 0.1 mol·L-1 HC O 水的体 反应温 反应时
2 2 4
编号
KMnO 溶液体积/mL 溶液体积/mL 积/mL 度/℃ 间/min
4
Ⅰ 2 2 0 20 2.1
Ⅱ V 2 1 20 5.5
1
Ⅲ V 2 0 50 0.5
2
下列说法不正确的是( )
A.V=1,V=2
1 2
B.设计实验Ⅰ、Ⅲ的目的是探究温度对反应速率的影响
C.实验计时是从溶液混合开始,溶液呈紫红色时结束
D.实验Ⅲ中用酸性KMnO 溶液的浓度变化表示的反应速率v(KMnO)=0.01 mol·L-1·min-1
4 4
3
学科网(北京)股份有限公司二、填空题(本题包括5个小题,共60分)
11.(9分)一定温度下,在容积为V L的密闭容器中进行反应:a N(g) b M(g),M、N的物质的量
随时间的变化曲线如图所示:
(1)此反应的化学方程式中 =________。
(2)t 到t 时刻,以M的浓度变化表示的平均反应速率为________________。
1 2
(3)下列叙述能说明上述反应达到平衡状态的是________(填字母)。
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
12.(16分)在一定条件下,二氧化硫和氧气发生反应:2SO (g)+O(g) 2SO (g)。
2 2 3
(1)降低温度,化学反应速率________(填“增大”“减小”或“不变”)。
(2)600 ℃时,在一容积为2 L的密闭容器中,将二氧化硫和氧气混合,在反应进行至10 min和
20 min时,分别改变了影响反应的一个条件,反应过程中SO 、O 、
2 2
SO 物质的量随时间的变化如图所示,前 10 min 正反应速率逐渐
3
________(填“增大”“减小”或“不变”);前15 min内用SO 表示
3
的平均反应速率为_____________________。
(3)图中反应进程,表示正反应速率与逆反应速率相等的时间段
是________________________。
(4)根据如图判断,10 min时改变的条件可能是______(填字母,
下同);20 min时改变的反应条件可能是________。
a.加入催化剂 b.缩小容器容积
c.降低温度 d.增加O 的物质的量
2
13.(14分)某同学设计如下实验方案探究影响锌与稀硫酸反应速率的因素,有关数据如下表所
示:
序号 纯锌粉/g 2.0 mol·L-1硫酸溶 温度/℃ 硫酸铜固 加入蒸馏水/
4
学科网(北京)股份有限公司液/mL 体/g mL
Ⅰ 2.0 50.0 25 0 0
Ⅱ 2.0 40.0 25 0 10.0
Ⅲ 2.0 50.0 25 0.2 0
Ⅳ 2.0 50.0 25 4.0 0
(1)①本实验待测数据可以是________________________________________________________,
实验Ⅰ和实验Ⅱ可以探究__________对锌与稀硫酸反应速率的影响。
②实验Ⅲ和实验Ⅳ的目的是______________________________________________________,
写出有关反应的离子方程式:_____________________________________________________。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验 体积V/mL
序号 KSO 溶液 水 KI溶液 NaSO 溶液 淀粉溶液
2 2 8 2 2 3
① 10.0 0.0 4.0 4.0 2.0
② 9.0 1.0 4.0 4.0 2.0
③ 8.0 V 4.0 4.0 2.0
x
表中V=________,理由是___________________________________________________。
x
14.(12分)在2 L密闭容器中,800℃时反应2NO(g)+O(g) 2NO (g)体系中,n(NO)随时间
2 2
的变化如表:
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO 变化曲线的是______。用O 表示从 0
2 2
~2 s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO )=2v(O ) b.容器内压强保持不变
2 2
c.v (NO)=2v (O ) d.容器内密度保持不变
逆 正 2
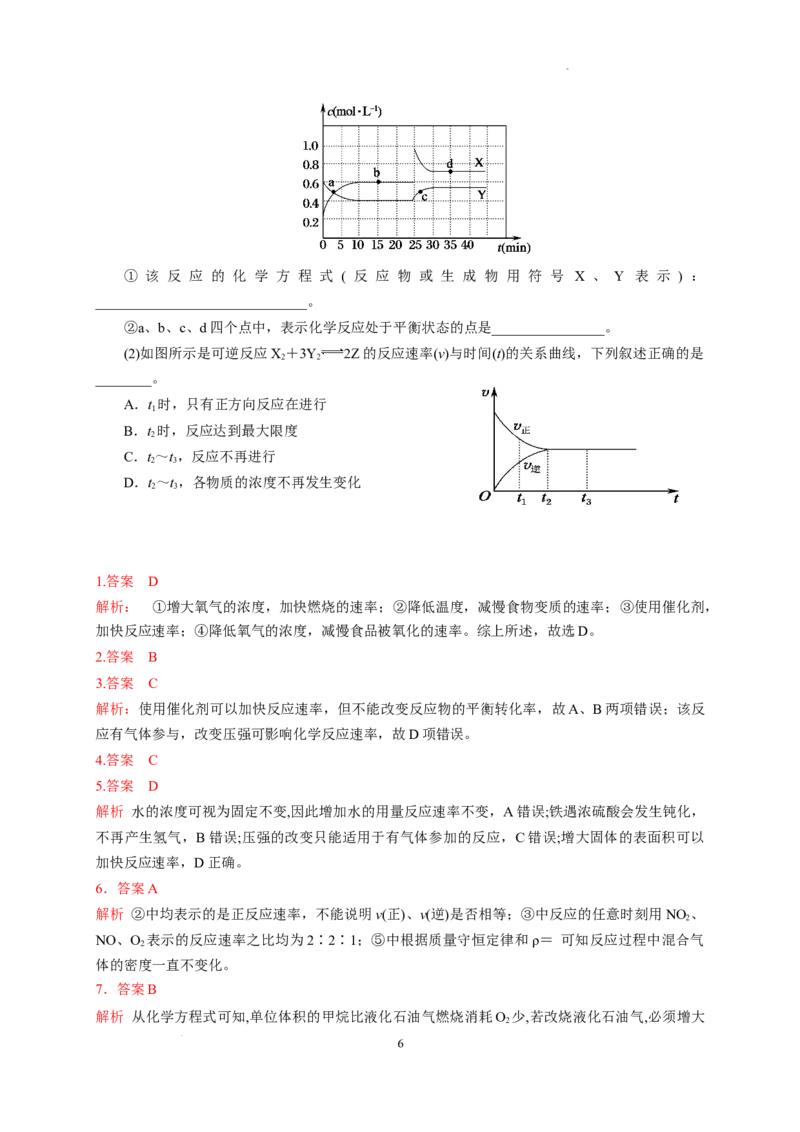
15.(9分)(1)在恒温条件下将一定量X和Y的混合气体通入容积为2 L的密闭容器中,X和Y
两物质的浓度随时间的变化情况如图所示。
5
学科网(北京)股份有限公司① 该 反 应 的 化 学 方 程 式 ( 反 应 物 或 生 成 物 用 符 号 X 、 Y 表 示 ) :
______________________________。
②a、b、c、d四个点中,表示化学反应处于平衡状态的点是________________。
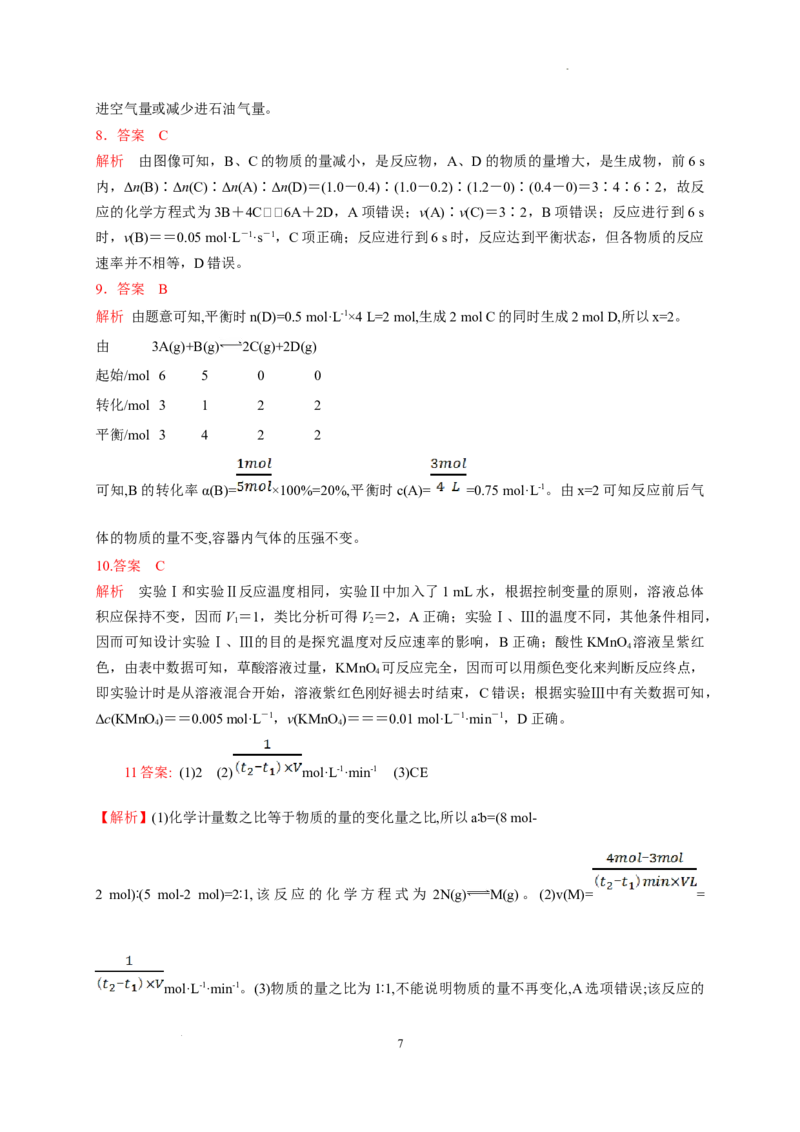
(2)如图所示是可逆反应X +3Y 2Z的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
2 2
________。
A.t 时,只有正方向反应在进行
1
B.t 时,反应达到最大限度
2
C.t~t,反应不再进行
2 3
D.t~t,各物质的浓度不再发生变化
2 3
1.答案 D
解析: ①增大氧气的浓度,加快燃烧的速率;②降低温度,减慢食物变质的速率;③使用催化剂,
加快反应速率;④降低氧气的浓度,减慢食品被氧化的速率。综上所述,故选D。
2.答案 B
3.答案 C
解析:使用催化剂可以加快反应速率,但不能改变反应物的平衡转化率,故A、B两项错误;该反
应有气体参与,改变压强可影响化学反应速率,故D项错误。
4.答案 C
5.答案 D
解析 水的浓度可视为固定不变,因此增加水的用量反应速率不变,A错误;铁遇浓硫酸会发生钝化,
不再产生氢气,B错误;压强的改变只能适用于有气体参加的反应,C错误;增大固体的表面积可以
加快反应速率,D正确。
6.答案A
解析 ②中均表示的是正反应速率,不能说明v(正)、v(逆)是否相等;③中反应的任意时刻用NO 、
2
NO、O 表示的反应速率之比均为2∶2∶1;⑤中根据质量守恒定律和ρ= 可知反应过程中混合气
2
体的密度一直不变化。
7.答案B
解析 从化学方程式可知,单位体积的甲烷比液化石油气燃烧消耗O 少,若改烧液化石油气,必须增大
2
6
学科网(北京)股份有限公司进空气量或减少进石油气量。
8.答案 C
解析 由图像可知,B、C的物质的量减小,是反应物,A、D的物质的量增大,是生成物,前6 s
内,Δn(B)∶Δn(C)∶Δn(A)∶Δn(D)=(1.0-0.4)∶(1.0-0.2)∶(1.2-0)∶(0.4-0)=3∶4∶6∶2,故反
应的化学方程式为3B+4C6A+2D,A项错误;v(A)∶v(C)=3∶2,B项错误;反应进行到6 s
时,v(B)==0.05 mol·L-1·s-1,C项正确;反应进行到6 s时,反应达到平衡状态,但各物质的反应
速率并不相等,D错误。
9.答案 B
解析 由题意可知,平衡时n(D)=0.5 mol·L-1×4 L=2 mol,生成2 mol C的同时生成2 mol D,所以x=2。
由 3A(g)+B(g) 2C(g)+2D(g)
起始/mol 6 5 0 0
转化/mol 3 1 2 2
平衡/mol 3 4 2 2
可知,B的转化率α(B)= ×100%=20%,平衡时c(A)= =0.75 mol·L-1。由x=2可知反应前后气
体的物质的量不变,容器内气体的压强不变。
10.答案 C
解析 实验Ⅰ和实验Ⅱ反应温度相同,实验Ⅱ中加入了1 mL水,根据控制变量的原则,溶液总体
积应保持不变,因而V=1,类比分析可得V=2,A正确;实验Ⅰ、Ⅲ的温度不同,其他条件相同,
1 2
因而可知设计实验Ⅰ、Ⅲ的目的是探究温度对反应速率的影响,B正确;酸性KMnO 溶液呈紫红
4
色,由表中数据可知,草酸溶液过量,KMnO 可反应完全,因而可以用颜色变化来判断反应终点,
4
即实验计时是从溶液混合开始,溶液紫红色刚好褪去时结束,C错误;根据实验Ⅲ中有关数据可知,
Δc(KMnO)==0.005 mol·L-1,v(KMnO)===0.01 mol·L-1·min-1,D正确。
4 4
11答案: (1)2 (2) mol·L-1·min-1 (3)CE
【解析】(1)化学计量数之比等于物质的量的变化量之比,所以a∶b=(8 mol-
2 mol)∶(5 mol-2 mol)=2∶1,该反应的化学方程式为 2N(g) M(g)。(2)v(M)= =
mol·L-1·min-1。(3)物质的量之比为1∶1,不能说明物质的量不再变化,A选项错误;该反应的
7
学科网(北京)股份有限公司反应物和生成物都是气体,根据质量守恒定律,反应前后,混合气体的质量始终不变,B选项错误;该反应
为气体体积减小的反应,若反应没有达到平衡状态,反应过程中气体的总物质的量和压强始终在减小,
当气体的总物质的量和压强不再发生变化时,则说明反应达到了平衡状态,C和E选项正确;消耗a mol
N和生成b mol M都表示的是正反应速率,没有体现逆反应速率的大小,不能说明反应达到了平衡状
态,D选项错误。
12. 答案:(1)减小
(2)减小 1.33×10-3 mol·L-1·min-1
(3)15~20 min、25~30 min (4)ab d
解析:(1)降低温度,化学反应速率减小。(2)前10 min随着反应的不断进行,反应物SO 和O
2 2
的浓度不断减小,正反应速率减小,前15 min内用SO 表示的平均反应速率为≈1.33×10-3 mol·L-
3
1·min-1。(3)反应过程中SO 、O 、SO 物质的量不随时间变化的时间段为15~20 min和25~30
2 2 3
min,反应处于平衡状态。(4)10~15 min时三条曲线的斜率突然增大,说明反应速率突然加快,其
原因可能是加入催化剂或缩小容器容积。反应进行至20 min时,曲线发生的变化是O 的物质的量
2
突然增大,平衡发生移动,引起SO 、SO 物质的量随之发生变化。
2 3
13.答案 (1)①反应结束所需要的时间(或相同条件下产生等体积的氢气所需要的时间) 硫酸
浓度 ②探究硫酸铜的质量对反应速率的影响 Zn+Cu2+===Zn2++Cu,Zn+2H+===Zn2++H↑
2
(2)2.0 保证反应物KSO 浓度的改变,而其他物质的浓度不变
2 2 8
解析 (1)实验Ⅰ和实验Ⅱ中,锌的质量和状态相同,硫酸的浓度不同,实验Ⅲ和实验Ⅳ中加入硫酸
铜,Cu2+的氧化性强于H+,首先发生反应Zn+Cu2+===Zn2++Cu,生成的铜附着在锌表面,在稀
硫酸溶液中构成原电池,加快锌失电子。但是加入的硫酸铜过多,生成的铜会覆盖在锌表面,阻止
锌与稀硫酸进一步反应,产生氢气的速率会减慢。
(2)实验的目的是探究KSO 溶液的浓度对化学反应速率的影响,故应保证每组实验中其他物质的
2 2 8
浓度相等,即溶液的总体积相等(为20.0 mL),从而可知V=2.0。
x
14.答案(1)是
(2)b 1.5×10-3 mol·(L·s)-1 (3)bc
解析:(1)该反应是可逆反应。
(2)由平衡体系2NO(g)+O(g)2NO (g)知,NO 为生成物,n(NO )=Δn(NO)=0.020 mol-
2 2 2 2
0.007 mol=0.013 mol
c(NO )==0.006 5 mol·L-1
2
故表示NO 变化曲线的为b。
2
v(NO)====0.003 mol·(L·s)-1,
则v(O )=v(NO)=0.001 5 mol·(L·s)-1。
2
(3)a项中未指明正、逆反应速率,故无法说明该反应是否达到平衡状态;由于该反应是反应前
后气体体积不相等的反应,当容器内压强保持不变时,说明该反应已达到平衡状态,故b项正确;
c项中已说明正、逆反应速率相等,故说明该反应已达到平衡状态;由于气体总质量不变,气体总
8
学科网(北京)股份有限公司体积也不变,因此,无论该反应是否达到平衡,容器内密度保持不变,故d项无法说明该反应是否
达到平衡状态。
15.(1)①Y2X ②bd (2)BD
解析:(1)从浓度变化趋势来看,X为生成物,Y为反应物。15 min时X增加了0.4 mol·L-1,Y
减小了0.2 mol·L-1,故X、Y的化学计量数之比为2∶1,10~25 min内,X、Y的浓度不发生变化,
达到化学平衡状态,则该反应为可逆反应,反应方程式为Y 2X。b、d两点处于化学平衡状态。
(2)对于可逆反应,反应开始后的任何时刻,正、逆反应均在进行。根据图象可知0~t 反应处于非
2
平衡状态,t 后,正、逆反应速率相等,但不等于0;处于平衡状态时,各物质的浓度不再发生变
2
化,故B、D正确。
9
学科网(北京)股份有限公司10
学科网(北京)股份有限公司