文档内容
第二章 海水中的重要元素——钠和氯
单元测试卷
时间:90分钟 满分:100分
一、 选择题(本题共12小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.同温同压下,质量相同的CO、H、O、CH、SO 五种气体,下列说法错误的是
2 2 2 4 2
A.所占的体积由大到小的顺序是:H>CH >O >CO >SO
2 4 2 2 2
B.所含分子数由多到少的顺序是:H>CH >O >CO >SO
2 4 2 2 2
C.密度由大到小的顺序是:SO >CO >O >CH >H
2 2 2 4 2
D.所含的电子数由多到少的顺序是:CO>SO>CH >O >H
2 2 4 2 2
2.若一个氖原子质量是a g,一个12C原子质量是b g,设阿伏加德罗常数的数值为N ,下列说法不正确的
A
是 ( )
A.该氖原子的相对原子质量是12a/b B.该氖原子的摩尔质量是aN g
A
C.Wg该氖原子的物质的量是 mol D.Wg该氖原子所含质子数是10W/a
3.下列解释实验现象的反应方程式正确的是( )
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O=Na O
2 2 2
B.将Na块放入水中,产生气体:2Na+2HO=2NaOH+H↑
2 2
C.NaO 在潮湿的空气中放置一段时间,变成白色粘稠物:2NaO+2CO=2Na CO+O
2 2 2 2 2 2 3 2
D.向NaHCO 溶液中加入过量的澄清石灰水,出现白色沉淀:2NaHCO +Ca(OH) =CaCO ↓+NaCO+
3 3 2 3 2 3
2HO
2
4.在紫色石蕊试液中分别加入(或通入)足量的下列物质,最后不能使溶液变成无色的是( )
A.Cl B.新制氯水 C.NaO D.NaOH
2 2 2
5.某同学将金属钠露置于空气中足够长时间,观察到下列现象:银白色→变灰暗→变白色→出现液滴→
白色固体→白色粉末。下列有关叙述不正确的是( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了NaO
2
B.出现液滴原因是生成的NaCO 吸收空气中的水蒸气在表面形成了溶液
2 3
C.最后白色粉末为碳酸钠粉末
D.最后白色粉末的质量比金属钠质量大
6.下列说法不正确的是( )
A.NaO 可以作为呼吸面具或潜水艇里的氧气来源
2 2
B.将NaO加到酚酞溶液中,溶液先变红色后褪色
2
C.可用水来检验某NaO样品中是否含有NaO
2 2 2
D.过氧化钠为淡黄色固体粉末
7.用N 代表阿伏加德罗常数,下列说法中正确的是( )
A
A.1 mol水含有的氢原子数目为N B.1 mol氩气分子所含的原子数目为2N
A AC.0.5 mol碳酸钠中含有的钠离子为0.5N D.0.5 mol硝酸中含有的氧原子为1.5N
A A
8.同温同压下,等质量的氧气和二氧化碳相比较,下列叙述正确的是
A.质子数之比为1∶1 B.氧原子数比为8∶11
C.物质的量之比为8∶11 D.原子个数比1∶1
9.气体的体积主要由以下什么因素决定:( )
①气体的分子多少 ②气体分子的大小
③气体分子间的平均距离 ④气体分子的相对分子质量.
A.①② B.①③ C.②③ D.②④
10.下图是一种实验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥的氯气,
C中红色布条颜色无变化;当关闭B时,C处红色布条褪色。则D瓶中盛有的溶液是( )
A.浓硫酸 B.饱和氯化钠溶液 C.浓氢氧化钠溶液 D.氢氧化钙悬浊液
11.下列说法错误的是
A.氯气可用作自来水的杀菌消毒
B.氯气能使湿润的淀粉碘化钾试纸变蓝,说明Cl 具有氧化性
2
C.氯气与水反应,Cl 是氧化剂,HO是还原剂
2 2
D.氯气与NaOH溶液反应的离子方程式为:Cl+2OH-=Cl-+ClO-+H O
2 2
12.欲除去小苏打溶液中混有的少量苏打,最好向溶液中加入(或通入) ( )
A.熟石灰 B.CO C.Ca(HCO ) D.盐酸
2 3 2
13.下列叙述中正确的是 ( )
A.1 mol CO 的质量为44 g/mol
2
B.硝酸的摩尔质量63g
C.2gH 所含原子数目为2mol
2
D.0.5molNa SO 溶于水中,所得溶液中Na+个数为6.02×1023
2 4
14.对于反应:2NaO+2HO===4NaOH+O↑,下列说法中正确的是 ( )。
2 2 2 2
A.NaO 是氧化剂,HO是还原剂
2 2 2
B.NaO 既是氧化剂,又是还原剂
2 2
C.该反应中电子转移的数目为4e-
D.氧气是还原产物
二、综合题
15.(14分)(1)在标准状况下,CO和CO 的混合气体共28L,质量为51g。其中CO 的质量为
2 2
_____g,混合气体中CO的物质的量分数为____。混合气体的平均摩尔质量为_______。
(2)同温同压下,同质量的NH 和HS气体体积比为______,原子个数之比为______,密度之比为
3 2________。
(3)在120℃时分别进行如下四个反应(除S外其它物质均为气体):
A.2HS+O=2HO+2S↓ B.2HS+3O=2HO+2SO
2 2 2 2 2 2 2
C.C H+3O =2HO+2CO D.C H+6O =4HO+4CO
2 4 2 2 2 4 8 2 2 2
若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d
>d 和V <V 的是___________;符合d >d 和V >V 的是___________(填写反应的代号)。
前 后 前 后 前 后 前 后
16.(15分)用MnO 氧化密度为1.19 g·cm-3,溶质质量分数为36.5%的HCl溶液。反应的化学方程式为:
2
MnO +4HCl(浓) MnCl +Cl↑+2H O
2 2 2 2
(1)该反应的离子方程式为:________________,该盐酸的物质的量浓度为___________mol/L。
(2)用双线桥法表示出该反应的电子转移方向和数目:___________________________。
(3)8.7gMnO 与足量浓盐酸反应能使________molHCl被氧化;其中,还原过程为:________→_______。
2
(4)浓盐酸在反应中显示出来的性质是__________(填字母)
a.还原性 b.酸性 c.氧化性 d. 挥发性
17.(14分)现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl 固体 ⑥稀
3
NaOH溶液 ⑦硝酸亚铁溶液。
(1)上述物质中属于电解质的物质序号为______ 。
(2)有两种物质发生反应的离子方程式为:H++OH-=H O,这两种物质的序号是______。
2
(3)加入盐酸、NaOH溶液均能发生化学反应的物质序号为______。
(4)能导电的物质序号为_______________。
(5)④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表
示)___________________________。
(6)实验室用⑤制备胶体的化学方程式为__________________________________。如果将1molFeCl 全部制
3
成胶体,制得的胶体________(选填“带负电”“电中性”“带正电”),胶粒数目________N (选填“大
A
于”“等于”“小于”)。
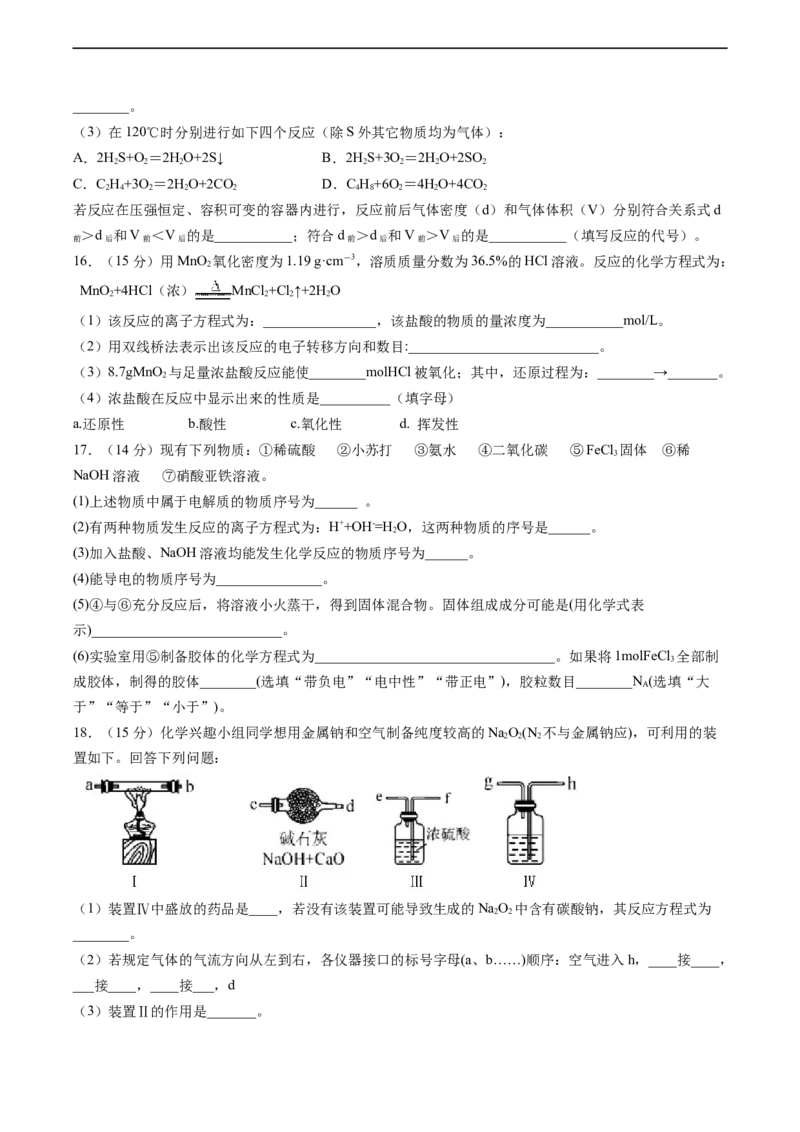
18.(15分)化学兴趣小组同学想用金属钠和空气制备纯度较高的NaO(N 不与金属钠应),可利用的装
2 2 2
置如下。回答下列问题:
(1)装置Ⅳ中盛放的药品是____,若没有该装置可能导致生成的NaO 中含有碳酸钠,其反应方程式为
2 2
________。
(2)若规定气体的气流方向从左到右,各仪器接口的标号字母(a、b……)顺序:空气进入h,____接____,
___接____,____接___,d
(3)装置Ⅱ的作用是_______。(4)某学习小组发现:在盛有NaO 的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡
2 2
消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入
少量MnO 粉末,又有气泡产生。
2
①使酚酞溶液变红是因为____,红色褪去的可能原因是_____。
②加入MnO 反应的化学方程式为____。
2
参考答案
1.D
【解析】
【详解】
A.根据n=m/M可知,质量相同时,摩尔质量越大,物质的量越小,则同温同压下体积与物质的量成正比,
质量相同的CO、H、O、CH、SO 五种气体,所占的体积由大到小的顺序是:H>CH>O>CO>
2 2 2 4 2 2 4 2 2
SO ,故A正确;
2
B.根据n=m/M可知,质量相同时,摩尔质量越大,物质的量越小,分子数越少,同温同压下,质量相同
的CO、H、O、CH、SO ,分子数由多到少的顺序是:H>CH>O>CO>SO ,故B正确;
2 2 2 4 2 2 4 2 2 2
C.同温同压下,密度之比等于摩尔质量之比,CO、H、O、CH、SO 五种气体摩尔质量由小到大的顺
2 2 2 4 2
序是:H<CH<O<CO<SO ,密度之比为:H<CH<O<CO<SO ,故C正确;
2 4 2 2 2 2 4 2 2 2
D.取mg四种气体,质量相同的CO、H、O、CH、SO 五种气体含电子数分别为:m/44×22,m/2×2,
2 2 2 4 2
m/32×16,m/16×10,m/64×32,所含的电子数由多到少是:H>CH>CO=O =SO,故D错误;
2 4 2 2 2
故选D。
2.B
【解析】
【详解】
A.氖原子质量是ag,12C的原子质量是bg,则该氖原子相对原子质量= = ,故A正确;
B.“g”是质量的单位,氖原子质量是ag,N 是阿伏加德罗常数的值,则氖原子摩尔质量为aN g/mol,故
A A
B错误;
C.Wg该氖原子的物质的量是 = mol,故C正确;
D.氖原子质量是a g,则Wg该氖原子含有原子数目= = ,氖原子含有10个质子,故含有质子数
目为 ,故D正确;
故答案为B。
3.B
【解析】【详解】
A、切开的金属Na暴露在空气中,光亮表面逐渐变暗是生成氧化钠的原因,选项A错误;
B、将Na块放入水中,反应生成氢氧化钠和氢气:2Na+2HO=2NaOH+H↑,选项B正确;
2 2
C、NaO 在潮湿的空气中放置一段时间,变成白色黏稠物是因为2NaO+2H O=4NaOH+O ↑,生成的氢氧
2 2 2 2 2 2
化钠潮解,选项C错误;
D、向NaHCO 溶液中加入过量的澄清石灰水,出现白色沉淀:NaHCO +Ca(OH) =CaCO ↓+NaOH+
3 3 2 3
HO,选项D错误;
2
答案选B。
4.D
【解析】
【详解】
A.Cl 溶于水生成HClO,HClO具有漂白性,能使紫色石蕊试液变成无色,故A不选;
2
B.新制氯水中含有HClO,HClO具有漂白性,能使紫色石蕊试液变成无色,故B不选;
C.NaO 具有漂白性,能使紫色石蕊试液变成无色,故C不选;
2 2
D.NaOH具有碱性,没有漂白性,能使紫色石蕊试液变成蓝色,不能使紫色石蕊试液变成无色,故D选;
故选D。
5.B
【解析】
【详解】
A.因钠很活泼,易被氧化,则金属钠在空气中易氧化形成氧化钠,出现表面变暗现象,故A正确;
B.氧化钠与空气中的水反应生成氢氧化钠,氢氧化钠吸收空气中的水蒸气在表面形成了溶液,故B错误;
C.生成的氢氧化钠再与空气中的二氧化碳反应生成碳酸钠的结晶水合物,最终风化变成的白色粉末为碳
酸钠,故C正确;
D. 最后白色粉末为碳酸钠,质量比金属钠的质量大,故D正确;
故选B。
6.B
【解析】
【详解】
A、过氧化钠可以和二氧化碳及水反应生成氧气,可用于呼吸面具或潜水艇中作为氧气的来源,故A正确;
B、氧化钠与水反应生成氢氧化钠,溶液呈碱性,所以将NaO加到酚酞溶液中,溶液变红色,故B错误;
2
C、2NaO+2H O=4NaOH+O ↑,而NaO+HO=2NaOH,如果NaO样品中含有NaO,加入水后会产生气
2 2 2 2 2 2 2 2 2
泡,故C正确;
D、过氧化钠为淡黄色粉末状固体,故D正确;
故选B。
【点睛】
本题的易错点为B,要注意区分NaO和NaO 性质的不同,过氧化钠具有强氧化性,而氧化钠没有。
2 2 2
7.D【解析】
【详解】
A.1 mol水含有的氢原子数目为1 mol×2×N =2N ,故A错误;
A A
B.氩气为单原子分子,因此1 mol氩气分子所含的原子数目为N ,故B错误;
A
C.0.5 molNa CO 中含有的钠离子为0.5 mol×2×N =N ,故C错误;
2 3 A A
D. 0.5 mol硝酸中含有的氧原子为0.3mol×3×N =1.5N ,故D正确;
A A
答案:D
8.A
【解析】
【分析】
等质量的氧气和二氧化碳,设质量均为mg,则氧气和二氧化碳的物质的量分别是 。
【详解】
A. 质子数之比为 1∶1,故A正确;
B. 氧原子数比 11∶8,故B错误;
C. 物质的量之比为 =11∶8,故C错误;
D. 原子个数比 22∶24,故D错误。
9.B
【解析】
【详解】
气体粒子间距离较大,远大于粒子的直径,所以粒子大小可以忽略不计,决定气体体积的因素主要为构成
物质的粒子数和粒子间的距离,答案为B。
10.B
【解析】
【分析】
干燥的氯气不能漂白有色布条,含水蒸气的氯气能使有色布条褪色,A处通入干燥的氯气,打开B,C中
红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去,说明从D中出来的气体为氯气和水蒸气,据
此分析解答。
【详解】
A.浓硫酸为干燥剂,能够吸收水蒸气,当氯气通过盛有浓硫酸的D瓶时,出来的仍然是干燥的氯气,不
能使有色布条褪色,故A错误;
B.干燥的氯气通过盛有饱和食盐水的D装置,出来的气体中含有氯气和水蒸气,能够使有色布条褪色,
故B正确;C.D中装有氢氧化钠,氯气通过D时与氢氧化钠反应,被吸收,从D中出来的气体中不含氯气,不能使
有色布条褪色,故C错误;
D.D中装有氢氧化钙悬浊液,氯气通过D时与氢氧化钙悬浊液反应,被吸收,从D中出来的气体中不含
氯气,不能使有色布条褪色,故D错误;
故选B。
11.C
【解析】
【详解】
A.Cl 与水反应生成HClO,所以Cl 可用于自来水的杀菌消毒,选项A正确;
2 2
B.Cl 使湿润的淀粉KI试纸变蓝是因为Cl 氧化KI产生I,淀粉遇I 变蓝,选项B正确;
2 2 2 2
C.Cl 与HO反应,Cl 中氯元素由0价变为+1价和-1价,既是氧化剂又是还原剂,HO中各元素化合价
2 2 2 2
不变,既不是氧化剂也不是还原剂,选项C错误;
D.Cl 与NaOH溶液反应生成NaCl、NaClO和HO,反应的离子方程式为:Cl+2OH-=Cl-+ClO-+H O,选
2 2 2 2
项D正确。
答案选C。
【点睛】
本题考查氯气的性质,易错点为选项B,碘离子的还原性强于氯离子,氯气氧化碘离子生成碘单质。碘遇
淀粉变蓝。
12.B
【解析】
【详解】
已知NaCO+H O+CO=2NaHCO,则除去小苏打溶液中混有的少量苏打,最好向溶液中通入过量CO 气
2 3 2 2 3 2
体即可,故答案为B。
13.D
【解析】
【详解】
A.CO 的摩尔质量是44g/mol,1molCO 的质量是1mol×44g/mol=44g,故A错误;
2 2
B.硝酸的相对分子质量为是63,则其摩尔质量63g/mol,故B错误;
C.氢原子质量为2g,氢原子物质的量为 =2mol,氢原子数目为2×6.02×1023,故C错误;
D.已知NaSO =2 Na++SO2-,则0.5molNa SO 溶于水中,所得溶液中Na+个数为6.02×1023,故D正确;
2 4 4 2 4
故答案为D。
14.B
【解析】
【详解】
A.反应过程中过氧化钠中氧元素的化合价由-1价变为-2价和0价,所以NaO 既是氧化剂,又是还原剂,
2 2
故A错误;B.根据A选项分析可知,B正确;
C.反应过程中过氧化钠中氧元素的化合价由-1价升高到0价,反应生成1个氧气分子,转移2个电子,所
以该反应中电子转移的数目为2e-,故C错误;
D.反应中氧化产物为氧气,还原产物为NaOH,故D错误;
故答案选B。
15.44 20% 40.8g/mol 2:1 8:3 1:2 D A
【解析】
【详解】
(1)假设一氧化碳的物质的量为x mol,二氧化碳的物质的量为y mol,则有x+y= =1.25,
28x+44y=51,解x=0.25,y=1,则二氧化碳的质量为44g,一氧化碳的物质的量分数为 =20%,混合
气体的平均摩尔质量为 =40.8g/mol;
(2) 同温同压下,同质量的NH 和HS气体体积比等于摩尔质量的反比,即为34:17=2:1,原子个数之比
3 2
等于(2×4):(1×3)=8:3,密度比等于摩尔质量之比,即为17:34=1:2;
(3) 若反应在压强恒定、容积可变的容器内进行,四个反应的气体体积取决于气体的物质的量的变化,A
中体积变小,由于产生固体硫,所以气体密度减小;B中气体体积变小,密度变大;C中气体体积不变,
密度不变;D中气体体积变大,密度变小;故符合题意的为D和A。
16.MnO +4H++2Cl-=Mn2+ + Cl ↑+2H O 11.9 0.2
2 2 2
MnO Mn2+ a b
2
【解析】
(1)根据化学反应方程式可知该反应的离子方程式为MnO +4H++2Cl- Mn2++Cl↑+2H O:根据
2 2 2
可知该盐酸的物质的量浓度为 =11.9mol/L。(2)反应中氯元素
化合价从-1价升高到0价,Mn元素化合价从+4价降低到+2价,所以用双线桥法表示出该反应的电子转
移方向和数目为 。(3)8.7gMnO 的物质的量是8.7g÷87g/mol=
2
0.1mol,根据电子得失守恒可知与足量浓盐酸反应能使0.2molHCl被氧化;其中还原过程为MnO →Mn2+。
2
(4)根据方程式可知还有氯化锰生成,所以浓盐酸在反应中显示出来的性质是酸性和还原性,答案选
ab。
17.②⑤ ①⑥ ②⑦ ①③⑥⑦ NaOH和NaCO NaHCO 和NaCO FeCl +3H O
2 3 3 2 3 3 2
Fe(OH) (胶体)+3HCl 电中性 小于
3【解析】
【分析】
(1)在水溶液中或熔融状态下能够导电的化合物为电解质;
(2)离子反应体现的是强酸与强碱反应生成水的过程;
(3)该物质与酸、碱均反应;
(4)有自由移动的离子或电子的物质能导电;
(5)④与⑥充分反应后,根据二氧化碳的用量分情况讨论;
(6)实验室用饱和FeCl 溶液滴入沸水中加热制备氢氧化铁胶体,胶体不带电,得到的胶体微粒是多个氢
3
氧化铁的聚集体,据此分析作答;
【详解】
(1)根据定义可知,①③⑥⑦虽能导电,但属于混合物,不属于电解质;④虽为化合物,但在水溶液中
不是本身电离出自由移动的阴阳离子,所以不属于电解质;②和⑤属于盐,在水溶液中或熔融状态下能够
导电,属于电解质,
故答案为:②⑤;
(2)离子方程式为:H++OH-=H O,说明是强酸和强碱的中和反应,上述物质中,①稀硫酸与⑥稀氢氧化
2
钠的反应符合该离子方程式,
故答案为:①⑥;
(3)②小苏打是NaHCO 的俗名,它可与H+反应生成水和二氧化碳,同时可以与OH-反应生成碳酸根离
3
子与水;⑦硝酸亚铁溶液其溶质Fe(NO ) 遇NaOH会生成氢氧化亚铁沉淀与水,当加入盐酸时,因溶液中
3 2
的硝酸根离子与氢离子结合会具有强氧化性,所以Fe2+会与H+和NO -发生氧化还原反应,故符合题意的有:
3
②⑦,
故答案为:②⑦;
(4)上述物质中,溶液有自由移动的阴阳离子,所以导电的物质为:①③⑥⑦,
故答案为:①③⑥⑦;
(5)二氧化碳与NaOH充分反应,①若CO 少量,则发生的反应为:CO+2NaOH(过量) = Na CO+H O,
2 2 2 3 2
则溶液中溶质为NaOH和NaCO,水分蒸干后,得到的固体组成成分为:NaOH和NaCO;②CO 过量,
2 3 2 3 2
则过量的CO 继续与生成的NaCO,其化学方程式为:CO+ Na CO + H O = 2 NaHCO ,其固体组成成分
2 2 3 2 2 3 2 3
可能是:NaHCO 和NaCO,
3 2 3
故答案为:NaOH和NaCO、NaHCO 和NaCO;
2 3 3 2 3
(6)实验室制备Fe(OH) 胶体的化学方程式为:FeCl +3H O Fe(OH) (胶体)+3HCl,
3 3 2 3
故答案为:FeCl +3H O Fe(OH) (胶体)+3HCl;得到的胶体不带电,即电中性;一个氢氧化铁胶粒是多
3 2 3
个氢氧化铁的聚集体,所以1 mol FeCl 形成的胶体个数小于N 个,
3 A
故答案为:FeCl +3H O Fe(OH) (胶体)+3HCl;电中性;小于。
3 2 3
【点睛】
本题第(5)问,学生要理清氢氧化钠与二氧化碳可能发生的反应,结合产物分析作答,特别注意的是,
题设中将溶液小火蒸干,意味着固体成分可以有碳酸氢钠。学生审题要认真仔细,做题才能提高正答率。18.NaOH溶液 2NaO+2CO===2Na CO+O g f e a b c 防止空气中的水蒸气和二氧
2 2 2 2 3 2
化碳进入装置Ⅰ 过氧化钠和水反应生成氢氧化钠 反应生成的HO 具有漂白作用 2HO
2 2 2 2
2HO+O
2 2
【解析】
【详解】
(1)装置Ⅳ是利用NaOH溶液除去空气中的二氧化碳,若没有该装置,空气的CO 和NaO 反应会生成碳酸
2 2 2
钠,发生反应方程式为2NaO +2CO == 2Na CO + O ↑;
2 2 2 2 3 2
(2)依据上述分析确定连接顺序,组合实验装置时各仪器的正确连接顺序为Ⅳ、Ⅲ、Ⅰ、Ⅱ,根据气流方向
各接口的连接顺序为h g f e a b c;
(3)利用装置Ⅱ中有碱石灰防止空气中的水分和二氧化碳倒吸进入装置Ⅰ;
(4)①过氧化钠和水反应生成氢氧化钠是碱,碱遇酚酞变红;红色褪去的可能原因是过氧化钠和水反应生成
的过氧化氢具有氧化性,能氧化有色物质,故答案为:过氧化钠和水反应生成碱氢氧化钠;反应生成的
HO 具有漂白作用;
2 2
②过氧化氢在二氧化锰做催化剂分解生成水和氧气,反应的化学方程式为:2HO 2HO+O。
2 2 2 2
【点睛】
本题考查了物质性质的实验验证和分析判断,实验步骤的设计方法和注意问题,掌握物质性质和实验基本
操作是解题关键,题目难度中等。