文档内容
第二章 《化学反应与能量》单元评估卷A
限时:90分钟 总分:100分
第Ⅰ卷(选择题,共48分)
一、选择题(共48分,每小题3分,每小题有1个正确选项)
1.对于反应中的能量变化,下列表述中正确的是( )
A.放热反应中,反应物的总能量大于生成物的总能量 B.断开化学键的过程会放出能量
C.加热才能发生的反应一定是吸热反应 D.氧化还原反应均为吸热反应
2.下列关于原电池的叙述,正确的是( )
A.任何化学反应,均可以设计成原电池 B.原电池是把化学能直接转化成电能的装置
C.原电池的两极必须都是金属 D.原电池可以提供持续稳定的电流,应用十分广泛
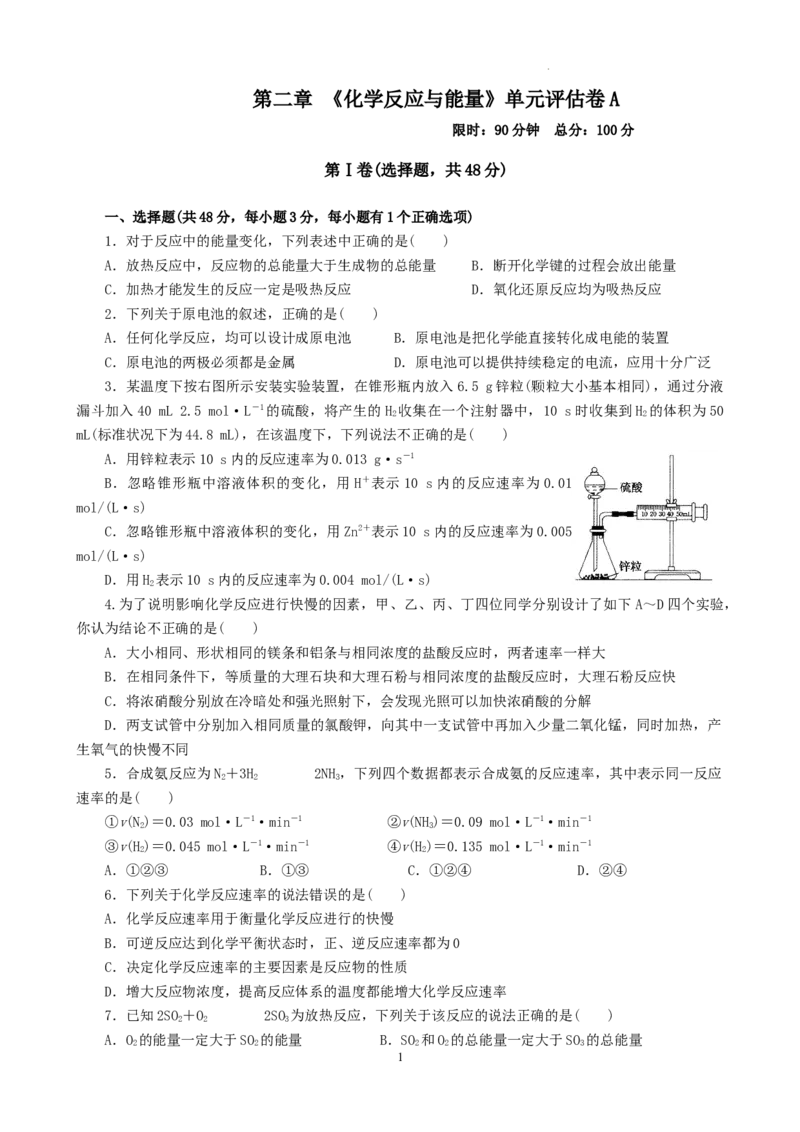
3.某温度下按右图所示安装实验装置,在锥形瓶内放入6.5 g锌粒(颗粒大小基本相同),通过分液
漏斗加入40 mL 2.5 mol·L-1的硫酸,将产生的H 收集在一个注射器中,10 s时收集到H 的体积为50
2 2
mL(标准状况下为44.8 mL),在该温度下,下列说法不正确的是( )
A.用锌粒表示10 s内的反应速率为0.013 g·s-1
B.忽略锥形瓶中溶液体积的变化,用 H+表示10 s内的反应速率为0.01
mol/(L·s)
C.忽略锥形瓶中溶液体积的变化,用Zn2+表示10 s内的反应速率为0.005
mol/(L·s)
D.用H 表示10 s内的反应速率为0.004 mol/(L·s)
2
4.为了说明影响化学反应进行快慢的因素,甲、乙、丙、丁四位同学分别设计了如下 A~D四个实验,
你认为结论不正确的是( )
A.大小相同、形状相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大
B.在相同条件下,等质量的大理石块和大理石粉与相同浓度的盐酸反应时,大理石粉反应快
C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解
D.两支试管中分别加入相同质量的氯酸钾,向其中一支试管中再加入少量二氧化锰,同时加热,产
生氧气的快慢不同
5.合成氨反应为N +3H2NH ,下列四个数据都表示合成氨的反应速率,其中表示同一反应
2 2 3
速率的是( )
①v(N)=0.03 mol·L-1·min-1 ②v(NH)=0.09 mol·L-1·min-1
2 3
③v(H)=0.045 mol·L-1·min-1 ④v(H)=0.135 mol·L-1·min-1
2 2
A.①②③ B.①③ C.①②④ D.②④
6.下列关于化学反应速率的说法错误的是( )
A.化学反应速率用于衡量化学反应进行的快慢
B.可逆反应达到化学平衡状态时,正、逆反应速率都为0
C.决定化学反应速率的主要因素是反应物的性质
D.增大反应物浓度,提高反应体系的温度都能增大化学反应速率
7.已知2SO+O2SO 为放热反应,下列关于该反应的说法正确的是( )
2 2 3
A.O 的能量一定大于SO 的能量 B.SO 和O 的总能量一定大于SO 的总能量
2 2 2 2 3
1
学科网(北京)股份有限公司C.SO 的能量一定大于SO 的能量 D.因该反应为放热反应,故不必加热反应就可发生
2 3
8.在盛有稀硫酸的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
A.铜片上发生了还原反应 B.电子通过导线由铜片流向锌片
C.正极有O 逸出 D.正极附近的SO浓度逐渐增大
2
9.硫代硫酸钠溶液与稀硫酸反应的化学方程式为NaSO +HSO===NaSO +SO↑+S↓+HO,下列各
2 2 3 2 4 2 4 2 2
组实验中最先出现浑浊的是( )
NaSO 溶液 稀硫酸 HO
2 2 3 2
实验 反应温度/℃
V/mL c/mol·L-1 V/mL c/mol·L-1 V/mL
A 25 5 0.1 10 0.1 5
B 25 5 0.2 5 0.2 10
C 35 5 0.1 10 0.1 5
D 35 5 0.2 5 0.2 10
10.已知:1 mol H(g)与1 mol Br(g)完全反应生成2 mol HBr(g)时放出72 kJ的热量,有关物质的
2 2
相关数据如下表:
化学键 H(g) Br(g) HBr(g)
2 2
断裂1 mol化学键需要吸收的能量/kJ 436 a 369
则表中a为( )
A.404 B.260 C.230 D.200
11.下列图示变化表示吸热反应的是( )
12.一定温度下,反应 2SO(g)+O(g)2SO(g)达到平衡时,n(SO)∶n(O)∶n(SO)=
2 2 3 2 2 3
2∶3∶4。减小反应体系的体积,反应再次达到平衡时,n(O)=0.8 mol,n(SO)=1.4 mol,此时SO 的
2 3 2
物质的量应是( )
A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol
13.对于放热反应Zn+HSO===ZnSO+H↑,下列叙述正确的是( )
2 4 4 2
A.反应过程中的能量关系可用右图表示
B.1 mol Zn的能量大于1 mol H 的能量
2
C.若将其设计为原电池,则锌作正极
D.若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气 体
一定为11.2 L
14.在相同条件下,做HO 分解的对比实验,其中(1)加入MnO ,
2 2 2
(2)不加MnO。下列各项是反应放出O 的体积随时间变化的示意图,其中正确的是( )
2 2
2
学科网(北京)股份有限公司15.生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO ,干燥后再安装,充电
4
后即可使用,发生的反应:2PbSO +2HOPbO +Pb+2HSO 。下列对铅蓄电池的说法错误的是(
4 2 2 2 4
)
A.需要定期补充硫酸 B.放电时Pb作负极,PbO 作正极
2
C.放电时负极上发生的反应是Pb+SO-2e-===PbSO D.放电时电解质溶液的密度减小
4
16.一定温度下,向容积为2 L的密闭容器中通入两种气体并使其发生化学反应,反应中各物质的
物质的量变化如右图所示,对该反应的推断合理的是( )
A.该反应的化学方程式为3B+4D6A+2C
B.0~1 s内,v(A)=v(C)
C.0~6 s内,B的平均反应速率为0.05 mol·L-1·s-1
D.0~6 s内,各物质的反应速率相等
第Ⅱ卷(非选择题,共52分)
本部分包括5个小题,共52分
17. (12分)化学反应与能量有着密不可分的关系,回答下列问题。
Ⅰ.已知31 g白磷变为31 g红磷释放能量。试回答:
(1)上述变化属于________(填“物理”或“化学”)变化。
(2)31 g白磷具有的能量______(“>”或“<”)31 g红磷具有的能量,常温常压下,______更稳定。
(3)31 g白磷完全燃烧释放的能量________(“>”或“<”)31 g红磷完
全燃烧释放的能量。
Ⅱ.从理论上讲,氧化还原反应都可以设计成原电池。请你根据以下这
个反应:Cu+2FeCl===CuCl +2FeCl ,设计一个原电池(如右图),在图中
3 2 2
括号内标明正负极的材料及电解质溶液。
18. (12分)工业合成氨的反应:N +3H2NH 是一个可逆反应,反
2 2 3
应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N
键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N 完全反应生成NH 可________(填“吸收”或“放出”)热量________kJ。
2 3
(2)如果将1 mol N 和3 mol H 混合,在一定条件下使其充分反应,反应放出的热量总小于上述数值,
2 2
其原因是_____________。
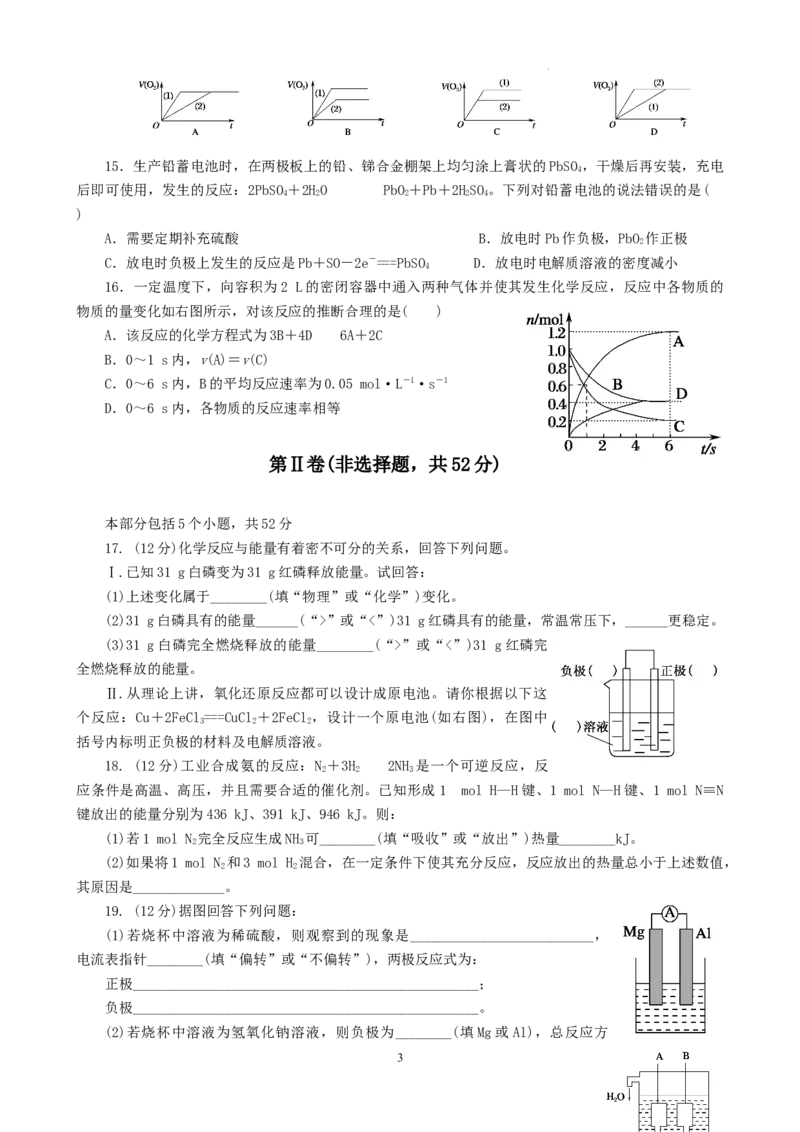
19. (12分)据图回答下列问题:
(1)若烧杯中溶液为稀硫酸,则观察到的现象是__________________________,
电流表指针________(填“偏转”或“不偏转”),两极反应式为:
正极_________________________________________________;
负极_________________________________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应方
3
学科网(北京)股份有限公司程式为________。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如下图所示:A、B两个电极均由多孔的碳块
组成。该电池的正极反应式为:_________________________。
(4)如果将上述装置中通入的H 改成CH 气体,也可以组成一个原电池装置,电池的总反应方程式为:
2 4
CH+2O+2KOH===KCO+3HO,则该电池的负极反应式为:_________________________。
4 2 2 3 2
20. (6分)某可逆反应在不同反应时间各物质的物质的量的变化
情况如图所示。
则该反应的反应物是________,生成物是________,化学方程式
是__________________;反应开始至2 min,能否表示出C的反应速
率?________,若能,其反应速率为多少,若不能,则其原因是什么?
________________________;2 min后,A、B、C各物质的量不再随
时间的变化而变化,说明在此条件下,反应已达到了________状态。
21.(10分)已知电极材料:铁、铜、银、石墨、锌、铝;电解
质溶液:CuCl 溶液、Fe(SO) 溶液、稀硫酸。按要求回答下列问题:
2 2 4 3
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用。原因是__________________________。
(2)若电极材料选铜和石墨,电解质溶液选 Fe(SO) 溶液,外加导线,________(填“能”或“不
2 4 3
能”)构成原电池。若能,写出电极反应,负极:____________,正极:________________________。
(若不能,后两空不填)
(3)设计一种以铁和稀硫酸反应为原理的原电池,要求画出装置图(需标明电极材料及电池的正、负
极)。
答案
1.A 断开化学键需要吸收能量,B错误;有些放热反应也需要加热才能进行,C错误;大多数自发
进行的氧化还原反应都是放热反应,D错误。
2.B 原电池中的氧化还原反应均是自发进行的,故非自发的氧化还原反应不能设计成原电池,如
2HO=====2H↑+O↑,A错误;原电池的两极必须能导电,但不一定都是金属,如干电池中的正极是碳
2 2 2
棒,为非金属,C错误;原电池是一种简易的装置,能产生电流但不稳定,D错误。
3.A Zn和稀硫酸反应:Zn+HSO===ZnSO+H↑,收集到H 的物质的量n(H)==0.002 mol,锌粒
2 4 4 2 2 2
为固体,其浓度可视为不变,不能用来表示反应速率,A错误;用H+表示10 s内的反应速率为=0.01
mol/(L·s),B正确;v(Zn2+)=v(H+)=0.005 mol/(L·s),C正确;v(H)==0.004 mol/(L·s),D正
2
确。
4.A Mg的活泼性大于Al,故Mg与盐酸反应速率快,A错误;固体颗粒越小,其表面积越大,故等
质量的大理石粉表面积远远大于大理石块,反应速率越快,B正确;在光照条件下,浓硝酸分解比在冷暗
处快,C正确;MnO 作为催化剂加快KClO 的分解,D正确。
2 3
5.D 根据同一个化学反应中,各物质的反应速率之比等于其化学计量数之比,
v(N)∶v(H)∶v(NH)=1∶3∶2,故D项正确。
2 2 3
6.B 可逆反应达到化学平衡状态时,正、逆反应速率相等但均不为0,B项错误。
7.B 放热反应只表明反应物的总能量比生成物的总能量高,而加热是反应的条件,二者无必然联系,
许多放热反应必须加热才能发生,故B项正确,D项错误。
8.A 因为锌的活动性强于铜的,所以锌作负极,失去电子,化合价升高,发生氧化反应;铜作正
4
学科网(北京)股份有限公司极,H+在正极得到电子,发生还原反应放出H ,A正确,C错误。在外电路中,电子由负极(锌片)通过导
2
线流向正极(铜片),B错误;在内电路中,阳离子向正极移动,阴离子向负极移动,即负极附近的 SO浓
度逐渐增大,D错误。
9.D 温度越高,反应速率越大;反应物的浓度越大,反应速率越大。反应速率越大,出现反应现
象就越快,D组最先出现浑浊。
10.C 化学键的键能与化学反应中能量变化的关系:化学反应中的能量变化值=反应物断裂化学键
吸收的总能量-生成物形成化学键放出的总能量。由于H(g)+Br(g)===2HBr(g)的反应为放热反应,则
2 2
369×2-(436+a)=72,解得a=230。
11.A A中反应物的总能量小于生成物的总能量,为吸热反应;B中反应物的总能量大于生成物的
总能量,为放热反应。C中浓硫酸溶于水放热不是化学变化;D中活泼金属(如Zn)与酸的反应为放热反应。
12.A 设第一次达到平衡时,SO 、O 、SO 的物质的量依次为2x mol、3x mol、4x mol,再次达到
2 2 3
平衡时,SO 转化了y mol,则
2
2SO(g)+O(g)2SO(g)
2 2 3
第一次平衡时(mol) 2x 3x 4x
转化(mol) y y
第二次平衡时(mol) 2x-y 3x- 4x+y
解得:x=0.3,y=0.2,所以2x-y=0.4。
13.A 由于该反应是一个放热反应,依据能量守恒原理可知,反应物的总能量大于生成物的总能量,
反应过程中的能量关系与题给图象相符,A项正确;反应物、生成物各有两种,无法确定Zn和H 所含能
2
量的高低,B项错误;若将其设计为原电池,则锌作负极,C项错误;因未指明温度、压强等条件,故气
体体积不确定,D项错误。
14.A 由图象知,横坐标为时间,纵坐标为V(O),只要HO 的量相同,两种情况下最终产生O 的
2 2 2 2
体积应相同。(1)中MnO 作催化剂,加快了HO 的分解,相同时间内产生O 的体积比(2)的大,反应结束
2 2 2 2
时所用时间短,故选A。
15.A 铅蓄电池放电时相当于原电池,Pb作负极,PbO 作正极,负极发生的反应是Pb失去电子生
2
成Pb2+,Pb2+与溶液中的SO反应生成PbSO 溶液,放电时消耗的HSO 与充电时生成的HSO 相等,在电池
4 2 4 2 4
制备时,PbSO 的量是一定的,说明不用补充硫酸。放电时,HSO 被消耗,溶液中的HSO 的物质的量浓
4 2 4 2 4
度减小,所以溶液的密度也随之减小。
16.C 由相同时间内同一反应中,各物质的物质的量变化之比等于其化学计量数之比知,
Δn(B)∶Δn(C)∶ΔDn(A)∶Δn(D)=3∶4∶6∶2,故该反应的化学方程式为3B+4C6A+2D,A项错
误;0~1 s内,v(A)==0.3 mol·L-1·s-1,v(C)==0.2 mol·L-1·s-1,B项错误;0~6 s内,v(A)
==0.1 mol·L-1·s-1,v(B)==0.05 mol·L-1·s-1,v(C)=≈0.067 mol·L-1·s-1,v(D)=≈0.033
mol·L-1·s-1,C项正确,D项错误。
17.Ⅰ.(1)化学 (2)> 红磷 (3)>
Ⅱ.负极:Cu 正极:Ag(Pt、C等) 电解液:FeCl 溶液
3
18.(1)放出 92
(2)该反应是可逆反应,1 mol N 和3 mol H 不能完全反应,因此放出的热量总是小于92 kJ
2 2
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器中进行,反应经过10 min后,生成10 mol
NH,则用N 表示的化学反应速率是________ mol·(L·min)-1。
3 2
(4)一定条件下,当合成氨反应达到化学平衡时,下列说法正确的是________。
5
学科网(北京)股份有限公司a.正反应速率和逆反应速率相等 b.正反应速率最大,逆反应速率为0
c.N 的转化率达到最大值 d.N 和H 的浓度相等
2 2 2
e.N、H 和NH 的体积分数相等 f.反应达到最大限度
2 2 3
(3)0.25 (4)acf
解析:(1)断键需要吸收的能量为:
946 kJ+3×436 kJ=2 254 kJ,
形成6 mol N—N新键释放的能量为:
6×391 kJ=2 346 kJ,
所以1 mol N 完全反应放出热量,其值为:
2
2 346 kJ-2 254 kJ=92 kJ。
(2)N 和H 生成NH 的反应是可逆反应,反应物不可能全部转化。
2 2 3
(3)v(N)==0.25 mol/(L·min)。
2
19.(1)镁逐渐溶解,铝上有气泡冒出 偏转
2H++2e-===H↑
2
Mg-2e-===Mg2+
(2)Al 2Al+2NaOH+2HO===2NaAlO+3H↑
2 2 2
(3)O+2HO+4e-===4OH-
2 2
(4)CH+10OH--8e-===CO+7HO
4 2
解析:(1)该装置形成原电池,Mg作负极,Al作正极,两极反应式为:正极2H++2e-===H↑,负极
2
Mg-2e-===Mg2+,所以镁逐渐溶解,铝上有气泡冒出,电流表指针发生偏转。
(2)若烧杯中溶液为氢氧化钠溶液,虽然Mg比Al活泼,但Al可以与氢氧化钠溶液反应而Mg不反应,
故Al作负极,总反应方程式就是Al与氢氧化钠溶液的反应方程式,即2Al+2NaOH+2HO===2NaAlO +
2 2
3H↑。
2
(3)由题图知该装置为H—O—KOH燃料电池,正极反应式为:O+2HO+4e-===4OH-。
2 2 2 2
(4)该电池的正极反应式为:O +2HO+4e-===4OH-,用总反应式减正极反应式得负极反应式:CH +
2 2 4
10OH--8e-===CO+7HO。
2
20.A、B C 2A+B2C 不能 无法求出浓度变化值 平衡
解析:从图象上可看出,A、B的物质的量随时间的变化而减小,C的物质的量随时间的变化而增大,
故A、B为反应物,C为生成物;由A减少2 mol,B减少1 mol,C增加2 mol可推知反应方程式为2A+
B2C;因只知A、B、C的物质的量的变化,而不知其浓度变化,故无法求其反应速率;2 min后,A、
B、C的物质的量不再随时间而变,即A、B、C的正逆反应速率相等,反应达到平衡。
21.(1)二者连接在一起时,接头处在潮湿的空气中构成原电池而被腐蚀
(2)能 Cu-2e-===Cu2+ 2Fe3++2e-===2Fe2+
6
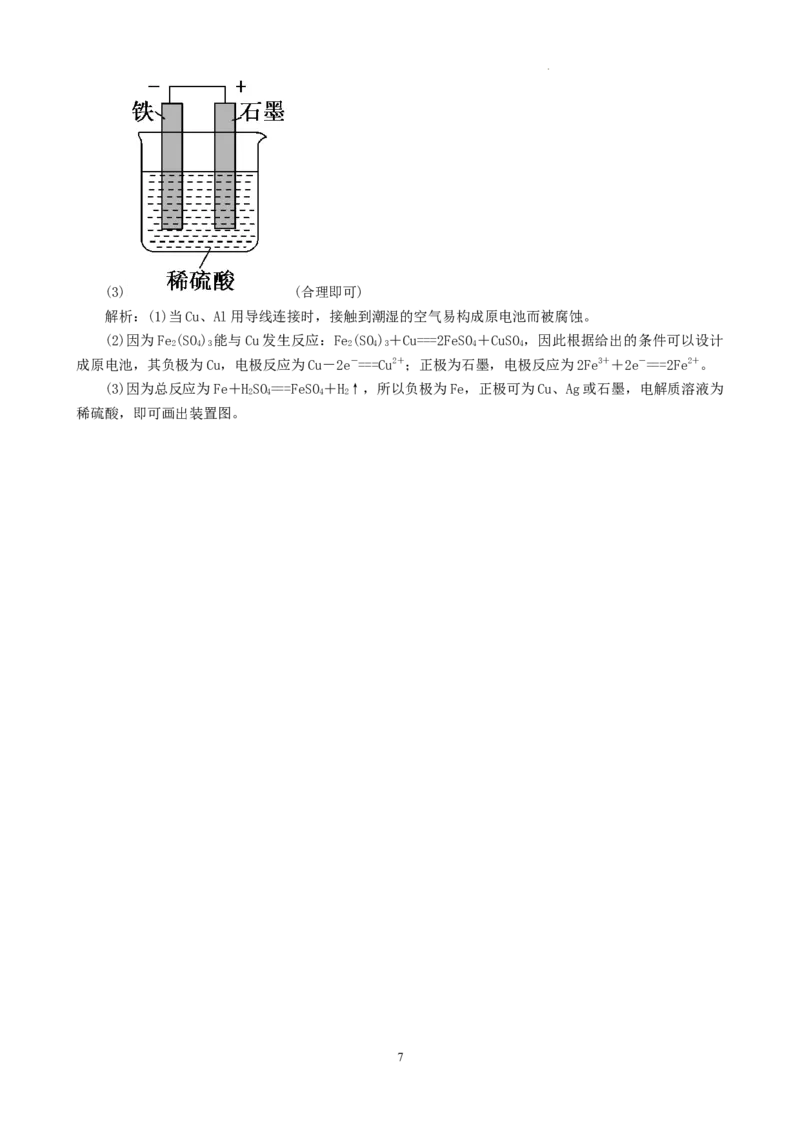
学科网(北京)股份有限公司(3) (合理即可)
解析:(1)当Cu、Al用导线连接时,接触到潮湿的空气易构成原电池而被腐蚀。
(2)因为Fe(SO) 能与Cu发生反应:Fe(SO) +Cu===2FeSO +CuSO ,因此根据给出的条件可以设计
2 4 3 2 4 3 4 4
成原电池,其负极为Cu,电极反应为Cu-2e-===Cu2+;正极为石墨,电极反应为2Fe3++2e-===2Fe2+。
(3)因为总反应为Fe+HSO===FeSO+H↑,所以负极为Fe,正极可为Cu、Ag或石墨,电解质溶液为
2 4 4 2
稀硫酸,即可画出装置图。
7
学科网(北京)股份有限公司8
学科网(北京)股份有限公司