文档内容
第一章 第2节 氯及其化合物-课时作业2022-2023学年高中
化学人教版(2019)必修第一册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列关于物质制备的说法正确的是
A.工业上用氯气与澄清石灰水反应制漂白粉
B.工业上用电解熔融NaCl制备金属Na
C.工业上常用H 与Cl 光照制备HCl
2 2
D.工业上主要用NaO和HO反应制备NaOH
2 2
2.下列有关各种物质的物理性质的叙述中不正确的是
A.金属钠的氧化物都是淡黄色的固体 B.金属钠的密度比水小
C.纯碱和小苏打都能溶于水 D.Cl 是一种黄绿色的有毒气体
2
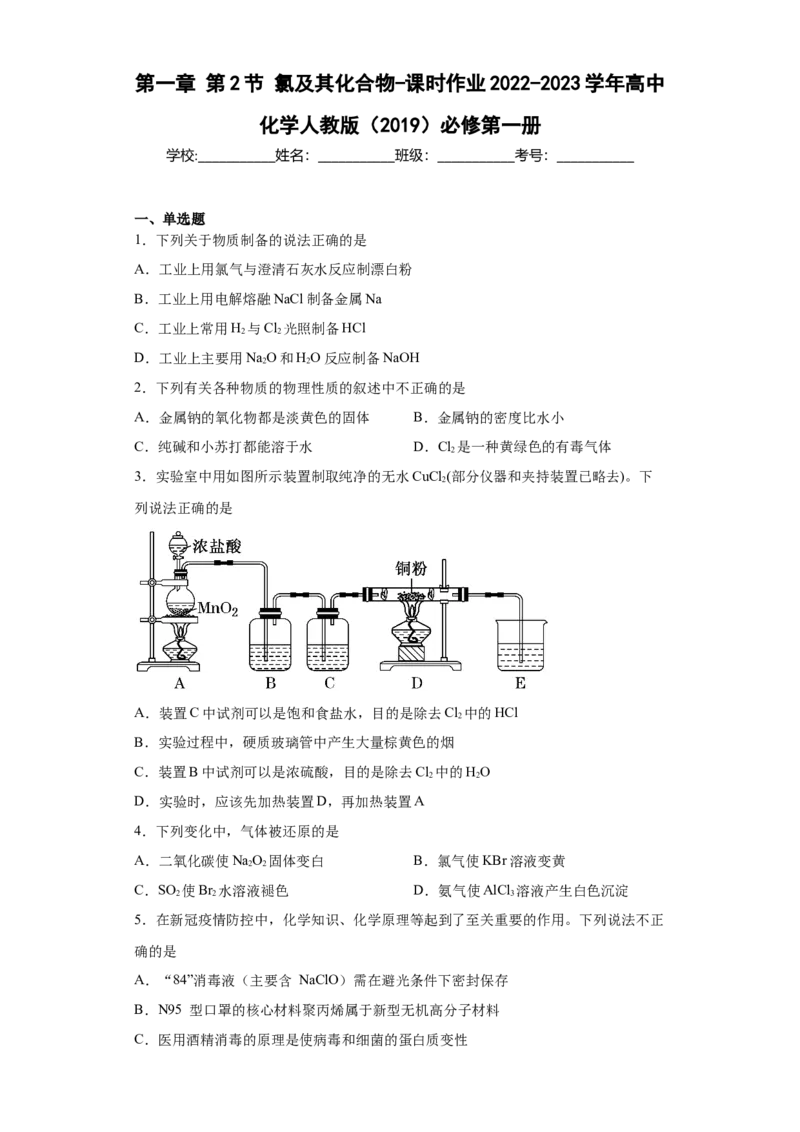
3.实验室中用如图所示装置制取纯净的无水CuCl (部分仪器和夹持装置已略去)。下
2
列说法正确的是
A.装置C中试剂可以是饱和食盐水,目的是除去Cl 中的HCl
2
B.实验过程中,硬质玻璃管中产生大量棕黄色的烟
C.装置B中试剂可以是浓硫酸,目的是除去Cl 中的HO
2 2
D.实验时,应该先加热装置D,再加热装置A
4.下列变化中,气体被还原的是
A.二氧化碳使NaO 固体变白 B.氯气使KBr溶液变黄
2 2
C.SO 使Br 水溶液褪色 D.氨气使AlCl 溶液产生白色沉淀
2 2 3
5.在新冠疫情防控中,化学知识、化学原理等起到了至关重要的作用。下列说法不正
确的是
A.“84”消毒液(主要含 NaClO)需在避光条件下密封保存
B.N95 型口罩的核心材料聚丙烯属于新型无机高分子材料
C.医用酒精消毒的原理是使病毒和细菌的蛋白质变性D.传播新冠病毒的“飞沫”与空气形成的分散系是气溶胶
6.关于二氧化硫和氯气叙述正确的是
A.两种气体都是无色有毒的气体,且都可用水吸收以消除对空气的污染
B.二氧化硫与过量的氯气混合后通入水中能得到两种常用的强酸
C.两种气体都具有强氧化性,因此都能够使品红溶液褪色
D.两种气体分别溶于水,都可以与水反应且只生成相应的酸
7.下列叙述Ⅰ和叙述Ⅱ均正确并有因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
A 乙醛使溴水褪色 乙醛与 发生加成反应
B 氯水使红色布条褪色 氯气具有强氧化性
C 能使溴水褪色 具有漂白性
D 乙烯使酸性高锰酸钾溶液褪色 乙烯被高锰酸钾氧化
A.A B.B C.C D.D
8.下列说法正确的是
A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即
可
B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸
石,应立即停止加热,冷却后补加
C.在未知溶液中滴加BaCl 溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知
2
溶液中存在SO 2-或SO 2-
4 3
D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过
滤、干燥的方法
9.近期埃博拉病毒在非洲各国肆虐,严重威胁了非洲人民的生命。在此期间,环境消
毒是极其关键的,常常喷洒一种名为“84”的消毒液,其有效成分为NaClO。下列有关
“84”消毒液的说法正确的是
A.“84”的消毒液属于纯净物
B.“84”的消毒液除能杀菌消毒外,还可作漂白剂
C.“84”消毒液中的NaClO比较稳定,不需密封保存
D.“84”消毒液杀菌消毒过程中并未发生氧化还原反应
10.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验
现象和结论一致且正确的是
试卷第2页,共3页A.将新制氯水加入到滴有酚酞的NaOH溶液中,红色逐渐消失,说明NaOH被氯水
中的酸完全中和
B.先加入盐酸酸化,再加入 溶液产生白色沉淀,说明氯水中有 存在
C.溶液呈浅黄绿色,且有刺激性气味,说明有 分子存在
D.加入有色布条,一段时间后有色布条褪色,说明溶液中有 存在
11.为除去下列物质中所含的杂质,选用的实验操作方法正确的是
A.NaC1溶液(NaHCO ):加入稍过量的盐酸,加热
3
B.Cl(HCl气体):通过足量的NaOH溶液
2
C.CO(HCl):通过盛有饱和NaCO 溶液的洗气瓶
2 2 3
D.NaHCO 固体(Na CO):加热至固体质量不再变化
3 2 3
12.某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、NH +、SO 2-、SO 2-、CO2-、I-、
4 4 3 3
Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是
( )
A.该溶液X中可能有Fe3+、Na+
B.该溶液可能由是硫酸亚铁、碘化钾和氯化铵溶于水后得到的
C.如果气体Y能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有NH +
4
D.取样溶液Z,滴加氯化钡溶液出现沉淀,可推出X中一定存在SO 2-、SO 2-中的某
4 3
一种
二、填空题
13.完成下列问题
(1)Na O 与CO 反应的化学方程式:_______。
2 2 2
(2)Cl 与水反应的离子方程式:_______。
2
(3)工业上用氯气通入石灰乳[Ca(OH) ]制取漂白粉的化学方程式:_______。
2
(4)为了除去NaCO 溶液中混有的少量NaHCO ,向其中加入适量的NaOH溶液,写出
2 3 3
该反应的离子方程式:_______。(5)次磷酸(H PO )是一种精细磷化产品,是一元中强酸,具有较强的还原性。HPO 可
3 2 3 2
将溶液中的Ag+还原为银,从而可用于化学镀银。利用HPO 进行化学镀银反应中,氧
3 2
化剂Ag+与还原剂HPO 的数目之比为4:1,则氧化产物为_______(填化学式)。
3 2
14.现有下列4种物质:① NH 、② SO 、③ NaHCO 、④ Ca(ClO) 。其中,受热分
3 2 3 2
解产生CO 的是_____(填序号,下同);遇氯化氢产生白烟的是_____;能使湿润的
2
蓝色石蕊试纸变红的是_____;可由氯气与冷的消石灰反应制得的是_____。
三、实验题
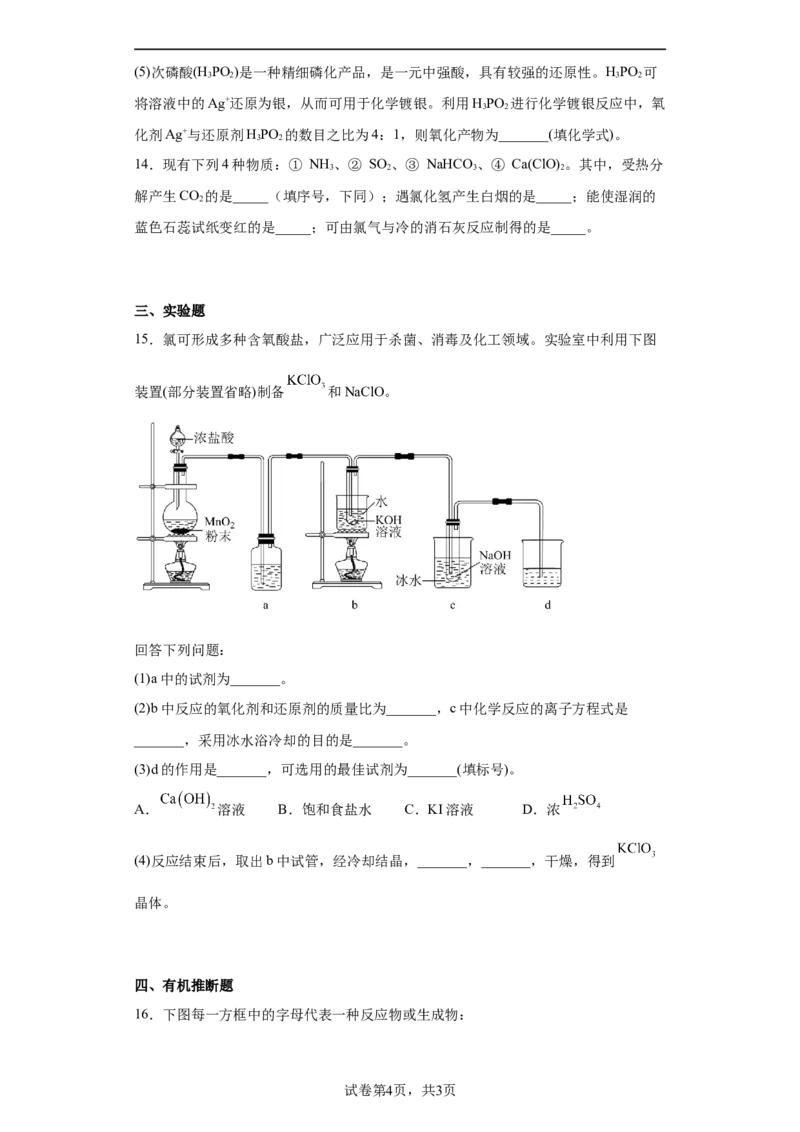
15.氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图
装置(部分装置省略)制备 和NaClO。
回答下列问题:
(1)a中的试剂为_______。
(2)b中反应的氧化剂和还原剂的质量比为_______,c中化学反应的离子方程式是
_______,采用冰水浴冷却的目的是_______。
(3)d的作用是_______,可选用的最佳试剂为_______(填标号)。
A. 溶液 B.饱和食盐水 C.KI溶液 D.浓
(4)反应结束后,取出b中试管,经冷却结晶,_______,_______,干燥,得到
晶体。
四、有机推断题
16.下图每一方框中的字母代表一种反应物或生成物:
试卷第4页,共3页物质A跟B反应生成物质E、F和G;物质C跟D反应生成气体I,I中含有植物生长
必须的元素之一,请填写下列空白:
(1)物质H的分子式是___________,气体I的分子式是____________
(2)写出电解饱和食盐水的化学方程式,并标出电子转移的方向和数目。
___________________________________________该反应中的还原剂是___________
(3)反应①的化学方程式是_________________________________________。参考答案:
1.B
【详解】A.氢氧化钙微溶于水,因此工业上将氯气通入冷的石灰乳中发生歧化反应制备
漂白粉,故A项错误;
B.钠单质属于活泼金属,因此工业上用电解熔融NaCl制备金属Na,故B项正确;
C.H 与Cl 光照下反应极易爆炸,不能用于制备HCl气体,工业上制取盐酸时,首先在反
2 2
应器中将氢气点燃,然后通入氯气进行反应,制得HCl气体,故C项错误;
D.NaO和HO反应制取NaOH反应剧烈,原料来源少且不符合经济效益,工业上是电解
2 2
饱和食盐水制备NaOH,故D项错误;
综上所述,正确的是B项。
2.A
【详解】A.金属钠的氧化物中过氧化钠是淡黄色的固体,氧化钠是白色固体,故A错误;
B.金属钠的密度比水小,比煤油的密度大,故B正确;
C.纯碱和小苏打都能溶于水,但碳酸钠的溶解度大于碳酸氢钠的溶解度,故C正确;
D.Cl 是一种黄绿色的有毒气体,密度比空气大,故D正确。
2
综上所述,答案为A。
3.B
【分析】二氧化锰与浓盐酸混合加热反应生成氯气,氯气中含有氯化氢和水蒸气,分别通
过饱和食盐水(装置B)、浓硫酸(装置C)除去,得到干燥纯净的氯气,在D中,铜和氯气加
热反应生成氯化铜,产生大量棕黄色的烟,多余的氯气被碱液吸收(装置E装有氢氧化钠溶
液),据以上分析解答。
【详解】A.为了得到干燥纯净的氯气,因此要先除去氯化氢,后除去水蒸气,因此装置
B盛放饱和食盐水,除去Cl 中的HCl,装置C中盛放浓硫酸,除去水蒸气,故A错误;
2
B.铜和氯气加热反应,产生棕黄色的烟,故B正确;
C.为了得到干燥纯净的氯气,因此要先除去氯化氢,后除去水蒸气,因此装置B盛放饱
和食盐水,除去Cl 中的HCl,装置C中盛放浓硫酸,除去水蒸气,故C错误;
2
D.实验时,为了排净装置内空气,应该先点燃装置A处的酒精灯,至产生的氯气充满整
个装置,然后再点燃D处的酒精灯,故D错误;
故选B。
4.B
【详解】A. 二氧化碳使NaO 固体变白,2NaO + 2CO = 2 Na CO + O ,过氧化钠既作
2 2 2 2 2 2 3 2氧化剂又作还原剂,二氧化碳没有被还原,故A不符合题意;
B. 氯气使KBr溶液变黄,氯气将溴离子氧化成溴单质,自身被还原为氯离子,故B符合
题意;
C. SO 使Br 水溶液褪色,二氧化硫、溴单质和水反应生成硫酸和氢溴酸,二氧化硫化合价
2 2
升高,被氧化,故C不符合题意;
D. 氨气使AlCl 溶液产生白色沉淀氢氧化铝沉淀,化合价无变化,故D不符合题意。
3
综上所述,答案为B。
【点睛】根据反应方程式分析化合价升降。
5.B
【详解】A. “84”消毒液中NaClO水解生成次氯酸,次氯酸见光会分解,故其需在避光条件
下密封保存,A说法正确;
B. N95 型口罩的核心材料聚丙烯属于有机高分子材料,B说法不正确;
C. 病毒和细菌均含蛋白质,医用酒精消毒的原理是使病毒和细菌的蛋白质变性,从而杀灭
病毒和细菌,C说法正确;
D. “飞沫”中的小水滴及病毒的直径达到了胶体粒子的直径范围,所以传播新冠病毒的
“飞沫”与空气形成的分散系是气溶胶,D说法正确。
本题选B。
6.B
【详解】A.氯气为黄绿色气体,故A错误;
B.二氧化硫与过量的氯气混合后通入水中发生氧化还原反应,能得到硫酸和盐酸两种强
酸,故B正确;
C.二氧化硫使品红褪色是因为漂白性,二氧化硫具有还原性,氧化性很弱,故C错误;
D.二氧化硫溶于水生成亚硫酸相应的酸,氯气与水发生氧化还原反应,生成盐酸和次氯
酸,故D错误;
故答案为B。
7.D
【详解】A.乙醛使溴水褪色是发生氧化反应,乙醛与 发生加成反应,两者没有因果关
系,A项错误;
B.氯水使红色布条褪色,是因为反应生成的次氯酸,结论错误,B项错误;
C. 能使溴水褪色,是因为其具有还原性,结论错误,C项错误;
答案第2页,共2页D.乙烯使酸性高锰酸钾溶液褪色,是因为酸性高锰酸钾溶液具有强氧化性,结论正确,D
项正确;
答案选D。
8.B
【详解】A、氯水中的次氯酸能漂白pH试纸,不能用pH试纸测定新制氯水的pH值,故A
错误;
B、液体加热要加沸石或碎瓷片,引入汽化中心,可防止溶液暴沸,如果加热一段时间后
发现忘记加碎瓷片,应该采取停止加热,待溶液冷却后重新添加碎瓷片,故B正确;
C、硫酸钡和AgCl均为不溶于酸的白色沉淀,则向某溶液中加入BaCl 溶液生成白色沉淀,
2
继续加稀硝酸沉淀不消失,溶液中可能含Ag+,故C错误;
D、氯化钠的溶解度受温度影响小,氯化钠中混有少量的硝酸钾,氯化钠是大量的,制得
的饱和溶液中硝酸钾量较少,不能采取降温结晶的方法,故D错误;
故答案选B。
9.B
【详解】A.“84”的消毒液是次氯酸钠的水溶液,属于混合物,A错误;
B.次氯酸根水解生成次氯酸,次氯酸具有漂白性,因此“84”的消毒液除能杀菌消毒外,
还可作漂白剂,B正确;
C.“84”消毒液在空气中久置,先发生反应CO+H O+NaClO=NaHCO+HClO,后发生反
2 2 3
应2HClO 2HCl+O ↑,从而变质,故“84”消毒液需密封保,C错误;
2
D.用“84”消毒液杀菌消毒,是因为次氯酸钠具有强氧化性,因此“84”消毒液杀菌消毒
过程中发生氧化还原反应,D错误;
答案选B。
10.C
【详解】A.将新制氯水加入到滴有酚酞的NaOH溶液中,红色逐渐消失;酸碱中和能使
酚酞褪色,次氯酸具有漂白性,次氯酸也能使酚酞褪色,故A错误;
B.先加入盐酸酸化,溶液中引入氯离子,再加入 溶液产生白色沉淀,不能说明氯
水中有 存在,故B错误;C.氯气为黄绿色气体,溶液呈浅黄绿色,且有刺激性气味,说明有 分子存在,故C正
确;
D.次氯酸具有漂白性,加入有色布条,一段时间后有色布条褪色,说明溶液中有 存
在,故D错误;
选C。
11.A
【详解】A.碳酸氢钠和盐酸反应生成氯化钠,加热后过量的盐酸挥发,可以除杂,故A
正确;
B.氯气、氯化氢均可以和氢氧化钠溶液反应,不能除杂,故B错误;
C.二氧化碳和氯化氢均可以和碳酸钠溶液反应,除去CO 中HCl用饱和碳酸氢钠溶液,
2
故C错误;
D.碳酸氢钠受热分解为碳酸钠,不能除杂,故D错误;
故选:A。
12.B
【分析】由实验流程可知,与过量氯水反应后的溶液中加入CCl 萃取后下层呈紫红色,说
4
明原溶液中含有I-,则能够氧化I-的Fe3+不能同时存在于溶液中;此时上层的水溶液中一定
含有氯水还原生成的Cl-,所以在该溶液中加入AgNO 生成的白色沉淀,不能说明原溶液
3
中是否存在Cl-;另外一份加入NaOH,加热,产生红褐色沉淀说明溶液中存在Fe3+,说明
原溶液中含有Fe2+,Fe2+的存在说明原溶液中不含有CO2-和SO 2-;生成气体Y,说明原溶
3 3
液中含有NH +,Y为氨气;Z的焰色反应为黄色说明含钠离子,但不能确定原溶液中是否
4
含钠离子,透过蓝色钴玻璃观察焰色反应为紫色火焰证明一定含钾离子,结合溶液中各离
子浓度相同分析解答。
【详解】A.根据上述分析,该溶液X中一定没有Fe3+,故A错误;
B.根据上述分析,该溶液中一定存在K+、Fe2+、I-、NH +,溶液中各离子浓度相同,根据
4
溶液的电中性原则,溶液中还一定含有SO 2-、Cl -,溶液可能是硫酸亚铁、碘化钾和氯化
4
铵溶于水后得到的,故B正确;
C.氨气是碱性气体,不能使湿润的蓝色石蕊试纸变红,此现象不能说明溶液中一定含有
NH +,故C错误;
4
D.根据上述分析,原溶液中不存在SO 2-,故D错误;
3
故选B。
答案第4页,共2页13.(1)2Na O+2CO =2Na CO+O
2 2 2 2 3 2
(2)Cl +H O H++Cl-+HClO
2 2
(3)2Ca(OH) +2Cl=CaCl +Ca(ClO) +2H O
2 2 2 2 2
(4)HCO +OH-=H O+CO
2
(5)H PO
3 4
【解析】(1)
NaO 与CO 反应生成碳酸钠和氧气,其反应的化学方程式:2NaO+2CO =2Na CO+O ;
2 2 2 2 2 2 2 3 2
故答案为:2NaO+2CO =2Na CO+O 。
2 2 2 2 3 2
(2)
Cl 与水反应生成盐酸和次氯酸,其反应的离子方程式:Cl+H O H++Cl-+HClO;故答
2 2 2
案为:Cl+H O H++Cl-+HClO。
2 2
(3)
工业上用氯气通入石灰乳[Ca(OH) ]制取漂白粉,反应生成氯化钙、次氯酸钙和水,其反应
2
的化学方程式:2Ca(OH) +2Cl=CaCl +Ca(ClO) +2H O;故答案为:
2 2 2 2 2
2Ca(OH) +2Cl=CaCl +Ca(ClO) +2H O。
2 2 2 2 2
(4)
为了除去NaCO 溶液中混有的少量NaHCO ,向其中加入适量的NaOH溶液,碳酸氢钠和
2 3 3
氢氧化钠反应生成碳酸钠和水,其反应的离子方程式:HCO +OH-=H O+CO ;故答案
2
为:HCO +OH-=H O+CO 。
2
(5)
根据题意得到氧化剂Ag+与还原剂HPO 的数目之比为4:1即物质的量之比为4:1,得到电
3 2
子4mol,而1mol HPO 失去4mol电子即化合价升高4个价态,变为+5价,则氧化产物为
3 2
HPO ;故答案为:HPO 。
3 4 3 4
14. ③ ① ② ④
【详解】试题分析:受热分解产生二氧化碳气体的是③;氨气遇到氯化氢产生白烟的是氨
气;使湿润蓝色石蕊试纸变红的是酸性物质②;由氯气与冷的消石灰反应的是次氯酸钙,
故答案为③ ① ②④。考点:物质的用途
15.(1)饱和食盐水
(2) 5∶1 避免生成
(3) 吸收氯气,防止污染空气 C
(4) 过滤 洗涤
【分析】浓盐酸和MnO 反应生成Cl,Cl 中含有HCl,通过a中的饱和食盐水除去Cl 中
2 2 2 2
含有的HCl,Cl 与KOH在加热条件下反应生成KClO,冰水条件下,氯气与NaOH反应
2 3
生成NaClO,最后d为尾气处理装置,吸收多余的氯气。
【详解】(1)根据分析可知a中为饱和食盐水。
(2)b中反应方程式为3Cl+6KOH 5KCl+KClO +3H O,该反应中氧化剂和还原剂均
2 3 2
为Cl,其中 个Cl 为氧化剂, 个Cl 为还原剂,则氧化剂和还原剂的质量比为5:1。
2 2 2
Cl 与NaOH反应的离子方程式为 ,采用冰水浴的目的是防
2
止生成NaClO。
3
(3)d为尾气处理装置,用于吸收氯气,防止其污染空气。
A.氢氧化钙在水中溶解度较小,浓度偏低,吸收氯气效果差,A错误;
B.氯气在饱和食盐水中溶解度小,吸收氯气效果较差,B错误;
C.KI能与Cl 反应从而吸收氯气,C正确;
2
D.浓硫酸不与氯气反应,无法吸收氯气,D错误;
故答案选C。
(4)反应结束后,取出b中试管,经冷却结晶,过滤,洗涤,干燥得到KClO 晶体。
3
16. HCl NH NaCl
3
Cl+2NaOH = NaCl+NaClO+H O
2 2
【分析】电解饱和食盐水生成Cl、H 和NaOH,其中Cl 和NaOH反应生成NaClO、NaCl
2 2 2
答案第6页,共2页和HO三种物质,而Cl 和H 反应只生成HCl,由框图可知A为NaOH,B为Cl,C为
2 2 2 2
H,由表中数据可知参加反应的各物质的物质的量之比为n(H):n(D):n(I)=3:
2 2
1:2,由质量守恒定律可知,D为双原子分子,1molI中含有3molH和1molD,I应为
NH ,则D为N,且I中含有植物生长必须的元素之一是N元素,以此进行解答。
3 2
【详解】依据上述分析易知:
(1)B为Cl,C为H,二者反应生成的H为HCl,故答案为HCl;
2 2
(2)电解饱和食盐水生成氢气、氯气和氢氧化钠,是氯碱工业的基础,反应中氯失去电子
被氧化,氢得电子被还原,其电子转移数与方向如下:
,还原剂为NaCl;
(3)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,其化学方程式为:Cl+2NaOH
2
= NaCl+NaClO+H O。
2答案第8页,共2页