文档内容
第一章 第3节 物质的量课时作业2022-2023学年高中化学
人教版(2019)必修第一册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
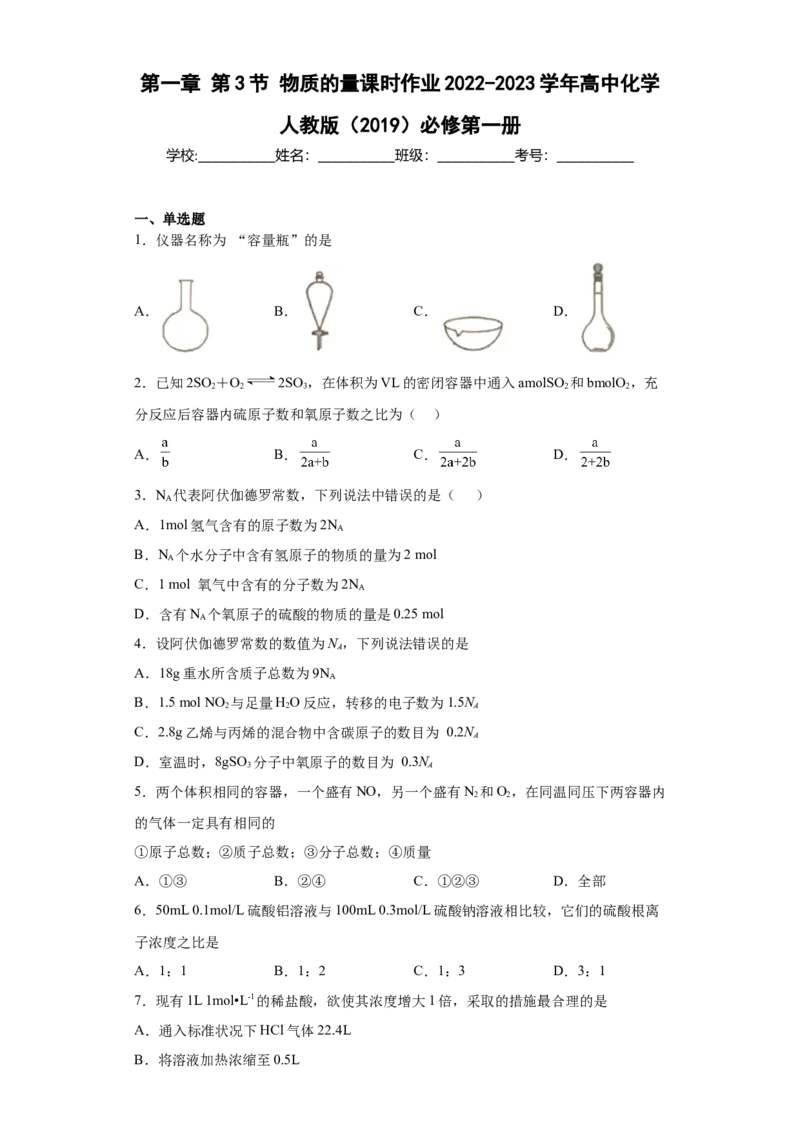
1.仪器名称为 “容量瓶”的是
A. B. C. D.
2.已知2SO +O 2SO ,在体积为VL的密闭容器中通入amolSO 和bmolO ,充
2 2 3 2 2
分反应后容器内硫原子数和氧原子数之比为( )
A. B. C. D.
3.N 代表阿伏伽德罗常数,下列说法中错误的是( )
A
A.1mol氢气含有的原子数为2N
A
B.N 个水分子中含有氢原子的物质的量为2 mol
A
C.1 mol 氧气中含有的分子数为2N
A
D.含有N 个氧原子的硫酸的物质的量是0.25 mol
A
4.设阿伏伽德罗常数的数值为N ,下列说法错误的是
A
A.18g重水所含质子总数为9N
A
B.1.5 mol NO 与足量HO反应,转移的电子数为1.5N
2 2 A
C.2.8g乙烯与丙烯的混合物中含碳原子的数目为 0.2N
A
D.室温时,8gSO 分子中氧原子的数目为 0.3N
3 A
5.两个体积相同的容器,一个盛有NO,另一个盛有N 和O,在同温同压下两容器内
2 2
的气体一定具有相同的
①原子总数;②质子总数;③分子总数;④质量
A.①③ B.②④ C.①②③ D.全部
6.50mL 0.1mol/L硫酸铝溶液与100mL 0.3mol/L硫酸钠溶液相比较,它们的硫酸根离
子浓度之比是
A.1:1 B.1:2 C.1:3 D.3:1
7.现有1L 1mol•L-1的稀盐酸,欲使其浓度增大1倍,采取的措施最合理的是
A.通入标准状况下HCl气体22.4L
B.将溶液加热浓缩至0.5LC.往原溶液加入5mol•L-1盐酸0.6L,再稀释至2L
D.往原溶液加入1L 3mol•L-1盐酸混合均匀
8.设N 为阿伏伽德罗常数的值,下列有关叙述正确的是
A
A.将4.6g 钠用铝箔包裹并刺小孔,与足量水充分反应生成H 分子数为0.1 N
2 A
B.1.0 L 1.0 mol/L的NaAlO 溶液中含氧原子数为2N
2 A
C.通常状况下,11.2 L 12C18O中含有的中子数为8N
A
D.室温下pH=11的NaCO 溶液10 L,由水电离出的OH-数目为0.01N
2 3 A
9.在NaCl、MgCl 和MgSO 三种盐配成的混合溶液中,若Na+的浓度为0.1 mol/L,
2 4
Mg2+的浓度为0.25 mol/L,Cl-的浓度为0.2 mol/L, 则SO 2-的物质的量浓度为( )
4
A.0.5 mol/L B.0.2 mol/L
C.0.45 mol/L D.0.25 mol/L
10.20℃时,饱和 溶液的密度为 ,物质的量浓度为c ,则下列说
法中正确的是
A.温度低于20℃时,饱和 溶液的浓度一定大于c
B.20℃时,饱和 溶液的质量分数为
C.20℃时,密度大于 的 溶液是不饱和溶液
D.20℃时,饱和 溶液的溶解度 水
11.下列叙述正确的是
A.常温常压下,4.6 g NO 和NO 的混合气体中约含有1.81×1023个原子
2 2 4
B.在标准状况下,80 gSO 所占的体积约为22.4L
3
C.常温下,0.1 mol/L醋酸溶液的pH约为1
D.16 g CH 与18 g NH +所含质子数相等
4 4
12.向一定量的Cu、CuO、Fe O 的混合物中加入100mL1mol/L的盐酸,恰好使混合
2 3
物完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,
固体减少的质量为( )
A.0.8g B.1.6g C.2.4g D.3.2g
二、填空题
13.CH 是21世纪的重要能源,NH 是重要的工业原料,现代工业生产中需要一定量
4 3
试卷第2页,共3页的CH 和NH 。请回答下列问题。
4 3
(1)若有等物质的量的两种气体,试完成下表:
质量比 分子个数比 原子个数比 氢原子个数比
CH:NH _______ _______ _______ _______
4 3
(2)若有等质量的两种气体,试完成下表:
原子个数
物质的量比 分子个数比 氢原子个数比
比
CH:NH _______ _______ _______ _______
4 3
14.O 和O 是氧元素的两种单质,根据其分子式完成下列各题:
2 3
(1)等质量的O 和O 所含分子个数比为_______,原子个数比为_______,分子的物质
2 3
的量之比为_______。
(2)等温等压下,等体积的O 和O 所含分子个数比为_______,原子个数比为_______,
2 3
质量比为_______。
(3)设N 为阿伏伽德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标
A
准状况下的体积约是_______(用含N 的式子表示)。
A
(4)配制100 mL 1 mol/L的稀HSO 溶液,需要用量筒量取浓HSO (密度为
2 4 2 4
1.84g·mL-1,质量分数为98%)的体积为_______ mL。
(5)氮化铝(AlN)广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过
如下反应合成:Al O+N +3C=2AlN+3CO,请用双线桥法在化学方程式上标出该反应
2 3 2
中电子转移的方向和数目_______。
三、实验题
15.某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠
溶液,静置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80'c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF 凝胶
3
④在干燥箱中,以100℃预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是______(用离子方程式表示)(2)步骤②的反应瓶材质可能是____(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,
该电池反应的化学方程式为________
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C1 , Fe2+恰好被完
2
全氧化成Fe3十,然后把溶液蒸干,灼烧至恒重得9. 6 g固体,则该铁氧体的化学式
为______。
试卷第4页,共3页参考答案:
1.D
【详解】A.图示仪器为圆底烧瓶,故A不符合题意;
B.该仪器为分液漏斗,故B不符合题意;
C.该仪器为蒸发皿,故C不符合题意;
D.该仪器为容量瓶,故D符合题意。
答案选D。
2.C
【详解】A. 中,没有考虑SO 中的O,错误;
2
B. 中,利用元素守恒进行计算,分母中b前面少2,错误;
C. 中,满足元素守恒关系,正确;
D. 中,2+2b应为2a+2b,错误。
答案是C。
【点睛】如果我们试图利用平衡状态进行计算,则产物为SO 、SO 、O 三种物质,那么计
2 3 2
算起来将非常繁琐。
3.C
【详解】A.1mol氢气含有2mol氢原子,即2N 个氢原子,故A错误;
A
B.N 个水分子的物质的量为1mol,含有2mol氢原子,故B正确;
A
C.1mol氧气中含有的分子的物质的量为1mol,即分子数为N ,故C错误;
A
D.根据硫酸的分子式HSO 可知,含有N 个(即1mol)氧原子的硫酸的物质的量为
2 4 A
0.25mol,故D正确;
故答案选C。
4.B
【详解】A、18g重水物质的量18g/20g·mol-1=0.9mol,所含质子总数=0.9×10×N =9N ,A
A A
项正确;
B、3NO +H O=2HNO +NO,3molNO 完全反应转移电子为2mol, 1.5 mol NO 与足量HO
2 2 3 2 2 2
反应,转移的电子数为N ,故B错误;
A
C、乙烯与丙烯最简式相同为CH,2.8g乙烯与丙烯的混合物中含CH 物质的量为2.8g /14
2 2
g=0.2mol,含碳原子的数目为0.2N ,C项正确;
AD、8gSO 分子物质的量8g/80 g·mol-1=0.1mol,分子中氧原子的数目为0.3N ,C项正确;
3 A
综上所述,本题正确选项B。
5.A
【分析】相同条件下,体积相同的两种容器内气体的物质的量相等,分子数相等,根据气
体的分子构成、原子构成作进一步判断。
【详解】相同条件下,体积相同的两种容器内气体的物质的量相等,根据N=nN 知分子数
A
相等,每个分子都含有2个原子,分子中含有的原子个数相等,所以原子总数相等。一氧
化氮分子、氮气分子或氧气分子中含有的质子数不等,所以两容器中总质子数不一定相等。
两容器中气体的摩尔质量不一定相等,所以其总质量不一定相等;
故合理选项是A。
6.A
【详解】50mL 0.1mol/L硫酸铝Al (SO ) 溶液中硫酸根离子浓度为0.3mol/L,100mL
2 4 3
0.3mol/L硫酸钠NaSO 溶液中硫酸根离子浓度为0.3mol/L,则两者之比为1:1,故选A。
2 4
7.C
【详解】A.通入标准状况下HCl气体22.4L,溶液体积发生改变,浓度不是2mol•L-1,故
不选A;
B.将溶液加热浓缩至0.5L,盐酸易挥发,浓度不是2mol•L-1,故不选B;
C.往原溶液加入5mol•L-1盐酸0.6L,再稀释至2L,c=
,故选C;
D.往原溶液加入1L 3mol•L-1盐酸混合均匀,溶液的体积不是2L,所以浓度不是
2mol•L-1,故不选D;
选C。
8.D
【详解】A.4.6g 钠的物质的量为0.2mol,与足量水反应2Na+2HO=2NaOH+H ↑,生成
2 2
0.2mol氢氧化钠和0.1mol氢气,生成的0.2mol氢氧化钠可与铝箔反应:2Al+2H O+2NaOH
2
= 2NaAlO +3H ↑,能继续生成氢气,则最终生成H 的物质的量大于0.1mol,即氢气的分子
2 2 2
数大于0.1 N ,故A错误;
A
B.1.0 L 1.0 mol/L的NaAlO 溶液中NaAlO 的物质的量为1mol,NaAlO 中含氧原子的物
2 2 2
质的量为2mol,但溶液中含有水,水分子中也含有氧原子,则NaAlO 溶液中含有的氧原
2
子的物质的量大于2mol,即氧原子的数目大于2N ,故B错误;
A
答案第2页,共2页C.1个12C18O分子中含有的中子数为16个,通常状况下,11.2 L 12C18O的物质的量不能用
标况下气体摩尔体积计算,则含有的中子数无法准确计算,故C错误;
D.室温下pH=11的NaCO 溶液中c(H+)=10-11mol/L,则溶液中c(OH-)=
2 3
,由水电离出的OH-的数目为0.001mol/L×10L×N
A
=0.01N ,故D正确;
A
答案选D。
9.B
【详解】令硫酸根的物质的量浓度为c,根据溶液中阴阳离子所带的正负电荷总数相等,
则:0.10mol•L-1×1+0.25mol•L-1×2=0.20mol•L-1×1+2c,解得:c=0.2mol/L,故答案为B。
【点睛】考查溶液物质的量浓度的计算,利用常规解法,比较麻烦,根据溶液不显电性阳
离子与阴离子所带电荷总数相等,即电荷守恒原则解答,注意电荷守恒原则在混合溶液有
关离子浓度计算经常运用。
10.B
【详解】A. 的溶解度随温度的下降而降低,温度低于20℃时,饱和 溶液的浓
度小于c ,A错误;
B.20℃时,设溶液体积为1L,饱和 溶液的质量分数为 ,B
正确;
C.20℃时,密度大于 的 溶液是过饱和溶液,C错误;
D.20℃时,设溶液体积为1L,则饱和 溶液的溶质质量为58.5cg,溶液质量为
,故溶解度 水,D错误;
故选B。
11.A
【详解】A.二氧化氮能转化为四氧化二氮,四氧化二氮的相对分子质量、原子个数是二氧化氮的2倍,把气体当作二氧化氮计算即可,二氧化氮分子个数
N=nN =m M N =4.6 46 N =0.1N 每个分子中含有3个原子,所以原子总数为
A A A A
1.81×1023,÷故×A正确;÷ ×
B.标况下,三氧化硫是固体,气体摩尔体积对其不适用,所以无法计算三氧化硫体积,
故B错误;
C.醋酸是弱电解质,在水溶液中存在电离平衡,所以常温下,0.1mol•L-1醋酸溶液的pH
大于1,故C错误;
D.16 g CH 与18 g NH +所含物质的量相等,但质子数不相等,故D错误;
4 4
故选A.
【点睛】在标准状况下,气体摩尔体积使用对象是气体,不能用于非气体物质,要注意物
质的聚集状态,标况下,三氧化硫是固体,不能用气体摩尔体积计算。
12.A
【详解】Cu、CuO、Fe O 的混合物中加入100mL 1mol•L-1的盐酸溶液,恰好使混合物完全
2 3
溶解,所得溶液中不含Fe3+,溶液中溶质为氯化铜、氯化亚铁,该反应过程为:盐酸与氧
化铁、氧化铜恰好反应,生成氯化铁、氯化铜与水,生成的氯化铁与铜恰好反应转化为氯
化铜、氯化亚铁。由水的分子式HO可知,氧化物中2n(O)=n(HCl)=0.1L×1mol/L=0.1mol,
2
故n(O)=0.05mol,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
氧化物中氧元素的质量,所以固体减少的质量为0.05mol×16g/mol=0.8g,故选A。
【点睛】本题考查混合物的有关计算,难度中等,利用守恒法判断氧化物中氧原子的物质
的量是解题的关键。混合物与盐酸完全溶解生成氯化铜、氯化亚铁和水,生成的水中的O
来自于混合物,H来自于盐酸,即2n(O)=n(HCl),CO在高温下还原原混合物,固体减少的
质量为氧化物中氧元素的质量。
13.(1) 16:17 1:1 5:4 4:3
(2) 17:16 17:16 85:64 17:12
【解析】(1)
因物质的量相同,故其质量之比等于摩尔质量之比,为16:17;物质的量相同,故分子数
相同,分子个数比为1:1;1mol CH 含有5mol原子(1mol C+4mol H),1mol NH 含有4mol
4 3
原子(1mol N+3mol H),原子个数比为5:4,氢原子个数比为4:3;
(2)
答案第4页,共2页若质量均为m g,CH 和NH 的物质的量比: ;分子个数比为17:
4 3
16;原子个数比为(17×5):(16×4)=85:64;氢原子个数比为(17×4):(16×3)=17:12。
14. 3∶2 1∶1 3∶2 1∶1 2∶3 2∶3 5.4
【详解】(1)设其质量为m,等质量的O 和O 所含分子个数比= N :
2 3 A
N =3:2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其氧原
A
子个数=(3×2):(2×3)=1:1,其物质的量之比= : =3:2;
(2)温同压下,气体摩尔体积相同,根据N= N 知,等体积的O 和O 所含分子个数比是
A 2 3
1:1,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以原子个数
之比是2:3,根据m= M知,其质量之比等于其摩尔质量之比=32g/mol:48g/mol=2:
3;(3)氧气的摩尔质量为M= = = g/mol,则cgO 在标准状况下体积为:
2
V= •V = ×22.4L/mol= L;
m
(4)该浓HSO 的物质的量浓度为:c= = mol/L=18.4mol/L;据稀释
2 4
定律得:100mL×1mol/L=18.4mol/L×V,解得:V=5.4mL。(5)AlO+N +3C=2AlN+3CO中,N元素的化合价由0降低为-3价,C元素的化合价由0升
2 3 2
高为+2价,该反应中转移6e-,则电子转移的方向和数目为 。
15. 2Fe2++H O+2H+=2Fe3++2H O C Fe(OH)+3HF=FeF +3H O 通风橱
2 2 2 3 3 2
(或密闭容器) FeF+3Li=Fe+3LiF Fe O(或2FeO•Fe O)
3 4 5 2 3
【详解】试题分析:(1)固体铁氧体磁性材料溶于过量盐酸,所得溶液中含有亚铁离子,
接着加入HO,HO 与亚铁离子反应生成三价铁离子,其反应的离子方程式为:
2 2 2 2
HO+2Fe2++2H+=2Fe3++2H O,故答案为HO+2Fe2++2H+=2Fe3++2H O;
2 2 2 2 2 2
(2)步骤②将沉淀加入反应瓶中,加入过量的氢氟酸溶液反应,由于氢氟酸能与玻璃及陶
瓷中的二氧化硅反应,所以反应瓶材质应该为聚四氟乙烯,故答案为C;
(3)氢氧化钠与三价铁离子反应生成氢氧化铁,再加HF,生成FeF 和水,则加氢氟酸反
3
生反应的化学方程式为Fe(OH)+3HF=FeF +3H O,故答案为Fe(OH)
3 3 2
+3HF=FeF +3H O;
3 3 2
(4)HF属于有毒的气体,为了防止中毒,则制备三氟化铁时应在通风橱中进行,故答案
为通风橱;
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应生成Fe和LiF,该电池反应的化
学方程式为FeF+3Li=Fe+3LiF,故答案为FeF+3Li=Fe+3LiF;
3 3
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672mL C1 ,则氯气的物质的量
2
为0.03mol,由2Fe2++Cl=2Fe3++2Cl-,可知Fe2+为0.06mol,则原铁氧体样品中n(FeO)
2
=0.06mol,把溶液蒸干,灼烧至恒重得9.6g固体为Fe O,则n(Fe O)=
2 3 2 3
=0.06mol,则原来溶液中Fe元素共0.06×2=0.12mol,所以原来溶液中n(Fe3+)=n(Fe)-n
(Fe2+)=0.12mol-0.06mol=0.06mol,则原铁氧体样品中n(Fe O)=0.06mol× =0.03,所
2 3
以原铁氧体样品中n(FeO):n(Fe O)=0.06mol:0.03mol=2:1,故铁氧体的化学式为
2 3
2FeO•Fe O 或Fe O;故答案为2FeO•Fe O 或Fe O。
2 3 4 5 2 3 4 5
考点:考查了物质制备方案的设计实验、氧化还原反应、方程式的书写、物质的量的有关
计算、元素化合物的性质的相关知识。
答案第6页,共2页