文档内容
}#}=AABAFQiAAAsEAExOgYCCChkQOkCgWQQCgAAAAhAgCgoEgQIBAQQ{#{}#}=AABAFQiAAAsEAExOgYCCChkQOkCgWQQCgAAAAhAgCgoEgQIBAQQ{#{}#}=AABAFQiAAAsEAExOgYCCChkQOkCgWQQCgAAAAhAgCgoEgQIBAQQ{#{}#}=AABAFQiAAAsEAExOgYCCChkQOkCgWQQCgAAAAhAgCgoEgQIBAQQ{#{贵阳市 2027 届高一年级联合考试(一)
化学参考答案
第Ⅰ卷(选择题,共42分)
一、选择题(本大题共 14 小题,每小题 3 分,共 42 分。在每小题给出的四个选项中,只有
一项是符合题目要求的)
题号 1 2 3 4 5 6 7
答案 D A D B B C A
题号 8 9 10 11 12 13 14
答案 C D A B A D C
【解析】
1.奥运火炬产生的烟是固体小颗粒分散到空气中,属于分散系,A正确。过氧化钠因为具有
强氧化性所以可以作为漂白剂,B 正确。制作豆腐过程中利用了胶体的聚沉,C 正确。酒
驾测试是利用乙醇将K Cr O 还原成Cr3+,D错误。
2 2 7
2.钢铁生锈、绿色植物的光合作用、金属的冶炼均属于氧化还原反应,A正确。Hg是金属单
质,B错误。CH 与石墨和金刚石不是同素异形体,C错误。Na O 不属于碱性氧化物,D
4 2 2
错误。
3.Na 与 O 在加热的条件下生成 Na O ,Na O 与水反应生成 NaOH,A 正确。H O 在二氧
2 2 2 2 2 2 2
化锰催化下生成 O ,O 与 H 燃烧生成 H O,B 正确。CaCl 可与可溶性碳酸盐反应生成
2 2 2 2 2
CaCO ,CaCO 高温煅烧可生成CO ,C 正确。Fe O 不溶于水,无法直接生成Fe(OH) ,
3 3 2 2 3 3
D错误。
4.四氧化三铁中铁元素的化合价为+2、+3,A正确。磁流体Fe O 属于胶体粒子(分散质),
3 4
不是胶体(分散系),B错误。磁流体四氧化三铁微粒直径介于5.5~36nm之间,故将其分
散在水中,形成的分散系是胶体,C 正确。胶体可以透过滤纸,所以四氧化三铁粒子可以
透过滤纸,D正确。
5.Na加入CuSO 稀溶液中会先与水反应生成氢氧化钠,最终生成氢氧化铜,A错误。Na O
4 2 2
能与水反应生成NaOH和O ,CaO 也能与水反应生成Ca(OH) 和O ,B正确。SO 与NaOH
2 2 2 2 2
反应生成Na SO ,C错误。Na CO 受热不易分解,D错误。
2 3 2 3
高一化学参考答案·第1页(共6页)
{#{QQABIQgEogCgAhAAAAgCQQWgCkOQkhCCCYgOxEAEsAAAiQFABAA=}#}6.NaHSO 在水溶液中的电离方程式为NaHSO =Na++H++SO2。
4 4 4
7.Ag+和 Cl−会反应生成 AgCl 沉淀,B 错误。H+和CO2会反应生成 H O 和 CO 气体,C 错
3 2 2
误。Ca2+和CO2会反应生成CaCO 沉淀,D错误。
3 3
8.H 原子不守恒,电子转移不守恒,A 错误。CO 通入 CaCl 溶液中,不会发生反应,B 错
2 2
误。离子配比错误,正确的离子方程式为 2H++SO2+2OH−+Ba2+=BaSO ↓+2H O,故
4 4 2
正确答案选C。
9.C原子无化合价变化,故无需加入氧化剂,A错误。氯元素从0价变为−1价,化合价降低,
属于还原反应,不需要加入氧化剂,B错误。铜元素从+2价变为0价,化合价降低,需要
加入适当还原剂,C错误。钠元素从0价变为+1价,化合价升高,需要加入适当氧化剂,
D正确。
10.由题意及图分析可知,属于阴影部分的反应是氧化还原反应且不属于四大基本反应。A、
B、C、D 均为氧化还原反应,但 B 为化合反应,B 错误。C 为分解反应,C 错误。D 为
置换反应,D错误,所以正确答案选A。
11.由图可知,在Ⅰ中发生的反应为:2NH+3O =2NO+2H O+4H+,O 作氧化剂,NO
4 2 2 2 2 2
为氧化产物,O 的氧化性强于 NO ,A 正确。在反应Ⅱ中发生的反应为:
2 2
NO+NH +=N ↑+2H O,结合反应Ⅰ可知,反应Ⅰ中NH和反应Ⅱ中NH的个数比
2 4 2 2 4 4
为 1∶1 时,氮的脱除效果最好,可完全转化为氮气,B 错误。反应Ⅱ的离子方程式为
NO+NH=N ↑+2H O,生成一个 N 转移 3 个电子,C 正确。若氧气过量,厌氧
2 4 2 2 2
氨氧化菌活性降低,部分NO可能会被氧化成NO而保留在溶液中,D正确。
2 3
12.液态石蜡也称石蜡油,故金属Na可保存在液态石蜡中,A正确。焰色试验是元素的性质,
火焰颜色呈黄色,证明该溶液中一定有钠元素,但钾元素的焰色要透过蓝色钴玻璃观察,
以滤去黄光的干扰,所以无法确定是否含有钾元素,B错误。二者均与碳酸钠溶液反应,
不能除杂,应选饱和碳酸氢钠溶液洗气,C错误。Na CO 和NaHCO 溶液均能与Ca(OH)
2 3 3 2
溶液反应生成沉淀,现象相同,不能用Ca(OH) 溶液鉴别,D错误。
2
13.碳酸氢钠受热易分解产生 CO ,可用作焙制糕点的膨松剂,A 正确。Na O 与 H O、CO
2 2 2 2 2
反应均生成 O ,所以常用做潜水艇或呼吸面具的供氧剂,B 正确。碱石灰主要是氧化钙
2
和氢氧化钠的混合物,为碱性干燥剂,可以用来干燥氧气、氢气等中性气体,C正确。向
饱和的FeCl 溶液中加入NaOH溶液,制得的是Fe(OH) 沉淀,而不是胶体,D错误。
3 3
高一化学参考答案·第2页(共6页)
{#{QQABIQgEogCgAhAAAAgCQQWgCkOQkhCCCYgOxEAEsAAAiQFABAA=}#}14.当Ba(OH) 与H SO 完全反应生成BaSO 和H O时,溶液中几乎没有自由移动的离子,
2 2 4 4 2
导电能力几乎为0,所以曲线①代表滴加硫酸的曲线,A错误。曲线①a点溶液中,Ba(OH)
2
与H SO 恰好完全反应,生成物为BaSO 和H O,两者均为电解质,B错误。曲线②中b
2 4 4 2
点为Ba(OH) 与NaHSO 反应生成BaSO 、H O和NaOH,溶质为NaOH,C正确。C点
2 4 4 2
曲线①中稀硫酸过量,溶质为H SO ,溶液显酸性。曲线②中硫酸氢钠过量,溶质为NaOH
2 4
和Na SO ,溶液显碱性,D错误。
2 4
第Ⅱ卷(非选择题,共58分)
二、填空题(本大题共4小题,共58分)
15.(除特殊标注外,每空2分,共15分)
(1)①②④⑧ ⑥⑦
(2)H++HCO=CO ↑+H O
3 2 2
(3)NaH PO
2 2
△
(4)2NaHCO =====Na CO +H O+CO ↑ CO (1分)
3 2 3 2 2 2
(5)C
(6)降温结晶(答“降温结晶或者冷却结晶”或“蒸发浓缩,冷却结晶”也给分)
【解析】(1)在水溶液里或熔融状态下能导电的化合物叫作电解质。NaCl、CH COOH、
3
NaHCO 、NaClO本身不导电,其水溶液能导电,属于电解质;C H OH、CH 是化合物
3 2 5 4
但两者的水溶液和熔融状态不导电;Fe是单质能导电、浓盐酸是混合物,不是电解质,
能导电。
(2)⑦是浓盐酸,④是 NaHCO ,这两者反应的实质是浓盐酸中的 H+和 NaHCO 电离出
3 3
的HCO反应生成CO 气体和H O。反应的离子方程式为H++HCO=CO ↑+H O。
3 2 2 3 2 2
(3)因为次磷酸属于一元酸,与足量的氢氧化钠反应生成 NaH PO 和 H O,生成的正盐
2 2 2
为NaH PO 。
2 2
△
(4)NaHCO 固体加热不稳定分解得到Na CO 、H O、CO ,化学方程式为:2NaHCO =====
3 2 3 2 2 3
Na CO +H O+CO ↑。
2 3 2 2
(5)取a g混合物充分加热,质量减少b g,NaHCO 加热分解为碳酸钠、二氧化碳、水,
3
84b 84b
则碳酸氢钠质量为 g ,Na
2
CO
3
的质量为 a g ,Na
2
CO
3
的质量分数为
31 31
高一化学参考答案·第3页(共6页)
{#{QQABIQgEogCgAhAAAAgCQQWgCkOQkhCCCYgOxEAEsAAAiQFABAA=}#}31a84b
100%,A不符合题意。取a g混合物与足量稀盐酸充分反应,加热、蒸干、
31a
x ya,
灼烧,得到b g固体,设Na 2 CO 3 和NaHCO 3 的质量分别是xg、yg,则117x 58.5y ,
b
106 84
方程可得碳酸钠的质量,进而计算出 Na CO 质量分数,B 不符合题意。取 a g 混合物
2 3
与足量NaOH溶液充分反应,得到b g溶液,不能计算碳酸钠质量,C符合题意。取a g
混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加 b g,可知
x ya,
二氧化碳的质量为b g,设Na 2 CO 3 和NaHCO 3 的质量分别是xg、yg,则44x 44y ,
b
106 84
解方程式可得碳酸钠的质量,进而计算出Na CO 质量分数,D不符合题意。
2 3
(6)根据氯化铵和氯化钠的溶解度曲线可知,氯化铵的溶解度随温度的变化较大,而氯
化钠的溶解度随温度的变化不大,从母液中分离出氯化铵晶体,在母液中加入氯化钠固
体使较高温度下氯化铵形成饱和溶液,降低温度使氯化铵以晶体形式析出,再将其过滤、
洗涤、干燥就可以得到纯净的氯化铵固体。
16.(每空2分,共14分)
(1)Cu2+、CO2、OH− Na+、Ca2+、Mg2+、Cl−、SO2
3 4
(2)Mg2++2OH−=Mg(OH) ↓
2
Ca2++2OH−=Ca(OH) ↓(不写也给分)
2
Ca2++CO2=CaCO ↓
3 3
(3)烧杯、玻璃棒
(4)蒸发结晶
(5)B
通电
(6)2Cl−+2H O=====Cl ↑+H ↑+2OH−
2 2 2
【解析】将粗盐固体溶于水得到无色溶液,说明溶液中没有Cu2+。
Ⅰ.取少量粗盐溶液滴入紫色石蕊溶液,溶液未出现蓝色,说明溶液中没有OH−。
Ⅱ.取少量粗盐溶液滴入足量的BaCl 溶液,有白色沉淀产生。过滤,向该白色沉淀中滴
2
入足量的稀盐酸,无气体生成,说明没有CO2,有SO2。
3 4
高一化学参考答案·第4页(共6页)
{#{QQABIQgEogCgAhAAAAgCQQWgCkOQkhCCCYgOxEAEsAAAiQFABAA=}#}Ⅲ.取少量粗盐溶液滴入过量的NaOH溶液,有白色沉淀生成,说明有Mg2+。过滤,向
滤液中加入Na CO 溶液,有白色沉淀生成,说明有Ca2+。所以原粗盐溶液中肯定不存在
2 3
的离子是Cu2+、OH−、CO2,肯定存在的离子是SO2、Mg2+、Ca2+、Na+、Cl−。根据Ⅲ
3 4
的 实 验 现 象 , 写 出 可 能 发 生 的 离 子 方 程 式 : Mg2++2OH−=Mg(OH) ↓ 、
2
Ca2++2OH−=Ca(OH) ↓、Ca2++CO2=CaCO ↓。
2 3 3
(3)操作①由固体到液体:溶解,操作②后得固体和液体:过滤,在Ⅳ中,操作①②均
要用到的玻璃仪器是:烧杯、玻璃棒。
(5)一系列操作由粗盐溶液得到精盐除去 Ca2+、Mg2+、SO2,依次加入①过量 BaCl 溶
4 2
液除SO2,②加入过量 Na CO 溶液除 Ca2+和过量的 BaCl ,③加入过量 NaOH 溶液除
4 2 3 2
去 Mg2+,④加入过量的稀盐酸除去②中过量的 Na CO 和③中过量的 NaOH,其中①
2 3
和②前后顺序不可换,NaOH溶液顺序可换,盐酸必须最后加入。所以选择 B。
通电
(6)元素守恒,且 A 为单质为 Cl 。发生反应的离子方程式为 2Cl−+2H O===== Cl ↑+H ↑
2 2 2 2
+2OH−。
17.(每空2分,共14分)
(1)CaCO +2H+=Ca2++CO ↑+H O(其他合理答案也给分)
3 2 2
(2)除去CO 中的HCl
2
(3)在B和C之间加一个干燥CO 的装置(主要是防硬质试管遇水炸裂,其他合理都可)
2
(4)Na CO
2 3
(5)变红 b
△
(6)4Na+3CO =2Na CO +C
2 2 3
【解析】(1)实验室制 CO 的固体物质 X 应为 CaCO ,所以离子方程式为:
2 3
CaCO +2H+=Ca2++CO ↑+H O。
3 2 2
(2)在制CO 中选用的盐酸,考虑盐酸的挥发性,所以CO 中混有HCl和H O,饱和NaHCO
2 2 2 3
溶液的作用是除去CO 中的HCl。
2
(3)从装置B中出来的CO 气体还带有H O,直接进入C中会造成硬质试管炸裂,所以
2 2
要在B和C之间加一个干燥CO 的装置。
2
(4)根据实验现象有黑色的单质C生成,可知CO 作氧化剂,那么Na作还原剂,会生成
2
钠的化合物,要么是 Na O 或 Na CO 之一或之二,因为是充分反应,Na O 也会与 CO
2 2 3 2 2
反应生成Na CO ,所以最终物质为Na CO 。
2 3 2 3
高一化学参考答案·第5页(共6页)
{#{QQABIQgEogCgAhAAAAgCQQWgCkOQkhCCCYgOxEAEsAAAiQFABAA=}#}(5)Na CO 的水溶液显碱性,故遇酚酞变红。BaCl 溶液与 Na CO 反应生成的 BaCO
2 3 2 2 3 3
沉淀为白色,其他要么不反应,要么沉淀颜色不是白色,故选b。
△
(6)根据以上分析的产物之一为Na CO ,故方程式为:4Na+3CO =2Na CO +C。
2 3 2 2 3
18.(除特殊标注外,每空2分,共15分)
(1)无水硫酸铜
(2)氧化(1分) 4
(3)B
(4)
(5)2 5 6 5 2 12
(6)①增大 ②H++OH−=H O
2
【解析】(1)无水硫酸铜遇水变蓝,实验室常用无水硫酸铜检验水。
(2)NaH+H O=NaOH+H ↑该反应中,水中H元素化合价降低,得电子,作氧化剂,
2 2
体现氧化性。
(3)元素的得电子能力:Cl>P,PCl 中P、Cl 的化合价分别为+3、−1 价,发生复分解反
3
应后,元素化合价不变,故产物为H PO 、HCl,B正确。
3 3
(5)根据得失电子守恒,配平该方程式的系数为2 5 6 5 2 12。
(6)①由图可知,经过阳离子交换树脂,Ca2+、Na+、Mg2+被H+替换,由电荷守恒可知阳
离子数目增多。
②再经过阴离子交换树脂得到纯净水,则 NO 、 Cl 、 SO2 被 OH−替换,则
3 4
H++OH−=H O。
2
高一化学参考答案·第6页(共6页)
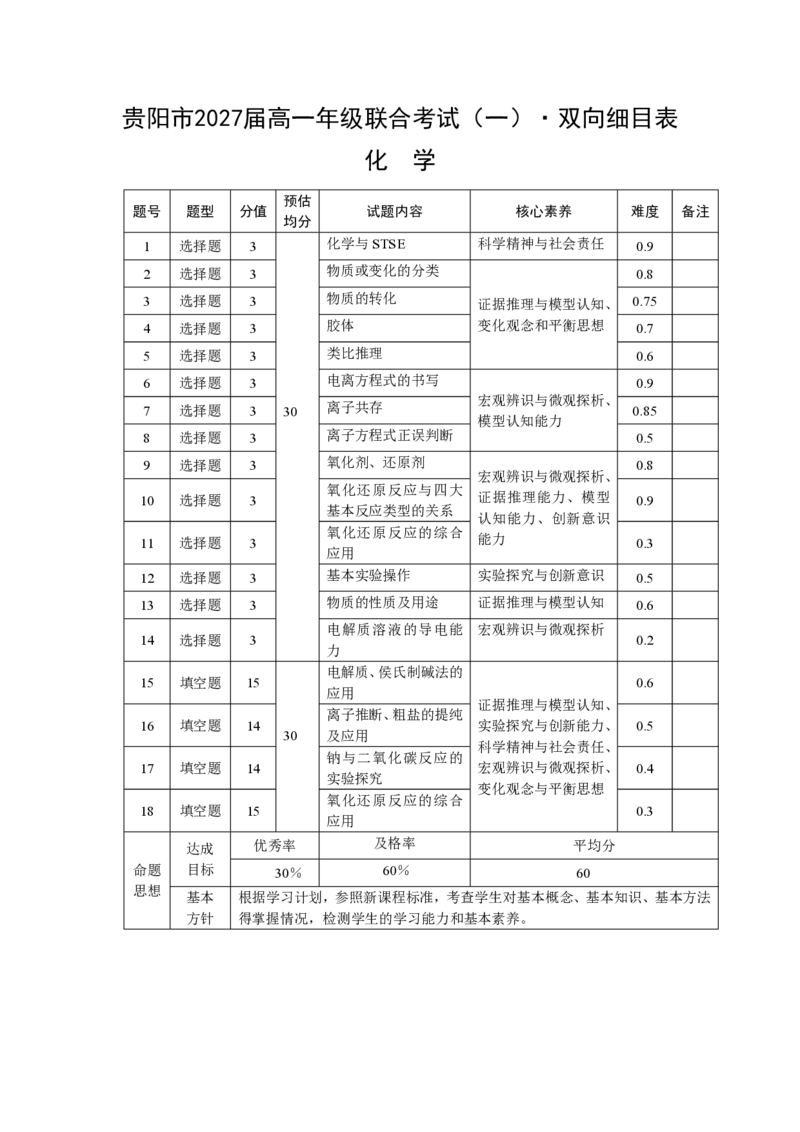
{#{QQABIQgEogCgAhAAAAgCQQWgCkOQkhCCCYgOxEAEsAAAiQFABAA=}#}贵阳市2027届高一年级联合考试(一)·双向细目表
化 学
预估
题号 题型 分值 试题内容 核心素养 难度 备注
均分
1 选择题 3 化学与STSE 科学精神与社会责任 0 . 9
2 选择题 3 物质或变化的分类 0.8
3 选择题 3 物质的转化 证据推理与模型认知、 0.75
4 选择题 3 胶体 变化观念和平衡思想 0.7
5 选择题 3 类比推理 0.6
6 选择题 3 电离方程式的书写 0.9
宏观辨识与微观探析、
7 选择题 3 30 离子共存 0.85
模型认知能力
8 选择题 3 离子方程式正误判断 0.5
9 选择题 3 氧化剂、还原剂 0.8
宏观辨识与微观探析、
氧化还原反应与四大
10 选择题 3 证据推理能力、模型 0.9
基本反应类型的关系
认知能力、创新意识
氧化还原反应的综合
11 选择题 3 能力 0.3
应用
12 选择题 3 基本实验操作 实验探究与创新意识 0.5
13 选择题 3 物质的性质及用途 证据推理与模型认知 0.6
电解质溶液的导电能 宏观辨识与微观探析
14 选择题 3 0.2
力
电解质、侯氏制碱法的
15 填空题 15 0.6
应用
证据推理与模型认知、
离子推断、粗盐的提纯
16 填空题 14 实验探究与创新能力、 0.5
30 及应用
科学精神与社会责任、
钠与二氧化碳反应的
17 填空题 14 宏观辨识与微观探析、 0.4
实验探究
变化观念与平衡思想
氧化还原反应的综合
18 填空题 15 0.3
应用
达成 优秀率 及格率 平均分
命题 目标 30% 60% 60
思想
基本 根据学习计划,参照新课程标准,考查学生对基本概念、基本知识、基本方法
方针 得掌握情况,检测学生的学习能力和基本素养。