文档内容
《化学反应速率与限度》练习
一、选择题
1. 将5.6g铁粉投入足量的100mL2mol/L稀硫酸中,2min时铁粉刚好完全溶解。下列有关这个反应
的反应速率表示正确的是( )
A. 铁的反应速率=0.5mol/(L·min) B. 硫酸的反应速率=0.5mol/(L·min)
C. 硫酸亚铁的反应速率=1mol/(L·min) D. 氢气的反应速率=0.5mol/(L·min)
2. 某温度下,浓度都是1mol/L的两种气体X 和Y ,在密闭容器中反应生成气体Z。反应2min后,
2 2
测得参加反应的X 为0.6mol/L,用Y 的变化表示的反应速率v(Y)=0.1mol/(L·min),生成的c(Z)为
2 2 2
0.4mol/L,则该反应的化学方程式是( )
A. X+2Y 2XY B. 2X+Y 2XY C. 3X+Y 2XY D. X+3Y 2XY
2 2 2 2 2 2 2 2 3 2 2 3
3.下列说法正确的是( )
A.密闭容器中充入1 mol N 和3 mol H 可生成2 mol NH
2 2 3
B.一定条件下,可逆反应达到平衡状态,该反应就达到了这一条件下的最大限度
C.对于任何反应增大压强,化学反应速率均增大
D.化学平衡是一种动态平衡,条件改变,原平衡状态不会被破坏
4.在一定温度时,将1 mol A和2 mol B放入容积为5 L的某密闭容器中发生如下反应:
A(s)+2B(g) C(g)+2D(g),经5 min后,测得容器内B的浓度减少了0.2 mol·L-1。则下列叙
述不正确的是( )
A.在5 min内该反应用C的浓度变化表示的反应速率为0.02 mol·(L·min)-1
B.在5 min时,容器内D的浓度为0.2 mol·L-1
C.该可逆反应随反应的进行,容器内压强逐渐增大
D.5 min时容器内气体总的物质的量为3 mol
5. 将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:
2A(g)+B(g) 2C(g)若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法正确的是( )
①用物质A表示的反应的平均速率为0.3mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol·L-1
A. ①③ B. ①④ C. ②③ D. ③④
6.可逆反应2NO(g)2NO(g)+O(g)在体积固定的密闭容器中,达到平衡状态的标志是( )
2 2
①单位时间内生成n mol O 的同时生成2n mol NO
2 2
②单位时间内生成n mol O 的同时生成2n mol NO
2
③用NO、NO、O 表示的反应速率的比为2∶2∶1的状态
2 2
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
1
学科网(北京)股份有限公司7. 在2L的密闭容器中进行如下反应:mX(g) pZ(g)+qQ(g)在2秒钟内用X表示的平均反应速率
为mol/(L·s),则2秒钟内Q物质增加了( )
A. mol B. mol C. mol D. mol
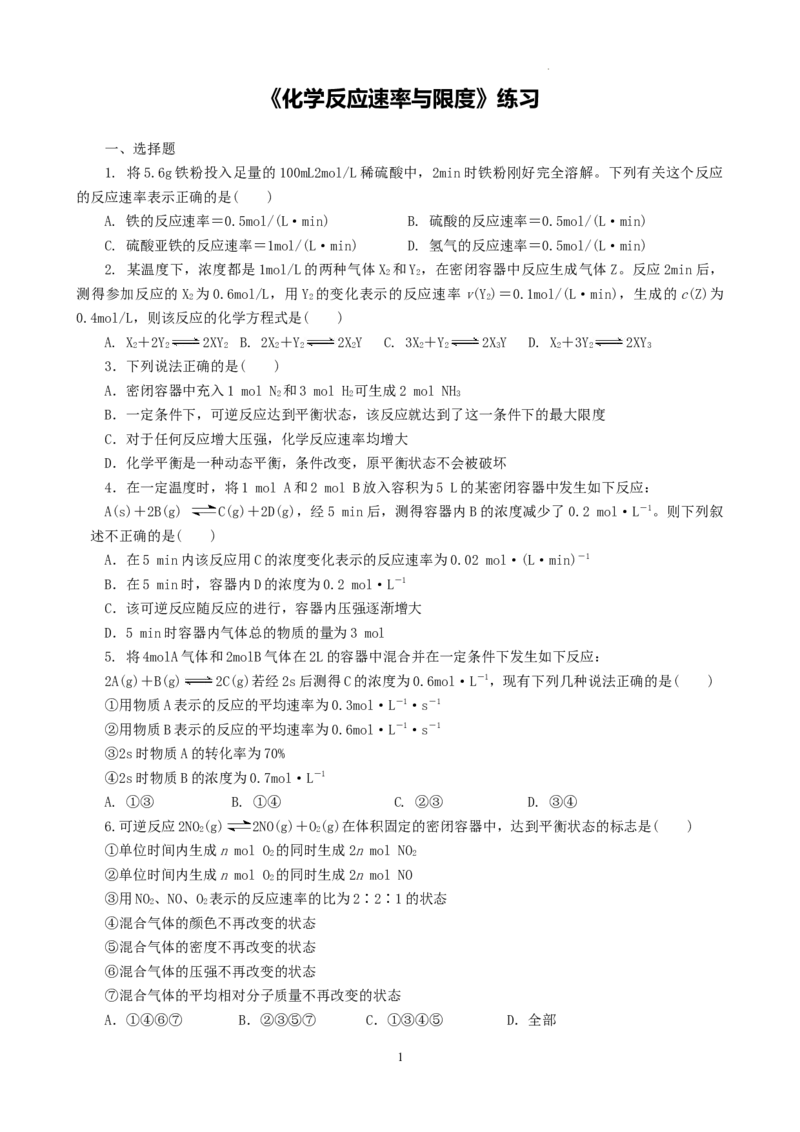
8.一定温度下,在容积为1 L的容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所
示,则下列表述中正确的是( )
A.该反应的化学方程式为2MN
B.t时,正、逆反应速率相等,达到平衡
2
C.t时,正反应速率大于逆反应速率
3
D.t时,N的浓度是M浓度的2倍
1
9.对于可逆反应:4NH(g)+5O(g)4NO(g)+6HO(g),下列说法正 确的
3 2 2
是( )
A.达到化学平衡时,4v (O)=5v (NO)
正 2 逆
B.若单位时间内生成x mol NO的同时消耗x mol NH,则反应达到平衡状态
3
C.达到平衡状态时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v (NH)=3v (HO)
正 3 正 2
10. 向等质量的a、b两份锌粉中,分别加入过量的稀HSO ,同时向a中加入少量的CuSO 溶液。
2 4 4
下图表示产生H 的体积(V)与时间(t)的关系,其中正确的是
2
二、填空题
11.t℃时,将2 mol SO 和1 mol O 通入体积为 2 L的恒温恒容密闭容器中,发生如下反应:
2 2
2SO(g)+O(g) 2SO(g),2 min时反应达到平衡,此时测得反应物O 还剩余0.8 mol,请填写下列空
2 2 3 2
白:
(1)从反应开始到化学平衡,生成SO 的平均反应速率为________;平衡时SO 转化率为________。
3 2
(2)下列叙述能说明该反应已达到化学平衡状态的是________。
A.容器内压强不再发生变化
B.SO 的体积分数不再发生变化
2
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol SO 的同时消耗n mol O
2 2
E.相同时间内消耗2n mol SO 的同时生成n mol O
2 2
(3)t℃时,若将物质的量之比为1∶1的SO 和O 混合气体通入一个恒温恒压的密闭容器中,反应达
2 2
到平衡时,混合气体体积减少了20%。SO 的转化率为________。
2
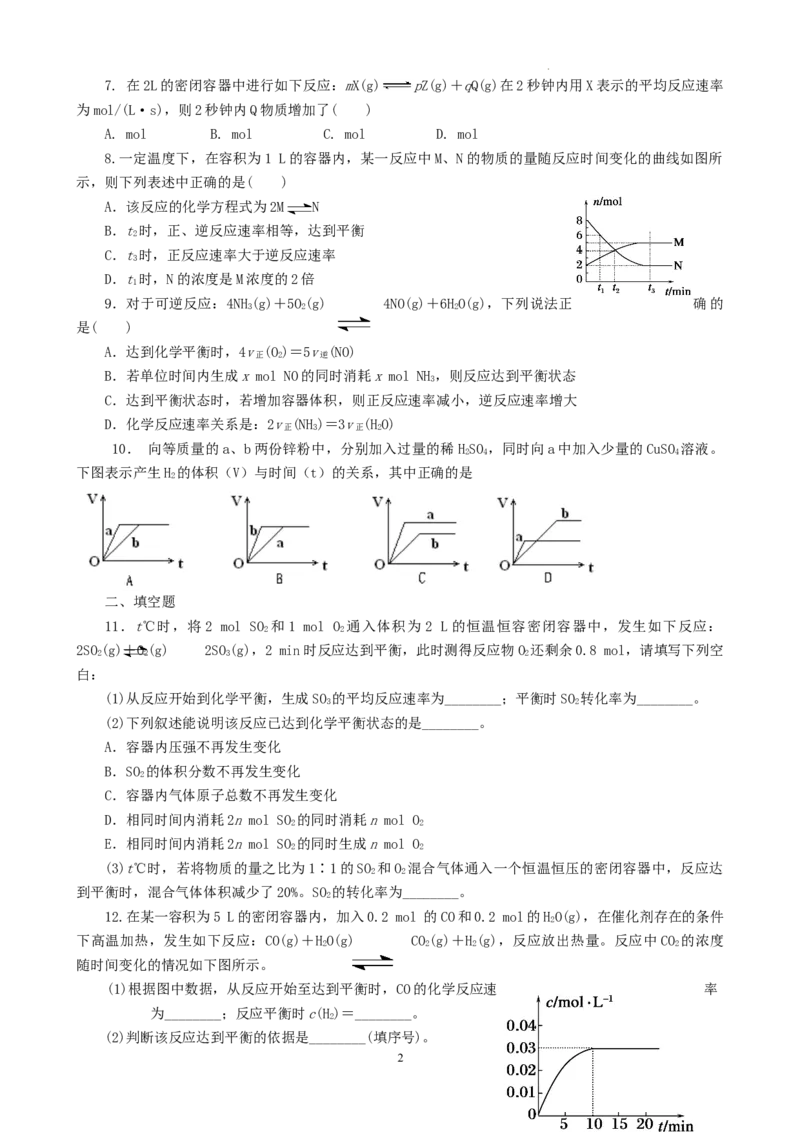
12.在某一容积为5 L的密闭容器内,加入0.2 mol 的CO和0.2 mol的HO(g),在催化剂存在的条件
2
下高温加热,发生如下反应:CO(g)+HO(g)CO(g)+H(g),反应放出热量。反应中CO 的浓度
2 2 2 2
随时间变化的情况如下图所示。
(1)根据图中数据,从反应开始至达到平衡时,CO的化学反应速 率
为________;反应平衡时c(H)=________。
2
(2)判断该反应达到平衡的依据是________(填序号)。
2
学科网(北京)股份有限公司A.CO减少的化学反应速率和CO 减少的化学反应速率相等
2
B.CO、HO、CO、H 的浓度都相等
2 2 2
C.CO、HO、CO、H 的浓度都不再发生变化
2 2 2
D.正、逆反应速率都为零
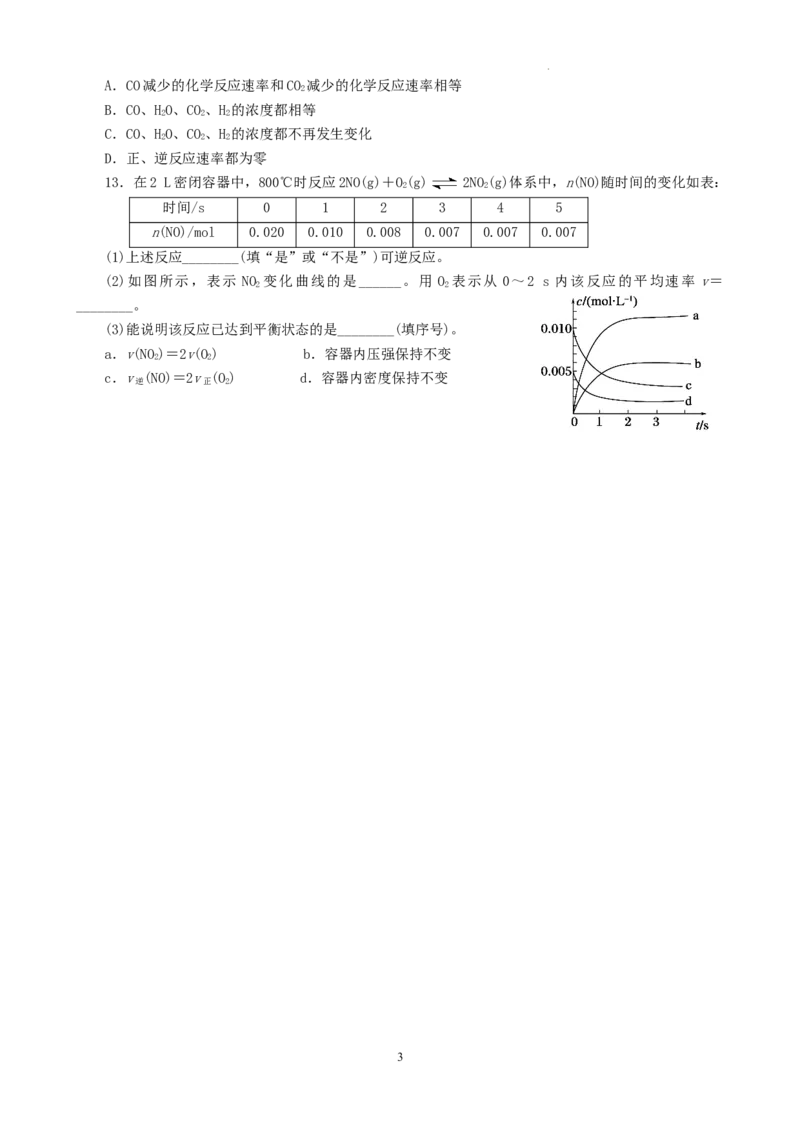
13.在2 L密闭容器中,800℃时反应2NO(g)+O(g) 2NO(g)体系中,n(NO)随时间的变化如表:
2 2
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示 NO 变化曲线的是______。用 O 表示从 0~2 s 内该反应的平均速率 v=
2 2
________。
(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO)=2v(O) b.容器内压强保持不变
2 2
c.v (NO)=2v (O) d.容器内密度保持不变
逆 正 2
3
学科网(北京)股份有限公司答案
1-10. B C B D B A D D A D
11.(1)0.1 mol·L-1·min-1 20% (2)ABE (3)80%
解析:(1) 2SO(g)+O(g)2SO(g)
2 2 3
起始浓度(mol·L-1) 1 0.5 0
转化浓度(mol·L-1) 0.2 0.1 0.2
平衡浓度(mol·L-1) 0.8 0.4 0.2
v(SO)==0.1 mol·L-1·min-1 α(SO)=×100%=20%
3 2
(3)设SO 、O 的物质的量均为1 mol,反应过程中减小了0.4 mol,即反应了0.8 mol SO ,SO 的转
2 2 2 2
化率为80%。
12.(1)0.003 mol·(L·min)-1
0.03 mol·L-1 (2)AC
解析:(1)由图可知第10 min时反应达到平衡,所以v(CO)=v(CO)===0.003 mol·(L·min)-1,
2
反应时转化的浓度之比=化学方程式的化学计量数之比,所以Δc(H)=Δc(CO)=0.03 mol·L-1。
2
(2)达到平衡的标志是各物质的百分含量保持一定,浓度不变,正、逆反应速率相等且不为0。
13.(1)是
(2)b 1.5×10-3 mol·(L·s)-1 (3)bc
解析:(1)该反应是可逆反应。
(2)由平衡体系2NO(g)+O(g)2NO(g)知,NO 为生成物,n(NO)=Δn(NO)=0.020 mol-
2 2 2 2
0.007 mol=0.013 mol
c(NO)==0.006 5 mol·L-1
2
故表示NO 变化曲线的为b。
2
v(NO)====0.003 mol·(L·s)-1,
则v(O)=v(NO)=0.001 5 mol·(L·s)-1。
2
(3)a项中未指明正、逆反应速率,故无法说明该反应是否达到平衡状态;由于该反应是反应前后气
体体积不相等的反应,当容器内压强保持不变时,说明该反应已达到平衡状态,故b项正确;c项中已说
明正、逆反应速率相等,故说明该反应已达到平衡状态;由于气体总质量不变,气体总体积也不变,因
此,无论该反应是否达到平衡,容器内密度保持不变,故d项无法说明该反应是否达到平衡状态。
4
学科网(北京)股份有限公司5
学科网(北京)股份有限公司