文档内容
第二章 第一节 第1课时 化学反应速率 测试题
榆次一中 李金虎
一、选择题(本题共有15小题,每小题4分,共60分,每小题只有一个正确选项)
1. 下列有关化学反应速率的说法中正确的是( )
A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.化学反应速率通常用单位时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
来表示
C.若某化学反应的反应速率为 0.5 mol·L-1·s-1,就是指在该时间内反应物和生成物的浓度变
化都为0.5 mol·L-1·s-1
D.化学反应速率是用来衡量化学反应进行快慢的尺度
2. 在N +3H 2NH 的反应中,经过一段时间后,NH 的浓度增加了0.6 mol·L-1,在此段时间
2 2 3 3
内用H 表示的平均反应速率为0.45 mol·L-1·s-1,则此段时间是( )
2
A.1 s B.2 s C.44 s D.1.33 s
3. 对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
4. 反应4A(s) + 3B(g) 2C(g) + D(g),经2 min B的浓度减少0.6 mol·L-1 。对此反应速率的正
确表示是( )
A.用A表示的反应速率是0.8 mol·L-1·s-1
B.分别用B、C、D表示反应的速率,其比值是3:2:1
C.在2 min末时的反应速率,用反应物B来表示是0. 3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值都是相同的
5. 在1 L的恒容密闭容器中进行反应:A(g)+3B(g) 2C(g),0~2 min内A的物质的量由2 mol
减小到0.8 mol,则用A的浓度变化表示该反应的反应速率为( )
A.1.2 mol/(L·min) B.1 mol/(L·min)
C.0.6 mol/(L·min) D.0.4 mol/(L·min)
6. 将气体A、B置于容积为2 L的恒容密闭容器中,发生反应:4A(g)+B(g) ===2C(g),反应进行到4
s末,测得A为0.5 mol,B为0.4 mol,C为0.2 mol,用反应物A浓度的减少来表示该反应的反
应速率为( )
A.0.025 mol·L-1·s-1 B.0.012 5 mol·L-1·s-1
C.0.05 mol·L-1·s-1 D.0.1 mol·L-1·s-1
1
学科网(北京)股份有限公司7. 反应A(g)+3B(g) 2C(g)+2D(g),在四种不同条件下的反应速率分别为:
①v(A)=0.45 mol·L-1·s-1; ②v(B)=0.6 mol·L-1·s-1;
③v(C)=0.4 mol·L-1·s-1; ④v(D)=0.45 mol·L-1·s-1。
该反应进行的快慢顺序为( )
A.①>③=②>④ B.①>②=③>④
C.②>①=④>③ D.①>④>②=③
8. 反应2SO (g)+O(g) 2SO (g)经a min后SO 的浓度变化情况如图所示,在0~a min内用
2 2 3 3
O 表示的平均反应速率为0.04 mol·L-1·min-1,则a等于( )
2
A.0.1
B.2.5
C.5
D.10
9 . 在 一 定 容 积 容 器 中 发 生 反 应 : 2CH(g)+2NH (g)
4 3
+3O (g)===2HCN(g)+6H O(g),15 min内测得反应速率用HCN表示为0.36 mol/(L·min),该段
2 2
时间内下列说法正确的是( )
A.15 min内反应消耗氨气5.4 mol
B.可用水表示该段时间内的反应速率为1.08 mol/(L·min)
C.各物质的反应速率关系:2v(CH)=2v(NH )=3v(O )
4 3 2
D.15 min时氧气浓度下降到8.1 mol/L
10. 一定温度下,向容积恒为V L的密闭容器中充入NO,NO转化为两种氧化物X和Y,平衡时,
体系中各物质的物质的量相等。容器内 NO的物质的量随时间变化的曲线如图所示。下列说法
正确的是( )
A.反应的化学方程式为3NO NO +NO
2 2
B.1~3 min时,v(生成物)= mol·L-1·min-1
C.平衡时NO的转化率为25%
D.充入He,反应速率增大
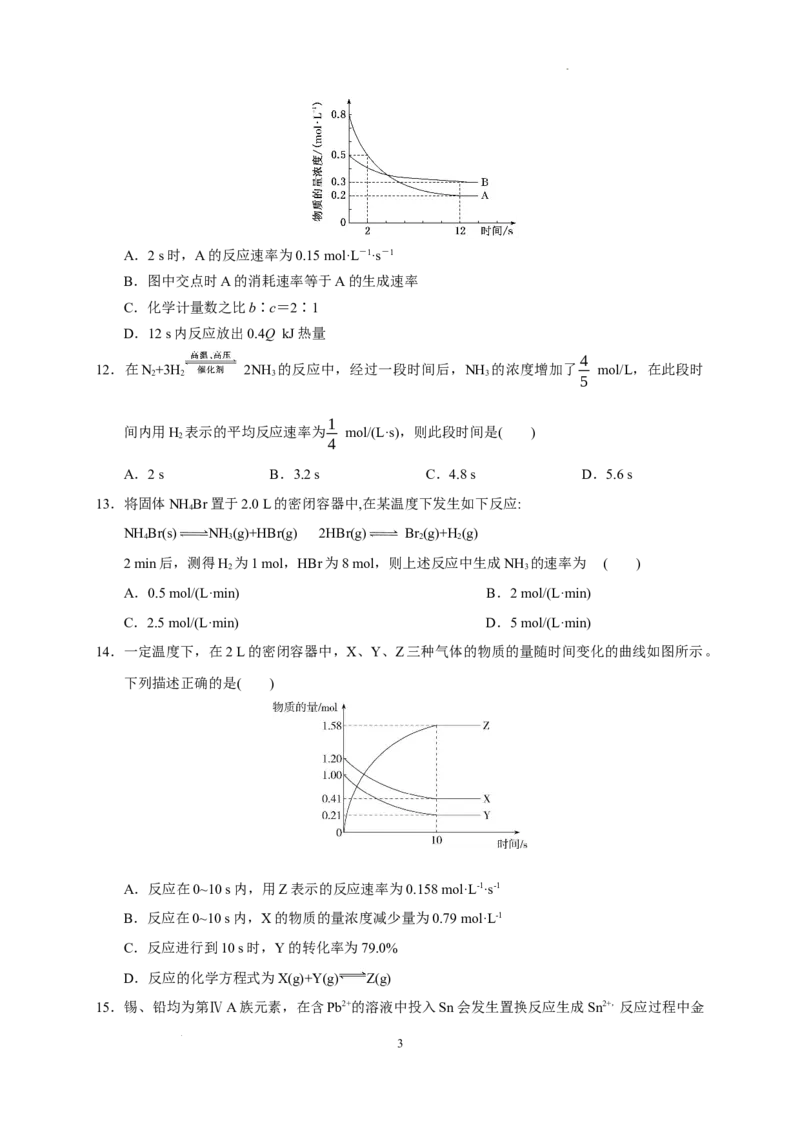
11.某温度下,在2 L恒容密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g) cC(g) ΔH
=-Q kJ·mol-1(Q>0),12 s时生成C的物质的量为0.8 mol(反应进程如图所示)。下列说法中
正确的是( )
2
学科网(北京)股份有限公司A.2 s时,A的反应速率为0.15 mol·L-1·s-1
B.图中交点时A的消耗速率等于A的生成速率
C.化学计量数之比b∶c=2∶1
D.12 s内反应放出0.4Q kJ热量
4
12.在N+3H 2NH 的反应中,经过一段时间后,NH 的浓度增加了 mol/L,在此段时
2 2 3 3
5
1
间内用H 表示的平均反应速率为 mol/(L·s),则此段时间是( )
2
4
A.2 s B.3.2 s C.4.8 s D.5.6 s
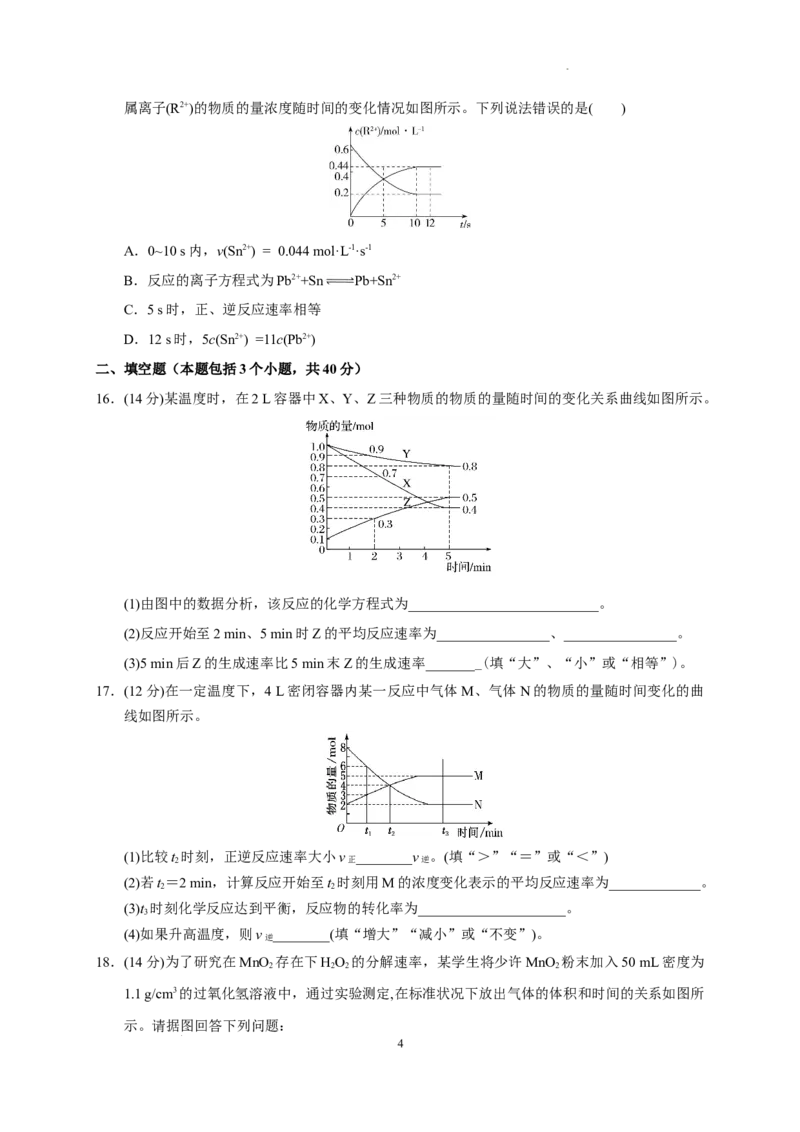
13.将固体NH Br置于2.0 L的密闭容器中,在某温度下发生如下反应:
4
NH Br(s) NH (g)+HBr(g) 2HBr(g) Br (g)+H(g)
4 3 2 2
2 min后,测得H 为1 mol,HBr为8 mol,则上述反应中生成NH 的速率为 ( )
2 3
A.0.5 mol/(L·min) B.2 mol/(L·min)
C.2.5 mol/(L·min) D.5 mol/(L·min)
14.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。
下列描述正确的是( )
A.反应在0~10 s内,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应在0~10 s内,X的物质的量浓度减少量为0.79 mol·L-1
C.反应进行到10 s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g) Z(g)
15.锡、铅均为第ⅣA族元素,在含Pb2+的溶液中投入Sn会发生置换反应生成Sn2+,反应过程中金
3
学科网(北京)股份有限公司属离子(R2+)的物质的量浓度随时间的变化情况如图所示。下列说法错误的是( )
A.0~10 s内,v(Sn2+) = 0.044 mol·L-1·s-1
B.反应的离子方程式为Pb2++Sn Pb+Sn2+
C.5 s时,正、逆反应速率相等
D.12 s时,5c(Sn2+) =11c(Pb2+)
二、填空题(本题包括3个小题,共40分)
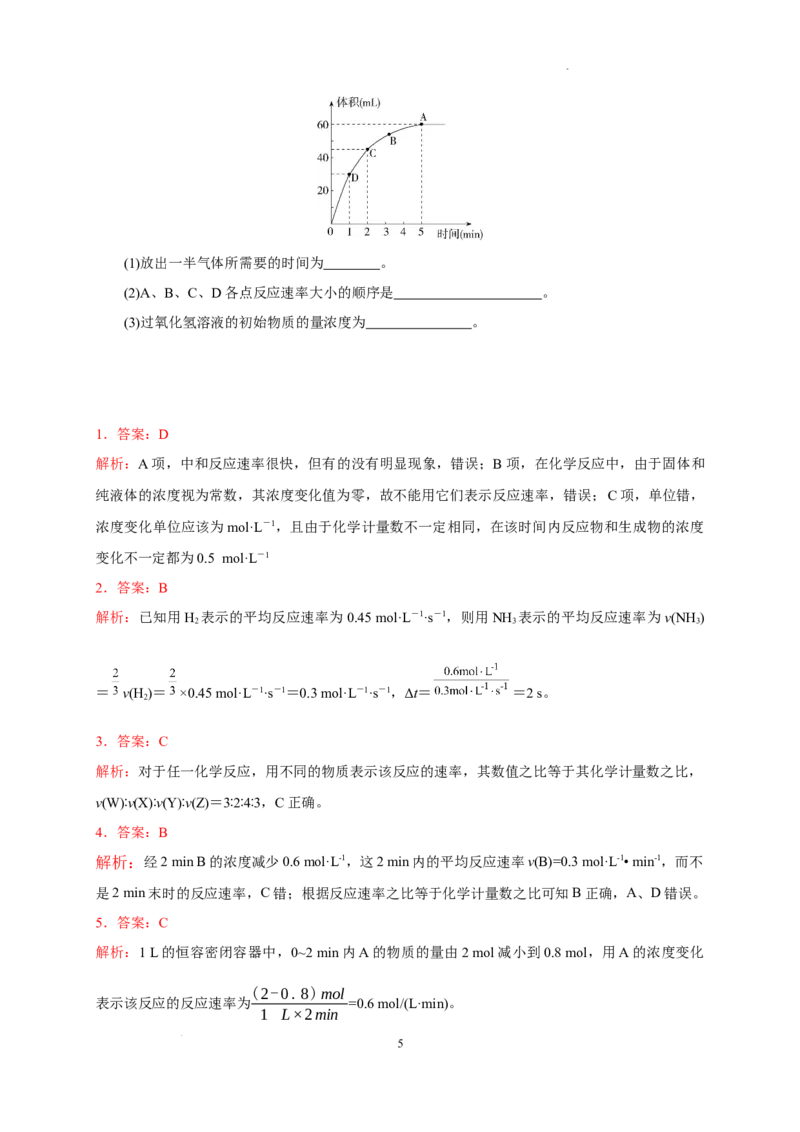
16.(14分)某温度时,在2 L容器中X、Y、Z三种物质的物质的量随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为___________________________。
(2)反应开始至2 min、5 min时Z的平均反应速率为________________、________________。
(3)5 min后Z的生成速率比5 min末Z的生成速率________(填“大”、“小”或“相等”)。
17.(12分)在一定温度下,4 L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲
线如图所示。
(1)比较t 时刻,正逆反应速率大小v ________v 。(填“>”“=”或“<”)
2 正 逆
(2)若t=2 min,计算反应开始至t 时刻用M的浓度变化表示的平均反应速率为_____________。
2 2
(3)t 时刻化学反应达到平衡,反应物的转化率为_____________________。
3
(4)如果升高温度,则v ________(填“增大”“减小”或“不变”)。
逆
18.(14分)为了研究在MnO 存在下HO 的分解速率,某学生将少许MnO 粉末加入50 mL密度为
2 2 2 2
1.1 g/cm3的过氧化氢溶液中,通过实验测定,在标准状况下放出气体的体积和时间的关系如图所
示。请据图回答下列问题:
4
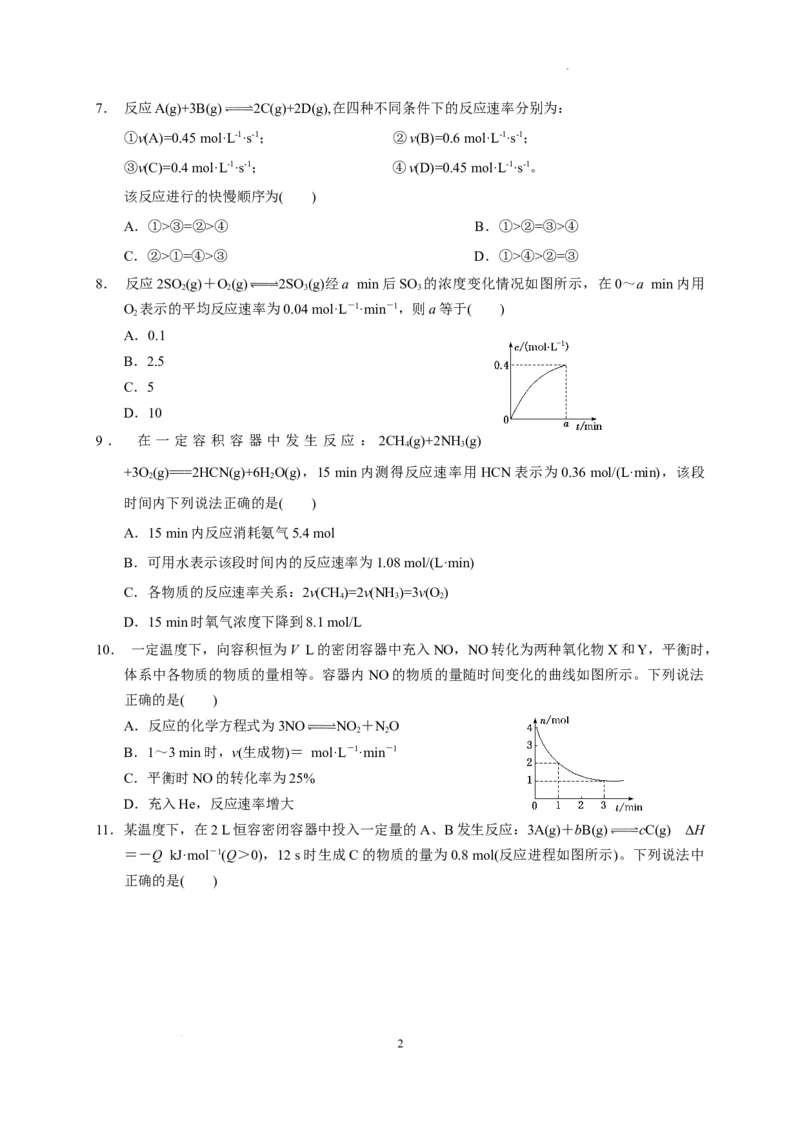
学科网(北京)股份有限公司(1)放出一半气体所需要的时间为 。
(2)A、B、C、D各点反应速率大小的顺序是 。
(3)过氧化氢溶液的初始物质的量浓度为 。
1.答案:D
解析:A项,中和反应速率很快,但有的没有明显现象,错误;B项,在化学反应中,由于固体和
纯液体的浓度视为常数,其浓度变化值为零,故不能用它们表示反应速率,错误;C项,单位错,
浓度变化单位应该为mol·L-1,且由于化学计量数不一定相同,在该时间内反应物和生成物的浓度
变化不一定都为0.5 mol·L-1
2.答案:B
解析:已知用H 表示的平均反应速率为0.45 mol·L-1·s-1,则用NH 表示的平均反应速率为v(NH )
2 3 3
= v(H )= ×0.45 mol·L-1·s-1=0.3 mol·L-1·s-1,Δt= =2 s。
2
3.答案:C
解析:对于任一化学反应,用不同的物质表示该反应的速率,其数值之比等于其化学计量数之比,
v(W)∶v(X)∶v(Y)∶v(Z)=3∶2∶4∶3,C正确。
4.答案:B
解析:经2 min B的浓度减少0.6 mol·L-1,这2 min内的平均反应速率v(B)=0.3 mol·L-1• min-1,而不
是2 min末时的反应速率,C错;根据反应速率之比等于化学计量数之比可知B正确,A、D错误。
5.答案:C
解析:1 L的恒容密闭容器中,0~2 min内A的物质的量由2 mol减小到0.8 mol,用A的浓度变化
(2-0.8)mol
表示该反应的反应速率为 =0.6 mol/(L·min)。
1 L×2min
5
学科网(北京)股份有限公司6.答案:C
Δc
解析:根据v= 计算v(C),再利用同一化学反应中物质的反应速率之比等于相应的化学计量数之
Δt
0.2mol
比计算v(A)。v(C)= 2 L =0.025 mol·L-1·s-1,v(A)=2v(C)=0.05 mol·L-1·s-1。
4 s
7.答案:D
解析:同一化学反应中,在化学反应速率的单位相同的情况下,某物质的化学反应速率与其化学计量
v(A) 0.45 v(B)
数的比值越大,该物质表示的反应速率越快。① = mol·L-1·s-1=0.45 mol·L-1·s-1;②
1 1 3
0.6 v(C) 0.4 v(D) 0.45
= mol·L-1·s-1=0.2 mol·L-1·s-1;③ = mol·L-1·s-1=0.2 mol·L-1·s-1;④ =
3 2 2 2 2
mol·L-1·s-1=0.225 mol·L-1·s-1,所以反应进行的快慢顺序为①>④>②=③。
8.答案:C
解析:由题图可知,0~a min内Δc(SO )=0.4 mol·L-1,则有v(SO )= mol·L-1·min-1。根据反应速
3 3
率与化学计量数的关系可得,v(O )=v(SO )= mol·L-1·min-1,又知“0~a min内用O 表示的平均
2 3 2
反应速率为0.04 mol·L-1·min-1”,则有 mol·L-1·min-1=0.04 mol·L-1·min-1,解得a=5,C项正确。
9.答案:B
解析:15 min内HCN浓度的变化量为0.36 mol/(L·min)×15 min=5.4 mol/L,由化学方程式可知氨气
浓度的减少量为5.4 mol/L,但容器容积未知,不能计算其物质的量,A错误;同一化学反应中,不
同物质的反应速率之比等于其对应化学计量数之比,则该段时间内用水表示的反应速率为0.36
6
mol/(L·min)× =1.08 mol/(L·min),B正确;应为3v(CH)=3v(NH )=2v(O ),C错误;氧气与HCN的
4 3 2
2
3
化学计量数之比为3∶2,则15 min内氧气浓度减小5.4 mol/L× =8.1 mol/L,初始浓度未知,不能
2
确定15 min时氧气的浓度,D错误。
10.答案:A
解析:A项,根据题图可知,3 min时反应达到平衡状态,NO的物质的量的变化量为3 mol,平衡
时NO和X、Y的物质的量相等,均为1 mol,参与反应的各物质的物质的量的变化量之比等于各物
质的化学计量数之比,则反应的化学方程式为3NO X+Y,根据原子守恒,可知反应的化学方
程式为3NONO +NO,正确;B选项,根据题图可知,1~3 min时,每个生成物的物质的量的
2 2
变化量均为 mol,故v(生成物)== mol·L-1·min-1,错误;C选项,Δn(NO)=3 mol,α(NO)=
6
学科网(北京)股份有限公司×100%=75%,错误;D选项,恒温恒容,充入He,浓度不变,反应速率不变,错误。
11.答案:D
解析:由题图可知0~2 s内A的浓度变化为0.8 mol·L-1-0.5 mol·L-1=0.3 mol·L-1,反应速率v=
==0.15 mol·L-1·s-1,所求为0~2 s的平均速率,不是2 s时的速率,A错误;图中交点时没有达
到平衡状态,A的消耗速率大于A的生成速率,B错误;12 s时达到平衡状态,B、C转化量之比
等于化学计量数之比,所以b∶c=(0.5 mol·L-1-0.3 mol·L-1)×2 L∶0.8 mol=1∶2,C错误;由题
意可知,3 mol A与1 mol B完全反应生成2 mol C时放出Q kJ的热量,12 s内,A的物质的量减少
(0.8 mol·L-1-0.2 mol·L-1)×2 L=1.2 mol,则放出的热量为0.4Q kJ,D正确。
12.答案:C
2 1 2 1 4
解析:v(NH )= v(H )= mol/(L·s)× = mol/(L·s),该段时间内NH 的浓度增加了 mol/L,则反应
3 2 3
3 4 3 6 5
4
mol/L
Δc 5
时间Δt= = =4.8 s。
v 1
mol/(L·s)
6
13.答案:C
解析:溴化铵分解为连锁反应,溴化铵分解生成的溴化氢又有一部分分解,故剩余的溴化氢的量为
溴化铵分解生成的溴化氢的量减去分解的溴化氢的量,即c (HBr)=c (HBr)-c (HBr);氢气的
剩余 生成 分解
物质的量为1 mol,其浓度为0.5 mol/L,则c (HBr)=1 mol/L;HBr的物质的量为8 mol,c
分解 剩余
(HBr)=8 mol÷2 L=4 mol/L;则c (HBr)=c (HBr)+c (HBr)=1 mol/L+4 mol/L=5 mol/L;溴化铵分
生成 分解 剩余
解生成的氨气浓度与溴化氢浓度相等,则2 min后溴化铵分解生成的c(NH )=c (HBr)=5 mol/L,
3 生成
氨气的平均反应速率为5 mol/L÷2 min=2.5 mol/(L·min),C正确。
14.答案:C
1.58mol
解析:从题图上看,在0~10 s内,Z的反应速率v(Z)= 2 L =0.079 mol·L-1·s-1;0~10 s内,X
10 s
(1.20-0.41)mol
的物质的量浓度的减少量为 =0.395 mol·L-1;反应进行到10 s时,Y的转化率
2 L
(1.00-0.21)mol
为 ×100%=79.0%;反应的化学方程式应为X(g)+Y(g) 2Z(g)。
1.00mol
15.答案:C
解析:0~10 s内Sn2+的浓度从 0变为 0.44 mol·L-1,所以v(Sn2+)=0.044 mol·L-1·s-1,A正确;在含
7
学科网(北京)股份有限公司Pb2+的溶液中投入Sn会发生置换反应生成Sn2+,由题图可知该反应为可逆反应,反应的离子方程式
为Pb2++Sn Pb+Sn2+,B正确;由题图可知5 s时Pb2+和Sn2+的浓度相等,反应还在向正反应方向
进行,正、逆反应速率不相等,C错误;由题图可知 12 s时,c(Sn2+)=0.44 mol·L-1,c(Pb2+)=0.2
mol·L-1,c(Sn2+)∶c(Pb2+)=0.44 mol·L-1∶0.2 mol·L-1=11∶5,即5c(Sn2+)=11c(Pb2+),D正确。
16.答案:(1)3X+Y 2Z (2)0.05 mol·L-1·min-1 0.04 mol·L-1·min-1 (3)相等
17.答案:(1)> (2)0.25 mol·L-1·min-1 (3)75% (4)增大
解析:(1)t 时刻,反应物逐渐减小,生成物逐渐增多,反应未达到平衡且正向进行,v >v 。
2 正 逆
(2)v===0.25 mol·L-1·min-1。(3)t 时刻化学反应达到平衡,剩余2 mol N,则转化了6 mol N,转
3
化率为×100%=75%。(4)升高温度,反应速率增大。
18.答案:(1)1 min (2)D>C>B>A (3)0.11 mol/L
解析:(1)由题图可知,放出一半气体所需要的时间为1 min。(2)随着反应的进行,过氧化氢溶液的浓
度逐渐减小,反应速率也逐渐减小。(3)该反应的化学方程式为2HO 2HO+O↑,在5 min
2 2 2 2
后,收集到的气体体积不再增加,说明过氧化氢完全分解,由题图可知,生成氧气的体积为60 mL,
2HO 2HO+O↑
2 2 2 2
2 mol 22.4 L
n(H O) 0.06 L
2 2
2mol×0.06 L 0.005 36mol
n(H O)= ≈0.005 36 mol,所以c(H O)= ≈0.11 mol/L。
2 2 22.4 L 2 2 0.05 L
8
学科网(北京)股份有限公司9
学科网(北京)股份有限公司