文档内容
人教版(2019)必修第二册第八章第二节 化学品的合理使
用课时训练二
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.中华文明源远流长,史书记载中蕴含着丰富的化学知识。下列说法不正确的是
A.《本草纲目》记载“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”,其中
“碱”指的是KCO
2 3
B.《易经》记载“泽中有火……上火下泽”,其描述的是CO在湖泊池沼水面上起火
的现象
C.《本草经集注》记载“强烧之,紫青烟起,云是真硝石也”,此法是利用焰色反应
鉴别“硝石”
D.《抱朴子》记载“丹砂(HgS)烧之成水银,积变又还成丹砂”,该过程为氧化还原
反应
2.下列物质在生活或生成中的应用错误的是
A.葡萄糖中添加二氧化硫用于杀菌、抗氧化
B.在含较多NaCO 的盐碱地中施加适量熟石灰降低了土壤碱性
2 3
C.陶瓷坩埚不能用于熔融烧碱
D.甲烷是一种强效温室气体,废弃的甲烷可用于生成甲醇
3.以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行
的分析不合理的是
A.四千余年前用谷物酿造出酒和醋,酿造过程中只发生水解反应
B.商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品
C.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土
D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
4.“水能载舟,亦能覆舟”,药物能治病,但用药不当也能给人带来伤害,我们应遵
医嘱,合理用药。关于药品的下列说法正确的是
A.Rx表示处方药,OTC表示非处方药
B.毒品就是有毒的药品
C.西药都是人工合成的,有毒,不能随便吃,中药是天然的,无毒,可放心食用
D.睡觉前服用安眠药,起床后服用兴奋剂,对学生学习很有好处
5.以下说法正确的是
A.误食铜、汞等重金属,应立即喝牛奶解毒,并去医院就诊B.病人在服用胃舒平(主要成分为氢氧化铝)期间可以多吃酸性食物
C.绿色化学就是要加强废气、废液及废渣等废弃物的处理或开发利用
D.用热的纯碱溶液能洗去油脂,说明酯类物质可以直接与NaCO 反应
2 3
6.化学与生活密切相关,下列说法正确的是
A.中草药中常含有苷类、生物碱、有机酸等成分,煎煮中草药不适宜使用铁锅
B.N95口罩所使用的熔喷布为聚丙烯,其单体为直线型分子
C.为增强“84”消毒液的消毒效果,可加入适量稀盐酸
D.二氧化硫有毒,严禁将其添加到任何食品和饮料中
7.食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是
A.硅胶可用作食品干燥剂
B.PO 不可用作食品干燥剂
2 5
C.六水合氯化钙可用作食品干燥剂
D.加工后具有吸水性的植物纤维可用作食品干燥剂
8.现代生活需要人们有一定的科学素养,下列有关化学的科学常识说法正确的是
A.碳酸钠俗名小苏打,可用作糕点膨松剂
B.食物腐败、Fe(OH) 胶体的制备都与氧化还原反应有关
3
C.为防止馅饼等富脂食品氧化变质,常在包装袋中放入生石灰
D.榨苹果汁时加入维生素C,可减缓其在空气中发生颜色变化
9.下列说法正确的是
A.在现代食品工业中,抗坏血酸、亚硝酸钠常作抗氧化剂使用
B.葡萄糖在酶的作用下可以水解生成乙醇
C.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同
D.在酸性条件下,CHCO18OC H 的水解产物是CHCOOH与C H18OH
3 2 5 3 2 5
10.春秋末期齐国《考工记》中载有“涑帛”的方法,即利用“灰”(草木灰)和“蜃”
(贝壳灰)混合加水所得溶液来洗涤丝帛。下列说法错误的是
A.草木灰中含有KCO,可用作钾肥
2 3
B.贝壳煅烧成灰的过程中发生了分解反应
C.“灰”和“蜃”混合加水所得溶液中含有KOH
D.可用焰色试验区分KCO、KOH两种物质
2 3
11.随着人民生活水平的不断提高,人们更加讲究合理膳食。下列饮食习惯科学的是
A.多吃肉,少吃蔬菜水果 B.多喝碳酸饮料,少饮矿泉水
C.多食用含防腐剂的食品 D.注意饮食的合理搭配
12.下列变化过程涉及氧化还原反应的是( )
A.从海水中获取氯化镁 B.煤的液化和气化
试卷第2页,共3页C.使用泡沫灭火器产生泡沫 D.铝土矿用强碱溶解
13.中华文化源远流长、博大精深。下列有关蕴含的化学知识的说法中,不正确的是
A.食品包装中常见的抗氧化剂成分为:还原性铁粉、氯化钠、炭粉等,其脱氧原理
与钢铁的吸氧腐蚀不相同
B.“陶尽门前土,屋上无片瓦。十指不沾泥,鳞鳞居大厦。”黏土烧制陶瓷的过程发
生了化学变化
C.“兰陵美酒郁金香,玉碗盛来琥珀光。”粮食发酵产生的酒精分散在酒糟中,可以
通过蒸馏与酒糟分离
D.侯氏制碱法中的“碱”指的是纯碱
14.化学与生产、生活密切相关。下列说法中不正确的是:
A.从海水中制取食用的精盐,需要有化学反应才能实现
B.高温及常用的消毒剂可使禽流感病毒蛋白质变性
C.生活中的铜制品既能发生析氢腐蚀又能发生吸氧腐蚀
D.植物油中含有碳碳双键,在空气中长时间放置容易氧化变质
15.近年来,我国大力弘扬中华优秀传统文化体现了中华民族的“文化自信”。下列
有关说法错误的是
A.成语“百炼成钢”、“蜡炬成灰”中均包含了化学变化
B.常温下,成语“金戈铁马”中的金属能溶于浓硝酸
C.谚语“雷雨肥庄稼”,其过程中包含了氧化还原反应
D.《荷塘月色》中“薄薄的青雾浮起在荷塘里”中的“青雾”属于胶体
二、填空题
16.葡萄酒是由葡萄汁发酵而成的。在酿造葡萄酒的过程中面临两大问题:一是在葡
萄汁发酵过程中产生的杂菌会影响葡萄酒的酿造和保存;二是葡萄酒中所含的还原性
物质一旦被氧化,葡萄酒的果香味就会消失,影响口感。在酿酒实践中,人们发现二
氧化硫可以解决这两大问题。(1)为什么二氧化硫能够解决酿酒中的这两大问题_______?
(2)在葡萄汁发酵过程中,会产生一定量的二氧化硫,但量比较少,不能完全解决问题,
需要额外添加。国家对葡萄酒中二氧化硫的含量有上限规定,检测二氧化硫的含量是
葡萄酒厂和相关食品质检部门的重要工作。
①你认为哪些化学反应可用于检测葡萄酒中二氧化硫的含量_______?为什么_______?
②某种检测方法用到 溶液、碘水、淀粉溶液等试剂。请书写该方法涉及的反应
的离子方程式_______。该反应为什么可以检测出二氧化硫的含量_______?
(3)有些人会对二氧化硫有过敏反应,出现头痛等症状。对哮喘病人来说,二氧化硫也
是增加支气管痉挛概率的危险物质。所以,研究人员希望找到能够替代二氧化硫的物
质。你认为替代物质需要满足哪些要求_______?
17.I.回答下列问题:
(1)人体缺乏某种微量元素将导致血液输送氧气能力下降,人体就无法获得充足的氧气,
生理机能就会下降,该微量元素是_____(填字母)。
a.碘 b.锌 c.铁
(2)抗生素是抑制某些微生物生长或杀灭某些微生物的一类物质,下列属于抗生素的是
_____(填字母)。
a.阿莫西林 b.胃舒平 c.阿司匹林
II.表中是我国部分城市空气质量周报,回答下列问题:(TSP—空气中的飘尘)
污染指 首要污染 空气质量 城 污染指 首要污染 空气质量
城市
数 物 级别 市 数 物 级别
武
天津 82 TSP II 83 NO II
汉 x
哈尔 重
96 TSP II 98 SO II
滨 庆 x
试卷第4页,共3页(3)最容易出现酸雨的城市是____。
(4)NaOH溶液可吸收废气中的氮氧化物,反应方程式:
2NO +2NaOH=NaNO +NaNO +H O。反应时消耗了10L0.1mol•L-1NaOH溶液,则反应
2 2 3 2
中转移电子的数目为:____。
III.湘江流域工厂较多,如果污水处理不当,容易造成工业污染。我国工业废水中几种
污染物的最高允许排放浓度如表:
污染物 汞 镉 铅
主要存在形式 Hg2+ Cd2+ Pb2+
最高允许排放浓度/(mg•dm-3) 0.05 0.1 1.0
(5)现有某工厂每日排放的污水中汞的质量分数为(1×10-6)%,镉的质量分数为(2×10-
5)%,铅的质量分数为(5×10-5)%(设该污水的密度为1g/cm3)。根据计算该厂三项污染物
中____超标。
18.下表是一种加碘食盐的配料表,回答下列问题:
配料表
精制海盐、碘酸钾
含碘量
储藏方法 密封避光、防潮
使用方法 烹调时待食品熟后加入
(1)碘酸钾和氯化钠在分类上都属于_______, 的摩尔质量为_______,
在水中电离出的离子的物质的量为_______。
(2)根据含碘盐的使用方法,可推测碘酸钾的化学性质(已知碘酸钾与氯化钠不反应):
碘酸钾在受热时易发生_______反应,若产物中有KI,则该反应属于_______(填“氧化
还原反应”或“非氧化还原反应”)。
(3)已知电解饱和NaCl溶液可以制取 和 。
,若电解时生成20g NaOH,则同时能得到和 的总体积(标准状况)为_______L。
(4)每千克该加碘食盐中含碘酸钾的质量最多为_______(保留一位小数)mg。
19.回答下列问题:
(1)下表是某食品包装袋上的说明
品名 早餐饼
配料 面粉 鸡蛋 植物油 白砂糖 食盐 苯甲酸钠
保质期 十二个月
生产日
2020年11月8日
期
在配料中,富含淀粉的是_______;富含蛋白质的是_______;富含油脂的是_______;
牛奶和豆浆中都含有大量的_______。
(2)缺乏某种微量元素会导致甲状腺肿大,而且会造成智力伤害,该微量元素是_______;
(3)头孢药物是一种常见的抗生素,在服用期间_______(填“能”或“不能”)饮酒。
(4)人体的胃液中含有少量盐酸,秘为胃酸。含有碳酸氢钠、碳酸钙,氧化镁,氢氧化
铝和氢氧化镁等成分的抗酸药可缓解胃酸分泌过多而导致的胃部不适。写出氢氧化铝
发挥药效时的化学方程式_______。
20.随着科学技术的迅猛发展,人类创造了空前丰富的物质财富,同时也导致了全球
性的资源短缺、环境污染和生态恶化。
(1)煤燃烧时产生的SO 等气体是形成酸雨的主要物质,酸雨的pH_______5.6(填“>”
2
“<”或“=”)。
(2)处理污水的方法有很多种,向污水中通入臭氧可以除去其中含有的油类与氰化物,
通入臭氧的方法属于_______(填字母代号)。
A.沉淀法 B.中和法 C.氧化法
(3)金属的腐蚀一般可分为化学腐蚀和_______腐蚀,钢铁在中性环境中发生电化学腐蚀
时,其正极电极反应式为_______。
(4)维生素 C能防治坏血病,又称为 _______,在维生素 C 溶液中滴紫色石蕊试液,
溶液颜色变红,说明维生素 C 溶液具有 _______性,在维生素 C 溶液中滴入少量酸
性 KMnO 溶液,可观察到的现象是 _______,说明维生素 C 具有_______性。
4
三、实验题
试卷第6页,共3页21.(1)茶叶、肉松、膨化食品等常采用真空充气包装,即将食品装入包装袋,抽出包
装袋内的空气,再充入防止食品变质的气体,然后封口。真空充气包装能使食品保持
原有的色、香、味及营养价值,防止食品受压而破碎变形。
提出问题:充入食品包装袋中的气体是什么?
猜想与验证:可能是 。实验初步验证的方法及现象:
________________________________。充入的气体还可能是_________。
(2)亚硝酸钠可作为食品的着色剂和防腐剂,但若用量超标,会危害人体健康。亚硝酸
钠具有咸味,外形与食盐相似。亚硝酸钠的水溶液呈碱性,食盐的水溶液呈中性。如
果请你鉴别亚硝酸钠溶液和食盐溶液,你将选用________来鉴别。
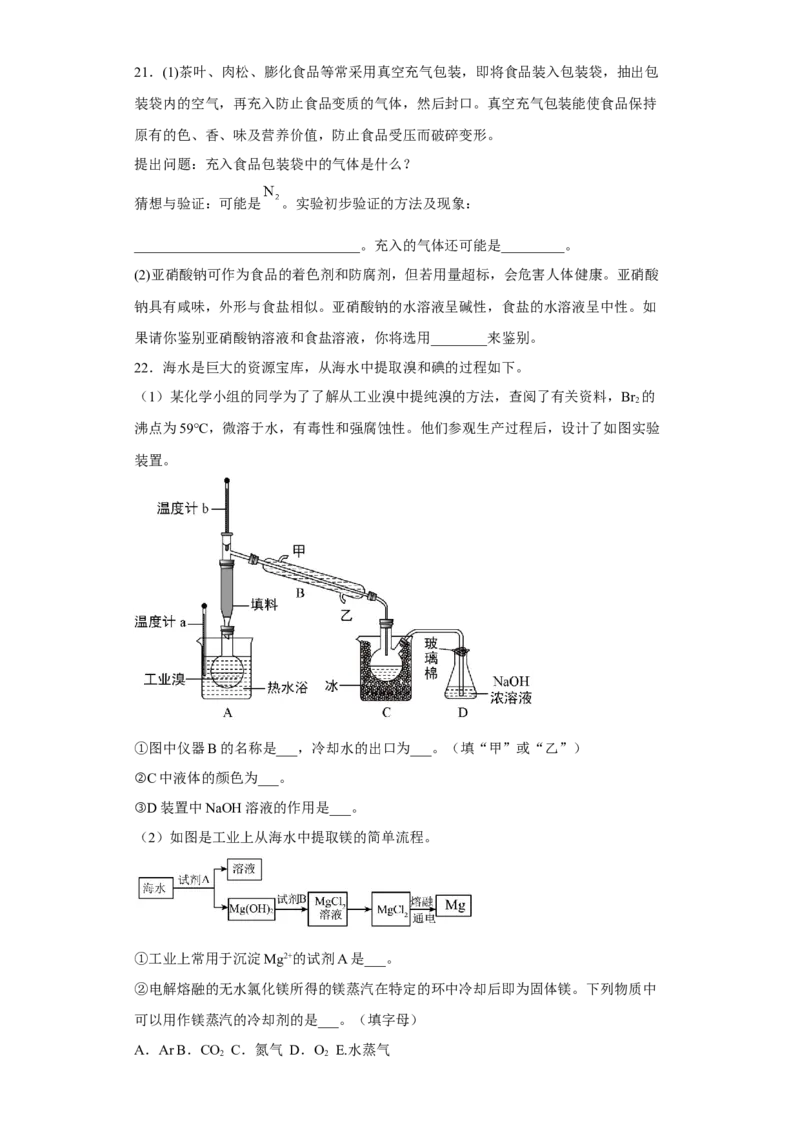
22.海水是巨大的资源宝库,从海水中提取溴和碘的过程如下。
(1)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br 的
2
沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图实验
装置。
①图中仪器B的名称是___,冷却水的出口为___。(填“甲”或“乙”)
②C中液体的颜色为___。
③D装置中NaOH溶液的作用是___。
(2)如图是工业上从海水中提取镁的简单流程。
①工业上常用于沉淀Mg2+的试剂A是___。
②电解熔融的无水氯化镁所得的镁蒸汽在特定的环中冷却后即为固体镁。下列物质中
可以用作镁蒸汽的冷却剂的是___。(填字母)
A.Ar B.CO C.氮气 D.O E.水蒸气
2 2(3)海带灰中富含以I-形式存在的碘元素。实验室提取I 的途径如图所示。
2
①灼烧海带时所用的主要仪器名称是___。
②向酸化的滤液中加HO 溶液,写出该反应的离子方程式___。
2 2
②向酸化的滤液应该再加入CCl 作萃取剂,振荡、静置,可以观察到CCl 层呈___色。
4 4
试卷第8页,共3页参考答案:
1.B
【详解】A.草木灰的主要成分是碳酸钾,碳酸钾水解显碱性,可洗衣服,“取碱浣衣”
其中的碱是KCO,故A正确;
2 3
B.湖泊池沼中腐烂的植物能产生甲烷,则“泽中有火……上火下泽”,其描述的是甲烷
在湖泊池沼水面上起火的现象,故B错误;
C.钾元素的焰色反应为紫色,硝石是硝酸钾,灼烧会产生紫色火焰,故C正确;
D.丹砂(HgS)烧之成水银,Hg的化合价从+2价降低到0价,Hg的化合价发生变化,属于
氧化还原反应,故D正确;
答案选B。
2.B
【详解】A. 二氧化硫具有还原性,具有一定的杀菌作用,葡萄糖中添加二氧化硫用于杀菌、
抗氧化,故A正确;
B. 熟石灰与NaCO 反应生成碳酸钙沉淀和氢氧化钠,在含较多NaCO 的盐碱地中施加适
2 3 2 3
量熟石灰提高了土壤碱性,故B错误;
C. 陶瓷坩埚中二氧化硅能与烧碱反应,故C正确;
D. 甲烷是一种强效温室气体,废弃的甲烷可用于生成甲醇,故D正确;
故选B。
3.A
【分析】本题考查的是化学知识在具体的生产生活中的应用,进行判断时,应该先考虑清
楚对应化学物质的成分,再结合题目说明判断该过程的化学反应或对应物质的性质即可解
答。
【详解】A.谷物中的淀粉在酿造中发生水解反应只能得到葡萄糖,葡萄糖要在酒化酶作
用下分解,得到酒精和二氧化碳。酒中含有酒精,醋中含有醋酸,显然都不是只水解就可
以的,选项A不合理;
B.商代后期铸造出工艺精湛的后(司)母戊鼎属于青铜器,青铜是铜锡合金,选项B合理;
C.陶瓷的制造原料为黏土,选项C合理;
D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,是利用青蒿素在乙醚中溶
解度较大的原理,将青蒿素提取到乙醚中,所以属于萃取操作,选项D合理。
【点睛】萃取操作有很多形式,其中比较常见的是液液萃取,例如:用四氯化碳萃取碘水
中的碘。实际应用中,还有一种比较常见的萃取形式是固液萃取,即:用液体溶剂萃取固体物质中的某种成分,例如:用烈酒浸泡某些药材。本题的选项D就是一种固液萃取。
4.A
【详解】A.Rx表示处方药,是指需凭医生处方才能购买,并在医生指导下使用的药物,
OTC表示非处方药,是不需持有医生处方就可直接从药店或药房购买使用的药物,A项正
确;
B.毒品不是有毒的药品,它是指一类能够使人形成瘾癖的麻醉药品和精神药品,B项错误;
C.不管是中药还是西药,合成的药物还是天然的药物,都有一定的毒性,C项错误;
D.药物都有一定的毒性,均不可滥用,D项错误;
答案选A。
5.A
【详解】A.因牛奶中含有蛋白质,所以误食铜、汞等重金属,可以喝牛奶解毒,并去医
院就诊,故A说法正确;
B.胃舒平(主要成分为氢氧化铝)可以中和胃酸,如同时多吃酸性食物,会减弱其中和胃酸
的效果,故B说法错误;
C.绿色化学是使污染消除在产生的源头,使整个合成过程和生产过程对环境友好,不再
使用有毒、有害的物质,不再产生废物,不再处理废物,故C说法错误;
D.用热的纯碱溶液能洗去油脂,是因为热的纯碱溶液显碱性,油脂在碱性条件下能发生
皂化反应,并不是酯类物质可以直接与NaCO 反应,故D说法错误;
2 3
本题答案A。
6.A
【详解】A.中草药中常含有苷类、生物碱、有机酸等成分,有机酸会和铁反应,因此煎
煮中草药不适宜使用铁锅,故A正确;
B.N95口罩所使用的熔喷布为聚丙烯,其单体丙烯结构为 ,不是直线
型分子,故B错误;
C.为增强“84”消毒液的消毒效果,NaClO和盐酸反应生成氯气,因此不能加适量稀盐酸,
故C错误;
D.二氧化硫常用作葡萄酒的防腐剂和抗氧剂,故D错误。
综上所述,答案为A。
答案第2页,共2页7.C
【详解】A.硅胶多孔,吸附水分能力强,且没有毒,常用作实验室和袋装食品、瓶装药
品等的干燥剂,A正确;
B.PO 是酸性氧化物吸水生成磷酸或偏硫酸,酸有腐蚀性,而偏磷酸有毒,因此不可用
2 5
作食品干燥剂,B正确;
C.氯化钙具有吸水性,而六水合氯化钙不具有吸水性,不能用作食品干燥剂,C错误;
D.加工后具有吸水性的植物纤维没有毒,没有腐蚀性,因此可用作食品干燥剂,D正确;
答案选C。
8.D
【详解】A.碳酸钠得俗名不是小苏打,也不可作糕点的膨松剂,碳酸氢钠俗名小苏打,
可用作糕点膨松剂,A错误;
B.食物腐败与氧化还原反应有关,而Fe(OH) 胶体的制备的方程式为:FeCl +3H O
3 3 2
Fe(OH) (胶体)+3HCl则与氧化还原反应无关,B错误;
3
C.CaO仅仅能干燥,没有抗氧化能力,故仅在包装袋中放入生石灰不能防止馅饼等富脂
食品氧化变质,而常常放入还原性铁粉可以起到抗氧化的作用,C错误;
D.新鲜苹果汁中含有Fe2+已被氧化为Fe3+,而Vc具有还原性,能够将Fe3+还原为Fe2+,从
而防止Fe2+被氧化,故榨苹果汁时加入维生素C,可减缓其在空气中发生颜色变化,D正
确;
故答案为:D。
9.D
【详解】A.抗坏血酸具有还原性,可以作抗氧化剂使用,但亚硝酸钠具有强氧化性,不
能作抗氧化剂使用,A错误;
B.葡萄糖是单糖不能发生水解反应,B错误;
C.活性炭为糖浆脱色原理为吸附作用,属于物理过程,而次氯酸盐漂白原理利用了次氯
酸的强氧化性,C错误;
D.乙酸乙酯在酸性条件下的水解方程式为:,酯基断开的
是碳氧单键,故 应在乙醇中,D正确;
故本题选D。
10.D
【详解】A.草木灰中含有KCO,含有钾元素,常用作钾肥,故A正确;
2 3
B.贝壳煅烧成灰的过程是碳酸钙分解生成氧化钙和二氧化碳气体,该过程中发生了分解
反应,故B正确;
C.“灰”(草木灰)和“蜃”(贝壳灰) ,“灰”和“蜃”混合加水反应生成KOH和碳酸钙,
所得溶液中含有KOH,故C正确;
D.钾的焰色反应为紫色,因此不能用焰色试验区分KCO、KOH两种物质,故D错误。
2 3
综上所述,答案为D。
11.D
【详解】A.少吃蔬菜,会造成维生素缺乏,A项饮食习惯不科学;
B.长期喝碳酸饮料会影响骨质、导致肥胖、影响口腔健康、胃肠功能紊乱、增加肾脏负
担等,矿泉水是地下水天然露出至地表或地下含水层露出地表,有一定有机物、矿物质,
能起到润肠通便、生津止渴的功效,应多喝矿泉水,少喝碳酸饮料,B项饮食习惯不科学;
C.含防腐剂的食物,食用过量会对人体有害,C项饮食习惯不科学;
D.注意饮食的合理搭配,合理膳食,有助于人体健康,D项饮食习惯科学;
本题答案选D。
12.B
【详解】A.从海水中获取氯化镁需要加入氢氧化钙,反应生成氢氧化镁沉淀,沉淀溶于盐
酸即可,故不涉及氧化还原反应,故错误;
B.煤的气化是将煤这种固体燃料变为一氧化碳和氢气,属于氧化还原反应,液化是指一氧
化碳和氢气反应生成甲醇等,也属于氧化还原反应,故正确;
C.泡沫灭火器的原理为Al2(SO4)3+6NaHCO3==3Na2SO4+2Al(OH)3↓+6CO2↑ ,不属于
氧化还原反应,故错误;
D.铝土矿用强碱溶解的过程中涉及氧化铝溶于氢氧化钠生成偏铝酸钠和水,不属于氧化还
答案第4页,共2页原反应,故错误。
故选B。
13.A
【详解】A项、食品包装中铁粉、氯化钠溶液、炭粉构成原电池,铁作负极,碳作正极,
负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,其脱氧原理实际上就是
钢铁的吸氧腐蚀,故A错误;
B项、黏土烧制陶瓷的过程中有新物质生成,属于化学变化,故B正确;
C项、酒精沸点低,可以用蒸馏与酒糟分离获得酒精,故C正确;
D项、侯氏制碱法是工业上制取碳酸钠的过程,故D正确;
故选A。
14.C
【详解】A. 粗盐精制过程需要除去粗盐中含有的硫酸根离子、钙离子、镁离子,需要加入
除杂剂,该过程中有新物质生成,发生化学变化,故A正确;
B. 病毒表现生命活动需要蛋白质,高温、消毒剂都能使蛋白质变性而失去生理活性,故B
正确;
C. 铜活泼性弱于氢,所以铜制品不能发生析氢腐蚀,而铁制品既能发生吸氧腐蚀又能发生
析氢腐蚀,故C错误;
D. 植物油中由于含有碳碳双键,易被氧化而变质,因此在空气中长时间放置容易氧化变质,
故D正确;
答案选C。
15.B
【详解】A. “百炼成钢”是将生铁中的C氧化为二氧化碳,发生了化学变化,“蜡炬成
灰”是烃的燃烧,发生了化学变化,A正确;
B. Fe在常温下在浓硝酸中会钝化,无法溶解在浓硝酸中,B错误;
C. “雷雨肥庄稼”是将空气中游离态的N元素氧化为化合态,涉及到了氧化还原反应,C
正确;
D. “薄薄的青雾浮起在荷塘里”中的“青雾”属于胶体,D正确;
故答案选B。
16.(1)SO 具有还原性,是一种抗氧化剂,可以防止原料被氧化;且SO 是一种杀菌剂,
2 2
能抑制杂菌的活动
(2) SO +I +2H O= H SO +2HI等 测量SO 的含量,首先应考虑固定SO ,可以
2 2 2 2 4 2 2用SO 的还原性,选择氧化剂如氯水、HO、酸性KMnO 溶液等将SO 氧化为SO ,加
2 2 2 4 2
入盐酸酸化后,再加入BaCl 溶液,使之生成BaSO 沉淀,通过称量BaSO 沉淀的质量测
2 4 4
SO 的含量 SO +I +2H O= SO +2I-+4H+ 测定原理:取一定体积和物质的量浓
2 2 2 2
度的碘水,先滴入少量淀粉溶液,再滴加葡萄酒并使化学反应充分发生,当碘水的蓝色刚
好褪去时,I 已恰好完全反应。此时可应用SO +I +2H O= SO +2I-+4H+求出葡萄酒中SO
2 2 2 2 2
的质量,进而求出葡萄酒中SO 的含量
2
(3)对人体无害;属于国家规定的食品添加剂;具有还原性,可抑制杂菌生长
【详解】(1)由于SO 中S元素为+4价,处于中间价态,故SO 具有还原性,又因SO 具
2 2 2
有毒性,能抑制杂菌的活动,故答案为:SO 具有还原性,是一种抗氧化剂,可以防止原
2
料被氧化;且SO 是一种杀菌剂,能抑制杂菌的活动;
2
(2)①由于SO 具有还原性,故可以用具有氧化性的物质如碘单质反应,且碘单质遇淀粉
2
溶液变蓝,可以测定SO 的含量,故答案为:SO +I +2H O= H SO +2HI等;测量SO 的含
2 2 2 2 2 4 2
量,首先应考虑固定SO ,可以用SO 的还原性,选择氧化剂如氯水、HO、酸性KMnO
2 2 2 2 4
溶液等将SO 氧化为SO ,加入盐酸酸化后,再加入BaCl 溶液,使之生成BaSO 沉淀,
2 2 4
通过称量BaSO 沉淀的质量测SO 的含量;
4 2
②由于SO 具有还原性,故可以用具有氧化性的物质如碘单质反应,且碘单质遇淀粉溶液
2
变蓝,可以测定SO 的含量,故答案为:SO +I +2H O= SO +2I-+4H+;测定原理:取一定
2 2 2 2
体积和物质的量浓度的碘水,先滴入少量淀粉溶液,再滴加葡萄酒并使化学反应充分发生,
当碘水的蓝色刚好褪去时,I 已恰好完全反应。此时可应用SO +I +2H O= SO +2I-+4H+求
2 2 2 2
出葡萄酒中SO 的质量,进而求出葡萄酒中SO 的含量;
2 2
(3)替代物质需要满足对人体无害;属于国家规定的食品添加剂;具有还原性,可抑制杂
菌生长,故答案为:对人体无害;属于国家规定的食品添加剂;具有还原性,可抑制杂菌
生长。
答案第6页,共2页17.(1)c
(2)a
(3)重庆
(4)0.5N
A
(5)镉
【详解】(1)人体如果缺乏铁元素将导致血液输送氧气的能力下降,人体内就无法获得充
足的氧气,故选c;
(2)a.阿莫西林是抗生素,a正确;
b.胃舒平是抗酸药,不属于抗生素,b错误;
c.阿司匹林是解热镇痛药,c错误;
故选a;
(3)武汉的空气中含有氮的氧化物,重庆的空气中含有二氧化硫,其中重庆的污染指数最
高,最容易出现酸雨;
(4)10 L0.1 mol ·L-1的NaOH溶液中含有NaOH的物质的量n(NaOH)=0.1 mol/L×10 L=1
mol,根据方程式可知:存在关系式: ,转移
的电子的物质的量等于氢氧化钠物质的量的二分之一,反应中转移电子的物质的量
0.5mol,数目为0.5N ;
A
(5)根据表格:1L水中,允许排放的汞离子的质量为:1L×0.05mg/dm3=0.05mg,质量分数为:
0.05mg÷(1000×1000mg)×100%=5×10-6%;1L水中,允许排放的镉离子的质量为:
1L×0.1mg/dm3=0.1mg,质量分数0.1mg/(1000×1000mg)×100%=1×10-6%;1L水中,允许排
放的铅离子的质量为: 1L×1.0mg/dm3=1mg,质量分数1mg÷(1000×1000mg)×100%=1×10-
4%;某工厂每日排放的污水中汞的质量分数为1×10-6%,小于5×10-6%,所以不超标;镉的
质量分数为2×10-5%,大于1×10-5%,所以超标;铅的质量分数为5×10-5%,小于1×10-4%
,所以不超标;因此,本题正确答案是:镉。
18.(1) 盐 214g/mol 0.2mol
(2) 分解 氧化还原反应
(3)11.2L
(4)67.4【解析】(1)
碘酸钾和氯化钠在分类上都属于盐; 的摩尔质量为214g/mol,水溶液中KIO =K++IO ,
3
故 在水中电离出的离子的物质的量为0.2mol;
(2)
烹调时待食品熟后加入,因为碘酸钾受热易分解,碘酸钾中碘元素是+5价,碘化钾中碘元
素是-1价,前后有价态的改变是氧化还原反应;
(3)
电解时生成20g NaOH即0.5mol,根据方程式中的计量系数可知生成0.5mol混合气体,标
况下为11.2L;
(4)
含碘量最大为40mg/kg,每千克该加碘食盐中含碘酸钾的质量最多为40 ( )
=67.4mg。
19.(1) 面粉 鸡蛋 植物油 蛋白质
(2)碘
(3)不能
(4)Al(OH) +3HCl=AlCl +3H O
3 3 2
【解析】(1)
面粉的主要成分是淀粉,则在配料中,富含淀粉的是面粉;鸡蛋的主要成分为蛋白质,则
富含蛋白质的是鸡蛋;富含油脂的是植物油;牛奶和豆浆中都含有大量的蛋白质。
(2)
缺乏碘元素会导致甲状腺肿大,而且会造成智力伤害。
(3)
服用头孢类药物后饮酒,很容易出现乙醛中毒,也就是双硫仑反应,会有恶心、呕吐、潮
红、心律不齐,甚至呼吸困难、心力衰竭、死亡等,在服用头孢药物期间不能饮酒。
(4)
氢氧化铝发挥药效时的化学方程式为Al(OH) +3HCl=AlCl +3H O。
3 3 2
20.(1)
(2)C
答案第8页,共2页(3) 电化学 O+4e-+2H O=4OH-
2 2
(4) 抗坏血酸 酸 酸性高锰酸钾颜色褪去 还原
【解析】(1)
正常雨水由于溶解了CO 而显酸性,pH约为5.6,pH小于5.6的酸性降水称为酸雨。
2
(2)
臭氧具有强氧化性,通入臭氧可以氧化污水中的油类和氰化物,故选C。
(3)
金属的腐蚀一般可分为化学腐蚀和电化学腐蚀,钢铁在中性环境中发生电化学腐蚀时,其
正极电极反应式为O+4e-+2H O=4OH-。
2 2
(4)
维生素 C能防治坏血病,又称为抗坏血酸,在维生素 C 溶液中滴紫色石蕊试液,溶液颜
色变红,说明维生素 C 溶液具有酸性,在维生素 C 溶液中滴入少量酸性 KMnO 溶液,
4
可观察到的现象是高锰酸钾溶液的紫色褪去,说明维生素 C 具有还原性。
21. 将燃烧的木条伸入包装袋内,木条熄灭,再将气体通入澄清石灰水中,石灰
水不变浑浊 试纸(或紫色石蕊溶液或酚酞溶液)
【详解】(1)真空包装是将包装袋内的空气抽尽,使微生物在无氧的环境下停止繁殖,从而
保存食品的方法,但对于膨化食品和易碎食品,采用真空包装在运输过程中会有很大的不
便,因此为防止食品受压而破碎变形,常采用真空充气包装。充入的气体要有抑制微生物
生存的作用,无毒、不与食物反应,其次从经济角度尽量选廉价易获得的气体,因此可用
、 等气体,其中初步验证氮气的方法及现象为将燃烧的木条伸入包装袋内,木条熄
灭,再将气体通入澄清石灰水中,石灰水不变浑浊;
(2)由于亚硝酸钠的水溶液呈碱性,食盐的水溶液呈中性,因此鉴别亚硝酸钠溶液和食盐溶
液,可选用 试纸或紫色石蕊溶液或酚酞溶液等。
22. 直形冷凝管 甲 深红棕色或红棕色 吸收尾气,
防止污染环境 Ca(OH) A 坩埚、酒精灯、泥三角、三脚架 2H++2I-
2
+H O=I +2H O 紫红
2 2 2 2
【分析】本题通过三组实验分别从海水中提取溴、镁、碘,第一组实验为工业溴的提纯实
验,因为溴是一种极易挥发的液体,故在热水浴中可以将溴挥发出来,通过冷凝管的冷凝作用将纯净的溴收集起来,达到提纯的效果;第二组实验为海水提镁实验,向海水中加入
氢氧化钙溶液将海水中的镁提取出来,后经过盐酸的溶解、蒸发得到固体氯化镁,通过电
解熔融的氯化镁得到纯净的镁,在电解过程中需通入惰性气体以保护镁不被氧化;第三组
实验为海带提碘实验,将干海带灼烧呈灰后加水溶解,含有碘的物质就转移到溶液中,向
溶液中加入少量酸化过的过氧化氢,碘离子可以与酸化的过氧化氢反应生成碘单质,在通
过萃取的方式将单质提纯,即得到纯净的碘单质。
【详解】(1)①图中仪器B的名称是直形冷凝管,为达到较好的冷凝效果,采用逆流原理,
冷却水的出口为甲,故答案为:直形冷凝管;甲;
②由题中信息可知,C中液体为液态溴,颜色为深红棕色或红棕色,故答案为:深红棕色
或红棕色;
③溴有毒性和强腐蚀性,D装置中NaOH溶液的作用是吸收尾气,防止污染环境,故答案
为:吸收尾气,防止污染环境;
(2)①石灰乳便宜易得,则工业上常用于沉淀Mg2+的试剂A是Ca(OH) ,故答案为:
2
Ca(OH) ;
2
②电解熔融的无水氯化镁所得的镁蒸汽在特定的环境中冷却后即为固体镁,Mg与二氧化
碳、氮气、氧气、水蒸气均反应,只有Ar可以用作镁蒸汽的冷却剂,故答案为:A;
(3)①灼烧海带时所用的主要仪器名称是坩埚、酒精灯、泥三角、三脚架,故答案为:坩埚、
酒精灯、泥三角、三脚架;
②向酸化的滤液中加HO 溶液,碘离子被氧化为碘单质,该反应的离子方程式为2H++2I-
2 2
+H O=I +2H O,故答案为:2H++2I-+H O=I +2H O;
2 2 2 2 2 2 2 2
②酸化的滤液中含有碘,碘易溶于有机溶剂,向滤液中再加入CCl 作萃取剂,振荡、静置,
4
可以观察到CCl 层呈紫红色,故答案为:紫红。
4
答案第10页,共2页