文档内容
人教版(2019)必修第二册第六章第一节化学反应与能量变化
课时训练二
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.原电池的电极反应不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中
不正确的是
A.由Al、Cu、稀HSO 组成原电池,其负极反应式为:Al-3e﹣=Al3+
2 4
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Mg-2e﹣=Mg2+
C.由Fe、Cu、FeCl 溶液组成原电池,其负极反应式为:Fe-2e﹣=Fe2+
3
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e﹣=Cu2+
2.下列化学反应中可以设计为原电池的是
A. B.
C. D.
3.化学与社会、生产、生活和科技密切相关。下列有关说法错误的是
A.食醋又称为冰醋酸,易溶于水和乙醇
B.干冰、AgI都可用于人工降雨,但原理不同
C.可燃冰 属于新型的一次能源
D.家用不粘锅的保护膜氟纶 属于有机高分子材料
4.下列说法不正确的是
A. 晶体与 晶体的反应是常见的吸热反应
B.化学反应必然伴随能量变化,原因是化学反应中旧键断裂所吸收的能量与新键生成
所释放的能量不相等
C.一定条件下,石墨转化为金刚石要吸收能量,说明石墨比金刚石稳定,等质量的金
刚石和石墨完全燃烧石墨释放的能量更多
D.太阳能、风能、地热能、海洋能、氢能都属于新能源
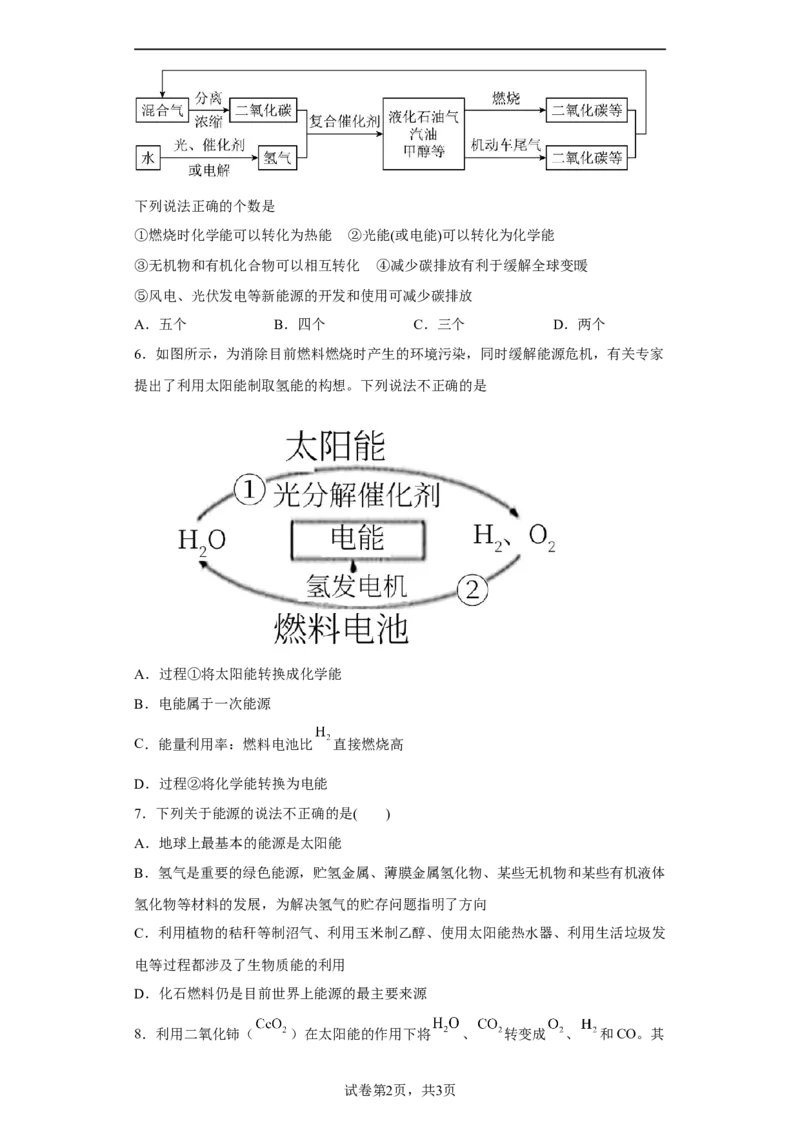
5.碳中和作为一种新型环保形式,可推动全社会绿色发展。我国争取2060年前实现
碳中和,科学家正在研究建立如图所示的二氧化碳新循环体系:下列说法正确的个数是
①燃烧时化学能可以转化为热能 ②光能(或电能)可以转化为化学能
③无机物和有机化合物可以相互转化 ④减少碳排放有利于缓解全球变暖
⑤风电、光伏发电等新能源的开发和使用可减少碳排放
A.五个 B.四个 C.三个 D.两个
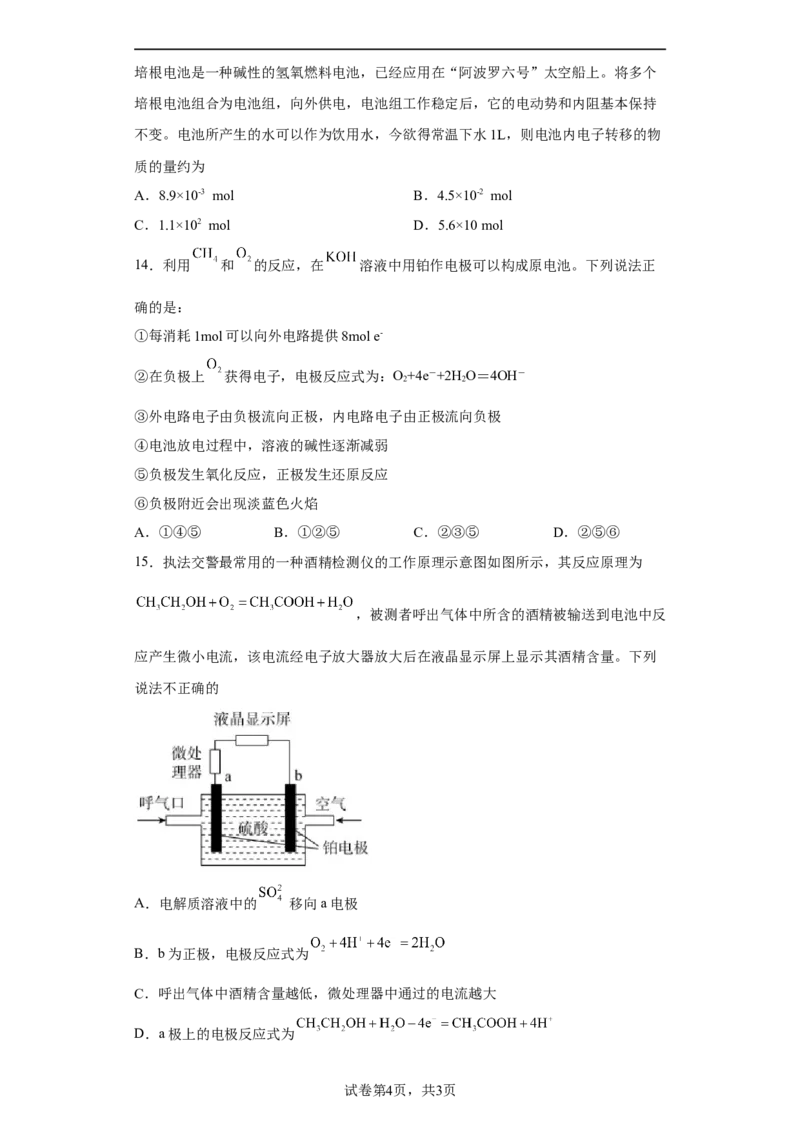
6.如图所示,为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家
提出了利用太阳能制取氢能的构想。下列说法不正确的是
A.过程①将太阳能转换成化学能
B.电能属于一次能源
C.能量利用率:燃料电池比 直接燃烧高
D.过程②将化学能转换为电能
7.下列关于能源的说法不正确的是( )
A.地球上最基本的能源是太阳能
B.氢气是重要的绿色能源,贮氢金属、薄膜金属氢化物、某些无机物和某些有机液体
氢化物等材料的发展,为解决氢气的贮存问题指明了方向
C.利用植物的秸秆等制沼气、利用玉米制乙醇、使用太阳能热水器、利用生活垃圾发
电等过程都涉及了生物质能的利用
D.化石燃料仍是目前世界上能源的最主要来源
8.利用二氧化铈( )在太阳能的作用下将 、 转变成 、 和CO。其
试卷第2页,共3页过程如下: 、
。下列说法不正确的是( )
A. 是该反应的催化剂 B.整个过程没有消耗
C.该过程实现了太阳能向化学能的转化 D. 在第一个反应中作氧化产物
9.下列说法正确的是( )
A.煤等化石燃料是可再生能源
B.需要加热才能发生的反应一定是吸热反应
C.节能减排符合低碳经济的要求
D.有能量变化的都是化学变化
10.某集团拟在太空建立巨大的激光装置,把太阳光变成激光用于分解海水制氢气,
其反应式可表示为2HO 2H↑+O ↑。有下列几种说法:①水的分解反应是放热反
2 2 2
应;②氢气是一级能源;③使用氢气作燃料有助于控制温室效应;④该过程将光能转
化为化学能。以上叙述中正确的是
A.①② B.③④ C.②③④ D.①③④
11.2022年北京冬奥会和冬残奥会通过科技助力“碳中和”,体现绿色环保理念。下
列说法错误的是
A.火炬“飞扬”采用氢能为燃料,体现“绿色低碳”的发展理念
B.火炬“飞扬”外壳由有机高分子材料碳纤维制成
C.奥运场馆使用的碲化镉发电玻璃,实现了太阳能向电能的转化
D.冬奥会使用的餐具均由可降解聚乳酸生物新材料制成,能有效减少白色污染
12.某储能电池的工作原理是: 。下
列说法正确的是
A.放电时, 在正极上发生氧化反应
B.放电时, 完全反应转移 电子
C.充电时,阳极反应式为
D.充电时,阴极与直流电源的正极连接
13.美国《时代周刊》将氢燃料电池评为21世纪对人类生活具有重大影响的技术之一、培根电池是一种碱性的氢氧燃料电池,已经应用在“阿波罗六号”太空船上。将多个
培根电池组合为电池组,向外供电,电池组工作稳定后,它的电动势和内阻基本保持
不变。电池所产生的水可以作为饮用水,今欲得常温下水1L,则电池内电子转移的物
质的量约为
A.8.9×10-3 mol B.4.5×10-2 mol
C.1.1×102 mol D.5.6×10 mol
14.利用 和 的反应,在 溶液中用铂作电极可以构成原电池。下列说法正
确的是:
①每消耗1mol可以向外电路提供8mol e-
②在负极上 获得电子,电极反应式为:O+4e-+2H O=4OH-
2 2
③外电路电子由负极流向正极,内电路电子由正极流向负极
④电池放电过程中,溶液的碱性逐渐减弱
⑤负极发生氧化反应,正极发生还原反应
⑥负极附近会出现淡蓝色火焰
A.①④⑤ B.①②⑤ C.②③⑤ D.②⑤⑥
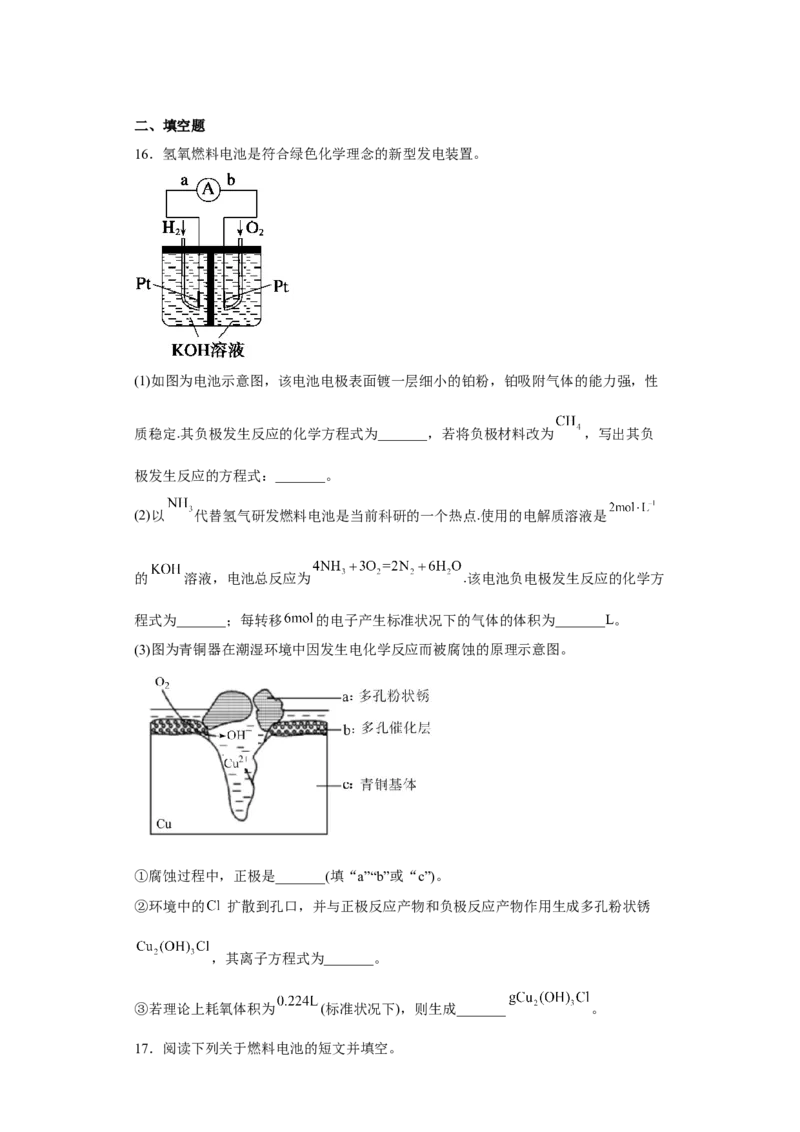
15.执法交警最常用的一种酒精检测仪的工作原理示意图如图所示,其反应原理为
,被测者呼出气体中所含的酒精被输送到电池中反
应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列
说法不正确的
A.电解质溶液中的 移向a电极
B.b为正极,电极反应式为
C.呼出气体中酒精含量越低,微处理器中通过的电流越大
D.a极上的电极反应式为
试卷第4页,共3页二、填空题
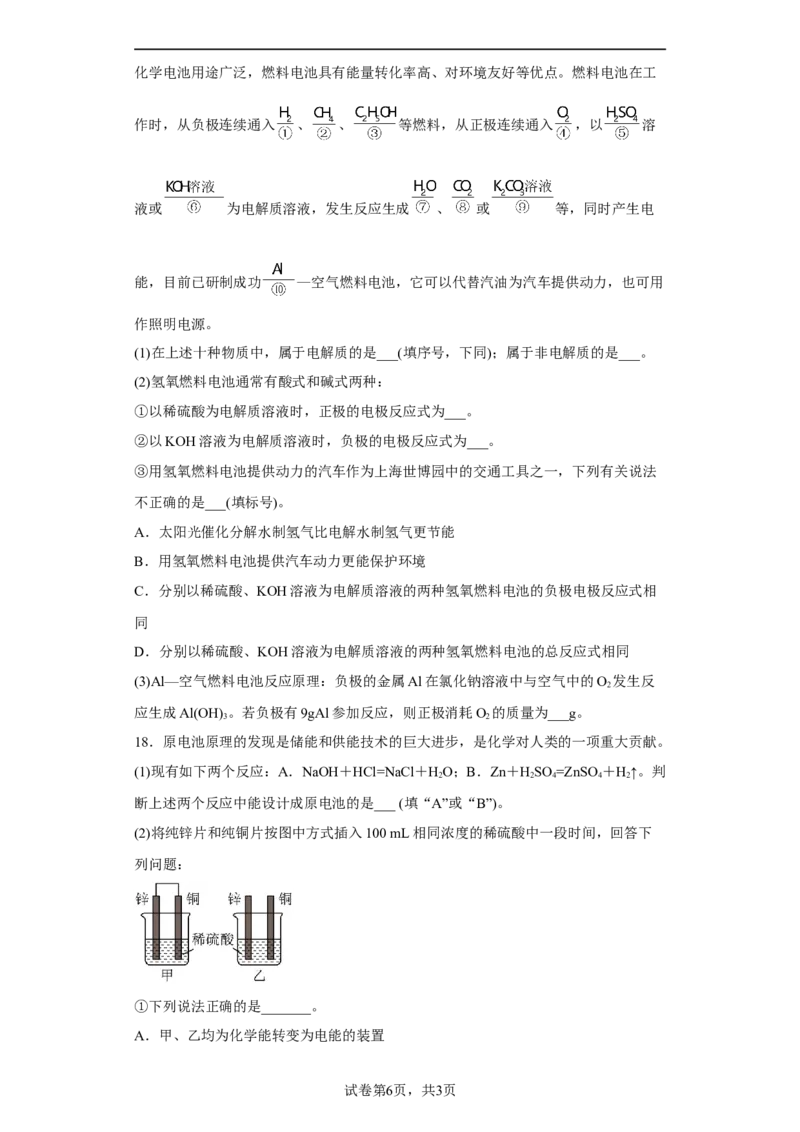
16.氢氧燃料电池是符合绿色化学理念的新型发电装置。
(1)如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性
质稳定.其负极发生反应的化学方程式为_______,若将负极材料改为 ,写出其负
极发生反应的方程式:_______。
(2)以 代替氢气研发燃料电池是当前科研的一个热点.使用的电解质溶液是
的 溶液,电池总反应为 .该电池负电极发生反应的化学方
程式为_______;每转移 的电子产生标准状况下的气体的体积为_______L。
(3)图为青铜器在潮湿环境中因发生电化学反应而被腐蚀的原理示意图。
①腐蚀过程中,正极是_______(填“a”“b”或“c”)。
②环境中的 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈
,其离子方程式为_______。
③若理论上耗氧体积为 (标准状况下),则生成_______ 。
17.阅读下列关于燃料电池的短文并填空。化学电池用途广泛,燃料电池具有能量转化率高、对环境友好等优点。燃料电池在工
作时,从负极连续通入 、 、 等燃料,从正极连续通入 ,以 溶
液或 为电解质溶液,发生反应生成 、 或 等,同时产生电
能,目前已研制成功 —空气燃料电池,它可以代替汽油为汽车提供动力,也可用
作照明电源。
(1)在上述十种物质中,属于电解质的是___(填序号,下同);属于非电解质的是___。
(2)氢氧燃料电池通常有酸式和碱式两种:
①以稀硫酸为电解质溶液时,正极的电极反应式为___。
②以KOH溶液为电解质溶液时,负极的电极反应式为___。
③用氢氧燃料电池提供动力的汽车作为上海世博园中的交通工具之一,下列有关说法
不正确的是___(填标号)。
A.太阳光催化分解水制氢气比电解水制氢气更节能
B.用氢氧燃料电池提供汽车动力更能保护环境
C.分别以稀硫酸、KOH溶液为电解质溶液的两种氢氧燃料电池的负极电极反应式相
同
D.分别以稀硫酸、KOH溶液为电解质溶液的两种氢氧燃料电池的总反应式相同
(3)Al—空气燃料电池反应原理:负极的金属Al在氯化钠溶液中与空气中的O 发生反
2
应生成Al(OH) 。若负极有9gAl参加反应,则正极消耗O 的质量为___g。
3 2
18.原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+HO;B.Zn+HSO =ZnSO +H↑。判
2 2 4 4 2
断上述两个反应中能设计成原电池的是___ (填“A”或“B”)。
(2)将纯锌片和纯铜片按图中方式插入100 mL相同浓度的稀硫酸中一段时间,回答下
列问题:
①下列说法正确的是_______。
A.甲、乙均为化学能转变为电能的装置
试卷第6页,共3页B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲_______乙(填“>”“<”或“=”)。
③请写出图中构成原电池的负极电极反应式:_______。
④当乙中产生1.12 L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至
1L,测得溶液中c(H+)=0.1 mol/L,试确定原稀硫酸的物质的量浓度为_______。
(3)燃料电池的工作原理是将燃料和氧化剂(如O)反应所放出的化学能直接转化为电能。
2
现设计一燃料电池,以C为电极,CHOH为燃料,采用氢氧化钠溶液为电解液,电池
3
工作时消耗1 mol CH OH,则电路中通过_______mol电子。
3
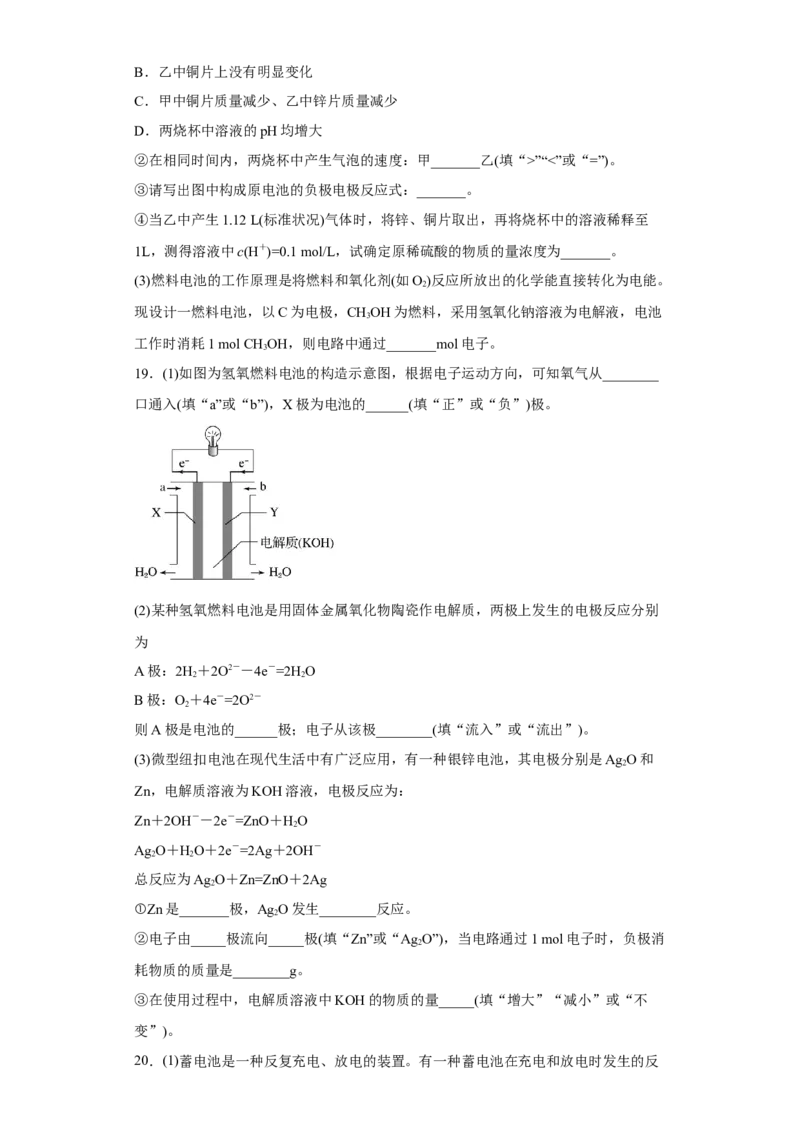
19.(1)如图为氢氧燃料电池的构造示意图,根据电子运动方向,可知氧气从________
口通入(填“a”或“b”),X极为电池的______(填“正”或“负”)极。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别
为
A极:2H+2O2--4e-=2H O
2 2
B极:O+4e-=2O2-
2
则A极是电池的______极;电子从该极________(填“流入”或“流出”)。
(3)微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag O和
2
Zn,电解质溶液为KOH溶液,电极反应为:
Zn+2OH--2e-=ZnO+HO
2
Ag O+HO+2e-=2Ag+2OH-
2 2
总反应为Ag O+Zn=ZnO+2Ag
2
①Zn是_______极,Ag O发生________反应。
2
②电子由_____极流向_____极(填“Zn”或“Ag O”),当电路通过1 mol电子时,负极消
2
耗物质的质量是________g。
③在使用过程中,电解质溶液中KOH的物质的量_____(填“增大”“减小”或“不
变”)。
20.(1)蓄电池是一种反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应如下:NiO+Fe+2HO Fe(OH) +Ni(OH) 。
2 2 2 2
①此蓄电池在充电时,电池负极应与外加电源的___极连接,电极反应式为__________。
②放电时生成Ni(OH) 的一极,在充电时发生_______反应(填“氧化”或“还原”)
2
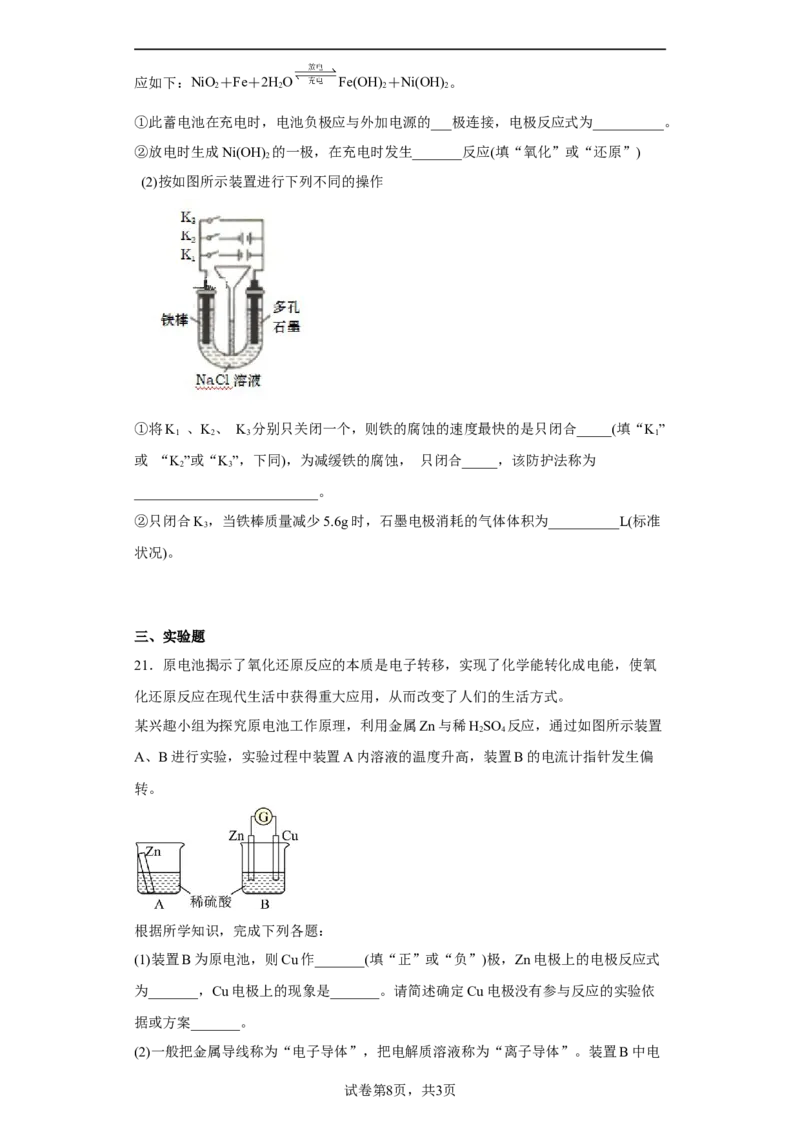
(2)按如图所示装置进行下列不同的操作
①将K 、K、 K 分别只关闭一个,则铁的腐蚀的速度最快的是只闭合_____(填“K”
1 2 3 1
或 “K”或“K”,下同),为减缓铁的腐蚀, 只闭合_____,该防护法称为
2 3
__________________________。
②只闭合K,当铁棒质量减少5.6g时,石墨电极消耗的气体体积为__________L(标准
3
状况)。
三、实验题
21.原电池揭示了氧化还原反应的本质是电子转移,实现了化学能转化成电能,使氧
化还原反应在现代生活中获得重大应用,从而改变了人们的生活方式。
某兴趣小组为探究原电池工作原理,利用金属Zn与稀HSO 反应,通过如图所示装置
2 4
A、B进行实验,实验过程中装置A内溶液的温度升高,装置B的电流计指针发生偏
转。
根据所学知识,完成下列各题:
(1)装置B为原电池,则Cu作_______(填“正”或“负”)极,Zn电极上的电极反应式
为_______,Cu电极上的现象是_______。请简述确定Cu电极没有参与反应的实验依
据或方案_______。
(2)一般把金属导线称为“电子导体”,把电解质溶液称为“离子导体”。装置B中电
试卷第8页,共3页池工作时“电子导体”中电子的流动方向可描述为_______;“离子导体”中主要离子
的移动方向可描述为_______。
(3)从能量转化的角度来看,装置A中反应物的总能量_______(填“高于”、“低于”
或“=”)生成物的总能量;从反应速率的角度上看,可以观察到A中反应比B中
_______(填“快”或“慢”)。
(4)装置B中稀HSO 用足量CuSO 溶液代替,起始时Zn电极和Cu电极的质量相等,
2 4 4
当导线中有0.2mol电子转移时,Zn电极和Cu电极的质量差为_______。
(5)该小组同学由此得出的结论错误的是_______。(多选)
A.任何自发进行的氧化还原反应均可以设计成原电池
B.装置B中Cu电极不可用碳棒代替
C.原电池的负极发生还原反应
D.原电池装置中化学能全部转化为电能
22.为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
(1)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢
氧化钡溶液与稀硫酸,根据所学知识推测该反应属于_______(填“吸热”或“放热”)
反应,预测U形管中可观察到的现象是_______。
(2)选择装置II进行探究固体M在甲中溶于水的热效应。
①若M为 ,则实验过程中烧杯中可观察到的现象是_______。
②若M为NaOH,则实验过程中烧杯中可观察到的现象为_______。
(3)上述3个装置中,不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”的是
_______(填序号)。理由是_______。
(4)至少有两种实验方法能证明过氧化钠与水的反应( )
是放热反应。
方法①:选择上述装置_______(填“I”、“II”或“III”)进行实验。
方法②:取适量过氧化钠粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到_______,则说明该反应是放热反应。
试卷第10页,共3页参考答案:
1.B
【详解】A.该原电池中,Al易失电子作负极、Cu作正极,负极上铝失电子、正极上氢离
子得电子,负极反应式为:Al﹣3e﹣=Al3+,故A正确;
B.该原电池中,Al能与NaOH溶液反应,Al易失电子作负极、Mg作正极,负极上Al失
电子、正极上水得电子,负极上电极反应式为Al+4OH﹣﹣3e﹣=AlO﹣+2H O,故B错误;
2 2
C.该装置中,铁比铜活泼,铁易失电子作负极、Cu作正极,负极上铁失电子、正极上铁
离子得电子,负极反应式为:Fe﹣2e﹣=Fe2+,故C正确;
D.该原电池中,铜易失电子作负极、Al作正极,负极上铜失电子、正极上硝酸根离子得
电子,负极电极反应式为Cu﹣2e﹣=Cu2+,故D正确;
故答案为B。
2.D
【分析】能设计成原电池的反应,必须为常温下能自发进行的氧化还原反应。
【详解】A. 中不含价态变化的元素,为非氧化还原反应,
不能设计成原电池,A不符合题意;
B. 为非氧化还原反应,不能设计成原电池,B不符合题意;
C. 为复分解反应,不能设计成原电池,C不符合题意;
D. 为常温下发生的置换反应,能设计成原电池,D符合题意;
故选D。
3.A
【详解】A.食醋为 的醋酸的水溶液,不是冰醋酸,无水醋酸为冰醋酸,易溶于水和乙
醇,故A错误;
B.干冰升华吸热,碘化银在云层中形成水蒸气凝结核,二者都能使水汽凝结为雨滴,原
理不同,故B正确;
C. 属于化石燃料,是不可再生资源,属于新型的一次能源,故B正确;
D.氟纶 是四氟乙烯经过加成反应生成的,属于有机高分子材料,故D正确。
故答案为A。
4.C
【详解】A.Ba(OH)2⋅8H2O晶体与NH4Cl晶体的反应是常见的吸热反应,A正确;
B.化学反应中旧键断裂所吸收的能量与新键生成所释放的能量不相等,使得化学反应的
过程中伴随着能量的变化,B正确;
C.一定条件下,石墨转化为金刚石要吸收能量,说明等质量的情况下,石墨所含能量更
低,则石墨比金刚石稳定,且等质量的金刚石和石墨完全燃烧,金刚石释放的能量更多,
C错误;
D.太阳能、风能、地热能、海洋能、氢能都属于新能源,D正确;
故选C。
5.A
【详解】①燃烧是放热反应,燃烧时化学能转化为热能,①正确;
②由图可知,水在光、催化剂(或电解)作用下可以得到氢气,光能(或电能)可以转化为化学
能,②正确;
③由图可知,二氧化碳、氢气在催化剂条件下得到汽油、甲醇等,汽油、甲醇燃烧生成二
氧化碳,则无机物和有机化合物可以相互转化,③正确;
④二氧化碳是温室效应气体,减少碳排放有利于缓解全球变暖,④正确;
⑤使用风电、光伏发电等新能源可减少火力发电,可减少碳排放,⑤正确;
综上,5个均正确,答案选A。
6.B
【详解】A.化学物质中存在化学能,过程①是水在太阳能的作用下转化为氢气和氧气,
是太阳能转换成化学能,故A正确;
B.电能是经过人为加工获得的,为二次能源,故B错误;
C.燃料电池的能量利用率要比燃料直接燃烧的能量利用率高,故C正确;
D.过程②是燃料电池,是将化学能转换为电能,故D正确;
故选B。
7.C
【详解】A.地球上的能源主要来源于太阳能,通过植物的光合作用被循环利用,即地球
上最基本的能源是太阳能,故A正确;
B.贮氢金属和氢气反应生成氢化物的方法,解决气体难以储存和运输的问题,则为解决
答案第2页,共2页氢气的贮存问题指明了方向,故B正确;
C.生物质能就是太阳能以化学能形式贮存在生物质中的能量形式,它直接或间接地来源
于绿色植物的光合作用,太阳能热水器不属于生物质能的范畴,故C错误;
D.化石燃料目前占能源的85%,仍然是世界上能源的主要来源,故D正确;
故选C。
8.A
【详解】A. 是中间产物,该反应的催化剂是 ,A错误;
B. 由反应①+反应②得总反应: ,可知整个过程没有消耗
,B正确;
C. 二氧化铈( )在太阳能作用下将 , 转变为 、 、CO,实现了太阳能
向化学能的转化,C正确;
D. 第一个反应中氧元素化合价升高, 在第一个反应中作氧化产物,D正确;
答案选A。
9.C
【详解】A.煤、石油、天然气等化石燃料的形成需要经过成千上万年,故属于不可再生
能源,A错;
B.可燃物燃烧需要加热到着火点,但燃烧属于放热反应,即需要加热的反应不一定是吸
热反应,B错;
C.节能减排可以减少化石燃料的使用,符合低碳经济的要求,C正确;
D.物质三态之间的转化也会伴随能量变化,但属于物理变化,D错误;
故答案选C。
10.B
【详解】①把太阳光变成激光用于分解海水制氢,太阳光提供能量,所以,水分解反应是
吸热反应,故①错误;
②自然界中没有现存的氢气,把太阳光变成激光用于分解海水制氢,说明氢气为二级能源,
故②错误;③温室效应产生的原因是二氧化碳的增多,使用氢气作燃料2H+O 2HO,能减少二
2 2 2
氧化碳的排放,有助于控制温室效应,故③正确;
④2H O 2H↑+O ↑,由反应条件可知,该过程是将光能转化为化学能,故④正确;
2 2 2
正确的有③④,故选B。
11.B
【详解】A.采用氢能为燃料,燃烧产物是水,不会产生二氧化碳且无污染,体现“绿色
低碳”的发展理念,故A正确;
B.有机高分子材料属于有机物,碳纤维属于无机非金属材料,故B错误;
C.碲化镉发电玻璃,将太阳能转化为电能,故C正确;
D.使用可降解聚乳酸生物新材料制成餐具,能有效减少白色污染,故D正确;
故答案为B。
12.C
【详解】A.放电时,正极上发生还原反应,A错误;
B.没有标明“标准状况”,不能计算转移电子数,B错误;
C.充电时,阳极发生氧化反应,即氯离子失电子生成氯气,C正确;
D.充电时阴极与电源负极相连,D错误;
故选C。
13.C
【详解】负极:2H-4e-+4OH-=4H O 正极:O+4e-+2HO=4OH-。所以产生2 mol水,转
2 2 2 2
移4 mol电子。制得1 L水转移电子数为 ×2=1.1×102 mol。故C正确;
故选:C。
14.A
【分析】碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反
应式为CH+10OH--8e-=CO +7H O,通入氧气的一极为原电池的正极,发生还原反应,
4 2
电极反应式为O+4e-+2H O=4OH-,原电池工作时,电子从负极经外电路流向正极,电
2 2
解质溶液中,阳离子向正极移动,阴离子向负极移动,据此解答。
答案第4页,共2页【详解】①通入CH 的电极为负极,电极反应为:CH+10OH--8e-=CO +7H O,每消耗
4 4 2
1molCH 可以向外电路提供8mole-,故①正确;
4
②在正极上O 获得电子,电极反应式为O+4e-+2H O=4OH-,故②错误;
2 2 2
③外电路电子由负极流向正极,内电路电子不能流动,故③错误;
④电池反应式为:CH+2OH-+2O =CO +3H O,随着反应的进行,溶液中氢氧根离子不
4 2 2
断减少,溶液pH不断减小,故④正确;
⑤负极发生氧化反应,正极发生还原反应,故⑤正确;
⑥负极附近不可能看到燃烧的现象,故不会出现淡蓝色火焰,故⑥错误。
故选A。
15.C
【分析】如图,该装置为原电池装置,电极b通入空气,主要是其中的氧气参与反应,则
电极b作为电池正极,环境为酸性,电极反应式为 ;电极a为负极,
酒精在电极a失电子,被氧化,电极反应式为 ;
【详解】A.原电池中,阴离子向负极移动,电极a为负极,所以电解质溶液中的 移
向a电极,故A正确;
B.电极b通入空气,主要是其中的氧气参与反应,则电极b作为电池正极,环境为酸性,
电极反应式为 ,故B正确;
C.呼出气体中酒精含量越低,根据电极反应式 ,
产生的电子越少,电流越微弱,故C错误;
D.电极a为电池的负极,酒精在电极a失电子,被氧化,电极反应式为
,故D正确;
故选C。
16.22.4 b
2.145
【详解】(1)由图可知,电解质为KOH溶液,a极通入氢气,为负极,氢气失电子发生氧化
反应,b极通入氧气,为正极,氧气得电子发生还原反应,则正极极反应式为:
O+2H O+4e-=4OH-,负极极反应式为: ;若将负极材料改为 ,
2 2
甲烷发生氧化反应,负极发生反应的方程式: ;
(2) 电解质溶液是 的 溶液,电池总反应为 ;根据反应
可知,氨气发生氧化反应,做原电池的负极,氧气发生还原反应,做原电池的正极;该电
池负电极发生反应的化学方程式为 ;根据反应可知,每转移
的电子产生标准状况下的气体的量为1mol,标况下体积为22.4L;
(3)①据图可知,氧气得到电子生成氢氧根离子,铜失电子生成铜离子,发生吸氧腐蚀,青
铜基体做负极,正极为多孔催化层,故选b;
② 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈 ,
负极上生成铜离子、正极上生成氢氧根离子,所以氯离子、铜离子、氢氧根离子反应生成
Cu (OH) Cl,反应的方程式为: ;
2 3
③理论上耗氧体积为 (标准状况下),物质的量为0.01mol;由图可知,负极极反应为:
Cu-2e-=Cu2+,正极极反应式为:O+4e-+2H O=4OH-,根据电子转移守恒规律可知,消耗
2 2
0.01mol氧气,生成铜离子0.02mol,生成Cu (OH) Cl为0.01mol,质量为0.01mol×214.5g/
2 3
mol=2.145g。
17. ⑤⑦ ②③⑧ O+4e-+4H+=2H O H+2OH--2e-=2H O
2 2 2 2
C 8
【详解】(1)①H 是单质,即不是电解质也不是非电解质;②CH 是化合物,但其水溶液或
2 4
熔融状态下不导电,属于非电解质;③CHCHOH是化合物,但其水溶液只存在乙醇分子,
3 2
不导电,属于非电解质;④O 是单质,即不是电解质也不是非电解质;⑤HSO 在水溶液
2 2 4
答案第6页,共2页中能电离出硫酸根离子和氢离子,能导电,是化合物,是强电解质;⑥KOH在水溶液中或
熔融状态下均能导电的化合物,属于电解质;⑦HO能电离出极少量H+和OH-的化合物,
2
属于弱电解质;⑧CO 在水溶液中与水反应生成碳酸,碳酸电离出自由移动的氢离子和碳
2
酸根离子导电,CO 自身不能电离,CO 是非电解质;⑨KCO 在熔融状态下或水溶液中均
2 2 2 3
能导电,KCO 是化合物,所以是电解质;⑩Al是单质,故既不是电解质,也不是非电解
2 3
质;
综上,属于电解质的是⑤⑦;属于非电解质的是②③⑧;
(2)①以稀硫酸为电解质溶液时,氢氧燃料电池通入氧气的为正极,发生还原反应,酸性溶
液中正极反应为:O+4e-+4H+=2H O;
2 2
②以KOH溶液为电解质溶液时,氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧
化反应,碱性溶液中负极反应为H+2OH--2e-=2H O;
2 2
③
A.太阳能催化分解水制氢气将太阳能直接转化为化学能,节省能源,选项A正确;
B.氢氧燃料电池产物无污染,能有效保护环境,选项B正确;
C.分别以稀硫酸、KOH溶液为电解质溶液的两种氢氧燃料电池的负极电极反应式分别为
H+-2e-=2H+、H+2OH--2e-=2H O,选项C错误;
2 2 2
D.分别以稀硫酸、KOH溶液为电解质溶液的两种氢氧燃料电池的总反应式相同,均为
O+2 H =2H O,选项D正确;
2 2 2
答案选C;
(3)Al—空气燃料电池反应原理:负极的金属Al在氯化钠溶液中与空气中的O 发生反应生
2
成Al(OH) 。若负极有9gAl参加反应,转移电子为 ,则正极消耗O
3 2
的质量为 =8g。
18.(1)B
(2) BD > Zn—2e—=Zn2+ 1 mol/L
(3)6
【分析】构成原电池的条件是:①有两个活泼性不同的电极;②将电极插入电解质溶液中;③两电极间构成闭合回路;④能自发的进行氧化还原反应。
【详解】(1)构成原电池条件之一是能发生氧化还原反应,由方程式可知,盐酸与氢氧化
钠溶液的中和反应是没有元素化合价变化的非氧化还原反应,不能设计成原电池,锌与稀
硫酸的反应是有元素化合价变化的氧化还原反应,能设计成原电池,故答案为:B;
(2)①A.由图可知,甲装置为将化学能转化成电能的原电池装置,乙装置没有形成闭合
回路,不属于原电池装置,故错误;
B.由图可知,乙装置没有形成闭合回路,不属于原电池装置,铜与稀硫酸不发生反应,
所以铜片上没有明显变化,故正确;
C.由图可知,甲装置为将化学能转化成电能的原电池装置,金属性比铜活泼的锌为负极,
铜为正极,氢离子在正极得到电子发生还原反应生成氢气,铜片质量不变,故错误;
D.由图可知,两烧杯中发生的反应都为Zn+HSO =ZnSO +H↑,反应中消耗稀硫酸,溶
2 4 4 2
液的氢离子浓度减小,溶液pH增大,故正确;
故选BD;
②由图可知,甲装置为将化学能转化成电能的原电池装置,原电池反应加快反应速率,则
甲烧杯中产生气泡的速度快,故答案为:>;
③由图可知,甲装置为将化学能转化成电能的原电池装置,金属性比铜活泼的锌为负极,
锌失去电子发生氧化反应生成锌离子,电极反应式为Zn—2e—=Zn2+,故答案为:Zn—2e—
=Zn2+;
④由图可知,乙中发生的反应为Zn+HSO =ZnSO +H↑,由题意可知,原稀硫酸的物质
2 4 4 2
的量为 +0.1 mol/L×1L× =0.1 mol,则溶液的浓度为 =1 mol/L,故答案
为:1 mol/L;
(3)由题意可知,通入甲醇的石墨电极为燃料电池的负极,碱性条件下甲醇在负极失去电
子发生氧化反应生成碳酸根离子和水,电极反应式为CHOH—6e—+8OH—=CO +6H O,则
3 2
电池工作消耗1 mol甲醇时,电路中通过电子的物质的量为6mol,故答案为:6。
19. b 负 负 流出 负 还原
Zn Ag O 32.5 不变
2
【详解】(1)氢氧燃料电池中,电子从负极向正极移动, X是负极;Y是正极,氧气得电子,
氧气应通入正极。
(2)根据电极反应可知,A极发生氧化反应,应该是电池的负极,电子从该极流出。
答案第8页,共2页(3)①根据电极反应可知Zn失电子被氧化而溶解,Ag O得电子被还原发生还原反应。
2
②发生原电池反应时,电子由负极经外电路到正极,即电子从Zn极经外电路到Ag O极,
2
当通过电路1 mol时,负极消耗Zn的质量是32.5 g。
③根据电极反应式,电池中KOH只起到增强导电的作用,不参与反应,故电池使用过程中
KOH的量不变。
20. 负 Fe (OH) +2 e-=Fe+2OH- 氧化 K
2 1
K 外加电源阴极保护法(或阴极电保护法) 1.12L
2
【分析】(1)①此蓄电池在充电时,电池负极应与外加电源的负极连接作阴极,得电子发
生还原反应;
②根据电池总反应NiO+Fe+2HO Fe(OH) +Ni(OH) 中,充放电过程中Ni的化合
2 2 2 2
价升降变化,判断电极发生的反应类型。
(2)①只闭合K 为电解池,铁做阳极,铁失电子生成亚铁离子,由于电源不断提供电子,
1
铁电极腐蚀较快;只闭合K 为电解池,铁做阴极,被保护,不被腐蚀;只闭合K 为原电
2 3
池,铁做负极,铁失去电子生成亚铁离子发生吸氧腐蚀,则铁的腐蚀的速度最快的是只闭
合K;只闭合K 为电解池,铁做阴极,被保护,不被腐蚀,该防护法称为外加电源的阴极
1 2
保护法;
②只闭合K 为原电池,铁做负极,铁失去电子生成亚铁离子发生吸氧腐蚀,电极反应为:
3
Fe-2e-= Fe2+,当铁棒质量减少5.6g时,算出反应掉铁的物质的量,即铁棒减少0.1mol,共
转移0.2mol电子,石墨电极上,氧气得电子与水反应生成氢氧根离子,电极反应为:
2HO+O+4e-=4OH-,根据得失电子守恒,转移0.2mol电子消耗氧气的物质的量为
2 2
=0.05mol,则标准状况下,石墨电极消耗的氧气的体积为0.05mol×22.4L/mol=1.12L。
【详解】(1)①此蓄电池在充电时,电池负极应与外加电源的负极连接作阴极,得电子发生
还原反应,反应式为:Fe(OH) +2e-═Fe+2OH-,
2
故答案为负;Fe(OH) +2e-═Fe+2OH-;
2
②根据电池总反应NiO+Fe+2HO Fe(OH) +Ni(OH) ,放电时NiO 转化为
2 2 2 2 2
Ni(OH) ,Ni的化合价由+4价降低为+2价,得电子发生还原反应,该电极为正极,在充电
2
时该电极发生的反应为放电时的逆过程,即发生氧化反应,
答案为:氧化;(2)①只闭合K 为电解池,铁做阳极,铁失电子生成亚铁离子,由于电源不断提供电子,铁
1
电极腐蚀较快;只闭合K 为电解池,铁做阴极,被保护,不被腐蚀;只闭合K 为原电池,
2 3
铁做负极,铁失去电子生成亚铁离子发生吸氧腐蚀,则铁的腐蚀的速度最快的是只闭合
K;只闭合K 为电解池,铁做阴极,被保护,不被腐蚀,该防护法称为外加电源的阴极保
1 2
护法,
答案为:K;K;外加电源阴极保护法(或阴极电保护法);
1 2
②只闭合K 为原电池,铁做负极,铁失去电子生成亚铁离子发生吸氧腐蚀,电极反应为:
3
Fe-2e-= Fe2+,当铁棒质量减少5.6g时,即铁棒减少 =0.1mol,共转移0.2mol电子,
石墨电极上,氧气得电子与水反应生成氢氧根离子,电极反应为:2HO+O+4e-=4OH-,根
2 2
据得失电子守恒,转移0.2mol电子消耗氧气的物质的量为 =0.05mol,则标准状况下,
石墨电极消耗的氧气的体积为0.05mol×22.4L/mol=1.12L,
答案为:1.12L。
21.(1) 正 Zn-2e=Zn2+ 有气泡产生 反应前后溶液颜色与铜电极表
面没有明显变化
(2) 电子从负极(Zn)流出经外电路流向正极(Cu) H+向正极(Cu)移动、SO 向负极(Zn)
移动
(3) 高于 慢
(4)12.9g
(5)BCD
【分析】装置A中金属Zn与稀硫酸反应为 ;装置B为原电池,
Cu作正极,发生还原反应,有气泡产生,Zn作为负极,发生氧化反应;据此分析解题。
【详解】(1)装置B为原电池,Cu作正极,发生还原反应, ,有气泡产生;
Zn作为负极,发生氧化反应, ;反应前后溶液颜色与铜电极表面没有明显变
答案第10页,共2页化,说明Cu没有参与反应;故答案为正; ;有气泡产生;反应前后溶液颜色
与铜电极表面没有明显变化;
(2)据分析可知,Cu作正极,发生还原反应,得到电子;Zn作为负极,发生氧化反应,
失去电子;所以装置B中电池工作时“电子导体”中电子的流动方向可描述为电子从负极
(Zn)流出经外电路流向正极(Cu);“离子导体”中主要离子的移动方向可描述为H+向正极
(Cu)移动、SO 向负极(Zn)移动;故答案为电子从负极(Zn)流出经外电路流向正极(Cu);
H+向正极(Cu)移动、SO 向负极(Zn)移动;
(3)实验过程中装置A内溶液的温度升高,从能量转化的角度来看,装置A中反应物的
总能量高于生成物的总能量;装置B的电流计指针发生偏转,原电池可以加快反应速率,
所以A中反应速率比B中慢;故答案为高于;慢;
(4)装置B中稀HSO 用足量CuSO 溶液代替,Cu作正极,发生还原反应为 ;
2 4 4
Zn作为负极,发生氧化反应, ;当导线中有0.2mol电子转移时,Zn电极质量
减少 ;Cu电极质量增加 ;Zn电极和Cu电极的
质量差为起始时Zn电极和Cu电极的质量相等,当导线中有0.2mol电子转移时,Zn电极
和Cu电极的质量差为12.9g;故答案为12.9g;
(5)A.构成原电池内界条件是自发的发生氧化还原反应,所以理论上说,任何能自发进
行的氧化还原反应都可设计成原电池,故A正确;
B.装置B中Cu作正极,可用碳棒代替,故B错误;
C.原电池的负极发生氧化反应,故C错误;
D.原电池装置中化学能部分转化为电能,故D错误;
故答案选BCD。
22.(1) 放热 U形管左端液柱降低,右端液柱升高
(2) 导管内形成一段液柱 产生气泡,冷却至室温,烧杯里的导管内形成一段液
柱
(3) Ⅲ 锌和稀硫酸反应产生氢气,通过导气管进入烧杯中,产生气泡,无法判断反应
是吸热反应还是放热反应(4) Ⅰ或Ⅱ 棉花燃烧
【分析】本题利用气体的热胀冷缩,来判断热量变化。
【详解】(1)酸碱中和反应属于放热反应,氢氧化钡与硫酸反应属于中和反应,反应放热,
所以锥形瓶中气体受热膨胀,导致U形管左端液柱降低,右端液柱升高;
(2)①若M为 , 溶于水吸热,外管内气体温度降低收缩,则实验过程中
烧杯中可观察到的现象烧杯里的导管内形成一段液柱;
②若M为NaOH,NaOH溶于水放热,外管内气体温度升高膨胀,则实验过程中烧杯中可
观察到的现象为产生气泡,冷却至室温,烧杯里的导管内形成一段液柱;
(3)装置Ⅲ不能用来证明“锌和稀硫酸反应是吸热反应还是放热反应”,因为锌和稀硫酸
反应产生氢气,通过导气管进入烧杯中,产生气泡,无法判断反应是吸热反应还是放热反
应;
(4)方法①:选择上述装置Ⅰ或Ⅱ进行实验,Ⅰ装置右边U形管中左端液柱降低,右端
液柱升高(或烧杯中导管中有气泡放出),证明该反应为放热反应;故答案为Ⅰ或Ⅱ;
方法②:取适量过氧化钠粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,
片刻后,若观察到棉花燃烧,则说明该反应放出大量热,使棉花燃烧,证明该反应是放热
反应。
答案第12页,共2页