文档内容
班级 姓名 学号 分数
第四章 化学反应与电能(A卷·知识通关练)
核心知识1 原电池的工作原理
1.在锌、铜、硫酸原电池中,下列说法正确的是
A.锌是负极,发生还原反应
B.负极反应是:Zn-2e-===Zn2+
C.铜是正极,发生氧化反应
D.铜极反应是:Cu2++2e-===Cu
【答案】B
【详解】
A.在锌、铜、硫酸原电池中,锌的金属性比较活泼做负极,发生氧化反应,故A错误;
B.在锌、铜、硫酸原电池中,锌的金属性比铜活泼做负极,发生氧化反应,则负极反应式为:Zn-2e-
=Zn2+,故B正确;
C.在锌、铜、硫酸原电池中,锌的金属性比铜活泼做负极,铜做正极,发生还原反应,故C错误;
D.在锌、铜、硫酸原电池中,锌的金属性比铜活泼做负极,铜做正极,氢离子在此极发生还原反应,反应
式是:2H++2e-=H ,故D错误;
2
故答案:B。
2.如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,下列说法
错误的是
A.B极为原电池的正极 B.A、B、C可能分别为Zn、Cu、稀硫酸
C.C中阳离子向A极移动 D.A极发生氧化反应
【答案】C
【分析】
电流表指针发生偏转,说明形成原电池反应,化学能转化为电能;同时A极质量减少,则A为原电池负极,
B极上有气泡产生,B为原电池正极,C为电解质溶液。
1 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司【详解】
A.B极上有气泡产生,应为氢离子被还原为氢气,为原电池的正极,A正确;
B.锌比铜活泼,且可以与稀硫酸反应生成氢气,稀硫酸作电解质溶液形成原电池时,Zn为负极、Cu为正
极,符合题意,B正确;
C.原电池中阳离子流向正极,即阳离子流向B极,C错误;
D.A电极是原电池的负极,失去电子,发生氧化反应,D正确;
综上所述答案为C。
3.在盛有稀HSO 的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是
2 4
2
A.SO4 向铜片移动
B.电子通过导线由铜片流向锌片
C.正极有O 逸出
2
D.铜片上有H 逸出
2
【答案】D
【详解】
Zn、Cu、硫酸构成的原电池金属锌做负极,金属铜做正极。
2
A.原电池中阳离子移向正极,阴离子移向负极,溶液中的SO4 移向负极,即向锌片移动,故A错误;
B.电子通过导线由锌片流向铜片,故B错误;
C.正极上放电的是氢离子,正极有氢气逸出,故C错误;
D.金属铜做正极,正极上放电的是氢离子,有氢气逸出,故D正确。
故选D。
4.下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片作负极,铜片作正极,在CuSO 溶液中,铜片质量增加
4
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
【答案】C
【详解】
A. 把铜片和铁片紧靠在一起浸入稀硫酸中,形成铜、铁、稀硫酸原电池,正极是金属铜,该电极上溶液
中的氢离子得到电子产生氢气,A项正确;
2 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司B.用锌片作负极,铜片作正极,在CuSO 溶液中,铜片上有金属铜单质析出,质量增加,B项正确;
4
C. 把铜片插入三氯化铁溶液中,铜和氯化铁反应生成氯化铜和氯化亚铁,铜的金属活动性不及铁,铜不
能置换出铁,C项错误;
D. 把锌片放入盛盐酸的试管中,加入几滴氯化铜溶液,锌置换出铜,所以形成了铜、锌、稀盐酸原电池,
原电池反应可以加速反应速率,D项正确;
答案选C。
5.如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下。则卡片上
的描述合理的是
2022.6.18,实验后的记录:
①Cu为正极,Zn为负极
②Cu极上有气泡产生,发生还原反应
SO2
Cu
③ 4 向 极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
CuZn
⑤电子的流向是:
⑥正极反应式:Cu2e=Cu2,发生氧化反应
A.①②④ B.②④ C.②③④ D.③④⑤
【答案】A
【分析】
Zn和Cu形成的原电池中,Zn比Cu活泼,Zn作负极,发生 Zn-2e-=Zn2+; Cu电极为正极,发生2H++2e-
=H ↑,总电池反应Zn+2H+=Zn2++H ↑,电子由负极流向正极,阴离子向负极移动。
2 2
【详解】
①根据分析可知,Zn为负极,Cu为正极,故①正确;
②根据分析,Cu电极上发生的电极反应为2H++2e-=H ↑,所以Cu极上有气泡产生,发生还原反应,故②
2
正确;
3 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司SO2
③原电池中,阴离子向负极移动,Zn为负极,则 4 向Zn极移动,故③错误;
④由2H++2e-=H ↑可知,有0.5mol电子流向导线,产生氢气0.25mol,故④正确;
2
⑤原电池外电路,电子由负极经导线流向正极,电流与电子运动方向相反,电流由正极流向负极,Zn为负
极,Cu为正极,则电流的流向是:Cu→Zn,故⑤错误;
⑥根据分析,负极反应式:Zn-2e-= Zn2+,发生氧化反应,正极反应式:2H++2e-=H ↑,发生还原反应,故⑥
2
错误;
综上所述①②④正确,故选A。
2AgaqCusCu2aq2Ags
6.依据氧化还原反应: 设计的原电池如图所示。盐桥是为了让
两个池形成闭合回路。
(1)电极X的材料是______;电解质溶液Y是______。
(2)银电极为电池的______极,发生的电极反应为____________,X电极上发生的电极反应为
______________________。
(3)外电路中的电子是从______电极流向______电极。
( )
(4)X电极看到的现象是_________________,发生___________ 填氧化或还原 反应。
(5)上述原电池每消耗64gCu同时转移电子数为______________________。
【答案】铜 AgNO 溶液 正 Ag++e-==Ag Cu-2e-==Cu2+ Cu Ag X电极逐渐溶解
3
氧化 2N
A
【分析】
在带有盐桥的原电池中,金属电极材料与电解质中的阳离子往往相同。
【详解】
(1)电极X所在的半电池中,电解质为CuSO ,所以电极X的材料是铜;电解质溶液Y所在的半电池中,
4
电极材料为Ag,则电解质溶液Y是AgNO 溶液。答案为:铜;AgNO 溶液;
3 3
4 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司(2)右池中,Ag+得电子,则银电极为电池的正极,发生的电极反应为 Ag++e-==Ag,X电极为负极,发生
的电极反应为Cu-2e-==Cu2+。答案为:正;Ag++e-==Ag;Cu-2e-==Cu2+;
(3)外电路中的电子由负极流向正极,所以是从Cu电极流向Ag电极。答案为:Cu;Ag;
(4)X电极看到Cu失电子转化为Cu2+进入溶液,所以产生的现象是X电极逐渐溶解,发生氧化反应。答
案为:X电极逐渐溶解;氧化;
64g
2N
(5)上述原电池每消耗64gCu同时转移电子数为64g/mol A= 2N 。答案为:2N 。
A A
【点睛】
有盐桥的原电池反应与一般的原电池反应的不同点,主要是使用两种不同的电解质,且两电极在两个容器
内出现。
核心知识2 化学电源
7.关于化学能、电能与原电池下列判断不正确的是
A.利用原电池装置,可以将化学能转化为电能
B.燃料电池是一种高效、环境友好的发电装置,能量转化率可高达100%
C.人们日常使用的电能主要来自火力发电
D.最早使用的锌锰干电池的寿命和性能都不如改进后的碱性锌锰电池
【答案】B
【详解】
A.原电池装置,是将化学能转化为电能的装置,故A正确;
B.燃料电池是一种高效、环境友好的发电装置,但是在使用过程中还伴随着放出热量,能量转化率不可
高达100%,故B错误;
C.人们日常使用的电能主要来自火力发电,故C正确;
D.最早使用的锌锰干电池电解质溶液显酸性容易腐蚀锌皮,寿命和性能都不如改进后的碱性锌锰电池,
故D正确;
故答案为B。
8.关于化学电源:①银锌纽扣电池;②氢氧燃料电池;③锌锰干电池;④铅蓄电池,有关说法正确的是
A.②和③都属于绿色电池 B.①和③都属于一次电池
C.①和④都属于二次电池 D.②可将化学能全部转化为电能
【答案】B
【详解】
5 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司A.锌锰干电池含有重金属元素,不是绿色电池,A错误;
B.①银锌纽扣电池和③锌锰干电池完全放电后均不能再使用,属于一次电池,B正确;
C.①银锌纽扣电池完全放电后不能再使用,属于一次电池,C错误;
D.燃料电池放电过程中会有一部分化学能转化为热能,D错误;
综上所述答案为B。
9.下列有关装置的说法正确的是
A.装置Ⅰ中Mg为原电池的负极
B.装置Ⅱ为一次电池
C.装置Ⅲ可构成原电池
D.装置Ⅳ工作时,电子由锌通过导线流向碳棒
【答案】D
【详解】
A.镁与氢氧化钠溶液不反应,铝能够与氢氧化钠溶液反应,装置Ⅰ中铝为负极,镁为正极,故A错误;
B.铅蓄电池是二次电池,可以放电充电,故B错误;
C.装置Ⅲ中的两个材料相同、都是Zn,不能构成原电池,故C错误;
D.装置Ⅳ为干电池,锌为负极,碳棒为正极,工作时,原电池中电子由负极沿导线流向正极,因此电子
由锌通过导线流向碳棒,故D正确;
故选D。
10.碱性锌锰干电池是一种使用广泛的便携式电源。电池总反应为
Zn2MnO 2H OZnOH 2MnOOH
2 2 2 ,下列说法错误的是
A.MnOOH中Mn的合价为+3
MnO H O
B.参与正极反应的物质为 2和 2
Zn2e Zn2
C.负极的电极反应为
6 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司D.电池工作时,电子由负极通过外电路流向正极
【答案】C
【详解】
A.MnOOH中0为-2价,H为+1价,故Mn的化合价为+3,A项正确;
MnO eH OMnOOHOH MnO H O
B.正极的电极反应为 2 2 ,故参与正极反应的物质为 2和 2 ,B项正
确;
Zn2e2OH ZnOH
C.负极的电极反应为 2,C项错误;
D.原电池工作时,电子由负极通过外电路流向正极,D项正确。
故选C。
11.铅蓄电池放电时发生的化学反应:PbO +Pb+2H SO =2PbSO+2H O,其电极材料分别是PbO 和Pb,电
2 2 4 4 2 2
解质为HSO 溶液,下列说法不正确的是
2 4
A.电池工作过程中,HSO 溶液浓度降低
2 4
B.电池工作过程中,电解质溶液中H+向正极移动
C.每当有2mol电子通过电路时,负极材料增重96g
D.正极发生反应为:PbO +4H++2e-=Pb2++2H O
2 2
【答案】D
【详解】
A.铅蓄电池工作时,硫酸参加反应生成硫酸铅的同时还生成水,导致硫酸浓度降低,故A正确;
B.原电池放电时,阴离子向负极移动,阳离子向正极移动,即电解质溶液中H+向正极移动,故B正确;
SO2
C.在铅蓄电池中,负极上金属Pb失电子发生氧化反应:Pb+ 4 -2e-=PbSO,每当有2mol电子通过电路
4
时,负极材料增重96g,故C正确;
SO2
D.在铅蓄电池的正极上,PbO 得电子发生还原反应:PbO +4H++ 4 +2e-=PbSO+2H O,故D错误;
2 2 4 2
答案选D。
12.燃料电池是目前电池研究的热点之一、现有某课外小组自制的氢氧燃料电池,如下图所示,a、b均
为惰性电极。下列叙述不正确的是
7 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司A.a极是负极,该电极上发生氧化反应
2H O ═2H O
B.电池总反应为 2 2 2
O 4OH4e═2H O
C. b 极电极反应式为 2 2
D.氢氧燃料电池是一种具有广阔应用前景的绿色电源
【答案】C
【分析】
2H O ═2H O
该装置为氢氧燃料电池,总反应为 2 2 2 ,通氢气的一极为负极,发生氧化反应,通氧气的一
O 4e 2H O═4OH
极为正极,发生还原反应,考虑到碱性环境,正极反应式为 2 2 ,氢氧燃料电池能量
转化率高,对环境友好,是一种具有广阔应用前景的绿色电源,据此解题。
【详解】
A.通氢气的一极为负极,发生氧化反应,故A正确;
2H O ═2H O
B.该装置为氢氧燃料电池,总反应为 2 2 2 ,故B正确;
O O 4e 2H O═4OH
C.b电极反应式中 2得到电子写成失去电子,应为: 2 2 ,故C错误;
D.氢氧燃料电池能量转化率高,对环境友好,是一种具有广阔应用前景的绿色电源,故D正确;
故选C。
13.已知:HO 是一种强氧化剂。MgHO 电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶
2 2 2 2
液,示意图如图所示。该电池工作时,下列说法不正确的是
A.Mg电极是该电池的负极
8 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司B.HO 在石墨电极上发生氧化反应
2 2
C.该装置能将化学能转化为电能
D.溶液中Cl-向Mg电极移动
【答案】B
【详解】
A.金属镁只能失电子,做原电池的负极,A正确;
B.HO 是一种强氧化剂,在原电池的正极上发生还原反应,B错误;
2 2
C.该装置为化学能变为电能的装置,为原电池,C正确;
D.溶液中Cl-向负极(镁电极)移动,D正确;
正确选项B。
【点睛】
原电池中负极发生氧化反应,正极发生还原反应,阳离子向正极移动,阴离子向负极移动,电子由负极流
向正极。
ZnPbO K SO H SO
14.我国科学家最近发明了一种 2电池,电解质为 2 4、 2 4和KOH,由a和b两种离子交
换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如下:
回答下列问题:
K SO H SO
(1)电池中,Zn为_______极,B区域的电解质为_______(填“ 2 4”“ 2 4”或“KOH”)。
(2)电池反应的离子方程式为_______。
(3)阳离子交换膜为图中的_______(填“a”或“b”)膜。
K SO PbO SO2Zn2H OPbSO ZnOH2
【答案】负 2 4 2 4 2 4 4 a
【详解】
(1)根据图示可知,Zn失去电子变成Zn2 ,与溶液中的OH结合形成
ZnOH2
4
,所以Zn电极为负极;A
9 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司K SO H SO K SO
区域的电解质为KOH,B区域的电解质为 2 4,C区域的电解质为 2 4,故答案为:负; 2 4;
Zn2e4OH ZnOH2
(2)负极的电极反应式为 4 ,正极的电极反应式为
PbO 2e4H SO2 PbSO 2H O
2 4 4 2 ,总反应的离子方程式为
PbO SO2Zn2H OPbSO ZnOH2 PbO SO2Zn2H OPbSO ZnOH2
2 4 2 4 4 ,故答案为: 2 4 2 4 4 ;
(3)A区域中,OH发生反应变为
ZnOH2
4
,为了维持溶液呈电中性,多余的K 通过离子交换膜进入B区
域,因此a膜为阳离子交换膜,故答案为:a。
15.(1)把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池。若a、b相连,
a为正极;c、d相连,c为负极;a、c相连,c上产生气泡;b、d相连,b质量减小,则四种金属的活动性
由强到弱顺序为:___________。
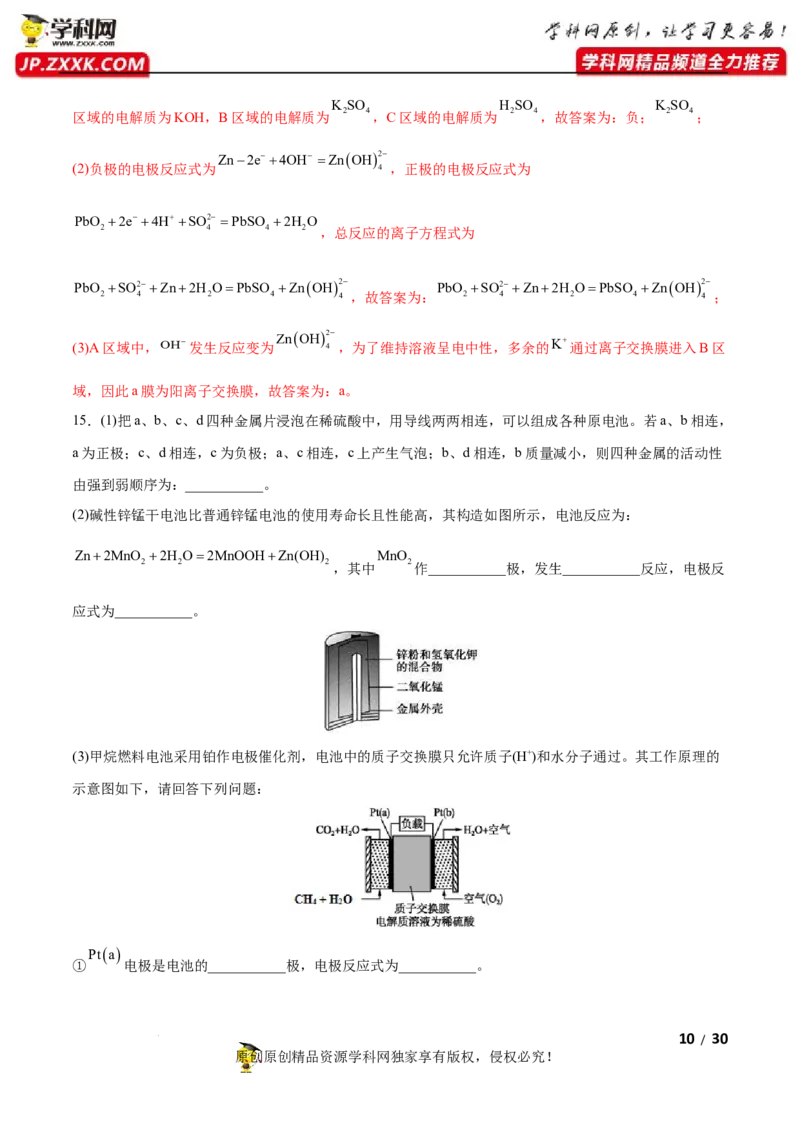
(2)碱性锌锰干电池比普通锌锰电池的使用寿命长且性能高,其构造如图所示,电池反应为:
Zn2MnO 2H O2MnOOHZn(OH) MnO
2 2 2,其中 2作___________极,发生___________反应,电极反
应式为___________。
(3)甲烷燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子(H+)和水分子通过。其工作原理的
示意图如下,请回答下列问题:
Pta
① 电极是电池的___________极,电极反应式为___________。
10 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司H
②电解质溶液中的 向___________(填“a”或“b”)极移动,电子流入的电极是___________(填“a”或“b”)极。
11.2LCH
③该电池工作时消耗 4(标准状况下),则电路中通过___________mol电子。
b>a>c>d MnO H Oe MnOOHOH
【答案】 正极 还原 2 2 负极
CH 2H O8e CO 8H
4 2 2 b b 4
【详解】
(1)把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池。一般负极是活泼
金属,失去电子,质量减小,正极为不活泼金属,溶液中的H+得到电子生成氢气。若a、b相连,a为正极,
则b比a活泼;c、d相连,c为负极,则c比d活泼;a、c相连,c上产生气泡,则c为正极,a比c活泼;
b、d相连,b质量减小,则b为负极,b比d活泼,则四种金属的活动性由强到弱顺序为b>a>c>d。
Zn2MnO 2H O2MnOOHZn(OH)
(2)碱性锌锰干电池的电池反应为: 2 2 2,MnO 中Mn的化合价从+4
2
MnO
价降低到MnOOH中的+3价,化合价降低,被还原, 2作正极,在碱性溶液中的电极反应式为:
MnO H Oe MnOOHOH
2 2 。
(3)甲烷燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子(H+)和水分子通过。该电池是将甲
烷和氧气的燃烧反应的化学能转化为电能。通入甲烷的电极为负极,通入空气的电极为正极。
Pta
①由以上分析可知, 电极是电池的负极,甲烷失去电子生成二氧化碳,电极反应式为:
CH 2H O8e CO 8H
4 2 2 。
H
②在原电池中,阳离子移向正极,所以电解质溶液中的 向b极移动,电子从负极出发,流入正极,则电
子流入的电极是b极。
11.2LCH
③该电池工作时消耗标准状况下 4即0.5molCH,甲烷中碳元素的化合价从-4价升高到二氧化碳中
4
的+4价,1molCH 失去8mol电子,则0.5mol甲烷失去4mol电子,即电路中通过4mol电子。
4
核心知识3 电解原理
11 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司16.用电解水的方法分析水的组成时,需要加入一些电解质以增强水的导电性,宜加入的物质是( )
A.蔗糖 B.AgNO C.KOH D.CuSO
3 4
【答案】C
【分析】
用电解水的方法分析水的组成时,需要加入一些电解质以增强水的导电性,加入的物质是可溶性强电解质,
且该电解质电离出的阴阳离子不能在电极上放电,据此分析解答。
【详解】
A.蔗糖是非电解质,加入水溶液中以分子存在,所以水中离子浓度不变,则导电性不变,故A错误;
B.加入可溶性强电解质硝酸银,电解时阴极上银离子放电而不是氢离子放电,所以不符合条件,故B错
误;
C.加入可溶性强电解质KOH,KOH电离生成钾离子和氢氧根离子而不影响氢离子、氢氧根离子放电,所
以符合条件,故C正确;
D.加入强电解质硫酸铜后,电解时阴极上铜离子放电而不是氢离子放电,所以不符合条件,故D错误;
故答案选C。
【点睛】
明确实验目的及离子放电顺序是解本题关键,注意题干中隐含信息,注意:电解质溶液导电性与离子浓度
有关。
17.要实现反应:Cu+2HCl=CuCl +H↑,设计了下列四个实验,你认为可行的是
2 2
A. B. C. D.
【答案】C
【分析】
实现Cu+2HCl=CuCl +H↑反应,因Cu与稀盐酸常温下不反应,则应设计为电解池,Cu为阳极,电解质
2 2
为HCl。
【详解】
A.应设计为电解池,该装置为原电池,铁做负极,铜做正极,氢离子在正极得电子生成氢气,故A错误;
B.应设计为电解池,该装置中虽然铜的活泼性大于银,但铜与盐酸不能自发进行氧化还原反应,故B错
误;
12 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司C.电解池中Cu为阳极,电解质为HCl,符合题意,故C正确;
D.电解池中C为阳极,不符合题意,故D错误;
故答案为C。
18.如图中X、Y分别是直流电源的两极,通电后发现a电极质量增加,b电极处有气体放出。符合这一情
况的是表中的
选项 a b X 溶液
A 锌 石墨 负极 CuSO
4
B 石墨 石墨 负极 NaOH
C 银 铁 正极 AgNO
3
D 铜 石墨 负极 CuCl
2
【答案】A
【详解】
通电后发现a极板质量增加,所以金属阳离子在a极上得电子,a极是阴极,溶液中金属元素在金属活动性
顺序表中处于氢元素后边;b极是阳极,b极板处有无色无味气体放出,即溶液中氢氧根离子放电生成氧气,
电极材料必须是不活泼的非金属,电解质溶液中的阴离子必须是氢氧根离子或含氧酸根离子。
A.该选项符合条件,电解硫酸铜溶液,阳极生成气体氧气,阴极析出铜,A正确;
B.电解质溶液中金属阳离子钠离子在氢元素前边不放电,阴极和阳极生成气体,B错误;
C.铁是活泼金属,作阳极失电子,所以在b极上得不到气体,C错误;
D.电解氯化铜溶液,阳极生成有色气体氯气,阴极析出铜,不符合,D错误;
故答案为:A。
19.以石墨作电极,电解AgNO 溶液,可在两极分别得到Ag和O,下列说法正确的是
3 2
-
A.氧化性:Ag+ > H+,还原性:NO3> OH-
B.Ag附着在阳极:Ag+ + e-=Ag
C.电解过程中溶液的酸性将逐渐减弱
13 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司D.电路中每转移1mol电子,可生成1molAg和0.25molO
2
【答案】D
【详解】
-
A. 根据放电顺序可知,氧化性:Ag+ > H+,还原性:OH-> NO3 ,A错误;
B. Ag附着在阴极,阴极上发生还原反应:Ag+ + e-=Ag,B错误;
C. 电解过程中阳极上氢氧根离子不断发生氧化反应生成氧气,阳极附近水的电离平衡被破坏,氢离子浓度
增大,溶液的酸性将逐渐增强,C错误;
D. 根据电子转移守恒4Ag~O~4e-可知,电路中每转移1mol电子,可生成1molAg和0.25molO,D正确;
2 2
答案为D。
20.用惰性电极电解下列溶液,一段时间后,再加入一定量的另一种物质(括号内),溶液能与原来溶液
完全一样的是
A.CuCl [CuSO ] B.NaOH [NaOH]
2 4
C.NaCl [HCl] D.CuSO [Cu(OH) ]
4 2
【答案】C
【分析】
电解池中,要想使电解质溶液复原,遵循的原则是:电解后从溶液中减少的物质是什么,就利用元素守恒
来加什么物质。
【详解】
A.电解氯化铜时,阳极放出氯气,阴极生成金属铜,所以应加氯化铜让电解质溶液复原,A错误;
B.电解氢氧化钠时,阳极产生氧气,阴极产生氢气,所以应加水让电解质溶液复原,B错误;
C.电解氯化钠时,阳极产生氯气,阴极产生氢气,所以应加氯化氢让电解质溶液复原,C正确;
D.电解硫酸铜时,阳极产生氧气,阴极产生金属铜,所以应加氧化铜让电解质溶液复原,加入氢氧化铜相
当于多加入水,D错误;
故合理选项是C。
【点睛】
本题考查了电解池原理,掌握电解原理,弄清两个电极上产生的物质,是本题解答的关键,本着“出什么
加什么”的思想可使电解质复原。
21.用铁丝(电极a)、铜丝(电极b)和CuSO 溶液可以构成原电池或电解池,如图所示,则下列说法正确的
4
是( )
14 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司A.构成原电池时b极反应为Cu-2e-=Cu2+
B.构成电解池时a极质量一定减少
C.构成电解池时b极质量可能减少也可能增加
D.构成的原电池或电解池工作后均能产生大量气体
【答案】C
【详解】
A. 构成原电池时,较不活泼的金属铜作正极,正极上溶液中铜离子得电子生成铜单质而析出,电极反应
式为Cu2++2e-=Cu,A错误;
B. 构成电解池时,连接电源正极的电极为阳极,阳极上金属电极失电子发生氧化反应,如a连接电源负极,
则a电极质量增加,B错误;
C. 构成电解池时,连接电源正极的电极为阳极,阳极上金属电极失电子发生氧化反应,连接电源负极的电
极为阴极,阴极上铜离子得电子发生还原反应;如果b为阳极,电解池工作时,铜失电子生成铜离子进入
溶液,导致电极质量减少;如果b为阴极,溶液中铜离子得电子生成铜单质而析出附着在b电极上,导致
电极质量增加,C正确;
D. 构成原电池时,正极上铜离子得电子而析出;构成电解池时,阴极上溶液中铜离子得电子而析出,所
以无论是原电池还是电解池都没有气体生成,D错误;
故合理选项是C。
22. (1)如图装置闭合电键时,电流计A的指针将发生偏转。
则B池是___________;Pt是__________极
Cu极上电极反应:_______
15 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司C极上电极反应:_______
2-
(2)铅蓄电池是典型的可充电电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO +4H++2SO4
2
充电
放电 2PbSO
4
+2H
2
O
请回答下列问题(不考虑氢、氧的氧化还原):
①放电时,正极的电极反应式是__________。电解液中HSO 的浓度将变__________,当外电路通过1 mol
2 4
电子时,理论上负极板的质量增加_________。
②在完全放电耗尽PbO 和Pb时,若按如图连接,电解一段时间后,则在A电极上生成______
2
2-
【答案】电解池 阳 2H++2e-=H ↑ Cu2++2e-=Cu PbO +2e-+4H++SO4 =PbSO+2H O 减小
2 2 4 2
48g Pb
【详解】
(1)如图所示,装置A为原电池,Zn比Cu活泼,Zn电极为负极,Cu电极为正极,Zn(负极)电极反应为:
Zn-2e-=Zn2+,Cu(正极)电极反应:2H++2e-=H ↑,B为电解池,电解池中电源负极与电解池阴极相连,电源
2
正极与电解池阳极相连,则C为阴极,Pt为阳极,根据放电顺序,C(阴极)电极上Cu2+放电,得电子,生成
铜单质,电极反应为:Cu2++2e-=Cu;
充电
(2)①电池总反应式为:Pb+PbO
2
+4H++2SO 2
4
- 放 电 2PbSO
4
+2H
2
O,放电时:负极电极反应:
2- 2-
Pb-2e-+SO4 =PbSO ,正极电极反应:PbO +2e-+4H++SO4 =PbSO+2H O;根据电极反应可知,电解液中
4 2 4 2
HSO 的浓度将减少;当外电路通过1mol电子时,依据电子守恒计算理论上负极板的质量增加=硫酸铅的
2 4
质量-铅单质的质量=0.5mol×303g/mol-0.5mol×207g/mol=48g;
②在完全放电耗尽PbO 和Pb时,电极上析出的是PbSO ,若按题图连接则装置为电解池,B为阳极应是
2 4
16 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司失去电子发生氧化反应,A为阴极是得到电子发生还原反应,B电极上发生反应为:PbSO +2H O-2e-
4 2
2- 2-
=PbO+4H++SO4 ,A电极发生反应为:PbSO +2e-=Pb+SO4 ,所以A电极上生成Pb。
2 4
核心知识4 电解原理的应用
23.下列关于电解饱和食盐水过程的说法正确的是
A.电解饱和食盐水的工厂要首先将食盐进行除杂
B.与电源正极相连的电极区有NaOH生成
C.与电源负极相连的电极上有氯气生成
D.电解饱和食盐水的过程中Na+的浓度减小
【答案】A
【详解】
A.电解饱和食盐水的工厂采用的是离子交换膜法,若食盐中混有Mg2+、Ca2+等杂质,在电解过程中会生
成Mg(OH) 、Ca(OH) 等沉淀堵塞交换膜,所以电解前要首先将食盐进行除杂,故A正确;
2 2
B.与电源正极相连的电极为阳极,在阳极上是Cl-失去电子生成氯气,不生成NaOH,故B错误;
C.与电源负极相连的电极为阴极,在阴极是水电离产生的H+放电生成H,故C错误;
2
D.Na+没有参与反应,其物质的量不变,但电解过程中消耗了水,溶液体积减小,Na+的浓度增大,故D
错误;
故选A。
24.电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是
A.电解时以硫酸铜溶液作电解液,精铜作阳极
B.粗铜与电源负极相连,发生氧化反应
C.阳极上发生的反应有Fe-2e-=Fe2+
D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥
【答案】C
【详解】
A.电解精炼铜时以硫酸铜溶液为电解质溶液,粗铜作阳极,精铜作阴极,A错误;
B.粗铜作阳极,与电源的正极相连,B错误;
Fe2e Fe2
C.Fe比Cu活泼,电解时优先发生失电子的氧化反应: ,C正确;
17 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司Fe2 Zn2
D.Fe、Zn等比Cu活泼,电解时Fe、Zn等在阳极发生失电子的氧化反应,生成 、 ,等进入电解
质溶液中,Ag等活动性不如Cu的杂质会沉积在电解槽底部形成阳极泥,D错误;
答案选C。
25.如图是工业上电解饱和食盐水的装置示意图,下列说法中不正确的是
A.装置出口①处的物质是氯气
B.出口②处的物质是氢气,该离子交换膜不能让阴离子通过
通电
C.装置中发生反应的离子方程式为2Cl-+2H+ Cl↑+H ↑
2 2
D.该装置将电能转化为化学能
【答案】C
【详解】
A.与电源正极相连的为阳极,溶液中的氯离子在阳极失电子生成氯气,出口①处的物质是氯气,A正确;
B.溶液中水电离出的氢离子在阴极得到电子发生还原反应生成氢气,出口②处的物质是氢气,离子交换
膜是阳离子交换膜,允许阳离子通过,不能让阴离子通过,B正确;
C.电解饱和食盐水过程中生成氢氧化钠、氢气和氯气,反应的离子方程式为
通电
2Cl2H O Cl H 2OH
2 2 2 ,C错误;
D.该装置是电解池,将电能转化为化学能,D正确;
故选C。
26.欲在铁制品上镀一层一定厚度的铜,以下方案设计正确的是
A.铜作阳极,镀件作阴极,溶液中含有铜离子
B.铂作阴极,镀件作阳极,溶液中含有铜离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
18 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司D.铜作阴极,镀件作阳极,溶液中含有亚铁离子
【答案】A
【详解】
电镀原理是镀层金属作阳极发生氧化反应,镀件作阴极镀层金属阳离子在镀件发生还原反应,含有镀层金
属阳离子的电解质溶液作电镀液,综上分析A符合题意,故选A。
答案选A
通电
===
27.用电解法可以在铝制品表面生成致密保护膜而有效防止铝被腐蚀,其原理为:2Al+3H O
2
Al O+3H ↑,下列说法正确的是
2 3 2
A.电解时阳极材料可选用金属铜
B.电解形成保护膜过程中阳极附近溶液pH降低
SO2
C.若电解质选用稀硫酸,则 4 向阴极移动
D.形成保护膜的铝制餐具可长时间盛放碱性食品
【答案】B
【详解】
A. 由电解总反应知,Al失去电子,所以阳极应该是铝制品,A项错误;
B. 在阳极形成保护膜,反应为:2Al−6e−+3H O=Al O+6H+,产生H+,溶液酸性增强,pH降低,B项正确;
2 2 3
SO2
C. 4 带负电荷,应该向阳极移动,C项错误;
AlO
D. Al O 能与碱反应生成 2,所以铝制餐具不能长时间盛放碱性食品,D项错误;
2 3
答案选B。
28.氯碱工业中电解饱和食盐水的原理示意图如图所示:
(1)图中A极要连接电源的 ____(填“正”或“负”)极。
(2)精制饱和食盐水从图中_____位置补充,NaOH溶液从图中____位置流出。(填“a” “b” “c” “d” “e”或“f”)
19 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司(3)电解饱和食盐水的离子方程式是_____________________;
(4)电解时用盐酸控制阳极区溶液的pH在2~3,盐酸的作用是______________________。
某实验小组同学对电化学原理进行了一系列探究活动。
(5)如图为某实验小组依据的氧化还原反应:(用离子方程式表示)_________________设计的原电池装置,该
装置中,盐桥的作用是_______________________ 。
(6)反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过_______mol电子。
通电
【答案】负极 a d 2Cl 2H O 2OH H Cl 提高H+浓度,降低Cl 的溶解度
2 2 2 2
Cu2+ + Fe = Fe2+ + Cu 提供离子,平衡电荷,保持溶液的电中性 0.2
【分析】
工业上用电解饱和食盐水制取氯碱,在阳极区域加入饱和食盐水,氯离子在阳极上放电生成氯气,阴极上
氢离子放电生成氢气,同时电极附近有氢氧化钠生成,所以在阴极区域产生氢氧化钠,阳离子交换膜只能
阳离子通过,钠离子通过离子交换膜进入阴极区,则从d可导出氢氧化钠溶液;
【详解】
(1)由图知,钠离子从左侧区向右侧区移动,则左侧为阳极区,图中A极为阳极、要连接电源的正极。
(2)阳离子交换膜法电解饱和食盐水,氯离子在阳极放电、钠离子透过阳离子交换膜进入阴极区,阴极的反
2H O2e H 2OH
应式为: 2 2 ;故精制饱和食盐水从图中a位置补充,NaOH溶液从图中d位置
流出。
通电
(3)电解饱和食盐水的离子方程式是2Cl 2H O 2OH H Cl ;
2 2 2
(4)电解时用盐酸控制阳极区溶液的pH在2~3,与饱和食盐水相比,氢离子浓度较大,可抑制氯气溶解;
则盐酸的作用是提高H+浓度,降低Cl 的溶解度。
2
(5)如图所示为一个双液电池,该原电池装置的离子方程式为: Cu2+ + Fe = Fe2+ + Cu该装置中,盐桥的作
用是提供离子,平衡电荷,保持溶液的电中性,能产生稳定的电流。
20 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司FeCu2=Fe2 Cu
(6)反应前,电极质量相等,电池总反应为 ,每转移2mol电子,消耗1molFe,铁电
极减少56g,同时正极生成1molCu,石墨电极增加64g,则两电极质量相差120 g,若一段时间后两电极质
量相差12 g,则导线中通过0.2mol电子。
核心知识5 金属的腐蚀
29.下列过程通电后才能进行的是( )
①电离;②电解;③电镀;④电化学腐蚀
A.①②③ B.①②④ C.②③ D.全部
【答案】C
【解析】
①电离是电解质在水溶液中离解出自由移动离子的过程,不需要通电,故①错误;
②电解池是外加电源强迫下的氧化还原反应,必须加外加电源,故②正确;
③电镀池实质是一个电解池,必须加外加电源,故③正确;
④电化学腐蚀原理是原电池原理,原电池中不含电源,是自发进行的氧化还原反应,故④错误;
故②③,答案选C。
30.以下现象和电化学腐蚀无关的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.银制物品久置表面变暗
C.铁质器件附有铜制配件,在接触处易生铁锈
D.生铁比纯铁容易生锈
【答案】B
【详解】
A.黄铜(铜锌合金)制作的铜锣中,金属锌为负极,金属铜做正极,Cu被保护,不易腐蚀,和电化学腐蚀
有关,A项不选;
B.银制物品久置表面变暗,是金属银和空气中的成分发生反应的结果,属于化学腐蚀,与电化学腐蚀无
关,B项选;
C.铁质器件附有铜质配件,在接触处形成原电池装置,其中金属铁为负极,易生铁锈,和电化学腐蚀有
关,C项不选;
D.生铁中金属铁、碳、潮湿的空气能构成原电池,金属铁为负极,易被腐蚀而生锈,和电化学腐蚀有关,
D项不选。
答案选B。
21 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司31.下列关于钢铁腐蚀的叙述不正确的是
A.钢铁在潮湿的空气中易腐蚀
B.钢铁腐蚀的主要原因是化学腐蚀
C.腐蚀使钢铁色泽、外形等发生变化
D.一般情况下,温度对钢铁的化学腐蚀影响较明显
【答案】B
【详解】
A.钢铁在潮湿的空气中易形成原电池,发生电化学腐蚀,加快腐蚀,A正确;
B.钢铁中含有Fe、C元素,可以作为两个活泼性不同的电极,在潮湿的空气中易形成原电池,发生电化
学腐蚀,而不是化学腐蚀,B错误;
C.钢铁被腐蚀后生成红褐色的铁锈(Fe O),在外形、色泽以及机械性能等方面都将发生变化,C正确;
2 3
D.一般情况下,温度越高,反应速率越快,温度对钢铁的化学腐蚀影响较明显,D正确;
综上所述答案为B。
32.下列有关金属腐蚀的说法正确的是
A.金属的腐蚀一定伴有电流产生
B.钢铁在干燥的空气里比在潮湿的空气里更易被腐蚀
C.发生化学能转变为电能的腐蚀时,较活泼的金属总是作正极而被腐蚀
D.发生电化学腐蚀时有能量的转变,且被腐蚀的金属总是失电子
【答案】D
【详解】
A.金属发生化学腐蚀时,没有电流产生,A错误;
B.钢铁在潮湿的空气中,其表面形成微小的原电池,铁被腐蚀更快,B错误;
C.发生化学能转变为电能的腐蚀时较活泼的金属作负极而被腐蚀,C错误;
D.发生电化学腐蚀时有能量的转变,被腐蚀的金属失去电子,D正确;
故答案为:D。
33.对钢铁析氢腐蚀和吸氧腐蚀的比较,合理的是
A.负极反应不同 B.正极反应相同
C.析氢腐蚀更普遍 D.都是电化学腐蚀
【答案】D
【分析】
钢铁的化学腐蚀和电化学腐蚀往往同时发生,但电化学腐蚀比化学腐蚀要普遍的多,且腐蚀速度也快得多,
22 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司在钢铁的电化学腐蚀中,在酸性条件下发生析氢腐蚀,在弱酸性、中性或碱性条件下发生吸氧腐蚀,钢铁
的吸氧腐蚀比析氢腐蚀普遍。
【详解】
A项、钢铁的析氢腐蚀和吸氧腐蚀的负极都是铁放电生成亚铁离子,负极反应相同,故A错误;
B项、钢铁的析氢腐蚀的正极是水膜中氢离子放电,吸氧腐蚀的正极是水膜中氧气放电,正极反应不同,
故B错误;
C项、在钢铁的电化学腐蚀中,钢铁的吸氧腐蚀比析氢腐蚀普遍,故C错误;
D项、钢铁析氢腐蚀和吸氧腐蚀都是电化学腐蚀,故D正确。
故选D。
【点睛】
题考查了钢铁的吸氧腐蚀和析氢腐蚀,明确原电池原理是解本题关键。
34.下列实验中,在相同的时间里,铁腐蚀程度最大的是( )
A.将生铁放在煮沸过的水里
B.将白铁片(镀锌铁)放在溶有CO 的水中
2
C.将有磨损的马口铁(镀锡铁)放在溶有CO 的水中
2
D.将有磨损的放在白铁片(镀锌铁)溶有CO 的水中
2
【答案】C
【详解】
生铁在水中发生吸氧腐蚀,煮沸可减少溶解在水中的O ,减缓铁的腐蚀。白铁皮放在溶有CO 的水中,形
2 2
成酸性条件下的原电池,锌的活泼性大于铁,活动性强的锌为原电池的负极,发生析氢腐蚀,表面的锌被
腐蚀,铁为正极,铁受到保护;如为磨损的镀锡铁,铁的活泼性大于锡,活动性强的铁为负极,发生析氢
腐蚀,加快了铁的腐蚀。综合可见C中铁腐蚀程度最大,故选C。
35.下列电极反应式与出现的环境相匹配的是
电极反应式 出现的环境
A H-2e-=2H+ 碱性环境下氢氧燃料电池的负极反应
2
B O+2H O+4e-=4OH- 钢铁吸氧腐蚀的正极反应
2 2
C Cu-2e-=Cu2+ 电镀铜的阴极反应
D 4OH--4e-=O ↑+2H O 用惰性电极电解HSO 溶液的阳极反应
2 2 2 4
【答案】B
23 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司【详解】
A.碱性环境中不会生成氢离子,应为H-2e-+2OH-=2H O,A错误;
2 2
B.钢铁在碱性、中性、弱酸性环境中发生吸氧腐蚀,所以正极反应为O+2H O+4e-=4OH-,B正确;
2 2
C.电镀铜时阴极是铜离子被还原为Cu单质,电极反应为Cu2++2e-=Cu,C错误;
D.电解质溶液显酸性,不会有氢氧根参与反应,正确反应为2HO-4e-=O ↑+4H+,D错误;
2 2
综上所述答案为B。
36.下列各容器中盛有海水,则铁被腐蚀的速率由快到慢的顺序是
A.④>②>①>③>⑤>⑥ B.⑤>④>②>③>①>⑥
C.④>⑥>②>①>③>⑤ D.⑥>③>⑤>②>④>①
【答案】C
【详解】
由题图可知,④中铁作电解池的阳极,被腐蚀的速率最快;②、⑥中铁作原电池的负极,铁被腐蚀,且两
电极金属的活泼性相差越大,负极金属越容易被腐蚀,则铁被腐蚀的速率:⑥>②;①中铁发生化学腐蚀;
⑤中铁作电解池的阴极,铁被保护,被腐蚀的速率最慢;③中铁作原电池的正极,铁被保护,但被腐蚀的
速率大于⑤。综上所述,铁被腐蚀的速率由快到慢的原序为④>⑥>②>①>③>⑤,C项符合题意。
故选C。
37.I.炒过菜的铁锅为及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是_____________腐蚀(填“析氢“或“吸氧”)。
(2)写出铁锅腐蚀时正极的电极反应式:_______________。
II.①某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
Cu+H SO (稀)=CuSO+H ↑。请画出能够实验这一反应的装置图___________。
2 4 4 2
②某同学在做一定条件下铜与稀硫酸的反应实验时,看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你
分析其原因___________。
24 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司【答案】吸氧 2H O+O +4e-=4OH- 两极与电源的正负极接反了,或铜棒接电
2 2
源的负极了等
【详解】
(1)①弱碱或者中性条件下,钢铁发生吸氧腐蚀。
②正极发生还原反应,氧气得电子变成氢氧根离子,方程式为:2H O+O +4e-=4OH-;
2 2
(2)①铜和稀硫酸不反应,要实现该反应,需要通过电解,装置如图所示: 。
②当两极与电池的正负极接反了之后,该电解池就相当于电解水,正负极都会有气泡产生,而且铜不会被
腐蚀。
核心知识6 金属的防护
38.下列做法不能起防锈作用的是
A.保留铁制品上的铁锈 B.在铁制品表面镀锌
C.在金属机械上涂油 D.在车、船的表面刷油漆
【答案】A
【详解】
A.铁锈是一种松脆多孔的物质,不能阻止内层的铁与外界的接触,从而不能起防锈作用,A符合;
B.镀锌避免Fe和空气接触,能起防锈作用,B不符合;
C.涂油避免Fe和空气接触,能起防锈作用,C不符合;
D.在车、船的表面刷油漆,避免Fe和空气接触,能起防锈作用,D不符合。
答案选A。
39.为了降低某水库的铁闸门被腐蚀的速率,可以采取如图所示的方案,其中焊接在铁闸门上的固体材料
R可以采用( )
25 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司A.锌 B.钠 C.铜 D.石墨
【答案】A
【详解】
如图方案降低水库的铁闸门被腐蚀的速率,属于牺牲阳极的阴极保护法,根据原电池原理,R应选用活泼
性比铁强的金属,且不能与水反应,所以只能选择金属锌,答案选A。
40.下列金属防腐的措施中,使用牺牲阳极的阴极保护法的是
A.地下钢管连接锌块 B.金属护拦表面涂漆
C.汽车底盘喷涂高分子膜 D.水中的钢闸门连接电源的负极
【答案】A
【详解】
A.地下钢管连接锌块,Fe、Zn、电解质溶液构成原电池,Fe失电子能力小于Zn而作正极被保护,所以
该保护方法属于牺牲阳极的阴极保护法,故A正确;
B.金属护拦表面涂漆,阻止Fe与空气、水接触,从而防止金属被腐蚀,属于物理方法,故B错误;
C.汽车底盘喷涂高分子膜,阻止Fe与空气、水接触,从而防止金属被腐蚀,属于物理方法,故C错误;
D.水中的钢闸门连接电源的负极,构成电解池,是外接电流阴极保护法,故D错误。答案选A。
41.港珠澳大桥设计使用寿命为120年,对桥体钢构件采用多种方法防腐。下列分析错误的是
A.防腐原理主要是避免发生反应:2Fe+O+2HO=2Fe(OH)
2 2 2
B.钢构件表面喷涂环氧树脂涂层是为了隔绝空气、水等,防止形成原电池
C.采用外加电流的阴极保护法时需直接在钢构件上绑上锌块
D.钢构件可采用不锈钢材料以减缓腐蚀速率
【答案】C
【详解】
A.大桥在海水中发生吸氧腐蚀,负极上铁失电子:Fe-2e-=Fe2+,正极上氧气得电子:O+4e-
2
+2HO=4OH-,故总反应为2Fe+O+2HO=2Fe(OH),故防腐蚀即为了避免此反应的发生,故A正确;
2 2 2 2
B.钢铁生锈的条件是有氧气和水,而钢构件表面喷涂环氧树脂涂层,能隔绝空气和水,故能防止原电池
的形成,故B正确;
26 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司C.外加电流的阴极保护法中,钢铁做阴极被保护,阳极可以采用惰性阳极,而无需采用活性电极,故C
错误;
D.不锈钢的耐腐蚀性比较好,故钢构件可以采用不锈钢,故D正确。
故选C。
42.下列措施中,不符合生产实际的是
A.电解法精炼粗铜,用纯铜作阴扱
B.利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连
C.为保护地下管道中的金属铁,可将其与锌极相连
D.在镀件上电镀锌,用锌作阳极
【答案】B
【详解】
A、电解精炼铜是粗铜作阳极,精铜作阴极,故A符合;
B、利用外加电流的阴极保护法,应将水下的钢闸门与电源负极相连,避免被氧化,故B不符合;
C、锌比铁活泼,锌铁原电池中锌做负极被氧化,可以保护铁,故C符合;
D、电镀原理中,镀层金属做阳极,镀件金属做阴极,在镀件上镀锌,可用硫酸锌作电解质溶液,故D符
合;
故答案为B。
43.下列说法正确的是
A.由原电池原理可知所有的合金都比纯金属更易被腐蚀
B.铜板上的铜铆钉处在潮湿的空气中发生电化学腐蚀的负极反应式为Fe-3e-=Fe3+
C.船舶外壳镶嵌锌块,锌作负极,以防船体被腐蚀
D.镀层破损后,马口铁(镀锡铁)比白铁皮(镀锌铁)耐腐蚀
【答案】C
【详解】
A.有些合金由于金属的内部组织结构被改变而比纯金属更难被腐蚀,A说法错误;
B.铜板上的铜铆钉处在潮湿的空气中发生电化学腐蚀的负极反应式为Fe-2e-=Fe2+,B说法错误;
C.船舶外壳镶嵌锌块,锌比铁活泼,锌作负极,铁作正极,被保护,可防船体被腐蚀,C说法正确;
D.镀层破损后,马口铁(镀锡铁)铁作负极,失电子生成亚铁离子,白铁皮(镀锌铁)中锌作负极,铁被保护,
故白铁皮更耐腐蚀,D说法错误;
答案为C。
44.某课外小组同学对不同条件下铁钉的锈蚀进行了实验。
27 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司实验序号 ① ② ③ ④
实验
内容
一周后观察:
(1)铁钉被腐蚀程度最大的是_____________(填实验序号)。
(2)实验③中主要发生的是__________(填“化学腐蚀”或“电化学腐蚀”)。
(3)铁钉发生电化学腐蚀的负极反应式为:____________。
(4)根据上述实验,你认为铁发生电化学腐蚀的条件是________________。
(5)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀
可采取的措施有_________(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬
③将钢管用导线与镁条连接 ④将钢管用导线与碳棒连接
【答案】④ 电化学腐蚀 Fe-2e-=Fe2+ 铁接触空气和电解质溶液(铁与潮湿空气接触)
①②③
【分析】
(1)铁的腐蚀有化学腐蚀和电化学腐蚀两种,根据条件分析腐蚀类型,判断反应快慢;
(2)注意分析能否形成原电池条件来判断腐蚀的类型;
(3)负极上发生氧化反应,正极发生还原反应,以此来判断并书写电极反应式;
(4)电化学腐蚀发生了原电池反应,从原电池的形成条件来判断;
(5)金属的防护措施有牺牲阳极的阴极保护法、外加电流的阴极保护法,另外还有电镀、喷镀、喷油漆
等方法使金属与空气、水等物质隔离,以防止金属腐蚀。
【详解】
(1)①在干燥空气中难以腐蚀,②隔绝空气也难以腐蚀,③④发生电化学腐蚀,但④中电解质溶液离子
浓度大,导电性强,电化学腐蚀速率快,故答案为④;
(2)③中蒸馏水溶解氧气,能发生电化学腐蚀,故答案为电化学腐蚀;
(3)反应中铁是负极,发生氧化反应,生成Fe2+,故答案为Fe-2e-=Fe2+;
(4)电化学腐蚀的发生了原电池反应,从原电池的形成条件来判断:有两个活泼性不同的电极、电解质
溶液、闭合回路,金属腐蚀时还有有空气,故答案为铁接触空气和电解质溶液(铁与潮湿空气接触);
(5)本题中①②为外加防护膜的保护法,可以隔绝空气,③中金属镁比铁活泼,属于牺牲阳极的阴极保
28 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司护法(可理解为牺牲负极的正极保护法),④中加快了金属的腐蚀,故答案为①②③。
29 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司30 / 30
原创原创精品资源学科网独家享有版权,侵权必究!
学科网(北京)股份有限公司