文档内容
第四章 第一节 第1课时 原电池的工作原理 测试题
榆次一中 李金虎
一、选择题(本题共有15小题,每小题4分,共60分,每小题只有一个正确选项)
1. 某同学根据离子反应方程式2Fe3++Fe===3Fe2+来设计原电池。下列设计方案中可行的是(
)
A.电极材料为Fe和Zn,电解质溶液为FeCl 溶液
3
B.电极材料为Fe和Cu,电解质溶液为Fe(NO ) 溶液
3 3
C.电极材料为Fe和石墨,电解质溶液为FeCl 溶液
2
D.电极材料为石墨,电解质溶液为FeCl 溶液
3
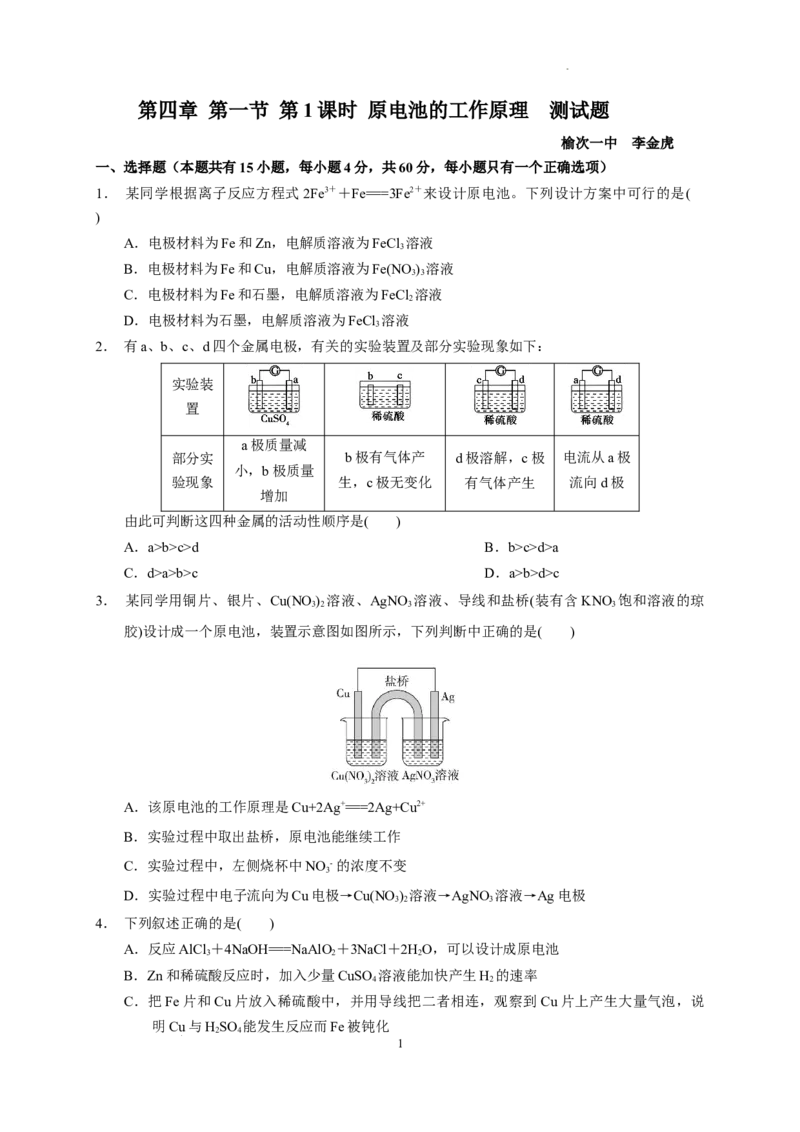
2. 有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装
置
a极质量减
部分实 b极有气体产 d极溶解,c极 电流从a极
小,b极质量
验现象 生,c极无变化 有气体产生 流向d极
增加
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
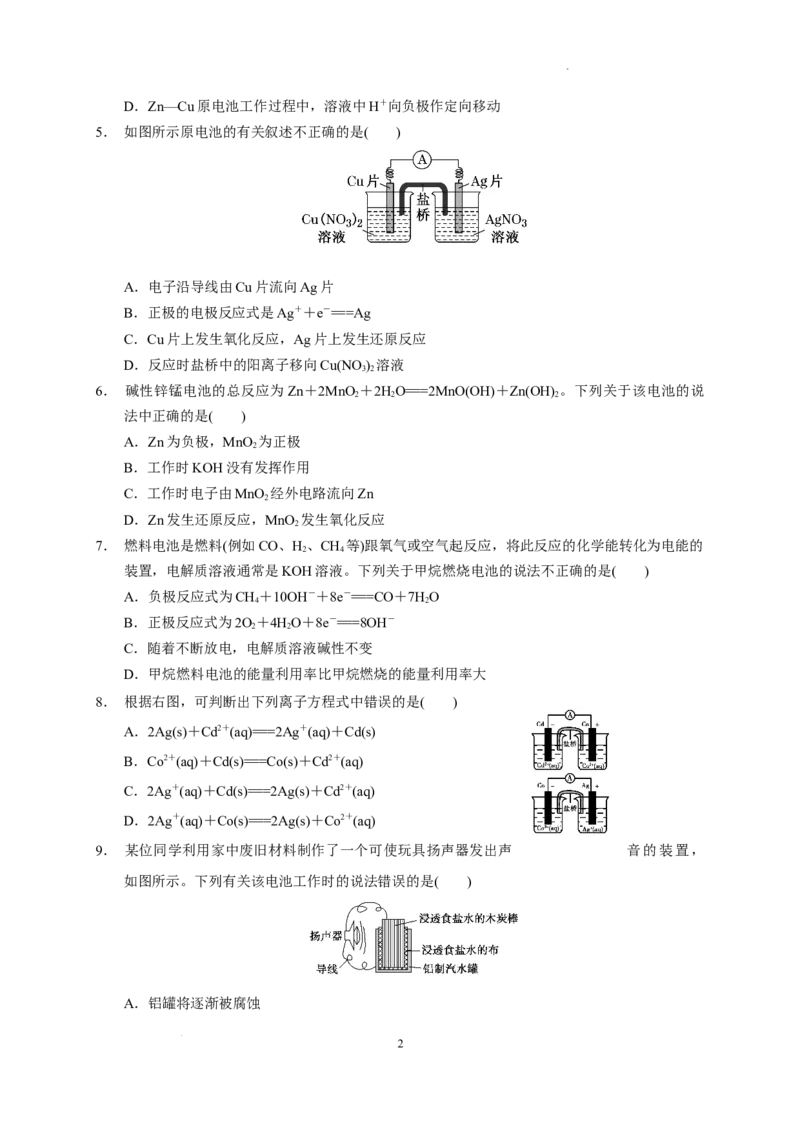
3. 某同学用铜片、银片、Cu(NO ) 溶液、AgNO 溶液、导线和盐桥(装有含KNO 饱和溶液的琼
3 2 3 3
胶)设计成一个原电池,装置示意图如图所示,下列判断中正确的是( )
A.该原电池的工作原理是Cu+2Ag+===2Ag+Cu2+
B.实验过程中取出盐桥,原电池能继续工作
C.实验过程中,左侧烧杯中NO- 的浓度不变
3
D.实验过程中电子流向为Cu电极→Cu(NO ) 溶液→AgNO 溶液→Ag电极
3 2 3
4. 下列叙述正确的是( )
A.反应AlCl +4NaOH===NaAlO+3NaCl+2HO,可以设计成原电池
3 2 2
B.Zn和稀硫酸反应时,加入少量CuSO 溶液能加快产生H 的速率
4 2
C.把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu片上产生大量气泡,说
明Cu与HSO 能发生反应而Fe被钝化
2 4
1
学科网(北京)股份有限公司D.Zn—Cu原电池工作过程中,溶液中H+向负极作定向移动
5. 如图所示原电池的有关叙述不正确的是( )
A.电子沿导线由Cu片流向Ag片
B.正极的电极反应式是Ag++e-===Ag
C.Cu片上发生氧化反应,Ag片上发生还原反应
D.反应时盐桥中的阳离子移向Cu(NO ) 溶液
3 2
6. 碱性锌锰电池的总反应为Zn+2MnO +2HO===2MnO(OH)+Zn(OH) 。下列关于该电池的说
2 2 2
法中正确的是( )
A.Zn为负极,MnO 为正极
2
B.工作时KOH没有发挥作用
C.工作时电子由MnO 经外电路流向Zn
2
D.Zn发生还原反应,MnO 发生氧化反应
2
7. 燃料电池是燃料(例如CO、H、CH 等)跟氧气或空气起反应,将此反应的化学能转化为电能的
2 4
装置,电解质溶液通常是KOH溶液。下列关于甲烷燃烧电池的说法不正确的是( )
A.负极反应式为CH+10OH-+8e-===CO+7HO
4 2
B.正极反应式为2O+4HO+8e-===8OH-
2 2
C.随着不断放电,电解质溶液碱性不变
D.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
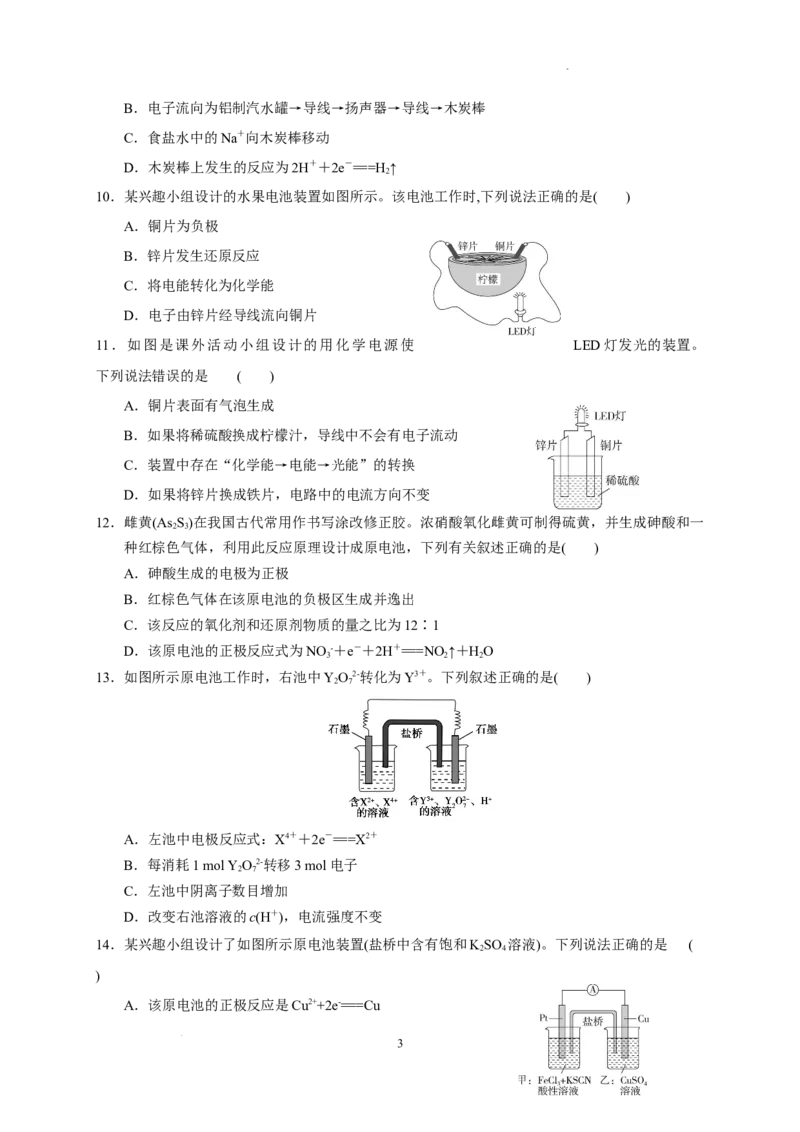
8. 根据右图,可判断出下列离子方程式中错误的是( )
A.2Ag(s)+Cd2+(aq)===2Ag+(aq)+Cd(s)
B.Co2+(aq)+Cd(s)===Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s)===2Ag(s)+Cd2+(aq)
D.2Ag+(aq)+Co(s)===2Ag(s)+Co2+(aq)
9. 某位同学利用家中废旧材料制作了一个可使玩具扬声器发出声 音的装置,
如图所示。下列有关该电池工作时的说法错误的是( )
A.铝罐将逐渐被腐蚀
2
学科网(北京)股份有限公司B.电子流向为铝制汽水罐→导线→扬声器→导线→木炭棒
C.食盐水中的Na+向木炭棒移动
D.木炭棒上发生的反应为2H++2e-===H ↑
2
10.某兴趣小组设计的水果电池装置如图所示。该电池工作时,下列说法正确的是( )
A.铜片为负极
B.锌片发生还原反应
C.将电能转化为化学能
D.电子由锌片经导线流向铜片
11.如图是课外活动小组设计的用化学电源使 LED灯发光的装置。
下列说法错误的是 ( )
A.铜片表面有气泡生成
B.如果将稀硫酸换成柠檬汁,导线中不会有电子流动
C.装置中存在“化学能→电能→光能”的转换
D.如果将锌片换成铁片,电路中的电流方向不变
12.雌黄(As S)在我国古代常用作书写涂改修正胶。浓硝酸氧化雌黄可制得硫黄,并生成砷酸和一
2 3
种红棕色气体,利用此反应原理设计成原电池,下列有关叙述正确的是( )
A.砷酸生成的电极为正极
B.红棕色气体在该原电池的负极区生成并逸出
C.该反应的氧化剂和还原剂物质的量之比为12∶1
D.该原电池的正极反应式为NO -+e-+2H+===NO↑+HO
3 2 2
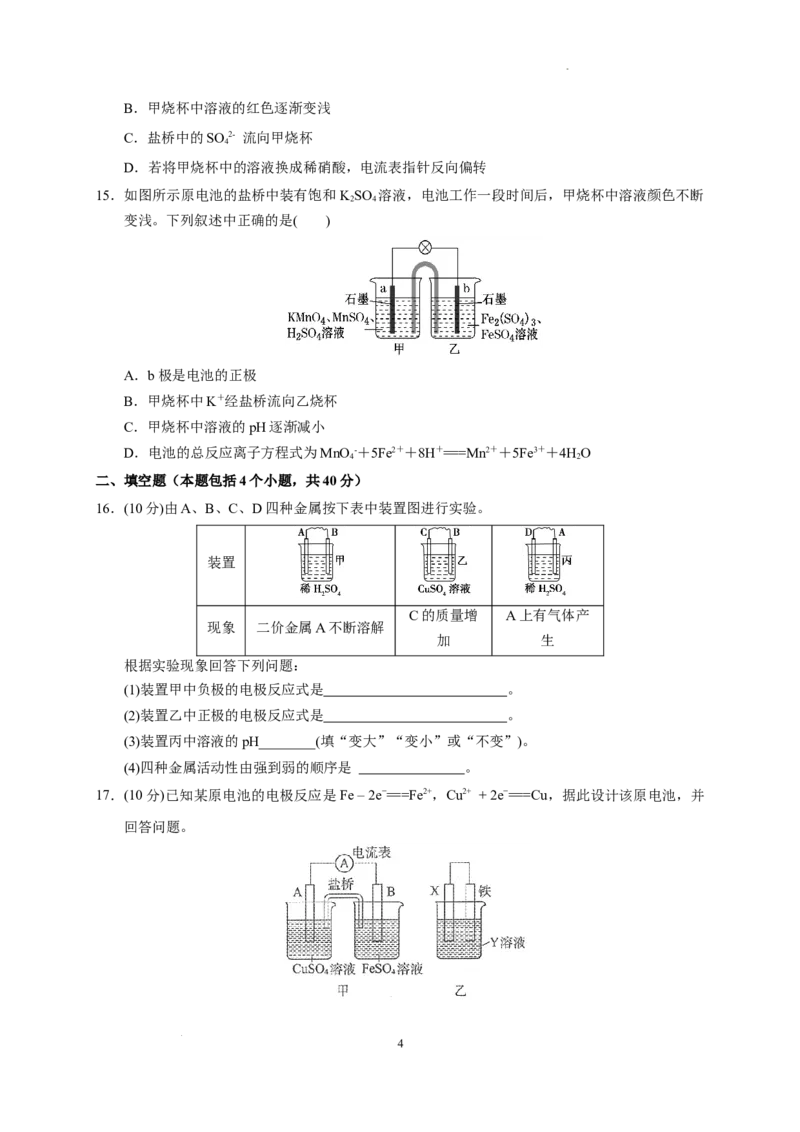
13.如图所示原电池工作时,右池中YO2-转化为Y3+。下列叙述正确的是( )
2 7
A.左池中电极反应式:X4++2e-===X2+
B.每消耗1 mol Y O2-转移3 mol电子
2 7
C.左池中阴离子数目增加
D.改变右池溶液的c(H+),电流强度不变
14.某兴趣小组设计了如图所示原电池装置(盐桥中含有饱和KSO 溶液)。下列说法正确的是 (
2 4
)
A.该原电池的正极反应是Cu2++2e-===Cu
3
学科网(北京)股份有限公司B.甲烧杯中溶液的红色逐渐变浅
C.盐桥中的SO 2- 流向甲烧杯
4
D.若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转
15.如图所示原电池的盐桥中装有饱和KSO 溶液,电池工作一段时间后,甲烧杯中溶液颜色不断
2 4
变浅。下列叙述中正确的是( )
A.b极是电池的正极
B.甲烧杯中K+经盐桥流向乙烧杯
C.甲烧杯中溶液的pH逐渐减小
D.电池的总反应离子方程式为MnO -+5Fe2++8H+===Mn2++5Fe3++4HO
4 2
二、填空题(本题包括4个小题,共40分)
16.(10分)由A、B、C、D四种金属按下表中装置图进行实验。
装置
C的质量增 A上有气体产
现象 二价金属A不断溶解
加 生
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是 。
(2)装置乙中正极的电极反应式是 。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是 。
17.(10分)已知某原电池的电极反应是Fe – 2e−===Fe2+,Cu2+ + 2e−===Cu,据此设计该原电池,并
回答问题。
4
学科网(北京)股份有限公司(1)若原电池装置为图中甲:
①电极材料A是 ,B是 (写名称)。
②观察到A电极的现象是 。
(2)若原电池装置为图中乙:
①电极材料X是 (填序号,下同)。
a.铁 b.铜 c.石墨
②电解质Y是 。
a.FeSO b.CuSO c.CuCl
4 4 2
18. (10分)有甲、乙两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有关性
质,分别设计了如下图所示的原电池,请完成下列问题:
(1)甲池中正极上的实验现象是 。
(2)乙池中总反应的离子方程式为: 。
(3)上述实验证明了“利用金属活动性顺序表直接判断原电池的正负极”,这种做法
________(填“可靠”或“不可靠”),如不可靠,请你提出另一种判断原电池正负极的可行的
方案________________________。(若你认为可靠,此空可不作答)
(4)一段时间后,乙学生将乙池两极取出,然后取少许乙池溶液逐滴滴加6 mol/L H SO 溶液直
2 4
至过量,①可能观察到的现象是________________________;②各阶段对应的离子方程式分别
是________、________、________。
19.(10分)某研究性学习小组根据反应2KMnO +10FeSO+8H SO ===2MnSO +5Fe (SO )+ K SO +
4 4 2 4 4 2 4 3 2 4
8HO设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积
2
均为200 mL,盐桥中装有含饱和KSO 溶液的琼胶。
2 4
回答下列问题:
(1)此原电池的正极是石墨 (填“a”或“b”),发生 反应。
(2)电池工作时,盐桥中的SO 2-移向 (填“甲”或“乙”)烧杯。
4
(3)写出两烧杯中的电极反应式:
5
学科网(北京)股份有限公司甲 ,
乙 。
(4)若不考虑溶液的体积变化,MnSO 浓度变为 1.5 mol·L-1,则反应中转移的电子为
4
mol。
1.答案:B
解析:据反应2Fe3++Fe===3Fe2+知,负极发生氧化反应的是Fe-2e-===Fe2+,因此Fe作负极,正
极应是活泼性比Fe弱的金属或碳棒,电解质溶液应是可溶性铁盐酸,B合适。
2.答案:C
解析:由第一个装置可知a极溶解,故a极是负极,可知金属活动性a>b;第二个装置依据氧化性,
还原性的规律可知金属活动性b>c;由第三个装置得金属活动性d>c;第四个装置电子从d→a;故
金属活动性d>a。
3.答案:A
解析:Cu电极为负极,Ag电极为正极,该原电池的工作原理是Cu+2Ag+===2Ag+Cu2+,A正确;
实验过程中取出盐桥,不能形成闭合回路,因此原电池不能继续工作,B错误,;实验过程中,盐
桥中的NO-不断向左侧迁移,因此左侧烧杯中NO- 的浓度增大,C错误;实验过程中电子流向为
3 3
Cu电极→导线→Ag电极,电子不能通过电解液,D错误。
4.答案:B
解析:A项,属于非氧化还原反应,不能用于设计原电池;B项,锌与置换出来的铜在电解质溶液
中构成原电池,加快产生H 的速率;C项,Cu与稀HSO 不反应,Fe在稀HSO 中不发生钝化;
2 2 4 2 4
D项,H+应向原电池的正极作定向移动。
5.答案:D
解析:A项,该装置是原电池,铜作负极,银作正极,电子从铜片沿导线流向银片,正确; B项,
正极电极反应式为Ag++e-===Ag,正确; C项,铜片上失电子发生氧化反应,银片上得电子发
生还原反应,正确; D项,原电池工作时,电解质溶液以及盐桥中的阳离子向正极移动,阴离子
向负极移动,所以反应时盐桥中的阳离子移向AgNO 溶液,错误。
3
6.答案:A
解析:B项,KOH是电解质,增强导电性,错误;C项,工作时电子从负极Zn流出,错误;D项,
Zn发生氧化反应,MnO 发生还原反应,错误。
2
7.答案:C
解析:A、B两项是正确的;综合A、B两项知C项不正确;根据能量转化的规律,燃烧时产生的
热能是不可能全部转化为功的,能量利用率不高,而电能转化为功的效率要大得多,D项正确。
8.答案:A
6
学科网(北京)股份有限公司解析:从两个原电池的电极可以判断出三种金属的活动性关系为:Cd>Co>Ag,则氧化性关系为:
Cd2+A>B>C
解析:甲、乙、丙均为原电池装置。依据原电池原理,甲中A不断溶解,则A为负极、B为正极,
活动性A>B;乙中C极增重,即析出Cu,则B为负极,活动性B>C;丙中A上有气体即H 产生,
2
则A为正极,活动性D>A,随着H+的消耗,pH变大。
17.答案:(1)①铜(或石墨棒) 铁 ②有红色物质析出(或变粗) (2)①bc ②bc
解析:(1)结合氧化还原反应的知识可知Fe−2e−===Fe2+是负极反应,故Fe作负极,Cu2+
+2e−===Cu是正极反应,故A应是铜或石墨棒,现象是看到有红色物质析出,电极变粗。(2)不
含盐桥的原电池中正极材料是比负极金属活泼性差的金属或导电的非金属,故此时正极是铜或石墨,
但负极只能是铁,电解质溶液是含不活泼金属离子的盐溶液,可为硫酸铜、氯化铜或硝酸铜。
18.答案:(1)电极上产生气泡 (2)2Al+2OH-+2HO===2AlO+3H↑
2 2
(3)不可靠 将两种金属电极连上电流计而构成原电池,利用电流计检测电流的方向,从而判断
电子流动方向,由此确定原电池的正负极
(4)① 开始无明显变化,过一段时间产生白色沉淀,后逐渐溶解最后消失 ② H++OH-
===H O AlO+H++HO===Al(OH) ↓ Al(OH) +3H+===Al3++3HO
2 2 3 3 2
解析:当稀硫酸是电解液时,Mg作负极(活泼性Mg>Al),Al作正极且电极上产生气泡;当NaOH
是电解液时,Al作负极(因为Mg不与NaOH溶液反应),总反应为2Al+2OH-+2HO===2AlO+
2
3H↑。乙学生将乙池两极取出,电解液中含有AlO,是NaOH和NaAlO 的混合溶液,所以逐滴滴
2 2
加稀HSO ,应该先中和掉NaOH,再与NaAlO 反应生成沉淀,当硫酸过量时,Al(OH) 沉淀逐渐
2 4 2 3
消失。
19.答案:(1)a 还原 (2)乙
(3)Mn +5e-+8H+===Mn2++4H O 5Fe2+-5e-===5Fe3+
O- 2
4
(4)0.5
解析:(1)根据题目提供的总反应方程式可知,KMnO 作氧化剂,发生还原反应,故石墨a是正极。
4
(2)电池工作时,SO 2-向负极移动,即向乙烧杯移动。(3)甲烧杯中的电极反应式为 Mn +5e-
4 O-
4
+8H+===Mn2++4H O;乙烧杯中的电极反应式为 5Fe2+-5e-===5Fe3+。(4)溶液中的 MnSO 浓度由 1
2 4
mol·L-1变为 1.5 mol·L-1,由于溶液的体积未变,则反应过程中生成的 MnSO 的物质的量为 0.5
4
mol·L-1×0.2 L=0.1 mol,故转移的电子为0.1 mol×5=0.5 mol。
8
学科网(北京)股份有限公司9
学科网(北京)股份有限公司