文档内容
第一学期高一年级化学学科期中考试卷
考试时间90分钟,满分100分
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,所有答案均在答题纸上
可能用到的相对原子质量:H-1,C-12,N-14,O-16,Na-23,Mg-24,Al-27,Si-28,S-32,Cl-35.5
第I卷(共42分)
选择题(只有一个正确答案,每小题2分,共42分)
1. 下列各项内容中,属于化学科学研究内容的是
A. 利用指南针确定航海方向 B. 培育新品种,增加农作物产量
C. 综合利用石油生产优质人造纤维 D. 利用滑轮提升重物
2. 下列有关研究物质性质的方法中,说法不正确的是
A. 研究物质的性质时,常用观察、实验、分类、比较、模型、假说等方法
B. 观察是一种有计划、有目的地运用感官考察研究对象的方法
C. 科学家提出的假说一定能成为科学理论
D. 使用模型有助于人们研究物质的性质
3. 生石灰(CaO)可作食品干燥剂,属于碱性氧化物,不能与其发生反应的物质是
.
A HSO B. SO C. HO D. NaOH
2 4 2 2
4. 磁流体是电子材料的新秀。在一定条件下,将含等物质的量的FeSO 和Fe(SO) 的溶液混合,再滴入稍
4 2 4 3
过量的NaOH溶液,可得到分散质粒子大小在36~55nm之间的黑色磁流体。下列说法中正确的是( )
A. 所得的分散系属于悬浊液 B. 所得的分散系中分散质为FeO
2 3
C. 用光束照射该分散系能产生丁达尔效应 D. 分散系为胶体,分散质粒子大小即Fe(OH) 分子直
3
径
5. 盐是一类常见的物质,下列物质通过一定反应可直接形成盐的是
①金属单质 ②碱性氧化物 ③非金属单质 ④酸性氧化物 ⑤酸 ⑥碱
A. ①②③ B. ①④⑥ C. ②⑤⑥ D. 全部
6. 下列物质分类的正确组合是( )
选项 混合物 纯净物 单质 电解质
A 盐酸 NaOH 石墨 KSO 溶液
2 4
B 空气 Fe(OH) 胶体 铁 NaCO
3 2 3
C CuSO ·5H O CaCl 水银 铜
4 2 2
D 氨水 明矾 C NaCl
70.
A A B. B C. C D. D
7. 用自来水养金鱼时,通常先将自来水经日晒一段时间后,再注入鱼缸,其目的是( )
A. 利用紫外线杀死水中的细菌 B. 提高水温,有利于金鱼生长
C. 增加水中氧气 的含量 D. 促使水中的次氯酸分解
8. 自来水厂常使用氯气消毒,市场上有些小商小贩用自来水充当纯净水出售。下列试剂中,可用来辨其真
伪的是( )
A. 酚酞溶液 B. 氯化钡溶液 C. 氢氧化钠溶液 D. 硝酸银溶液
9. 用玻璃棒蘸取新制氯水滴在pH试纸中部,观察到的现象是( )
A. B. C. D.
10. 已知Fe(OH) 为红褐色,下列关于钠的反应现象的叙述中,不正确的是( )
3
选项 反应内容 反应现象
A 切开钠,观察其颜色的变化 钠切面颜色变暗,最后呈淡黄色
B 把小块钠投入硫酸铁溶液中 钠浮在水面上、四处游动、产生红褐色沉淀
C 把小块钠投入饱和氢氧化钠溶液中 钠浮在水面上、四处游动、产生白色浑浊
D 把燃着的钠伸入盛有氯气的集气瓶中 钠与氯气剧烈反应,产生大量白烟
A. A B. B C. C D. D
11. 实验室用右图装置干燥、收集某气体R,则R可能是
A. SO B. NH
2 3
C. HCl D. Cl
2
12. 下列说法正确的是( )
A. 液态HCl不导电,所以HCl是非电解质
B. CO 的水溶液导电,所以CO 是电解质
2 2C. 铜、石墨均导电,所以它们都是电解质
D. 蔗糖在水溶液中和熔融时均不导电,所以蔗糖是非电解质
13. 下列说法错误的是
A. 熔融NaCl发生了电离,能导电
B. NaCl晶体不能导电
C. NH NO 电离时产生了 、 ,无金属离子,所以NH NO 不是盐
4 3 4 3
D. NaHSO 在水溶液中电离出Na+、H+、 三种离子
4
14. 维生素C是一种水溶性维生素,熔点为190℃,其分子式为C HO。下列有关维生素C的说法不正确
6 8 6
的是
A. 维生素C的摩尔质量为176g.mol-1
B. 标准状况下,维生素C 的摩尔体积为22.4L.mol-1
C. 维生素C中C、O两种元素的质量比为3:4
D. 维生素C中C、H、O原子个数比为3:4:3
15. 下列物质混合后不会发生离子反应 的是
A. 硝酸银溶液和氯化钠溶液 B. 澄清的石灰水和二氧化碳
C. 氯化镁溶液和硫酸铜溶液 D. 澄清的石灰水和稀盐酸
16. 某溶液中可能含有 、 、Cl-.检验其中是否含有 ,除BaCl 溶液外,还需要的溶液是
2
A. HSO B. HCl C. NaOH D. NaNO
2 4 3
17. 下列离子方程式书写正确的是
A. 过氧化钠固体与水反应:2O +2H O=4OH-+O ↑
2 2
B. 碳酸钠溶液与醋酸溶液:CO +2H+=CO ↑+H O
2 2
C. 碳酸镁跟硫酸反应:MgCO +2H+=Mg2++H O+CO↑
3 2 2
D. 氢氧化铜溶液与硫酸混合:OH-+H+=H O
2
18. 有五瓶失去标签的溶液,它们分别是①Ba(NO );②KCl;③NaOH;④CuSO ;⑤NaSO ,如果不
3 2 4 2 4
用其它任何试剂,用最简单的方法将它们一一鉴别开来,则在下列的鉴别顺序中,最合理的是
A. ④③①⑤② B. ④⑤①③② C. ①⑤④③② D. ③④①⑤②
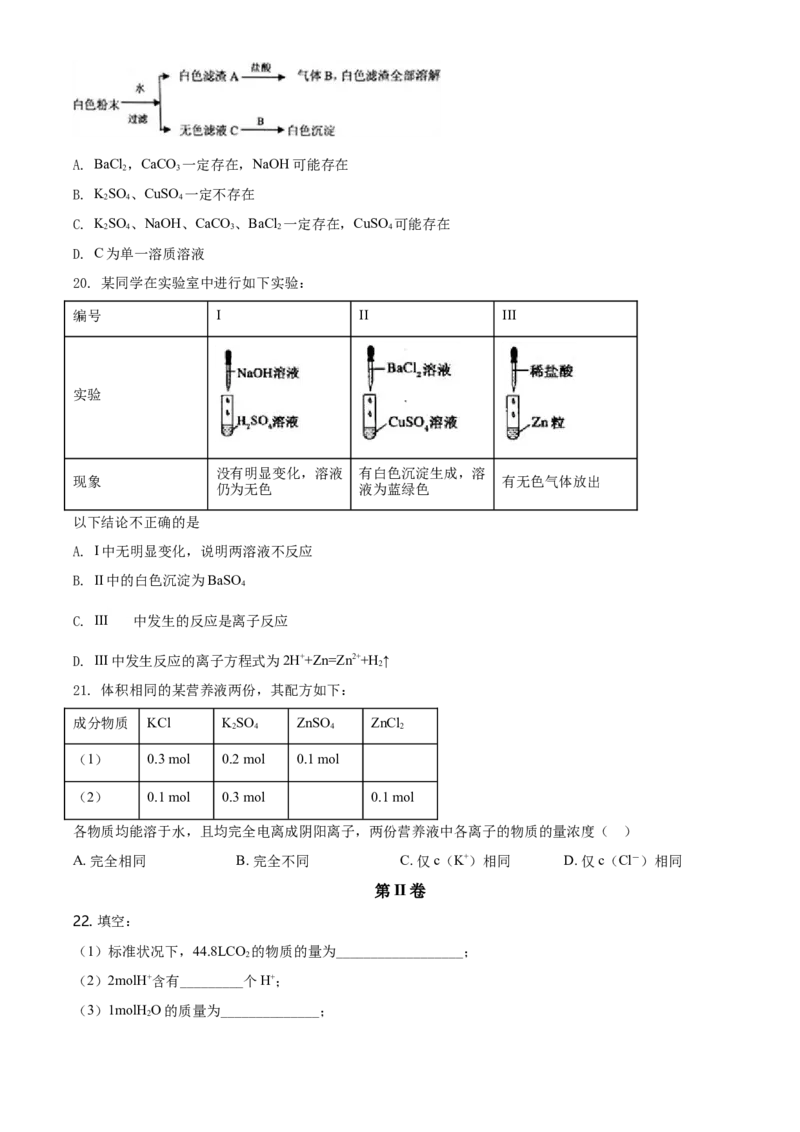
19. 有一包白色粉末,由BaCl 、KSO 、CaCO 、NaOH、CuSO 中的一种或几种组成,为了探究它的成份,
2 2 4 3 4
进行了如下实验:下列判断正确的是( )A. BaCl ,CaCO 一定存在,NaOH可能存在
2 3
B. KSO 、CuSO 一定不存在
2 4 4
C. KSO 、NaOH、CaCO 、BaCl 一定存在,CuSO 可能存在
2 4 3 2 4
D. C为单一溶质溶液
20. 某同学在实验室中进行如下实验:
编号 I II III
实验
没有明显变化,溶液 有白色沉淀生成,溶
现象 有无色气体放出
仍为无色 液为蓝绿色
以下结论不正确的是
A. I中无明显变化,说明两溶液不反应
B. II中的白色沉淀为BaSO
4
C. III 中发生的反应是离子反应
D. III中发生反应的离子方程式为2H++Zn=Zn2++H ↑
2
21. 体积相同的某营养液两份,其配方如下:
成分物质 KCl KSO ZnSO ZnCl
2 4 4 2
(1) 0.3 mol 0.2 mol 0.1 mol
(2) 0.1 mol 0.3 mol 0.1 mol
各物质均能溶于水,且均完全电离成阴阳离子,两份营养液中各离子的物质的量浓度( )
A. 完全相同 B. 完全不同 C. 仅c(K+)相同 D. 仅c(Cl-)相同
第II卷
22. 填空:
(1)标准状况下,44.8LCO 的物质的量为__________________;
2
(2)2molH+含有_________个H+;
(3)1molH O的质量为______________;
2(4)将20gNaOH溶于水配成500mL溶液,该溶液中溶质的物质的量浓度为_________;
(5)同温、同压下,等体积的N 和O 的质量比为________。
2 2
23. 把对应物质的字母代码填入括号内。
A 明矾 B 硝酸铵 C 新制氯水 D 小苏打 E 次氯酸钙
(1)能使紫色石蕊试液先变红后褪色______
(2)能做净水剂_______
(3)能做处理胃酸过多的一种药剂_______
24. 目前,世界上多采用电解熔融氯化钠的方法来生产金属钠:2NaCl(熔融) 2Na+Cl ↑。已知物质
2
A、B、C、D、E、F 有如图所示转化关系:
(1)写出A、B生成NaCl的化学方程式:_____。
(2)写出化学式:D_____,E_____,F_____。
(3)工业生产中常利用B与Ca(OH) 反应来制备漂白粉,反应方程式是_______。
2
(4)若把A投入盛有D的溶液中,该过程所发生的的化学方程式为_______。
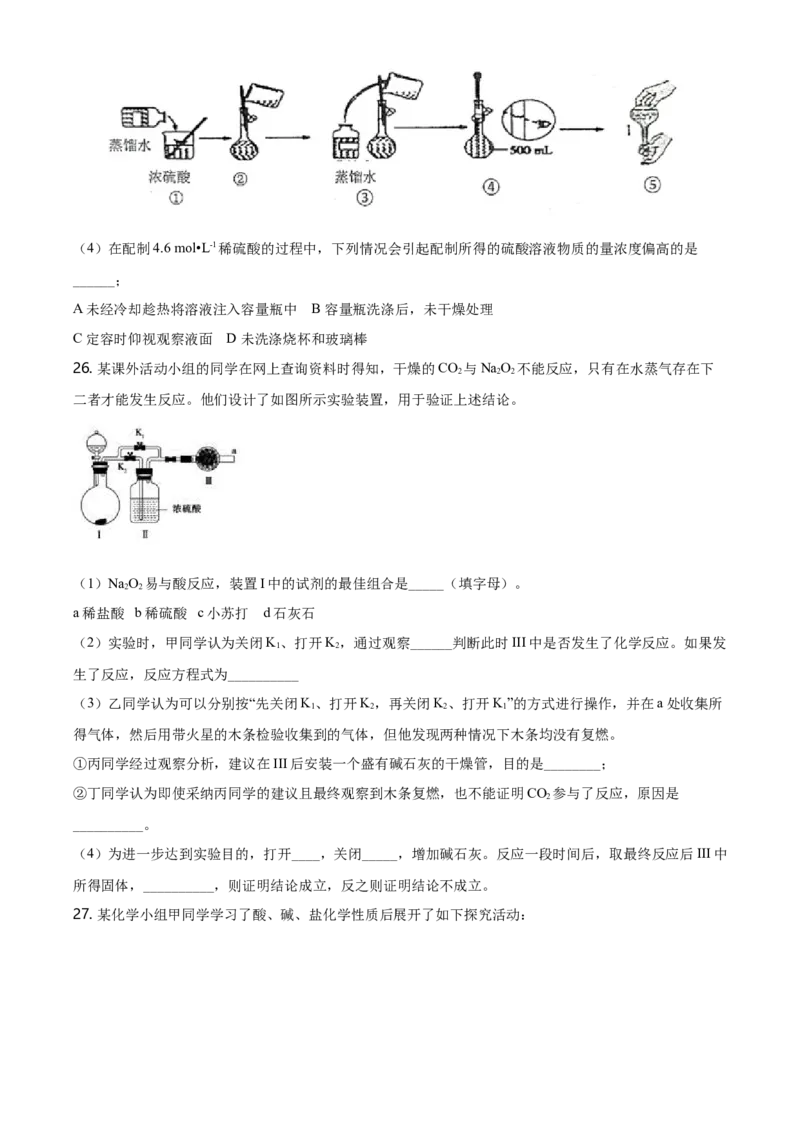
25. 如图是硫酸试剂瓶标签上的内容:
(1)某化学兴趣小组进行硫酸性质的实验探究时,需要490mL 4.6 mol•L-1的稀硫酸,现要配制该浓度的溶
液所需要的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要_____(填仪器名称);需要量取98%
浓硫酸____mL进行配制;
(2)配制溶液时有如下操作:a.稀释溶液b.摇匀c.洗涤d.冷却e.量取f.将溶液移至容量瓶g.定容,实验操
作顺序正确的是____
A e→a→f→d→c→f→g→b B e→a→d→f→c→f→g→b
C e→a→f→d→c→f→b→g D e→a→d→f→c→f→b→g
(3)下列为配置过程中部分操作的示意图,其中有错误的是_____(填序号);(4)在配制4.6 mol•L-1稀硫酸的过程中,下列情况会引起配制所得的硫酸溶液物质的量浓度偏高的是
______;
A 未经冷却趁热将溶液注入容量瓶中 B 容量瓶洗涤后,未干燥处理
C 定容时仰视观察液面 D 未洗涤烧杯和玻璃棒
26. 某课外活动小组的同学在网上查询资料时得知,干燥的CO 与NaO 不能反应,只有在水蒸气存在下
2 2 2
二者才能发生反应。他们设计了如图所示实验装置,用于验证上述结论。
(1)NaO 易与酸反应,装置I中的试剂的最佳组合是_____(填字母)。
2 2
a稀盐酸 b稀硫酸 c小苏打 d石灰石
(2)实验时,甲同学认为关闭K、打开K,通过观察______判断此时III中是否发生了化学反应。如果发
1 2
生了反应,反应方程式为__________
(3)乙同学认为可以分别按“先关闭K、打开K,再关闭K、打开K”的方式进行操作,并在a处收集所
1 2 2 1
得气体,然后用带火星的木条检验收集到的气体,但他发现两种情况下木条均没有复燃。
①丙同学经过观察分析,建议在III后安装一个盛有碱石灰的干燥管,目的是________;
②丁同学认为即使采纳丙同学的建议且最终观察到木条复燃,也不能证明CO 参与了反应,原因是
2
__________。
(4)为进一步达到实验目的,打开____,关闭_____,增加碱石灰。反应一段时间后,取最终反应后III中
所得固体,__________,则证明结论成立,反之则证明结论不成立。
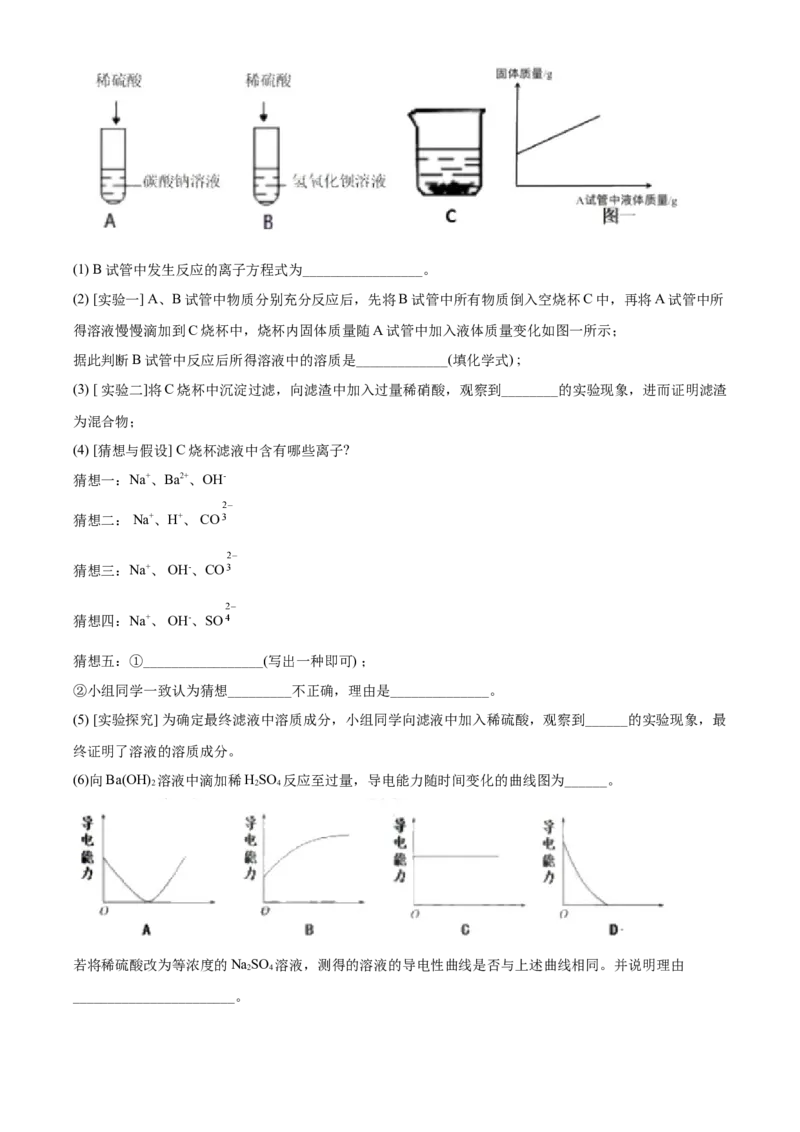
27. 某化学小组甲同学学习了酸、碱、盐化学性质后展开了如下探究活动:(1) B试管中发生反应的离子方程式为_________________。
(2) [实验一] A、B试管中物质分别充分反应后,先将B试管中所有物质倒入空烧杯C中,再将A试管中所
得溶液慢慢滴加到C烧杯中,烧杯内固体质量随A试管中加入液体质量变化如图一所示;
据此判断B试管中反应后所得溶液中的溶质是_____________(填化学式) ;
(3) [ 实验二]将C烧杯中沉淀过滤,向滤渣中加入过量稀硝酸,观察到________的实验现象,进而证明滤渣
为混合物;
(4) [猜想与假设] C烧杯滤液中含有哪些离子?
猜想一:Na+、Ba2+、OH-
猜想二: Na+、H+、 CO
猜想三:Na+、 OH-、CO
猜想四:Na+、 OH-、SO
猜想五:①_________________(写出一种即可) ;
②小组同学一致认为猜想_________不正确,理由是______________。
(5) [实验探究] 为确定最终滤液中溶质成分,小组同学向滤液中加入稀硫酸,观察到______的实验现象,最
终证明了溶液的溶质成分。
(6)向Ba(OH) 溶液中滴加稀HSO 反应至过量,导电能力随时间变化的曲线图为______。
2 2 4
若将稀硫酸改为等浓度的NaSO 溶液,测得的溶液的导电性曲线是否与上述曲线相同。并说明理由
2 4
_______________________。