文档内容
化学答案
1.【答案】D
【解析】液氧和甲烷分别作助燃剂和燃料,A错误;SiN 熔点很高不可能为分子晶体,B错误;碳
3 4
纤维是用腈纶和粘胶纤维做原料,经高温氧化碳化而成的含碳量在90%以上的纤维,C错误,钛
合金和不锈钢均为合金材料,D正确。
2.【答案】C
【解析】制造阻燃或防火线缆的橡胶应为网状结构,C错误。
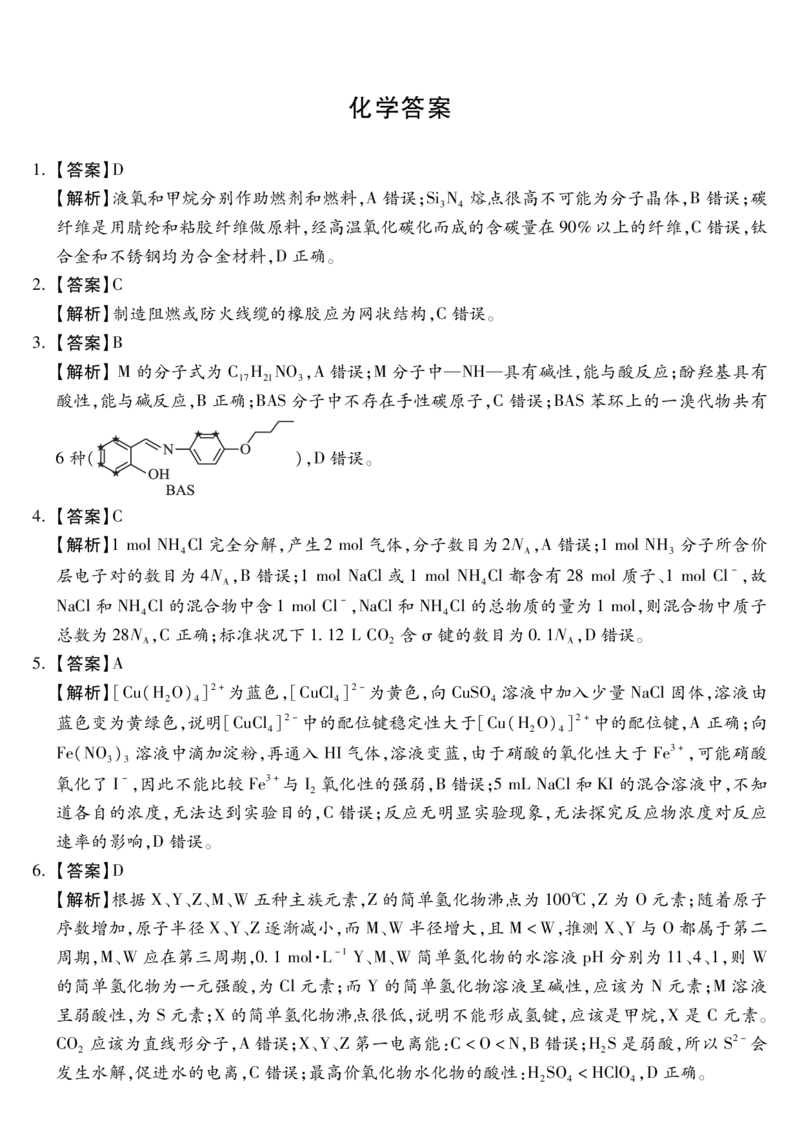
3.【答案】B
【解析】M的分子式为 C H NO,A错误;M分子中—NH—具有碱性,能与酸反应;酚羟基具有
17 21 3
酸性,能与碱反应,B正确;BAS分子中不存在手性碳原子,C错误;BAS苯环上的一溴代物共有
6种( ),D错误。
4.【答案】C
【解析】1molNHCl完全分解,产生2mol气体,分子数目为2N,A错误;1molNH 分子所含价
4 A 3
层电子对的数目为 4N,B错误;1molNaCl或 1molNHCl都含有 28mol质子、1molCl-,故
A 4
NaCl和 NHCl的混合物中含1molCl-,NaCl和 NHCl的总物质的量为1mol,则混合物中质子
4 4
总数为28N,C正确;标准状况下112LCO 含 σ键的数目为01N,D错误。
A 2 A
5.【答案】A
【解析】[Cu(HO)]2+为蓝色,[CuCl]2-为黄色,向 CuSO 溶液中加入少量 NaCl固体,溶液由
2 4 4 4
蓝色变为黄绿色,说明[CuCl]2-中的配位键稳定性大于[Cu(HO)]2+中的配位键,A正确;向
4 2 4
Fe(NO) 溶液中滴加淀粉,再通入 HI气体,溶液变蓝,由于硝酸的氧化性大于 Fe3+,可能硝酸
3 3
氧化了 I-,因此不能比较 Fe3+与 I氧化性的强弱,B错误;5mLNaCl和 KI的混合溶液中,不知
2
道各自的浓度,无法达到实验目的,C错误;反应无明显实验现象,无法探究反应物浓度对反应
速率的影响,D错误。
6.【答案】D
【解析】根据 X、Y、Z、M、W五种主族元素,Z的简单氢化物沸点为 100℃,Z为 O元素;随着原子
序数增加,原子半径 X、Y、Z逐渐减小,而 M、W半径增大,且 M<W,推测 X、Y与 O都属于第二
周期,M、W应在第三周期,01mol·L-1Y、M、W简单氢化物的水溶液 pH分别为 11、4、1,则 W
的简单氢化物为一元强酸,为 Cl元素;而 Y的简单氢化物溶液呈碱性,应该为 N元素;M溶液
呈弱酸性,为 S元素;X的简单氢化物沸点很低,说明不能形成氢键,应该是甲烷,X是 C元素。
CO 应该为直线形分子,A错误;X、Y、Z第一电离能:C<O<N,B错误;HS是弱酸,所以 S2-会
2 2
发生水解,促进水的电离,C错误;最高价氧化物水化物的酸性:HSO <HClO,D正确。
2 4 4
{#{QQABTYAAggigQpAAARgCQwWiCgCQkBGCCAoORAAEMAAAyQNABAA=}#}
书书书7.【答案】D
【解析】①操作需用盐酸溶解卤块,所用仪器为玻璃棒、烧杯,A正确;“氧化”目的是将 Fe2+氧化
为 Fe3+,再通过调节 pH除去,离子方程式为 2Fe2++HO +2H+2Fe3+ +2HO,B正确;②
2 2 2
和③操作都得到液体和固体,均为过滤,C正确;“沉镁”工序中 Mg2+、HCO- 转化为
3
MgCO·Mg(OH)·3HO[2Mg2+ +4HCO- +2HOMgCO·Mg(OH)·3HO↓ +3CO↑],
3 2 2 3 2 3 2 2 2
温度过高 NHHCO 分解才可能产生 NH,D错误。
4 3 3
8.【答案】A
【解析】反应中 O元素化合价降低,部分 C元素化合价升高,A正确;根据反应过程,生成 HO
2 2
时总反应方程式判断,反应属于氧化反应,不属于消去反应,B错误; 、 等
均是反应的中间产物,C错误;反应中有氧气 O! O及烷烃中 C—H等断裂,形成C! C、H—O
等化学键,D错误。
9.【答案】A
【解析】Ge原子之间难以形成双键或三键,是因为 Ge的原子半径较大,未杂化的 p轨道很难肩
并肩重叠,形成 π键,B错误;O 为极性分子,但是极性小,因此在 CCl中的溶解度大于在水中
3 4
的溶解度,C错误;等离子体是由电子、阳离子和电中性粒子三种粒子组成且能导电的气态物
质,D错误。
10.【答案】D
【解析】容器内NH(g)与CO(g)两种气体物质的量始终保持2∶1,则气体平均摩尔质量始终
3 2
不变,因此不能用容器内气体平均相对分子质量不再变化说明反应已经达到平衡状态,A错
误;反应的 K=c2(NH)c(CO),因为温度一定,则 K保持不变,NH 和 CO 的浓度均保持不
3 2 3 2
1
变,B错误;利用图像中的任意两组数据代入关系式:R×lnK =-ΔH× +C,如将 a、b点数
p T
据分别带入得①:-6782=-3342×10-3×ΔH+C,②:-6973=-3354×10-3×ΔH+C,
① -②:191=0012×10-3×ΔH,ΔH=+1592×103J·mol-1=+1592kJ·mol-1,C错误;根
据图像直线斜率判断,氨基甲酸铵分解反应为吸热反应,则合成氨基甲酸铵为放热反应,所以
在低温环境有利于合成氨基甲酸铵,D正确。
11.【答案】A
【解析】过程①中超分子不溶于甲苯,为固态,分离操作选择a为过滤;过程②中C 为不溶于氯
60
仿的固体,因此分离操作选择为 a;过程③中分离氯仿和杯酚,二者互溶,但沸点不同,因此通
过装置 d蒸馏分离,A选项合理。
{#{QQABTYAAggigQpAAARgCQwWiCgCQkBGCCAoORAAEMAAAyQNABAA=}#}12.【答案】D
【解析】由分析可知,d为正极,a膜为质子交换膜,故 A错误;乙池中通入一氧化氮的电极为阴
极,酸性条件下电极反应式为 NO+5e-+6H+HO+NH+,故 B错误;甲池中质子向 d极
2 4
迁移,C错误;当浓缩室得到2L06mol·L-1盐酸时,从 M室通过阳离子交换膜 a膜进入浓缩室
的氢离子物质的量为(06mol·L-1-01mol·L-1)×2L=1mol,则M室消耗水的质量为1mol×
1
×18g·mol-1=9g,D正确。
2
13.【答案】C
【解析】当 c(OH-)浓度越大,越抑制 CO2-水解,c(Ba2+)=c(CO2-),使 c2(Ba2+)越接近 26
3 3
×10-9,此时 K =c(Ba2+)·c(CO2-)=c2(Ba2+)=26×10-9,A正确;若忽略 CO2- 的第二步
sp 3 3
c(CO2-)·c(H+)
水解,当 c(CO2-)=c(HCO-)时,K (HCO)= 3 =c(H+),c(Ba2+)=
3 3 a2 2 3 c(HCO-)
3
c(CO2-)+c(HCO-)=2c(CO2-),c2(Ba2+)=c(Ba2+)×2c(CO2-)=2K =52×10-9,即
3 3 3 3 sp
10-14
N点,此时 c(OH-)=2×10-4,c(H+)= =5×10-11,K (HCO)=5×10-11,
20×10-4 a2 2 3
B正确;由图像知 c2(Ba2+)随 c(OH-)增大而减小,所以 c(Ba2+)随 c(H+)增大而增大,
C错误;在 N点,由 B选项得知,c(CO2-)=c(HCO-),M点 c(OH-)小,c(H+)大,所以更促进
3 3
CO2-转化成 HCO-,因此有 c(Ba2+)>c(HCO-)>c(CO2-),D正确。
3 3 3 3
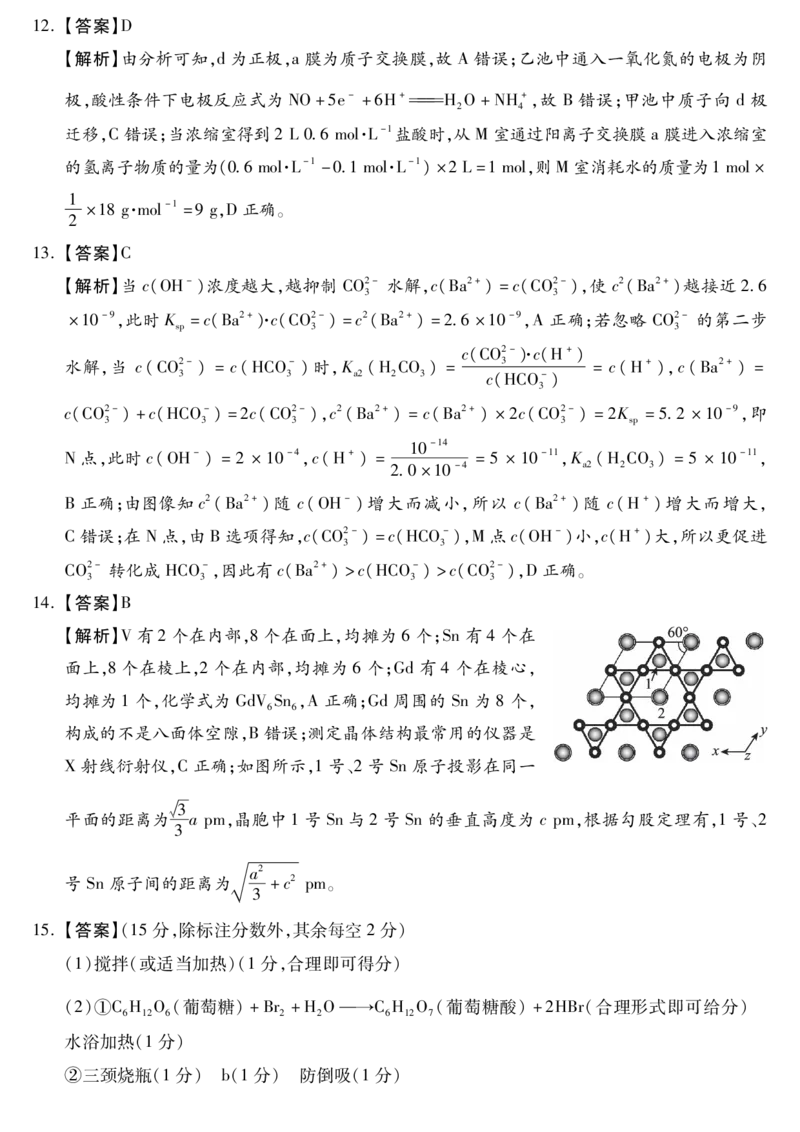
14.【答案】B
【解析】V有2个在内部,8个在面上,均摊为 6个;Sn有 4个在
面上,8个在棱上,2个在内部,均摊为 6个;Gd有 4个在棱心,
均摊为1个,化学式为 GdVSn,A正确;Gd周围的 Sn为 8个,
6 6
构成的不是八面体空隙,B错误;测定晶体结构最常用的仪器是
X射线衍射仪,C正确;如图所示,1号、2号 Sn原子投影在同一
槡3
平面的距离为 apm,晶胞中1号 Sn与2号 Sn的垂直高度为 cpm,根据勾股定理有,1号、2
3
a2
号 Sn原子间的距离为 +c2 pm。
槡
3
15.【答案】(15分,除标注分数外,其余每空2分)
(1)搅拌(或适当加热)(1分,合理即可得分)
(2)①CH O(葡萄糖)+Br+HO→CH O(葡萄糖酸)+2HBr(合理形式即可给分)
6 12 6 2 2 6 12 7
水浴加热(1分)
②三颈烧瓶(1分) b(1分) 防倒吸(1分)
{#{QQABTYAAggigQpAAARgCQwWiCgCQkBGCCAoORAAEMAAAyQNABAA=}#}(3)趁热过滤 分离难溶于水的 CaCO 时,葡萄糖酸钙冷却后会结晶,如不趁热过滤会损失产
3
品 有利于葡萄糖酸钙的析出
100
005×V×10-3×430×
20
(4) ×100%
0500
【解析】(1)过程ⅰ为溶解的操作,加快溶解的措施为搅拌(或适当加热)。
(2)①利用溴水作氧化剂,将葡萄糖氧化成葡萄糖酸,因此化学方程式为 CH O(葡萄糖)+
6 12 6
Br+HO→CH O(葡萄糖酸)+2HBr,反应温度为55℃,适合用水浴加热。
2 2 6 12 7
②冷凝时,冷凝水均从下口入,上口出;装置乙中倒扣漏斗的作用是防止倒吸。
(3)分离难溶于水的 CaCO 时,葡萄糖酸钙冷却后会结晶,如不趁热过滤会损失产品;乙醇可
3
降低葡萄糖酸钙在溶液中的溶解度,有利于葡萄糖酸钙的析出。
(4)根据反应关系,EDTA的物质的量与葡萄糖酸钙物质的量相等,因此计算关系式为
100
005×V×10-3×430×
20
×100%。
0500
16.【答案】(14分,每空2分)
(1)2 AD
(2)2Fe2++ClO-+5HO2Fe(OH)↓ +Cl-+4H+
2 3
(3)pH越小,H+浓度越大,平衡逆向移动
高温
(4)4CoCO·2HO+2LiCO +3O 4LiCoO +10CO +8HO
2 4 2 2 3 2 2 2 2
(5)CoO
2 3
(6)16
【解析】(1)丁二酮肟分子中 sp3杂化的原子是两个甲基中的碳原子,个数为 2;二丁二酮肟镍
中存在的化学键有 σ键、π键、配位键,氢键不属于化学键,金属键存在于金属或合金中,故答
案选 AD。
(2)因为pH值为4~5,Fe2+转化为Fe(OH),2Fe2++ClO-+5HO2Fe(OH)↓+Cl-+4H+。
3 2 3
(3)根据图像分析 pH越小,氢离子浓度越大,该反应化学平衡逆向移动,降低了萃取率。
(4)CoCO·2HO和 LiCO 在空气氛围中焙烧可得到 LiCoO,其化学反应方程式为
2 4 2 2 3 2
高温
4CoCO·2HO+2LiCO +3O 4LiCoO +10CO +8HO。
2 4 2 2 3 2 2 2 2
(5)CoCO·2HO(M=183g·mol-1),取 1mol的 CoCO·2HO,则 Co元素的质量为 59g,
2 4 2 2 4 2
C点固体物质中 O元素约为183g×4536% -59g=24g,Co原子和 O原子物质的量之比为
1∶15,化学式为 CoO。
2 3
1 1
(6)由晶胞结构可知,晶胞中位于顶点、面心和体内的锂离子的个数为 8× +6× +4=8,
8 2
由钴酸锂的化学式可知,晶胞中含有 O的个数为8×2=16。
{#{QQABTYAAggigQpAAARgCQwWiCgCQkBGCCAoORAAEMAAAyQNABAA=}#}17.【答案】(14分,除标注分数外,其余每空2分)
(1)(a+b)-(c+d)(1分) 低温(1分)
P
(2) 5
50
(3)b
(4)1∶2
(5)将[Co(NH)]3+还原为[Co(NH)]2+
3 6 3 6
(6)HO+HNO -2e-NO-+3H+
2 2 3
【解析】(1)提取图中数据,依据盖斯定律,ΔH=反应物的总键能 -生成物的总键能 =[(a+b)
-(c+d)]kJ·mol-1;由于该反应是放热反应,所以该反应在低温下能自发进行。
2 2
×PMPa ( )2
5 P x2(ClNO) 5
(2)v(ClNO)= = MPa·min-1;K = = =5。
20min 50 x x(Cl)×x2(NO) 1 2
2 ×( )2
5 5
(3)起始条件相同,在恒容容器中发生反应 2NO(g)+Cl(g)幑幐2ClNO(g),相对于恒压状态,
物质浓度减小,反应速率减慢,NO的百分含量增大,达到平衡时所需时间较长,所以 b点符合
要求。
(4)由题干图示信息可知,[Co(NH)]2++NO[Co(NH)NO]2++NH,
3 6 3 5 3
2[Co(NH)]2++O [(NH)CoOOCo(NH)]4++6NH,
3 6 2 3 3 3 3 3
[Co(NH)NO]2++[(NH)CoOOCo(NH)]4+ +6NH +HO[Co(NH)NO]2+ +
3 5 3 3 3 3 3 2 3 5 2
2[Co(NH)]3++2OH-,由此分析可知,与 NO反应的[Co(NH)]2+和与 O 反应的
3 6 3 6 2
[Co(NH)]2+物质的量之比为1∶2。
3 6
(5)由题干信息可知,[Co(NH)]2+对 NO的配合能力很强,而[Co(NH)]3+对 NO的配合
3 6 3 6
能力极低,钴氨溶液经过多次循环吸收 NO后,其吸收 NO的能力会降低,为了恢复钴氨溶液吸
收 NO的能力,需采取的方法是将[Co(NH)]3+还原为[Co(NH)]2+。
3 6 3 6
(6)阳极上亚硝酸被氧化成硝酸,电极反应式为 HO+HNO -2e-NO-+3H+。
2 2 3
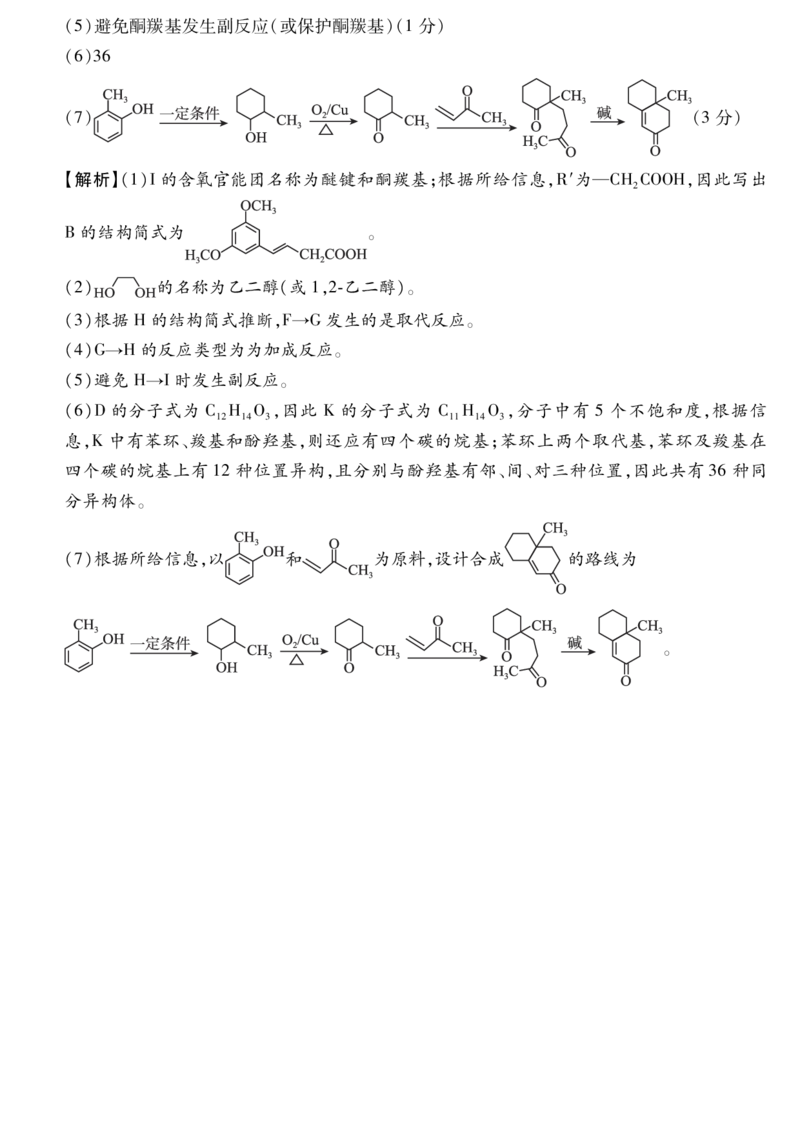
18.【答案】(15分,除标注分数外,其余每空2分)
(1)醚键、(酮)羰基 C H O(1分)
17 18 4
(2)乙二醇(或1,2乙二醇)(1分)
(3)
(4)加成反应(1分)
{#{QQABTYAAggigQpAAARgCQwWiCgCQkBGCCAoORAAEMAAAyQNABAA=}#}(5)避免酮羰基发生副反应(或保护酮羰基)(1分)
(6)36
(7) (3分)
【解析】(1)I的含氧官能团名称为醚键和酮羰基;根据所给信息,R′为—CHCOOH,因此写出
2
B的结构简式为 。
(2) 的名称为乙二醇(或1,2乙二醇)。
(3)根据 H的结构简式推断,F→G发生的是取代反应。
(4)G→H的反应类型为为加成反应。
(5)避免 H→I时发生副反应。
(6)D的分子式为 C H O,因此 K的分子式为 C H O,分子中有 5个不饱和度,根据信
12 14 3 11 14 3
息,K中有苯环、羧基和酚羟基,则还应有四个碳的烷基;苯环上两个取代基,苯环及羧基在
四个碳的烷基上有 12种位置异构,且分别与酚羟基有邻、间、对三种位置,因此共有 36种同
分异构体。
(7)根据所给信息,以 和 为原料,设计合成 的路线为
。
{#{QQABTYAAggigQpAAARgCQwWiCgCQkBGCCAoORAAEMAAAyQNABAA=}#}永久高中群【资料无水印】
1.包含服务:
每一年的高一高二高三群免费进,好处就是每年都可以免费进入我们提供高中群,不用每年缴费,一次
付费,永久享受,包含到高一到高三的。
2.资料覆盖:
整个高中的所有资料,包含每年每个年级最新的高中群(含高一到高三的)
3.资料包含:
整个高中的最新模拟卷、复习资料、精品资料等等,和高中相关的资料都可以免费获取
4.入群价格:
目前入群特价199元(原价299元)
2025 高三 VIP 资料【资料无水印】
资料提供形式:QQ群+网盘群(两个群一起,QQ群每日实时更新,网盘群分类汇总)
资料包含内容:【3年高二试卷+4年高三试卷】
1、2022年9月份到2024年7月底各地高二月考卷、期中期末卷、联考卷等等
2、2021年9月份到2024年6月份高三各地名校卷、各地联考卷、一二模模拟卷等等
3、2024 年 8 月份到 2025 年 6 月份高三各地名校卷、各地联考卷、一二模模拟卷(2024 年8 月开始,
每天实时更新)
4、各科知识点总结、笔记、答题模板
5、全套专题讲义训练、复习讲义
6、专属精品内部资料
进群费用:目前进群仅需69元(原价129元,每天前5名,享受69元优惠价)
时间期限:资料持续更新到2025年6月高考结束,资料截止更新
进群请联系一枚试卷君
【微信号: 】
YMSJJ6868